介孔二氧化硅‑甲氨蝶呤‑米托蒽醌纳米粒,其制备,活性及应用的制作方法
发明领域
本发明涉及一种介孔二氧化硅-甲氨蝶呤(mtx)/米托蒽醌(mit)纳米粒(msnn-mtx/mit)。涉及它的制备方法,即在介孔二氧化硅纳米粒表面修饰氨基制备氨基功能化的介孔二氧化硅纳米粒(msnn),接着msnn的氨基和mtx共价结合形成了甲氨蝶呤-氨基修饰的介孔二氧化硅纳米粒(msnn-mtx),最后往msnn-mtx的纳米孔道加载米托蒽醌,制得纳米级别的介孔二氧化硅-甲氨蝶呤/米托蒽醌纳米粒(msnn-mtx/mit)。涉及它的抗肿瘤作用。与常规mtx和mit联合应用相比,msnn-mtx/mit显著延长s180小鼠的生存时间,提高了疗效并降低了全身毒性反应。因而本发明公开了msnn-mtx/mit在制备mtx与mit联用的抗肿瘤药物中的应用。本发明的msnn-mtx/mit有良好的临床应用前景。本发明属于生物医药领域。
背景技术:
甲氨蝶呤和米托蒽醌都是临床一线抗肿瘤药物。严重的不良反应限制了它们的治疗效果。为了提高甲氨蝶呤或米托蒽醌治疗的癌症病人的生存率和治愈率并降低全身毒性反应,设计了多种联合化疗方案。例如米托蒽醌加甲氨蝶呤加丝裂霉素c继顺铂加吉西他滨治疗晚期恶性胸膜间皮瘤、米托蒽醌加甲氨蝶呤加丝裂霉素c治疗晚期乳腺癌、米托蒽醌加环磷酰胺加甲氨蝶呤加5-氟尿嘧啶加泼尼松治疗晚期乳腺癌、甲氨蝶呤加米托蒽醌加叶酸加甲基强的松龙加长春新碱加粒细胞酸治疗急性淋巴细胞白血病、卡莫司汀加阿霉素加依托泊苷加长春新碱加环磷酰胺加米托蒽醌加阿糖胞苷加甲氨蝶呤加甲酰四氢叶酸治疗非霍奇金淋巴瘤和米托蒽醌加甲氨蝶呤加亚叶酸钙治疗局部晚期或转移性膀胱移行细胞癌。此外,与甲氨蝶呤加米托蒽醌的相关联合应用也被用来减少其他抗肿瘤药物的毒性。例如甲氨蝶呤加米托蒽醌加丝裂霉素c用来减轻以阿霉素为基础的治疗方案的恶心、呕吐、脱发和心脏毒性反应。然而,与常规mtx加mit组合形式类似,上述联合化疗方案仍然没有提高癌症病人的生存期、治愈率和毒性反应。可见,发明甲氨蝶呤加米托蒽醌的新型联合抗肿瘤剂型具有临床重要性。
发明人认识到,将药物载入递送载体后常常可以降低毒性反应。为此,发明人进行了长期探索。发明人发现,用氨基修饰介孔二氧化硅纳米粒表面制得氨基化介孔二氧化硅纳米粒(msnn)之后,便可将msnn的氨基和甲氨蝶呤(mtx)共价结合,形成甲氨蝶呤共价修饰的msnn的纳米粒(msnn-mtx)。msnn-mtx纳米粒表面有无数孔,往这些孔中加载米托蒽醌(mit)便可制得加载mit的msnn-mtx纳米粒(msnn-mtx/mit)。发明人还发现,在荷s180瘤的小鼠模型上,由msnn-mtx/mit代表的联合治疗比甲氨蝶呤加米托蒽醌的常规联合治疗有三个优越性。第一个优越性是,msnn-mtx/mit可明显提高s180小鼠的生存期,而甲氨蝶呤加米托蒽醌的常规联合治疗不能。第二个优越性是,msnn-mtx/mit可明显提高s180小鼠的治愈率,而甲氨蝶呤加米托蒽醌的常规联合治疗不能。第三个优越性是,msnn-mtx/mit可明显降低s180小鼠的全身毒性,而甲氨蝶呤加米托蒽醌的常规联合治疗不能。根据这些发现,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供msnn-mtx/mit。
本发明的第二个内容是提供制备msnn-mtx/mit的方法,该方法包括:
(1)从十六烷基三甲基溴化铵、正硅酸四乙酯和3-氨丙基三甲氧基硅烷制备msnn;
(2)甲氨蝶呤(mtx)和msnn偶联制备msnn-mtx;
(3)用msnn-mtx包载mit制备msnn-mtx/mit。
本发明的第三个内容是表征msnn-mtx/mit的纳米结构。
本发明的第四个内容是在s180小鼠模型上测定msnn-mtx/mit的抗肿瘤活性、生存时间和全身毒性反应。
附图说明
图1s180荷瘤小鼠用cmcna,mtx/mit和msnn-mtx/mit治疗7天并观察13天的生存率。
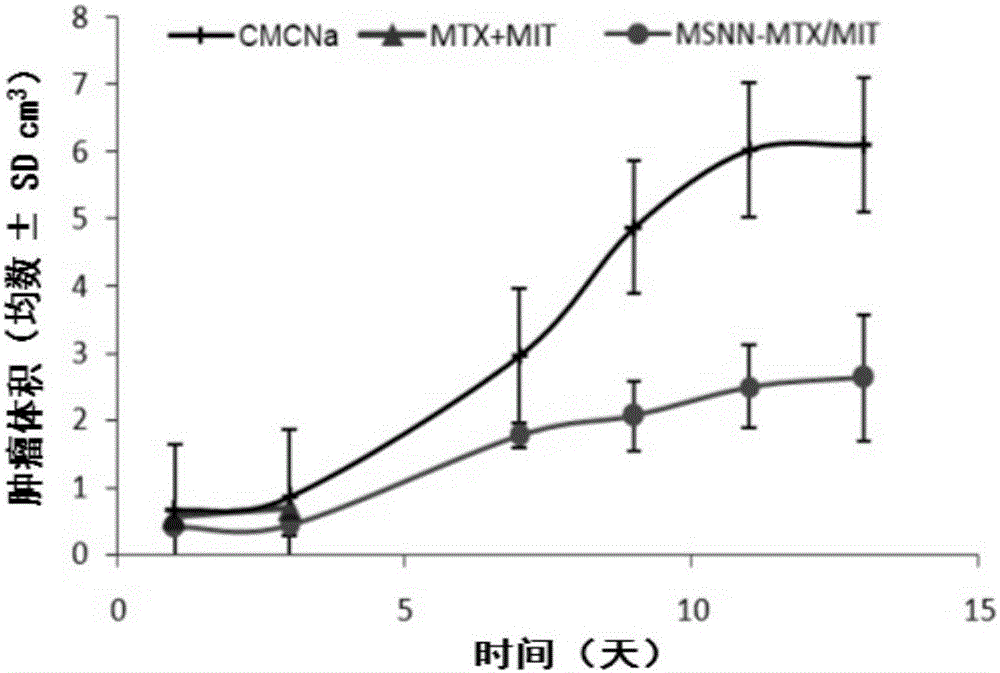
图2s180荷瘤小鼠用cmcna,mtx/mit和msnn-mtx/mit治疗后的肿瘤体积,n=12。
图3s180荷瘤小鼠用cmcna和msnn-mtx/mit治疗后的瘤重,n=12。
图4cmcna和msnn-mtx/mit治疗小鼠的血浆alt,ast和cr水平。
图5电镜图和zeta电位.(a)msnn的透射电镜图;(b)msnn-mtx的透射电镜图;(c)msnn-mtx/mit的透射电镜图;(d)msnn-mtx/mit的扫描电镜图;(a’)msn的zeta电位;(b’)msnn-mtx的zeta电位;(c’)msnn-mtx/mit的zeta电位。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备msnn-mtx/mit
1)制备msnn
将1g十六烷基三甲基溴化铵溶于480ml蒸馏水中,搅拌下加入3.5ml氢氧化钠水溶液(2m),80℃加热1h,剧烈搅拌至溶液澄清。然后快速加入5ml正硅酸四乙酯和1ml3-氨丙基三甲氧基硅烷,80℃加热2h。反应混合物降温,过滤,滤饼用20ml蒸馏水洗三次、用20ml乙醇洗三次,70℃真空干燥24h。干燥的固体后在350ml甲醇和7ml浓盐酸的混合溶剂中回流24h。反应混合物降温,过滤,滤饼用20ml蒸馏水洗三次、用20ml乙醇洗三次,70℃真空干燥24h。得到1.2g氨基功能化的介孔二氧化硅纳米粒(msnn)。
2)制备msnn-mtx
将66mg甲氨蝶呤(mtx)和150mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶于5ml无水二甲基亚砜。在氮气保护和锡箔纸避光下搅拌30min后加入500mg制得的
msnn,在氮气保护下继续反应24h,使mtx与msnn共价连接。然后依次用20ml二甲基亚砜和20ml乙醇洗涤,20℃下12000rpm离心15min,洗去未共价连接的mtx。固体37℃真空干燥24h,得到160mgmsnn-mtx。
3)制备msnn-mtx/mit
将5mg米托蒽醌(mit)溶于3ml去离子水,加入100mgmsnn-mtx,避光,超声20min,搅拌12h,过滤,37℃烘箱干燥。该操作重复三次,固体37℃真空干燥24h,得到30mgmsnn-mtx/mit。
实施例2测定msnn-mtx/mit的纳米结构
1)测定扫描电镜分别称取1mgmsnn,msnn-mtx和msnn-mtx/mit,用1.5ml无水乙醇超声分散,取100μl滴于载玻片表面,37℃干燥3天,于扫描电镜(jsm-6360lv,jeol,日本)下观察其形态,结果见图5。
2)测定透射电镜分别称取1mgmsnn,msnn-mtx和msnn-mtx/mit,用1.5ml无水乙醇超声分散,取约10μl滴于透射电镜铜网表面,37℃干燥3天,于透射电镜(jem-1230,jeol,日本)下观察其形态,结果见图5。
3)测定zeta电位分别称取1mgmsnn,msnn-mtx和msnn-mtx/mit,用1.5ml无水乙醇超声分散,样品加入小皿中,插入电极,用激光纳米粒度仪(zetaplus,brookhabeninstrumentscorporation,美国)测定zeta电位,结果见图5。
实施例3评价msnn-mtx/mit的抗肿瘤活性、小鼠存活期和毒性
雄性icr小鼠(体重为20±2g,购自北京维通利华动物实验技术有限公司),将s180瘤液稀释成1.5×107个/ml,每只小鼠右侧腋下接种0.2ml瘤液,每天用游标卡尺测量肿瘤体积,观察肿瘤生长情况。接种瘤液7天肿瘤体积生长至1.0cm3时,所有小鼠称重,随机分成3组,每组12只小鼠,分别接受cmc-na治疗,mtx+mit治疗和msnn-mtx/mit治疗。将msnn-mtx/mit过200目筛,用含5‰的cmc-na的生理盐水作为溶媒,腹腔注射给药。cmc-na组的剂量为每只小鼠0.2ml,mtx+mit组的给药剂量为4mg/kgmtx和0.5mg/kgmit,msnn-mtx/mit组的给药剂量为50mg/kg,给药体积为10ml/kg。每日一次,连续给药7天后,继续观察5天。给药期间观察小鼠的存活情况,记录各组每只小鼠的生存时间,结果见图1。于第13天所有小鼠采取摘眼球取血法,用3.8%柠檬酸钠抗凝,每1ml血液加抗凝剂100μl,血液离心(4000rpm,10min)后取上清即为血浆,采用谷丙转氨酶(gpt)试剂盒、谷草转氨酶(got)试剂盒和肌酐(cr)试剂盒(南京建成生物工程研究所)进行检测,按照标准曲线计算血浆中谷丙转氨酶,谷草转氨酶和肌酐的含量,观察药物的毒性反应,结果见图4。小鼠接受乙醚麻醉之后颈椎脱臼处死。测量肿瘤体积,结果见图2。称取瘤重。结果见图3。
- 还没有人留言评论。精彩留言会获得点赞!