治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂、其制备方法及应用与流程
本发明属于生物医药技术领域,具体涉及一种治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂、其制备方法及应用。
背景技术:
胃癌是危害人类健康的常见恶性肿瘤,我国每年死于胃癌的病人超过26万。胃癌前病变是胃癌发生的起始阶段,其进展为浸润性癌的年癌变率最高约达73%。近年来,由于环境、饮食、工作压力及幽门螺旋菌感染等因素影响,胃癌前病变发病率显著增加,因此,及早地阻断胃癌前病变的发生和发展对胃癌的预防有积极意义。
慢性萎缩性胃炎是重要的胃癌前病变表现。据2000年WHO公布的消化系统肿瘤病理和遗传学分类,导致胃癌的发展模式一般是慢性萎缩性胃炎、胃角溃疡、胃息肉等癌前病变形成肠上皮化生和异型增生,最终导致胃癌。慢性萎缩性胃炎是重要的胃癌前病变,其病理改变是胃粘膜壁细胞和主细胞凋亡造成腺体萎缩、减少。肠上皮化生是胃粘膜上皮细胞被类似肠粘膜的杯状细胞和柱状细胞所替代。顽固反复的炎性刺激最终导致癌变。因此有效治疗慢性萎缩性胃炎、逆转胃粘膜癌前病变的病理变化是预防胃癌发生的关键。
第一个技术问题,现阶段,针对慢性萎缩性胃炎的治疗包括根除幽门螺旋杆菌、补充抗氧化剂和微量元素、中医中药治疗、胃粘膜保护剂、抗生素等,但均存在治标不治本、不能长期使用、疗效差、易反复复发、无法根治等问题,而且对于伴有幽门螺旋杆菌感染的慢性萎缩性胃炎患者,即使杀灭幽门螺旋杆菌的感染之后,由于幽门螺旋杆菌引起的抗体存在,仍然对胃粘膜上皮进行持续的攻击,因此患者病痛不缓解,且仍继续向癌变发展。胃粘膜病变逐渐进展到肠上皮化生和异型增生阶段,针对胃癌前病变的能有效逆转胃粘膜病变病理特征的治疗方法和药物更是几乎没有,这使得胃癌前病变的治疗成为难点。
另一个技术问题。目前对疾病的诊断治疗已经进入分子和细胞时代。干细胞、免疫细胞具有很大的治疗潜力。关于干细胞研究公开资料很多,例如申请号CN201210133427.X的中国发明专利申请即公开了“一种用于创面修复的干细胞制剂及其制备方法”。而关于免疫细胞的仍多集中于研究阶段,公开资料较少,期刊文献Phenotypic characterization and identification of cytokine-induced killed cells[J].Exp Hematol,1993;21(13):1673-1679,较早的公开了免疫细胞在临床治疗方面的应用,具体公开了使用患者自体细胞体外诱导扩增后用于治疗肿瘤。现阶段另外的大部分关于免疫细胞的研究也多限于这方面,均是应用患者自身细胞,经体外扩增诱导后再回输患者。应用患者自体细胞治疗,细胞来源受限,治疗个体受限,价格高昂,无法做到大批量生产和产业化发展,也无法使更多的患者方便治疗。
综上,国内外尚未见到有免疫细胞制剂尤其是异体来源的免疫细胞制剂,对慢性萎缩性胃炎和胃癌前病变进行治疗报道研究。
技术实现要素:
为了解决现有技术存在的上述问题,本发明目的在于提供了一种能够逆转癌前病变、使萎缩性胃炎变成浅表性胃炎甚至治愈、并有效缓解症状治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。本发明还同时提供了所述免疫细胞制剂的制备方法及应用。本发明提供的制备方法可以以健康人外周血白细胞为免疫细胞来源,扩大了免疫细胞的来源,能够实现大批量的生产和产业化发展;同时有效利用了血站通常舍弃的人外周血白细胞部分,变废为宝。
本发明所采用的技术方案为:
本发明提供的治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂的制备方法包括以下步骤:取人全血,分离出单个核细胞,将分离出的单个核细胞进行培养以诱导扩增,培养完毕即得所述治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。
使用血站分离出的人外周血白细胞代替所述人全血;使用血袋取用盛装所述人外周血白细胞,使用浓度72~75vt%的酒精擦拭血袋外壁2~3遍。酒精擦拭的目的是为了杀菌,浓度体积分数75%以上酒精会在细菌细胞表面形成保护膜,阻止酒精进入细菌细胞,难以将细菌彻底杀死;浓度体积分数72%以下的酒精浓度过低,虽可进入细菌,但不能将其体内的蛋白质凝固,同样也不能将细菌彻底杀死。因此,采用体积分数浓度72~75%的酒精擦拭血袋外壁能够获得最佳的杀菌效果。
本发明中通过健康人外周血白细胞作为免疫细胞来源,扩大了免疫细胞的来源,进而利于实现免疫细胞制剂的大批量的生产和产业化发展。同时,血站收集的全血通常在分离出红细胞悬液、血浆、血小板等成分后,剩余的白细胞部分直接舍弃。本发明的制备方法可以很好的对白细胞实现再利用,变废为宝。
为了能够高质量、高效率的完成单个核细胞的分离以及培养诱导扩增,获得质量稳定可靠的治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂,本发明在不断的研究探索中,提供以下具体步骤及控制条件参数。
使用Ficoll-hypaque淋巴细胞分离液,以密度梯度离心法分离出所述单个核细胞。所述密度梯度离心法中,离心转速为1800~2200rpm/min,离心时间为18~22min。
以密度梯度离心法分离出所述单个核细胞后,加入无菌生理盐水离心洗涤2~3遍,离心洗涤的转速为1800~2200rpm/min,离心洗涤的时间为18~22min,然后再进行培养。多遍的离心洗涤目的是为了除去残留血小板和Ficoll-hypaque淋巴细胞分离液。
所述培养的具体步骤包括:向分离出的单个核细胞中加入培养液得到基础培养体系,然后再向基础培养体系中加入人血清和IFN-γ得到一次培养体系,将所述一次培养体系置于5%CO2培养箱中进行一次培养,然后向一次培养体系中加入IL-2、CD3McAb、IL-1、CD28抗体和IL-4配置得到二次培养体系,将二次培养体系置于5%CO2培养箱中进行二次培养,二次培养过程中每3天向二次培养体系内补加一次营养液,所述营养液包括培养液、人血清和IL-2,二次培养完毕后,收获分离出细胞,然后用无菌生理盐水洗涤细胞,即得治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。
所述培养液为GT-T551培养液;通过培养液的加入量控制所述基础培养体系中的细胞密度为3.5×106~4.5×106个/ml;通过营养液中培养液的加入量控制二次培养体系中的细胞密度为1.5×106~2.5×106个/ml。
所述一次培养和所述二次培养的培养温度为37±0.5℃;所述一次培养体系中人血清的浓度为8±1wt%,所述一次培养体系中IFN-γ的浓度为1000±100U/ml;配置所述二次培养体系时:每毫升一次培养体系所添加IL-2、CD3McAb、IL-1、CD28抗体和IL-4的量分别依次为500±50U、100±10ng、100±10U、500±50ng、500±50U;每次补加营养液时:均先添加培养液调整二次培养体系中的细胞密度为1.5×106~2.5×106个/ml,然后每100ml二次培养体系补加5±1ml人血清,每毫升二次培养体系补加500±50U的IL-2;所述一次培养的时间为24±2h,所述二次培养的时间为12~28天。
本发明还提供了治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂,所述免疫细胞制剂通过上述本发明提供的制备方法制备获得。
在对本发明提供的免疫细胞制剂的用途方面作了进一步深入研究之后,本发明还提供了前述本发明的免疫细胞制剂在制备治疗慢性萎缩性胃炎和/或胃癌前病变的药物中的应用。所述药物包括各种临床上可接受的剂型,包括但不限于输液等。为了进一步方便应用,所述药物中还包括治疗慢性萎缩性胃炎和/或胃癌前病变的试剂盒。本发明提供的免疫细胞制剂能够改善患者消化道症状,基于此,本发明的免疫细胞制剂在其他消化系统疾病方面也有显著疗效,例如化疗引起的消化道反应等,据此,本发明还提供了所述免疫细胞制剂在制备治疗化疗引起的消化道反应的药物中的应用。
基于以上论述,本发明的有益效果为:首先,本发明提供的免疫细胞制剂能够改善患者消化道症状,在治疗慢性萎缩性胃炎、逆转胃癌前病变方面疗效显著,能够实现标本兼治、并且疗效好、不易复发。同时,不仅仅局限于胃癌前病变、慢性萎缩性胃炎,由于能够改善患者消化道症状,本发明的免疫细胞制剂在其他消化系统疾病方面也有显著疗效,例如化疗引起的消化道反应等。其次,本发明提供的制备方法能够高效率的获得质量稳定可靠、治疗效果好的免疫细胞制剂,并且本发明提供的制备方法可以有多种白细胞来源,例如不仅限于患者本身,还包括亲属及他人捐献,不仅限于外周血,还可以是脐带血。并且,本发明提供的制备方法可以以血站常规舍弃的白细胞作为批量来源,变废为宝的同时,来源更为广泛,适于工业上大批量生产,降低了价格,方便使用,进而使更多患者受益。
附图说明
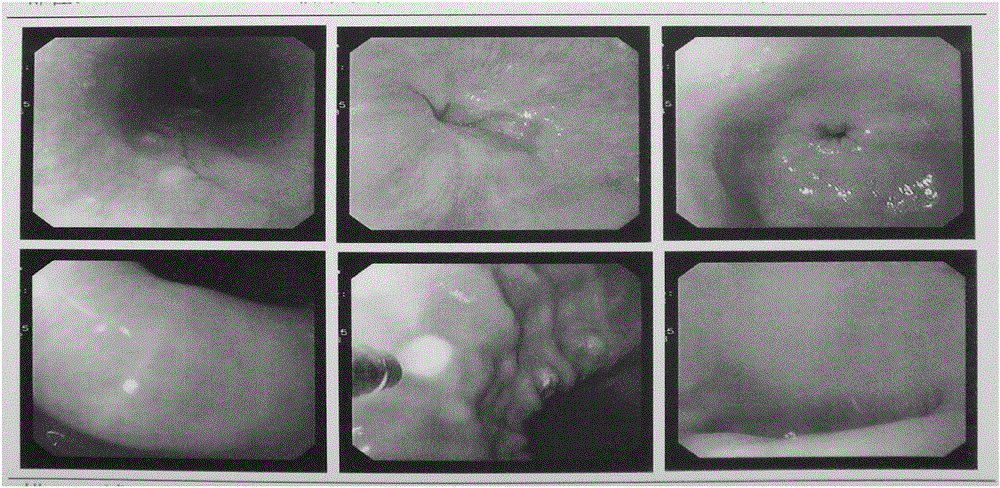
图1是本发明的典型临床病例1中患者于2013年7月的胃镜图;
图2是本发明的典型临床病例1中患者于2015年9月的胃镜图。
具体实施方式
下面结合附图及具体实施例对本发明作进一步阐释,如无特别说明,本发明中所用术语均遵从行业通常理解,所使用到的方法设备皆为行业通用方法设备,所使用试剂皆为行业通用普通市售试剂。以下实施例中述及的健康人全血取自长春市中心血站;以下实施例中述及的健康人外周血白细胞取自长春市中心血站的全血分离出红细胞悬液、血浆、血小板等成分后剩余的以外周血白细胞为主的部分。
实施例1:
本实施例提供一种治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂,通过以下步骤制备而得:用血袋取用盛装血站分离出的健康人外周血白细胞,使用浓度75vt%的酒精擦拭血袋外壁2遍。使用Ficoll-hypaque淋巴细胞分离液,以密度梯度离心法从血袋的人外周血白细胞中分离出单个核细胞;密度梯度离心法操作中,控制离心转速为2000rpm/min,离心时间为20min。分离完毕后,向分离出的单个核细胞中加入无菌生理盐水离心洗涤2遍,离心洗涤的转速为2000rpm/min,离心洗涤的时间为20min。离心洗涤完毕后,向洗涤过的单个核细胞中加入GT-T551培养液得到基础培养体系,通过GT-T551培养液的加入量,控制基础培养体系中的细胞密度为4×106个/ml。向基础培养体系中加入人血清和IFN-γ得到一次培养体系,所述一次培养体系中人血清的浓度为8wt%,所述一次培养体系中IFN-γ的浓度为1000U/ml。将一次培养体系置于37℃条件下的5%CO2培养箱中进行一次培养24h。一次培养完毕后,向一次培养体系中加入IL-2、CD3McAb、IL-1、CD28抗体和IL-4配置得到二次培养体系,每毫升一次培养体系所添加IL-2、CD3McAb、IL-1、CD28抗体和IL-4的量分别依次为500U、100ng、100U、500ng、500U。将二次培养体系置于37℃条件下的5%CO2培养箱中进行二次培养20天,二次培养过程中,每3天向二次培养体系内补加一次营养液,所述营养液包括培养液、人血清和IL-2,每次补加营养液时:均先添加培养液调整二次培养体系中的细胞密度为2×106个/ml,然后每100ml二次培养体系补加5ml人血清,每毫升二次培养体系补加500U的IL-2。二次培养完毕后,收获并分离出细胞,然后用无菌生理盐水洗涤细胞3遍,即得治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。
本实施例获得的免疫细胞制剂可以调整液体量后,直接应用于临床静脉输入以治疗慢性萎缩性胃炎和/或胃癌前病变;也可以先与其他药用辅料或者其他协同药物配合之后制成治疗慢性萎缩性胃炎和/或胃癌前病变的药物,再进一步用于慢性萎缩性胃炎和/或胃癌前病变的治疗。同样的,本实施例的免疫细胞制剂可以直接用于临床静脉输入以治疗化疗引起的消化道反应,也可以与其他药用辅料或药物复配后制成治疗化疗引起的消化道反应的药物后再进一步使用。
实施例2:
本实施例提供一种治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂,通过以下步骤制备而得:用血袋取用盛装健康人全血,使用浓度72vt%的酒精擦拭血袋外壁2遍。使用Ficoll-hypaque淋巴细胞分离液,以密度梯度离心法从血袋的人外周血白细胞中分离出单个核细胞;密度梯度离心法操作中,控制离心转速为1800rpm/min,离心时间为22min。分离完毕后,向分离出的单个核细胞中加入无菌生理盐水离心洗涤2遍,离心洗涤的转速为1800rpm/min,离心洗涤的时间为22min。离心洗涤完毕后,向洗涤过的单个核细胞中加入GT-T551培养液得到基础培养体系,通过GT-T551培养液的加入量,控制基础培养体系中的细胞密度为3.5×106个/ml。向基础培养体系中加入人血清和IFN-γ得到一次培养体系,所述一次培养体系中人血清的浓度为7wt%,所述一次培养体系中IFN-γ的浓度为900U/ml。将一次培养体系置于36.5℃条件下的5%CO2培养箱中进行一次培养22h。一次培养完毕后,向一次培养体系中加入IL-2、CD3McAb、IL-1、CD28抗体和IL-4配置得到二次培养体系,每毫升一次培养体系所添加IL-2、CD3McAb、IL-1、CD28抗体和IL-4的量分别依次为450U、90ng、90U、450ng、450U。将二次培养体系置于36.5℃条件下的5%CO2培养箱中进行二次培养12天,二次培养过程中,每3天向二次培养体系内补加一次营养液,所述营养液包括培养液、人血清和IL-2,每次补加营养液时:均先添加培养液调整二次培养体系中的细胞密度为1.5×106个/ml,然后每100ml二次培养体系补加4ml人血清,每毫升二次培养体系补加450U的IL-2。二次培养完毕后,收获并分离出细胞,然后用无菌生理盐水洗涤细胞3遍,即得治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。
实施例3:
本实施例提供一种治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂,通过以下步骤制备而得:用血袋取用盛装血站健康人全血分离出红细胞悬液、血浆、血小板等成分后剩余的外周血白细胞,使用浓度74vt%的酒精擦拭血袋外壁3遍。使用Ficoll-hypaque淋巴细胞分离液,以密度梯度离心法从血袋的人外周血白细胞中分离出单个核细胞;密度梯度离心法操作中,控制离心转速为2200rpm/min,离心时间为18min。分离完毕后,向分离出的单个核细胞中加入无菌生理盐水离心洗涤3遍,离心洗涤的转速为2200rpm/min,离心洗涤的时间为18min。离心洗涤完毕后,向洗涤过的单个核细胞中加入GT-T551培养液得到基础培养体系,通过GT-T551培养液的加入量,控制基础培养体系中的细胞密度为4.5×106个/ml。向基础培养体系中加入人血清和IFN-γ得到一次培养体系,所述一次培养体系中人血清的浓度为9wt%,所述一次培养体系中IFN-γ的浓度为1100U/ml。将一次培养体系置于37.5℃条件下的5%CO2培养箱中进行一次培养26h。一次培养完毕后,向一次培养体系中加入IL-2、CD3McAb、IL-1、CD28抗体和IL-4配置得到二次培养体系,每毫升一次培养体系所添加IL-2、CD3McAb、IL-1、CD28抗体和IL-4的量分别依次为550U、110ng、110U、550ng、550U。将二次培养体系置于37.5℃条件下的5%CO2培养箱中进行二次培养28天,二次培养过程中,每3天向二次培养体系内补加一次营养液,所述营养液包括培养液、人血清和IL-2,每次补加营养液时:均先添加培养液调整二次培养体系中的细胞密度为2.5×106个/ml,然后每100ml二次培养体系补加6ml人血清,每毫升二次培养体系补加550U的IL-2。二次培养完毕后,收获并分离出细胞,然后用无菌生理盐水洗涤细胞2遍,即得治疗慢性萎缩性胃炎及胃癌前病变的免疫细胞制剂。
临床试验例:
本发明还进一步研究了本发明的免疫细胞制剂关于治疗慢性萎缩性胃炎及胃癌前病变的疗效情况。临床试验过程如下:
1、一般资料:选取2014年12月-2016年6月我院(中国人民解放军第208医院)收治的15例病例进行临床观察,经胃镜及病理检查,均符合中华医学会消化病分会制定的慢性萎缩性胃炎癌前病变诊断标准,排除肝胆胰腺等器质性病变患者。其中男10例,女5例,年龄最小42岁,最大75岁;15例患者均有恶心、腹胀、嗳气、腹痛、早饱感、食欲不振、消化不良、上腹部不适及乏力等症状中至少3种,其中伴有糜烂4例,肠上皮化生7例,异型增生4例。患者均有2年以上病史,且经过其他治疗方法无改善,属于难治型病例。
2、治疗方案:静脉输注本发明实施例1方法所制得的免疫细胞制剂,每天1次,每次静脉滴注100ml(细胞浓度2×108个/100ml),连续8天为一疗程,每个月进行1个疗程,治疗6个疗程。治疗结束2个月后评价疗效。治疗期间停止其他药物治疗。
3、疗效评定标准:
治愈:临床症状及体征消失,食欲恢复正常。胃镜检查示胃粘膜形态基本恢复;病理检查示胃粘膜萎缩性改变基本消失,或仅有浅表性炎症改变,异型增生及肠上皮化生消失。
显效:临床症状及体征基本消失,食欲改善;胃镜检查示胃粘膜灰白区基本消失,呈红白相间以红象为主,未见蓝色血管;病理检查示胃粘膜萎缩、异型增生及肠上皮化生从重度转为中度或从中度转为轻度。
好转(有效):临床症状及体征明显减轻,但仍遗留部分症状;胃镜检查示胃粘膜灰白区范围缩小,蓝色血管透见影像;病理检查示胃粘膜萎缩、异型增生及肠上皮化生有好转但不显著。
无效:临床症状及体征无改善或恶化;胃镜检查示胃粘膜萎缩未减轻或加重;病理检查示固有腺体萎缩程度和范围均无变化或加重。
4、治疗结果:总例数15例,治愈11例占比约73%,显效3例占比约20%,有效1例占比约7%,总有效率100%。患者经过治疗后普遍反映症状缓解明显,体力显著增强。据《慢性萎缩性胃炎内科规范治疗临床分析,医学理论与实践,2016,29(2),192-193.》统计报道,当前现有方法的临床治愈率最高大约为40-50%,据此对比,本发明的临床治愈率约为73%,显著优于现有技术,取得了显著的进步。
典型临床病例如下:
1、患者张某,男性,70岁,于2013年7月因胃酸、腹胀、腹痛就诊于吉林大学第一医院,胃镜检查示:食管粘膜多发白色增生结节;贲门-胃底-胃体粘膜充血水肿,胃内见少量黄绿色浑浊粘液;胃角-胃窦粘膜充血水肿,部分粘膜变薄,粘膜下血管网清晰可见,色泽红白不均部分以白色为主,多发平坦糜烂;幽门螺旋杆菌阴性。诊断:慢性萎缩性胃炎伴糜烂,具体见图1。口服胃乐新、人参健脾丸、香砂和胃丸、胸腺蛋白等多种药物治疗一年多无好转。于2015年初来我院(中国人民解放军第208医院),给予本发明免疫细胞制剂100ml静脉滴注,每日1次,连续8天为1个疗程,每个月重复1疗程治疗。治疗2疗程后,患者胃酸、胃胀痛明显缓解。继续治疗4疗程,2015年9月复查胃镜示:食管未见异常;贲门-胃底-胃体粘膜光滑;胃角、胃窦粘膜散见片状充血斑,局部水肿,可见粘液附着,苍白色粘膜消失;幽门光滑通畅。结论:萎缩性胃炎及糜烂消失。轻度慢性浅表性胃炎。具体见图2。患者胃部不适症状完全消失,随访至今胃部不适感未复发,生活饮食均恢复正常,达到临床治愈。
2、患者李某某,男性,69岁,于2009年因胃酸、腹胀、腹痛就诊于吉林大学第一医院,胃镜诊断“慢性萎缩性胃炎伴肠上皮化生,重度异型增生”,检测HP阳性,应用四联药物治疗半年,复查HP阴性,但胃部不适症状始终不缓解。2013年9月胃镜:幽门型胃粘膜慢性浅表-萎缩性胃炎伴急性炎,腺体肠化生、重度异型增生。免疫组化:HP(-),Ki67(+),P53散在(+),符合癌前病变表现。2014年3月在吉林大学第一附属医院化验肿瘤标志物癌胚抗原CEA6.55(升高),2014年6月于吉林大学第一附属医院再次化验CEA6.64(升高),较前升高。患者多方治疗无好转,于2015年初到我院(解放军第208医院)采用本发明免疫细胞制剂进行治疗。2015年10月在吉林省医院复查胃镜显示腺体化生消失,异型增生消失,Ki67、P53阴性,化验CEA降至正常。2016年1月在我院(解放军第208医院)复查CEA正常(具体见下表1)。胃部不适症状显著缓解直至消失。至今症状未再复发,达到临床治愈。
表1临床病例2患者不同时间的CEA检测值
3、患者刘某某,男性,61岁,于2008年1月无明显诱因出现进食梗咽伴食后腹胀,全身乏力。在吉林北华大学附属医院胃镜检查示:萎缩性胃炎,胃活检病理示:慢性活动性萎缩性胃炎,腺上皮中度肠化生及异型增生。2008年6月在北京协和医院行胃镜检查,病理示:胃粘膜急性及慢性炎症伴中度肠上皮化生。经抗炎、杀灭幽门螺旋杆菌及保护胃粘膜等对症治疗后无明显好转。2015年4月来我院(解放军第208医院),胃镜示:慢性糜烂-萎缩性胃炎,伴息肉样增生,胃粘膜间质充血出血,见炎细胞,局部小血管增生似肉芽组织,见肠上皮化生呈息肉样。癌变可能极大,且无法手术治疗,患者生活在恐惧担忧之中。给予本发明免疫细胞制剂治疗,2015年12月在我院(解放军第208医院)复查胃镜示,胃粘膜未见充血出血,肠上皮化生逆转消失,息肉样增生和肉芽组织消失,患者症状明显缓解,至2016年2月,患者梗咽、腹胀症状完全消失,体力显著增强,能下地干农活,随访至今情况良好,达到临床治愈。
4、患者张某某,女性,51岁,上腹部不适十余年。于2014年5月症状加重,上腹胀痛,放散至左肋弓、肩背部酸痛,伴反酸嗳气。在吉林大学第三医院行胃镜检查示:食管炎,慢性萎缩性胃炎并糜烂,多发息肉,病理回报:胃粘膜慢性炎症,肠上皮化生,重度异型增生。经口服消炎药、多种胃药、中药等病情无明显好转,于2015年4月来我院(解放军第208医院)给予本发明免疫细胞制剂治疗,2疗程后腹痛症状显著缓解,反酸嗳气减轻,继续治疗4疗程后在吉林大学第三医院复查胃镜示:萎缩性胃炎并糜烂消失,轻度浅表性胃炎,多发息肉及重度异型增生均消失。患者不适症状已完全缓解,生活饮食恢复正常,达到临床治愈。
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其细节上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!