本发明涉及一种抗癌生物材料的制备方法,还涉及一种增进抗癌药物的抗癌效果的方法,属于生物医药领域。
背景技术:
化学治疗是目前应用最为广泛的癌症治疗手段。然而,传统的化学治疗会导致很多的负面效应,如头发脱落、热损伤、恶心等症状。为此,现有技术提出了如利用氧化石墨烯等具有生物相容性的材料来负载和传递治疗药物的方法,以提升癌症治疗效率。
然而,氧化石墨烯在水溶液和含有高浓度盐、蛋白和血清的细胞培养液中很容易产生团聚现象,且对哺乳动物细胞的具有生物毒性。另一方面,虽然研究发现还原态的氧化石墨烯的生物毒性较氧化石墨烯低,但现有的还原方法存在产率低、成本高的问题;而成本低的还原方法,其使用的还原剂通常具有强毒性或强酸碱度,且其产物分散性差,阻碍了其在生物医学中的应用。
“背景技术”段落只是用来帮助了解本
技术实现要素:
,因此在“背景技术”段落所揭露的内容可能包含一些没有构成所属技术领域中具有通常知识者所知道的习知技术。在“背景技术”段落所揭露的内容,不代表该内容或者本发明一个或多个实施例所要解决的问题,在本发明申请前已被所属技术领域中具有通常知识者所知晓或认知。
发明内容
本发明的一个目的是提供一种具有高负载率、可被细胞内吞,且对癌细胞有特异性作用的生物材料。
本发明的另一个目的是提供一种可选择性的在癌细胞内释放药物的生物材料。
本发明的又一个目的是提供一种利用茶多酚修饰生物材料,以增进抗癌治疗效果的方法。
本发明的其他目的和优点可以从本发明所揭露的技术特征中得到进一步的了解。
为达上述之一或部份或全部目的或是其他目的,本发明一方面提供了一种抗癌生物材料的制备方法,包括以下步骤:提供具有生物相容性的载体;以及以茶多酚作为还原剂或功能化试剂,还原和修饰所述的载体。
优选地,所述的具有生物相容性的载体材料为氧化石墨烯。
优选地,所述的氧化石墨烯的还原和修饰是利用原位水热合成法反应完成。
优选地,所述的抗癌生物材料的制备方法,还包括以下步骤:将茶多酚还原和修饰的载体与药物混合,使药物负载于茶多酚还原和修饰的载体上。
优选地,所述的药物为盐酸阿霉素。
优选地,所述的药物的负载是在pH值为7~8的条件下完成。
本发明另一方面还提供了一种增进抗癌药物的抗癌效果的方法,其特征在于,包括以下步骤:提供具有生物相容性的载体;以茶多酚作为还原剂或功能化试剂,还原和或修饰所述的载体;以及将茶多酚还原和或修饰的载体与药物混合,使药物负载于茶多酚还原和或修饰的载体上。
优选地,所述的具有生物相容性的载体为氧化石墨烯。
优选地,所述的药物为盐酸阿霉素。
优选地,所述的药物的负载是在pH值为7~8的条件下完成。
本发明的有益效果在于:本发明采用茶多酚作为还原剂和功能化试剂来修饰氧化石墨烯,制备茶多酚修饰的还原氧化石墨烯(简称茶多酚石墨烯)。相较于现有的还原氧化石墨烯,本发明的茶多酚石墨烯在水溶液和生理条件下都较为稳定,水分散性和生物相容性良好,且可选择性的对癌细胞产生毒性,对正常体细胞则表现出友好的性质。此外,利用本发明的茶多酚石墨烯负载盐酸阿霉素,可显著提高阿霉素的对癌细胞的穿透性和细胞核富集量,并能促进癌细胞的细胞凋亡。因此,本发明在药物传递、癌症治疗领域有广泛的应用前景。
为让本发明的上述和其它目的、特征和优点能更明显易懂,下文特举优选实施例,并配合附图,作详细说明如下。
附图说明
图1为本发明的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的紫外可见光(UV-Vis)光谱图。
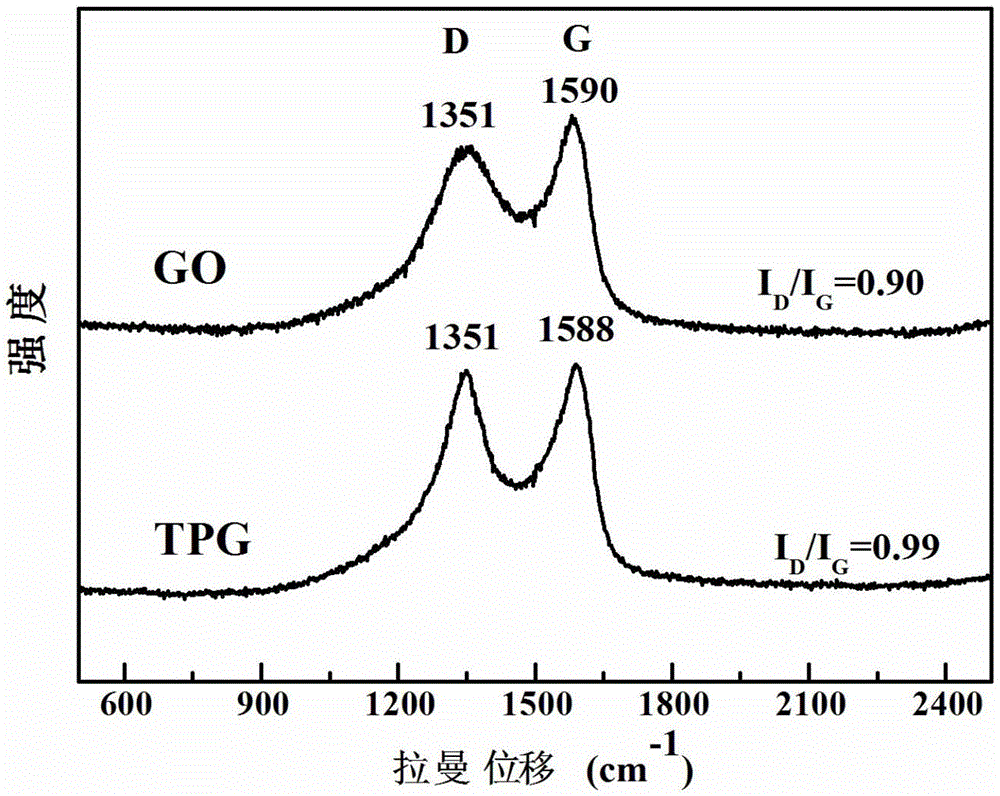
图2本发明的氧化石墨烯和茶多酚石墨烯的拉曼(Raman)光谱图。
图3a~3d分别为本发明的氧化石墨烯、阿霉素石墨烯(GO-DOX)、茶多酚石墨烯和阿霉素茶多酚石墨烯(TPG-DOX)的扫描电子显微镜(SEM)影像。
图4a~4d分别为本发明的氧化石墨烯、茶多酚石墨烯、阿霉素石墨烯和阿霉素茶多酚石墨烯的原子力显微镜(AFM)影像。
图5a为本发明的氧化石墨烯和茶多酚石墨烯的X射线粉末衍射(XRD)图。
图5b分别为商购阿霉素(DOX)与本发明的阿霉素石墨烯和阿霉素茶多酚石墨烯的X射线粉末衍射图。
图5c为商购阿霉素与本发明的氧化石墨烯、茶多酚石墨烯、阿霉素石墨烯和阿霉素茶多酚石墨烯的红外光谱(FT-IR)图。
图5d为商购阿霉素与本发明的氧化石墨烯、茶多酚石墨烯、阿霉素石墨烯和阿霉素茶多酚石墨烯在pH=7.4下的ζ电位图。
图6a~6e分别为本发明的氧化石墨烯、茶多酚石墨烯、阿霉素石墨烯和阿霉素茶多酚石墨烯与商购阿霉素的亲水角图。
图7绘示pH值对本发明的氧化石墨烯和茶多酚石墨烯的阿霉素负载效果的影响。
图8绘示反应时间对本实施例的氧化石墨烯和茶多酚石墨烯的阿霉素负载效果的影响,以及其吸附动力学。
图9绘示阿霉素初始浓度对本实施例的氧化石墨烯和茶多酚石墨烯的负载效果的影响,以及其吸附等温线。
图10绘示不同pH值和时间对本发明的阿霉素石墨烯和阿霉素茶多酚石墨烯的释放效果的影响。
图11绘示本发明的氧化石墨烯和茶多酚石墨烯对成纤维细胞(L929)和腺样囊性癌(ACC2)细胞的细胞存活率的影响。
图12绘示本发明的阿霉素石墨烯和阿霉素茶多酚石墨烯对ACC2细胞的存活率的影响。
图13为本发明的阿霉素石墨烯和阿霉素茶多酚石墨烯对ACC2细胞的穿透效果的细胞流式图。
图14为本实施例的氧化石墨烯、茶多酚石墨烯、阿霉素石墨烯和阿霉素茶多酚石墨烯对ACC2细胞的凋亡促进效果的二维细胞流式图。
具体实施方式
有关本发明的前述及其它技术内容、特点与功效,在以下配合参考附图中的一个优选实施例的详细说明中,将可清楚的呈现。
除非另外说明,本文中的术语“氧化石墨烯”指的是剥离后的单层或多层氧化石墨,附图中以缩写“GO”表示。
除非另外说明,本文中的术语“茶多酚石墨烯”指的是茶多酚修饰的还原氧化石墨烯,附图中以缩写“TPG”表示。
除非另外说明,本文中的术语“阿霉素”指的是盐酸阿霉素,为蒽环类广谱抗肿瘤抗生素阿霉素(doxorubicin)的盐酸盐,附图中以缩写“DOX”表示。
除非另外说明,本文中的术语“阿霉素石墨烯”指的是使用上述的氧化石墨烯作为药物载体,负载了阿霉素的氧化石墨烯,附图中以缩写“GO-DOX”表示。
除非另外说明,本文中的术语“阿霉素茶多酚石墨烯”指的是使用上述的茶多酚修饰的还原氧化石墨烯作为药物载体,负载了阿霉素的茶多酚石墨烯,附图中以缩写“TPG-DOX”表示。
除非另外说明,本文中的术语“细胞的异常增殖”指的是细胞的生长、分化和凋亡偏离细胞正常的生长周期。
除非另外说明,本文中的术语“细胞异常增殖有关的疾病”指的是为再生性障碍性贫血或恶性肿瘤,如口腔癌、乳腺癌、宫颈癌、卵巢癌、结肠癌、子宫内膜癌、肝癌、肺癌、骨髓癌、前列腺癌或胃癌等。
实施例一
茶多酚石墨烯(TPG)的制备
步骤一:由氧化石墨制备氧化石墨烯。将10mg的氧化石墨在400W的超声情况下超声1h,使其分散于20mL的超纯水中,继续超声一段时间,使其形成胶状分散液。然后4000rpm离心20min,以分离没有剥离开的氧化石墨和剥离完成的氧化石墨烯,去除沉淀、收集上清液。
步骤二:由氧化石墨烯制备茶多酚石墨烯。以茶多酚作为还原剂和功能化试剂,使用原位水热合成法进行制备。首先,将60mg茶多酚溶于20mL的超纯水中,然后慢慢加入20mL 0.5mg/mL的氧化石墨烯溶液中,强烈搅拌形成均匀的溶液。经过10min的超声处理后,将溶液转入50mL的高温反应釜中,在80℃下反应8h。最终得到的产物在11000rpm下离心,去掉上清液,使用超纯水洗涤3次,然后置于透析袋中透析1周,以去除游离的茶多酚。
茶多酚石墨烯的表征
请参照图1,图1为本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的紫外可见光(UV-Vis)光谱图。如图1所示,氧化石墨烯由于C=C的π-π*转变,在228nm处出现吸收峰;在使用茶多酚作为还原剂,修饰还原氧化石墨烯而生成茶多酚石墨烯后,228nm的吸收峰红移到271nm,且208nm处出现了茶多酚的吸收峰,表明了茶多酚分子成功负载到氧化石墨烯上。
请参照图2,图2为本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的拉曼(Raman)光谱图。如图2所示,氧化石墨烯和茶多酚石墨烯都呈现明显的D峰和G峰。氧化石墨烯的G峰出现在1590cm-1处,而茶多酚石墨烯的G峰蓝移到1588cm-1处,与纯石墨的G峰(1587cm-1)波长相近,表明了茶多酚成功还原了氧化石墨烯。此外,茶多酚石墨烯的D峰和G峰的强度比值(ID/IG)为0.99,高于氧化石墨烯的比值0.90,也表明了使用茶多酚还原后,石墨烯结构的恢复。
请参照图3a和3c。图3a和3c分别为本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的扫描电子显微镜(SEM)影像。其中,图3a和3c中可观察到分子团聚而产生的皱褶,且相较于图3a中所示的氧化石墨烯的表面,图3c中所示的茶多酚石墨烯的表面较为光滑,显示茶多酚不但可作为石墨烯的还原剂,还可作为一种功能性修饰分子,插入石墨烯的层状结构中,可降低分子团聚现象。
请参照图4。图4a和4b分别为本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的原子力显微镜(AFM)影像,其显示了氧化石墨烯和茶多酚石墨烯的三维形貌。经仪器自带软件量测,两者的厚度分别约为1.02±0.07nm和1.91±0.04nm。
请参照图5a。图5a为本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)的X射线粉末衍射(XRD)图,其横坐标为峰位(即衍射峰的2θ衍射角)、纵坐标为峰高。如图5a所示,氧化石墨烯的XRD特征峰为2θ=10°,在氧化石墨烯的含氧官能团被负载的茶多酚取代后,得到的茶多酚石墨烯的XRD特征峰红移为2θ=26°。
请参照图5c。图5c为商购阿霉素(DOX)与本实施例的氧化石墨烯(GO)、茶多酚石墨烯(TPG)、阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)的红外光谱(FT-IR)图,其横坐标为波数、纵坐标为透射率。如图5c所示,氧化石墨烯和茶多酚石墨烯的FT-IR特征峰均包括:3410cm-1的羟基O-H伸缩振动峰、1724cm-1的羧基C=O伸缩振动峰、1052cm-1的环氧基C-O振动峰。此外,相较于氧化石墨烯,茶多酚石墨烯在1724cm-1和3410em-1处的峰强度有所降低,说明了石墨烯加入茶多酚还原后,含氧量有所下降。
请参照图5d。图5d为商购阿霉素(DOX)与本实施例的氧化石墨烯(GO)、茶多酚石墨烯(TPG)、阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)在pH=7.4下的ζ电位图,其中的长条柱分别代表上述的五种材料,纵坐标显示电位值。如图5d所示,氧化石墨烯由于表面含有较多的含氧官能团,显示了较强的负电位(-52.97mV);使用茶多酚还原后,茶多酚石墨烯的表面含氧官能团减少,负电位提高到-35.57mV。
请参照图6。图6a~6e分别为与本实施例的氧化石墨烯(GO)、茶多酚石墨烯(TPG)、阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)的与商购阿霉素(DOX)亲水角图。如图6所示,氧化石墨烯和茶多酚石墨烯的亲水角分别为37.8°±1.3°和34.8°±0.0°。
实施例二
阿霉素石墨烯(GO-DOX)的制备
步骤1:将1mL 0.5mg/mL的氧化石墨烯(依照前述方法制备)和1mL 200ppm的商购阿霉素,分别溶解于pH 2~11的磷酸缓冲液(PBS)溶液中。
步骤2:负载。将上述两者在黑暗条件下进行混合,并在37℃、200rpm摇摆的条件下,反应0.5~30小时。
步骤3:分离纯化。10000rpm离心30min,再使用PBS洗涤3次直至上清液变成无色。
阿霉素石墨烯的表征
请参照图3a和3b。图3a和3b分别为氧化石墨烯(GO)和阿霉素石墨烯(GO-DOX)的扫描电子显微镜(SEM)影像。其中,相较于图3a中所示的氧化石墨烯的表面,图3b中所示的阿霉素石墨烯的表面发生了明显的团聚。
请参照图4a和4c。图4a和4c分别为氧化石墨烯(GO)和阿霉素石墨烯(GO-DOX)的原子力显微镜(AFM)影像,其显示了氧化石墨烯和阿霉素石墨烯的三维形貌。如图所示,当氧化石墨烯载入阿霉素后,盐酸阿霉素颗粒像种子般洒在了氧化石墨烯的表面,且厚度也有明显的增加。经仪器自带软件量测,氧化石墨烯在负载了盐酸阿霉素后,厚度由1.02±0.07nm增加至16.52±10.87nm。
请参照图5b。图5b为商购阿霉素(DOX)与本实施例的阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)的X射线粉末衍射(XRD)图,其横坐标为峰位(即衍射峰的2θ衍射角)、纵坐标为峰高。如图5b所示,阿霉素的XRD特征峰为2θ=32°和46°;而氧化石墨烯在负载了阿霉素后,氧化石墨烯的原XRD特征峰2θ=10°没有发生位移,并增加了阿霉素的两个XRD特征峰2θ=32°和46°。也就是说,阿霉素石墨烯的XRD特征峰包含2θ=10°、32°和46°。此外,负载阿霉素后没有新特征峰的出现,表明了氧化石墨烯和阿霉素之间可能通过简单的作用力,如π-π作用力、范德华作用力和/或氢键作用力,进行物理吸附。
请再次参照图5c。如图5c所示,氧化石墨烯(GO)的FT-IR特征峰包括:3410cm-1的羟基O-H伸缩振动峰、1724cm-1的羧基C=O伸缩振动峰、1052cm-1的环氧基C-O振动峰。在成功负载了阿霉素而形成阿霉素石墨烯后,除了可观察到上述的石墨烯特征峰,在1750cm-1处还显示了阿霉素的特征峰。
请再次参照图5d。如图5d所示,商购盐酸阿霉素(DOX)带正电荷,电位为9.86mV;氧化石墨烯(GO)则带负电荷,电位为-52.97mV。当氧化石墨烯负载阿霉素形成阿霉素石墨烯后,电位由负载前的-52.97mV提高到-16.33mV,表明了阿霉素是通过静电作用力负载到氧化石墨烯的表面。
请再次参照图6。如图6所示,氧化石墨烯(GO)和阿霉素石墨烯(GO-DOX)的亲水角分别为37.8°±1.3°和64.9°±0.9°,表明氧化石墨烯在负载了阿霉素后,表面含氧官能团减少,导致亲水性降低。
pH值对负载效果的影响
将本实施例的氧化石墨烯和阿霉素分别溶解于不同pH2.0、pH4.0、pH7.4、pH9.0和pH11.0的PBS溶液,避光混合24h后,离心取上清液,采用超高压液相色谱(UPLC)测量上清液中阿霉素的浓度。并根据公式1和公式2计算负载效率(E)和负载容量(qe):
负载效率(%)=(W加入-W游离)/W加入×100%--公式1
负载容量(mg/g)=(W加入-W游离)/W材料×100%--公式2
其中,W加入为阿霉素的初始浓度、W游离为上清液中阿霉素的浓度、W材料为氧化石墨烯的加入量。
请参照图7a,图7a绘示pH值对本实施例的氧化石墨烯(GO)的阿霉素负载效果的影响,其横坐标为溶液的pH值,纵坐标为负载效率以及负载容量。如图7a所示,过酸(pH2.0)或过碱(pH 11.0)的条件均不利于阿霉素的负载;而在pH=7.4时,氧化石墨烯对阿霉素的负载效率和负载容量都达到最高。
时间对负载效果的影响
将本实施例的氧化石墨烯和阿霉素分别溶解于pH7.4的PBS溶液中,避光混合后,反应10min、20min、30min、1h、1.5h、2h、2.5h、5h、10h、24h和30h,离心取上清液,采用UPLC测量上清液中阿霉素的浓度,并根据上述公式1和公式2计算负载效率(E)和负载容量(qe)。
请参照图8a,图8a绘示反应时间对本实施例的氧化石墨烯(GO)的阿霉素负载效果的影响,以及氧化石墨烯和阿霉素之间的吸附动力学研究,其横坐标为反应时间,纵坐标分别为负载效率以及负载容量。如图8a所示,随着反应时间的增加,氧化石墨烯对阿霉素的吸附效率和吸附容量都有所增加;其中,吸附效率在反应2min时便达到83.50%,而反应24h后,吸附效率达到95.06%,呈现吸附平衡状态。因此,本实施例中,氧化石墨烯负载阿霉素的最佳反应时间为24h。
此外,基于典型的准一级动力学模型(公式3)和准二级动力学模型(公式4)的吸附动力学研究发现,本实施例的氧化石墨烯具有很高的准一级和准二级相关系数(R2均大于0.98),表明了阿霉素主要是靠化学作用力负载在氧化石墨烯上。
阿霉素初始浓度对负载效果的影响
将本实施例的氧化石墨烯与25ppm、50ppm、100ppm、150ppm、200ppm、250ppm、400ppm、500ppm、750ppm和800ppm的阿霉素,分别溶解于pH7.4的PBS溶液,避光混合24h后,离心取上清液,采用UPLC测量上清液中阿霉素的浓度,并根据上述公式1和公式2计算负载效率(E)和负载容量(qe)。
请参照图9a,图9a绘示阿霉素初始浓度对本实施例的氧化石墨烯(GO)的负载效果的影响,以及氧化石墨烯和阿霉素之间的吸附等温线研究,其横坐标为阿霉素的浓度,纵坐标分别为负载效率和负载容量。如图9a所示,随着阿霉素浓度的增加,本实施例的氧化石墨烯的负载效率逐渐减低、负载容量逐渐升高。其中,在阿霉素浓度为25-250ppm时,氧化石墨烯的负载效率达到98.69%,基本处于平衡状态;当阿霉素浓度高于250ppm时,氧化石墨烯的吸附效率有所下降;阿霉素浓度为800ppm时,氧化石墨烯的吸附效率降至45.10%,表明了在此浓度下,氧化石墨烯需要更多的活性位点来容纳过多的阿霉素。因此,在本实施例中,等体积的0.5mg/mL的氧化石墨烯复合200ppm的阿霉素,为较佳的混合配比,能达到较高的吸附效率。
此外,如表1所示,基于典型的Langmuir吸附等温线模型(公式5)和Freundlich吸附等温线模型(公式6)的吸附等温线研究发现,本实施例的氧化石墨烯能符合上述两种模型(R2均大于0.97),说明单层吸附和多相吸附均发生在氧化石墨烯的表面,且氧化石墨烯对阿霉素的最大吸附容量能达到1.289×104mg/g。
表1
pH值和时间对释放效果的影响
将本实施例的阿霉素氧化石墨烯分别溶解于不同pH的PBS缓冲溶液中,包括pH=7.4(正常生理pH),pH=6.8(癌组织内的pH),pH=5.0(癌细胞胞浆内的pH),37℃避光混合后,200rpm摇摆反应1h、3h、6h、12h、24h、48h、72h、96h、120h和168h,离心取上清液,采用UPLC测量上清液中阿霉素的浓度。
请参照图10a,图10a绘示不同pH值和时间对阿霉素石墨烯(GO-DOX)的释放效果的影响,其横坐标为时间(h),纵坐标为阿霉素的释放效率(%)。如图10a所示,本实施例的阿霉素石墨烯具有一定的缓释能力,释放效率在6天后基本处于平稳。此外,阿霉素石墨烯在168h后在pH=7.4、pH=6.8和pH=5.0的条件下,释放效率分别达到了9.81%、21.14%和38.72%,pH=5.0的条件下释放效率远远高于pH=6.8和pH=7.4,表明阿霉素石墨烯的释放与氢离子浓度相关,阿霉素在癌组织环境中能更有效的释放。
实施例三
阿霉素茶多酚石墨烯(TPG-DOX)的制备
步骤1:将1mL 0.1mg/mL的茶多酚石墨烯(依照前述方法制备)和1mL 200ppm的商购阿霉素,分别溶解于pH 2~11的磷酸缓冲液(PBS)溶液中。
步骤2:负载。将上述两者在黑暗条件下进行混合,并在37℃、200rpm摇摆的条件下,反应0.5~30小时。
步骤3:分离纯化。10000rpm离心30min,再使用PBS洗涤3次直至上清液变成无色。
阿霉素茶多酚石墨烯的表征
请参照图3c和d。图3c和d分别为茶多酚石墨烯(TPG)和阿霉素茶多酚石墨烯(TPG-DOX)的扫描电子显微镜(SEM)影像。其中,相较于图13c中所示的茶多酚石墨烯的表面,图13d中所示的阿霉素茶多酚石墨烯的表面发生了明显的团聚。
请参照图4b和4d。图4b和4d分别为茶多酚石墨烯(TPG)和阿霉素茶多酚石墨烯(TPG-DOX)的原子力显微镜(AFM)影像,其显示了茶多酚石墨烯和阿霉素茶多酚石墨烯的三维形貌。如图所示,当茶多酚石墨烯载入阿霉素后,盐酸阿霉素颗粒像种子般洒在了茶多酚石墨烯的表面,且厚度也有明显的增加。经仪器自带软件量测,石墨烯在负载了盐酸阿霉素后,平面厚度由1.91±0.04nm增加至17.42±6.26nm。
请再次参照图5b。如图5b所示,阿霉素(DOX)的XRD特征峰为2θ=32°和46°;而茶多酚石墨烯在负载了阿霉素后,茶多酚石墨烯的原XRD特征峰2θ=26°没有发生位移,并增加了阿霉素的两个XRD特征峰2θ=32°和46°。也就是说,阿霉素茶多酚石墨烯(TPG-DOX)的XRD特征峰包含2θ=26°、32°和46°。且,阿霉素XRD特征峰的相对强度,阿霉素茶多酚石墨烯高于阿霉素石墨烯,表明了茶多酚石墨烯有更高的阿霉素负载量。此外,负载阿霉素后没有新特征峰的出现,表明了茶多酚石墨烯和阿霉素之间可能通过简单的作用力进行物理吸附,如π-π作用力、范德华作用力和/或氢键作用力。
请再次参照图5c。如图5c所示,茶多酚石墨烯的FT-IR特征峰包括:3410cm-1的羟基O-H伸缩振动峰、1724cm-1的羧基C=O伸缩振动峰、1052cm-1的环氧基C-O振动峰。在成功负载了阿霉素而形成阿霉素茶多酚石墨烯(TPG-DOX)后,除了可观察到上述的特征峰外,在1750cm-1处还显示了阿霉素的特征峰。
请再次参照图5d。如图5d所示,商购盐酸阿霉素(DOX)带正电荷,电位为9.86mV;茶多酚石墨烯则带负电荷,电位为-35.57mV。当茶多酚石墨烯负载阿霉素形成阿霉素茶多酚石墨烯(TPG-DOX)后,电位由负载前的-35.57mV提高到-2.72mV,表明了阿霉素是通过静电作用力负载到茶多酚石墨烯的表面。
请再次参照图6。如图6所示,茶多酚石墨烯(TPG)和阿霉素茶多酚石墨烯(TPG-DOX)的亲水角分别为34.8°±0.0°和35.5°±0.0°,两者的亲水角相似,且对比阿霉素石墨烯的亲水角(64.9°±0.9°),阿霉素茶多酚石墨烯显示了较好的亲水性,有利于阿霉素在体液中的渗透及传递。
pH值对负载效果的影响
将本实施例的茶多酚石墨烯和阿霉素分别溶解于不同pH2.0、pH4.0、pH7.4、pH9.0和pH11.0的PBS溶液,避光混合24h后,离心取上清液,采用超高压液相色谱(UPLC)测量上清液中阿霉素的浓度。并根据前述公式1和公式2计算负载效率(E)和负载容量(qe)。
请参照图7b,图7b绘示pH值对本实施例的茶多酚石墨烯(TPG)的阿霉素负载效果的影响,其横坐标为溶液的pH值,纵坐标为负载效率以及负载容量。如图7b所示,过酸(pH2.0)或过碱(pH11.0)的条件均不利于阿霉素的负载;而在pH=7.4时,氧化石墨烯对阿霉素的负载效率和负载容量都达到最高。
时间对负载效果的影响
将本实施例的茶多酚石墨烯和阿霉素分别溶解于pH7.4的PBS溶液中,避光混合后,反应10min、20min、30min、1h、1.5h、2h、2.5h、5h、10h、24h和30h,离心取上清液,采用UPLC测量上清液中阿霉素的浓度,并根据前述公式1和公式2计算负载效率(E)和负载容量(qe)。
请参照图8b,图8b绘示反应时间对本实施例的茶多酚石墨烯(TPG)的阿霉素负载效果的影响,以及茶多酚石墨烯和阿霉素之间的吸附动力学研究,其横坐标为反应时间,纵坐标分别为负载效率以及负载容量。如图8b所示,随着反应时间的增加,茶多酚石墨烯对阿霉素的吸附效率和吸附容量都有所增加;其中,吸附效率在反应2min时便高达到94.50%,且在反应10h后,吸附效率达到95.52%,呈现吸附平衡状态。因此,本实施例中,茶多酚石墨烯负载阿霉素的最佳反应时间为10h;相较于氧化石墨烯在反应24h后,才达到95.06%的吸附效率,茶多酚石墨烯具有更为显著的负载效果。
此外,基于前述的准一级动力学模型(公式3)和准二级动力学模型(公式4)的吸附动力学研究发现,本实施例的茶多酚石墨烯的准二级动力学系数(R2=1.000)远高于准一级系数(R2=0.5592),表明茶多酚石墨烯的负载行为,包括阿霉素和茶多酚石墨烯之间通过电子共享或交换形成的化学吸附,属于限速步骤。
阿霉素初始浓度对负载效果的影响
将本实施例的茶多酚石墨烯与25ppm、50ppm、100ppm、150ppm、200ppm、250ppm、400ppm、500ppm、750ppm和800ppm的阿霉素,分别溶解于pH7.4的PBS溶液,避光混合10h后,离心取上清液,采用UPLC测量上清液中阿霉素的浓度,并根据前述的公式1和公式2计算负载效率(E)和负载容量(qe)。
请参照图9b,图9b绘示阿霉素初始浓度对本实施例的茶多酚石墨烯(TPG)的负载效果的影响,以及茶多酚石墨烯和阿霉素之间的吸附等温线研究,其横坐标为阿霉素的浓度,纵坐标分别为负载效率和负载容量。如图9b所示,随着阿霉素浓度的增加,本实施例的氧化石墨烯的负载效率逐渐减低、负载容量逐渐升高。其中,在阿霉素浓度为25-250ppm时,茶多酚石墨烯的负载效率达到90.16%,基本处于平衡状态;当阿霉素浓度高于250ppm时,茶多酚石墨烯的吸附效率有所下降;阿霉素浓度为800ppm时,茶多酚石墨烯的吸附效率降至44.68%,表明了在此浓度下,茶多酚石墨烯需要更多的活性位点来容纳过多的阿霉素。因此,在本实施例中,等体积的0.1mg/mL的茶多酚石墨烯复合200ppm的阿霉素,为较佳的混合配比,能达到较高的吸附效率。
此外,如前述表1所示,基于前述的Langmuir吸附等温线模型(公式5)和Freundlich吸附等温线模型(公式6)的吸附等温线研究发现,本实施例的茶多酚石墨烯能符合上述两种模型(R2均大于0.99),说明单层吸附和多相吸附均发生在茶多酚石墨烯的表面,且茶多酚石墨烯对阿霉素的最大吸附容量能达到1.293×106mg/g。相较于氧化石墨烯的1.289×104mg/g,茶多酚石墨烯对阿霉素具有更显著的吸附力,可能是由于茶多酚的插入减少了石墨烯的团聚,使其具有更大的比表面积。
pH值和时间对释放效果的影响
将本实施例的阿霉素茶多酚石墨烯分别溶解于不同pH的PBS缓冲溶液中,包括pH=7.4(正常生理pH),pH=6.8(癌组织内的pH),pH=5.0(癌细胞胞浆内的pH),37℃避光混合后,200rpm摇摆反应1h、3h、6h、12h、24h、48h、72h、96h、120h和168h,离心取上清液,采用UPLC测量上清液中阿霉素的浓度。
请参照图10b,图10b绘示不同pH值和时间对阿霉素茶多酚石墨烯(TPG-DOX)的释放效果的影响,其横坐标为时间(h),纵坐标为阿霉素的释放效率(%)。如图10b所示,本实施例的阿霉素茶多酚石墨烯具有一定的缓释能力,释放效率在6天后基本处于平稳。此外,阿霉素茶多酚石墨烯在168h后在pH=7.4、pH=6.8和pH=5.0的条件下,释放效率分别达到了6.49%、11.64%和27.49%。其在pH=5.0的条件下释放效率远远高于pH=6.8和pH=7.4,表明阿霉素石墨烯的释放与氢离子浓度相关,阿霉素在癌组织环境中能更有效的释放。此外,相较于前述的阿霉素石墨烯的释放效率(参照图12a),阿霉素茶多酚石墨烯的释放效率较低,说明茶多酚石墨烯与阿霉素之间的作用力强于氧化石墨烯。
实施例四
茶多酚石墨烯对癌细胞的异常增殖能力的抑制
分别将成纤维细胞(L929)和腺样囊性癌(ACC2)细胞以5×104个细胞/孔的密度接种于96孔板中,在37℃、5%的CO2浓度下过夜培养。将依照前述方法制备的氧化石墨烯和茶多酚石墨烯分别配制5μg/mL、25μg/mL、50μg/mL、100μg/mL、150μg/mL和250μg/mL的水溶液,然后与L929和ACC2细胞分别在37℃、5%CO2浓度的条件下共培养24h、48h和72h。最后,使用细胞计数试剂盒(CCK-8)检测检测细胞的增殖能力。
请参照图11,图11绘示本实施例的氧化石墨烯(GO)和茶多酚石墨烯(TPG)分别对L929和ACC2细胞的存活率的影响,其横坐标为氧化石墨烯或茶多酚石墨烯的浓度,纵坐标为细胞存活率。如图11a和11c所示,随着氧化石墨烯的浓度的增加和培养时间的加长,L929细胞(图11a)和ACC2细胞(图11c)的存活率有明显的下降;尤其,当氧化石墨烯为250μg/mL、与细胞共培养72h时,L929和ACC2的细胞存活率分别降至42%和50%。而如图11b和11d所示,随着茶多酚石墨烯的浓度的增加和培养时间的加长,L929细胞(图11b)的存活率几乎不受影响,而ACC2(图11d)的存活率则有明显的下降;尤其,当茶多酚石墨烯为250μg/mL、与细胞共培养72h时,L929细胞的存活率基本为100%,而ACC2细胞的存活率显著下降至20%。
上述结果显示,氧化石墨烯对L929和ACC2两种细胞都存在有时间和浓度依赖性;而茶多酚石墨烯则是选择性的对ACC2癌细胞产生细胞毒性,对L929正常体细胞不具明显的毒性;此表明了茶多酚石墨烯不但具有良好的生物相容性,且可作为一种具有高度选择性的绿色抗癌药物。
须注意的是,本实施例虽以腺样囊性癌细胞为例,但本发明不以此为限;本发明所属领域的技术人员均能理解,本发明的茶多酚石墨烯还可用于抑制其他种类的恶性肿瘤细胞或其他与细胞异常增殖有关的疾病的细胞的异常增殖。此外,茶多酚还可用于修饰其他具有生物相容性的载体材料,同样可达到抑制细胞异常增殖的效果。
实施例五
阿霉素石墨烯和阿霉素茶多酚石墨烯对癌细胞的异常增殖能力的抑制
将腺样囊性癌(ACC2)细胞以5×104个细胞/孔的密度接种于96孔板中,在37℃、5%的CO2浓度下过夜培养。将商购盐酸阿霉素以及依照前述方法制备的阿霉素石墨烯和阿霉素茶多酚石墨烯分别配制为阿霉素的终浓度为1μM的水溶液,然后与ACC2细胞分别在37℃、5%CO2浓度的条件下共培养24h、48h和72h。最后,使用细胞计数试剂盒(CCK-8)检测检测细胞的增殖能力。
请参照图12,图12绘示本实施例的阿霉素石墨烯和阿霉素茶多酚石墨烯对ACC2细胞的存活率的影响,其横坐标长条柱依序表示作为对照组的等渗PBS、阿霉素(DOX)、阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX),纵坐标为ACC2细胞的存活率。如图12所示,相较于对照组和纯阿霉素,使用氧化石墨烯或茶多酚石墨烯作为阿霉素的载体时,ACC2的存活率明显降低;具体而言,在与阿霉素石墨烯和阿霉素茶多酚石墨烯共培养24h后,ACC2的细胞存活率分别为90%和89%,48h后为62%和59%,72h后则显著降低至48%和36%。阿霉素茶多酚石墨烯对ACC2的细胞毒性明显大于阿霉素石墨烯,可能是因为其较好的水溶性以及穿透性促进了细胞的摄入,进而提高了抑制癌细胞增殖的效果。
阿霉素石墨烯和阿霉素茶多酚石墨烯对癌细胞的穿透效果
将ACC2细胞以1.0×105的密度接种于24孔板中,在37℃、5%CO2浓度的条件下过夜培养,使用pH=7.4的PBS洗涤。将商购盐酸阿霉素以及本实施例的阿霉素石墨烯和阿霉素茶多酚石墨烯分别配制为阿霉素的终浓度为1μM的水溶液,然后与ACC2细胞共培养10min、30min、1h、2h和4h。最后,将细胞使用PBS洗涤,胰蛋白酶消化,2000rpm离心4min收集细胞,采用细胞流式仪选取2×104个细胞,通过观察阿霉素本身的红色荧光来分析阿霉素进入ACC2细胞的情况。
请参照图13,图13为本实施例的阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)对ACC2细胞的穿透效果的细胞流式图,其横坐标为荧光强度,纵坐标为细胞数。如图13所示,在共培养10min后,纯阿霉素(DOX)的摄入量仅为2.56%,随着时间的推移,1h后达到25.42%,4h后也仅仅达到48.95%;当使用氧化石墨烯作为阿霉素的载体时,10min达到5.36%,1h提升到59.37%,4h后基本全部摄入,达到98.51%;而使用茶多酚石墨烯作为阿霉素的载体时,则显著的加速了细胞对药物的摄入,10min时为7.50%,1h时就已基本全部摄入,摄入量高达99.83%,远远高于对阿霉素石墨烯(59.37%)和纯阿霉素(25.42%)的效果。此结果表明,以茶多酚石墨烯作为药物载体,可加快药物对癌细胞的穿透,提升药物摄入量,进而增强对癌细胞的抑制和治疗。
阿霉素石墨烯和阿霉素茶多酚石墨烯的细胞内定位
将ACC2细胞以4×105的密度接种于6孔板的玻片中,在37℃、5%的CO2浓度下过夜培养。将商购盐酸阿霉素以及本实施例的阿霉素石墨烯和阿霉素茶多酚石墨烯分别配制为阿霉素的终浓度为5μM的水溶液,以1mL/孔的量与ACC2细胞共培养4h。然后,将细胞使用PBS洗涤三次,再使用4%多聚甲醛在室温下固定5min。使用PBS洗涤后,使用2μg/mL的4,6-二脒基-2-苯基吲哚(DAPI)染色5min。最后,将玻片置于激光共聚焦显微镜(CLSM)下进行观察。
观察结果发现,在相同的时间内,与纯阿霉素的共培养,大部分的阿霉素集中在细胞质,只有极少部分围绕细胞核,而氧化石墨烯作为载体时,大部分释放出的阿霉素也富集在细胞质中,只有少量进入细胞核,细胞形态也没有太明显的变化;上述两种情况均较不利于对癌细胞的抑制和治疗。然而,当使用茶多酚石墨烯作为载体时,富集在细胞核中的阿霉素显著增加,且可以明显观察到细胞大小的萎缩。由此可知,茶多酚石墨烯是一种高效的药物载体,可促进药物富集并进入细胞核中,能有效提升癌细胞的抑制和治疗效率。
须注意的是,本实施例虽以腺样囊性癌细胞为例,但本发明不以此为限;本发明所属领域的技术人员均能理解,本发明的阿霉素茶多酚石墨烯还可用于抑制其他种类的恶性肿瘤细胞或其他与细胞异常增殖有关的疾病的细胞的异常增殖。此外,本实施例虽以负载阿霉素为例,但本发明不以此为限;本发明的氧化石墨烯和茶多酚石墨烯还可依照不同的癌症类型负载其他癌症治疗药物或辅助药物,同样可达到抑制细胞异常增殖的效果。
实施例六
阿霉素石墨烯和阿霉素茶多酚石墨烯促进癌细胞凋亡的效果
将腺样囊性癌(ACC2)细胞以5×105个细胞/孔的密度接种于24孔板中,在37℃、5%的CO2浓度下过夜培养。将商购盐酸阿霉素以及本实施例的阿霉素石墨烯和阿霉素茶多酚石墨烯分别配制为阿霉素的终浓度为1μM的水溶液,以1mL/孔的量与ACC2细胞共培养48h。然后,在室温、暗室条件下使用5μL的Annexin V-FITC和5μL的Propidium Iodide(PI)染色细胞15min。最后,使用细胞流式仪分析ACC2细胞死亡和凋亡的状况。
请参照图14,图14为等渗PBS和本实施例的氧化石墨烯(GO)、茶多酚石墨烯(TPG)、阿霉素石墨烯(GO-DOX)和阿霉素茶多酚石墨烯(TPG-DOX)对ACC2细胞的凋亡促进效果的二维细胞流式图,其横纵坐标均为荧光强度,R2区为坏死细胞,R3区为晚期凋亡细胞,R4区为活细胞,R5区为早期凋亡细胞。如图14所示,在PBS溶液下ACC2基本100%存活(图14a);纯氧化石墨烯可使ACC2凋亡,凋亡率达到21.10%(图14b);纯茶多酚石墨烯可使59.00%的ACC2细胞凋亡,显示优异的抗癌性能(图14c);纯阿霉素对ACC2的作用,死亡率为38.48%、凋亡率为57.89%(图14d)。此外,阿霉素石墨烯对ACC2的作用,死亡率为52.61%、凋亡率达到47.39%(图14e),表明以氧化石墨烯作为药物载体时,主要是通过提高细胞的死亡来杀死癌细胞的。而阿霉素茶多酚石墨烯对ACC2的作用,显示了死亡率为28.06%,凋亡率为71.94%(图14f),表明以茶多酚石墨烯作为药物载体时,主要是通过促进细胞凋亡途径来杀死癌细胞的。
须注意的是,本实施例虽以腺样囊性癌细胞为例,但本发明不以此为限;本发明所属领域的技术人员均能理解,本发明的阿霉素石墨烯和阿霉素茶多酚石墨烯还可用于促进其他种类的恶性肿瘤细胞或其他与细胞异常增殖有关的疾病的细胞的死亡和凋亡。此外,本实施例虽以负载阿霉素为例,但本发明不以此为限;本发明的氧化石墨烯和茶多酚石墨烯还可依照不同的癌症类型负载其他癌症治疗药物或辅助药物,同样可达到促进异常增殖细胞的死亡和凋亡的效果。
由上述的多个优选实施例可知,本发明采用茶多酚作为还原剂和功能化试剂来修饰氧化石墨烯,制备茶多酚修饰的还原氧化石墨烯。相较于现有的还原氧化石墨烯,本发明的茶多酚石墨烯在水溶液和生理条件下都较为稳定,水分散性和生物相容性良好,且可选择性的对癌细胞产生毒性,对正常体细胞则表现出友好的性质。此外,利用本发明的茶多酚石墨烯负载盐酸阿霉素,可显著提高阿霉素的对癌细胞的穿透性和细胞核富集量,并能促进癌细胞的细胞凋亡。因此,本发明在药物传递、癌症治疗领域有广泛的应用前景。
惟以上所述者,仅为本发明的优选实施例而已,当不能以此限定本发明实施的范围,即,大凡依本发明申请专利范围及发明说明内容所作的简单的等效变化与修饰,皆仍属本发明专利涵盖的范围内。另外本发明的任一实施例或申请专利范围无须达成本发明所揭露的全部目的或优点或特点。此外,摘要部分和标题仅是用来辅助专利文件搜寻之用,并非用来限制本发明的权利范围。