一种肝细胞膜仿生脂质体药物载体、制作方法及其应用与流程
本发明属于细胞治疗和脂质体药物精准输送技术领域,涉及一种肝细胞膜仿生脂质体药物载体,还涉及一种上述肝细胞膜仿生脂质体药物载体的制备方法,还涉及一种上述肝细胞膜仿生脂质体药物载体的应用,可用于精确靶向肝脏的药物输送和治疗。
背景技术:
药物的靶向性输送系统可以降低药物的使用量,提高药物的利用率,降低药物非靶向性的毒副作用,增加药物的有效性。当前药物的靶向给药系统包括脂质体、乳剂、微球、纳米粒等,其中脂质体给药系统是将药物装载在由脂类分子包裹(脂质体)的超微球状囊泡中,内部可装载亲水性药物,外层脂质分子层可装载亲脂性药物,大小一般在几个nm到几个μm。传统的各类脂质体对靶细胞的融合随机性比较大,特异性相对较低,由于脂质体膜缺乏专职介导膜融合的蛋白装置,脂质体的融合概率相对较低,造成了这种人工脂质体与靶细胞间的融合概率相对较低,与非靶细胞的非特异性融合增大,另外,传统脂质体易被体内的网状内皮系统所吞噬而被清理,导致药物的半衰期和有效性大大降低。设计针对特定细胞类型的脂质体是该领域的一个重要发展目标。
目前基因的靶向操作技术的进展,清除肝炎病毒基因组病毒源头的梦想逐渐成为现实,比如TALEN技术和CRISPR技术。二者各有优缺点,比如TALEN技术脱靶率很低,限于靶向性的DNA元件较大,超出多数载体的容量,因而不能用于多重打靶;而CRISPR技术仅采用一个核酸切割酶CAS9,搭载多个gRNA,可以实现多靶位切割,但是目前CRISPR存在一个缺点,即脱靶效应,对非特异性位点序列的切割会引起较大的麻烦和副作用。
无论TALEN和CRISPR技术,都存在体内的定向输送的难题,目前使用反转录病毒、慢病毒和AAV病毒介导的体内靶向,具有较高的感染率,但病毒系统的靶向性较差,某些病毒会整合基因组引起基因的异常变化,因而还存在一定的风险性。而普通质粒的风险性大大低于病毒的风险性,但质粒存在细胞导入效率较低,在细胞内的持续性表达时间较短等缺点,而且靶向性解决不了,非特异性副作用也是一个急需解决的问题,妨碍了临床的治疗应用。
肝炎病毒分为至少有5种,即甲、乙、丙、丁、戊型肝炎病毒,分别引起甲、乙、丙、丁、戊型病毒性肝炎,其中国内危害较重的为乙型肝炎。乙型肝炎病毒(HBV)分为ABCDEF等基因型,东亚等地区主要为B型乙肝病毒基因型。乙型肝炎病毒的基因组(HBV-DNA)是由两条螺旋的DNA链围成的一个环形结构。其中一条较长负链已经形成完整的环状;另一条长度较短的正链,呈半环状。在感染肝细胞之后,这条半环状的DNA链就会以负链为模板,在乙肝聚合酶(pol)的作用下延长,最终形成完整的环状。这种DNA被称做共价闭合环状DNA(即cccDNA),为病毒复制的原始模板。模板形成后,病毒基因会以其中的一条cccDNA为模板,利用肝细胞基因中的酶和DNA聚合酶的"催化",一段基因又一段基因地复制,形成负链和正链。最后再装配到一起形成新的HBV-DNA颗粒。HBV DNA负链有四个开放区,分别称为S、C、P及X(图26-2),能编码全部已知的HBV蛋白质。S区可分为二部分,S基因和前S基因。S基因(核苷酸155~833)能编码主要表面蛋白。S基因之前是一个能编码163个氨基酸(2,848-154)的前S基因,编码Pre S1和Pre S2蛋白。C区基因包括前C基因和C基因,分别编码HBeAg和HBcAg;P区(HBV聚合酶pol)最长,约占基因组75%以上,编码病毒体DNA多聚酶。HBV的X区(核苷酸1,374~1,835)可能编码有154个氨基酸的碱性多肽,长链的裂口位于此区。
纯化的HBsAg含有类脂质、糖类、脂质、蛋白质及糖蛋白。它由8种多肽和蛋白白组成:(1)主要表面蛋白(S蛋白,小分子HBsAg),由S基因编码的226个氨基酸组成。(2)中分子蛋白(中分子HBsAg),由前S2、S基因编码,在S蛋白226个氨基酸的N端附加一个含55个氨基酸的Pre S2蛋白组成,共281个氨基酸。(3)大分子蛋白(大分子HBsAg),由S,前S1和前S2基因编码,在中分子蛋白281个氨基酸的N端附加一个含119个氨基酸的Pre S1蛋白组成,共400个氨基酸。在乙型肝炎病人血循环中常可测出HBsAg—抗HBs的免疫复合物。免疫复合物可引起Ⅲ型变态反应,其中以关节炎和肾炎最为常见。在暴发性肝炎病从血中有时也可同时测HBsAg—抗HBs,这种病人预后不良,死亡率高。因此,认为免疫复合物可在肝外引起病人的一系列症状。由于HBV不会裂解被感染的肝细胞,机体清除乙肝病毒主要依赖T细胞(T杀伤细胞)或通过抗体介导的K细胞来杀伤靶细胞,将病毒释放于体液中,以后再经抗体作用而杀死血液中的HBV。因此针对上述基因,尤其是聚合酶pol的靶向性剪切,消除该基因的永久性正常表达,就会从源头上消除该疾病对人的健康威胁。
HBv的致癌性:约80%—90%的肝癌都有HBv背景,HBv是导致肝癌的重要因素。有人统计发现,20年HBv感染史者,约有5%—10%的发生癌变,癌变的原因是HBv的x基因整合到肝细胞基因上,发生了突变,导致肝癌。人们最为关心的也是HBV致癌问题,特别是无症状HBv携带者,尤其要当心肝癌变。因此针对X基因的靶向剪切突变,将有助于消除乙肝患者或者无症状乙肝携带者的肝癌潜在威胁。
肝癌的死亡率在消化系统恶性肿瘤中列第3位,我国每年死于肝癌约11万人,占全世界肝癌死亡人数的45%,而且近几年有逐年增加的趋势。平均患病年龄为44岁。肝癌恶性程度高,发展迅速,若治疗不及时或治疗方案选择不当,平均生存时间为半年。肝癌早期可无症状,一旦出现明显症状,约有1/3已属晚期,因此肝癌号称癌中之王,对我国人民带来极大的生命威胁。目前常用手术治疗、介入治疗、化疗等措施。手术后最大的一个问题是彻底消灭残存的癌细胞,防止复发和转移。针对肝癌细胞的药物靶向性输送,是一个重要的治疗手段,避免非特异性的毒副作用,提高药物的利用率,针对肝癌细胞的仿生脂质体药物输送系统是一个重要的技术革新。
技术实现要素:
本发明的目的解决上述技术问题,基于同型细胞膜融合的脂质体药物载体的设计,提供一种靶向性的、个性化的肝细胞膜仿生脂质体药物载体及其制备方法和应用,用于CRISPR基因打靶质粒的体内肝细胞靶向输送和药物的输送。
为了解决上述技术问题,本发明采用以下技术方案:一种肝细胞膜仿生脂质体药物载体,其特征在于,(1)该脂质体药物载体具有细胞膜蛋白组分;(2)该脂质体药物载体能够体外装载药物,用于细胞靶向融合释放;(3)该脂质体所具有的细胞膜蛋白组分来自于永生化的自体肝细胞,用于对肝炎病毒基因组的靶向剪切质粒的输送;(4)该脂质体所具有的细胞膜蛋白组分来自于永生化的人肝肿瘤细胞系,用于肝脏肿瘤的靶向药物输送。
进一步地,装载的药物为普通化学药物,或DNA药物,或蛋白药物,或多肽类药物或siRNA药物,或mRNA药物,或上述药物中的一种或多种的混合。
进一步地,所述肝细胞膜仿生脂质体药物载体是包封特异性靶向肝炎病毒基因组DNA的CRISPR打靶元件,用于剪切和失活病毒基因组,用于肝炎阳性的病人或者携带者。
进一步地,装载的药物为质粒载体,尤其是非病毒型质粒载体,为了提高其表达效率,增加传代机会,质粒添加S/MAR基因序列元件,为了提高肝细胞的表达特异性,减少非靶细胞的表达,使用肝细胞特异启动子,如AAT启动子,确保只有在肝细胞中才能开启表达,增加了安全性;为了增加切割肝炎病毒基因组的效率,采用CRISPR技术构建质粒,使用多重gRNA元件,切割多个位点和多个基因;包封药物还可以是核苷类药物,直接靶向抑制肝炎病毒;针对肝肿瘤的包封药物可以是针对肝癌的各类化疗药物,其中的化疗药物可以为亲水、疏水性药物或双亲性化学药物。
进一步地,所述的肝细胞膜仿生脂质体药物载体含有单个或者多个gRNA元件,或含有多个gRNA启动子,或含一个CAS9阅读框。进一步地,CAS9的表达可以由肝细胞特异性的基因启动子启动,用于增加脂质体在体内的特异性表达。
为了进一步提高细胞膜蛋白脂质体的靶向性,制作膜仿生脂质体的过程中添加磁性纳米颗粒。所述的肝细胞膜仿生脂质体药物载体,除了包封质粒等靶向性和基因剪切性DNA元件,还可以同时包封磁性纳米颗粒,在体外借助磁场的作用下,进一步增加肝脏的靶向性。磁性药物载体由于具有磁场反应性,可以在外加磁场的引导下进入靶位置,降低和延迟被网状内皮系统清除的概率,增加局部靶位的脂质体滞留时间,提高局部脂质体与靶细胞的融合概率。磁性纳米粒主要是四氧化三铁和三氧化二铁材质为主,四氧化三铁的磁性大于三氧化二铁,四氧化三铁使用的较多,常用化学沉淀法制备氧化铁纳米粒子,是根据金属离子在碱性环境下形成金属氧化物的原理而设计,但须在制备过程中保持无氧和加入保护剂,如氢氧化四甲级铵等,防止氧化物的聚集和沉淀的发生,反应温度维持85-95℃。反应的分子式2Fe3++Fe2++8OH-→Fe3O4↓+4H2O。由于磁性纳米粒子对电磁波有吸收从而产生热量,而肿瘤细胞较正常体细胞的耐热性低,可以利用该原理进行磁介导热疗,利用交变磁场的作用杀死吞噬磁性纳米粒子的肿瘤细胞。肿瘤相关细胞的磁性仿生脂质体药物从而给实体瘤的治疗带来了一个全新的治疗策略和方法。
进一步地,所述的肝细胞膜仿生脂质体药物载体,还可以装载核苷类药物,用于抗病毒,可以跟CRISPR靶向DNA元件共同包封,用于靶向性治疗肝炎。
进一步地,所述的肝细胞膜仿生脂质体药物载体在治疗肝癌的应用,其特征在于,所述的肝细胞膜仿生脂质体药物载体包封有抗肝癌药物。
进一步地,所述的肝细胞膜仿生脂质体药物载体在治疗肝癌的应用,其特征在于,所述的肝细胞膜仿生脂质体药物载体除了包封一种或者多种化疗药物的组合,还可以包封磁性纳米颗粒,进一步增加肝脏的靶向性。
肝细胞作为仿生细胞膜的来源,需要达到一定的数量,还要保持肝细胞的特有膜成分,来自健康志愿者的原代肝细胞,须无肝炎病毒携带,可通过体外诱导永生化,提高细胞的数量,由于原代细胞的生长和传代次数非常有限,需要对其进行永生化,一些肿瘤细胞在体外的生长能力也非常有限,也需要对其进行永生化处理,目前永生化的手段较为丰富,技术难度并不大,目前永生的技术主要是采用过表达端粒酶催化亚基Tert、SV40病毒大T抗原、c-myc、EB病毒、原癌基因过表达、射线照射等方法。经过永生化处理的细胞,传代能力大为增强,有些细胞可顺利实现永生化,这为仿生脂质体技术提供了较多的细胞膜蛋白的供给来源。另外,肝肿瘤细胞膜的来源,可以使用已经建立的永生化肝癌细胞系,由于许多肝癌细胞系含有肝炎病毒,需要CRISPR等基因靶向技术,消除内源性的肝炎病毒威胁,建立无病毒细胞系;根据肝癌病人的病情分期,选择恶性程度不同的细胞系用于细胞膜的来源,根据是否是肝炎病毒引起与否,选择不同的肝癌细胞系作为膜供体。
附图说明
图1为肝细胞永生化诱导质粒读码框的模式图谱;
图2为HBV基因组靶向CRISPR打靶质粒的读码框构建模式图;
图3为质粒P1的图谱;
图4为质粒P5的图谱;
图5为永生化干细胞仿生脂质体(空载)的粒径分布图;
图6为质粒、化学小分子药物、磁纳米颗粒的包封率测定图;
图7为包封不同HBV基因组靶向元件的质粒和HBV基因组质粒(3:1)的仿生脂质体对HepG2细胞分泌HBeAG抗原的影响;
图8为包封不同HBV基因组靶向元件的质粒对HepG2细胞分泌HBeAG抗原的影响;
图9为MTT法测定包封不同HBV基因组靶向元件的质粒和HBV基因组质粒(3:1)的仿生脂质体对HepG2细胞的增殖影响;
图10为装载不同质粒的仿生脂质体对PLC/PRF/5细胞内源性分泌HBsAG的影响;
图11为替诺福韦酯富马酸盐包封的仿生脂质体对PLC/PRF/5细胞内源性分泌HBsAG的影响;
图12为MTT法检测细胞的增殖。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。
1、原代肝细胞的永生化
本发明借助传统的细胞永生化方法进行细胞的处理,肝细胞来自于自体肝细胞,或者健康志愿者肝细胞,优选健康志愿者肝细胞,无肝炎病毒携带;主要采用hTERT、SV40大T抗原、EB病毒、c-MYC等方法处理,上述方法的单独处理和/或组合应用。优先采用hTERT和SV40大T抗原联合处理,hTERT和SV40大T抗原的表达质粒,分别单独由质粒编码或者由一个质粒编码,本发明优先采用hTERT(GenBank:NM_198253或者NM_001193376)和SV40大T抗原(GenBank:J02400.1)由同一个质粒编码的方式,二者之间采用2A自切肽间隔,用于二者的独立表达,为了提高原代肝细胞的存活,HGF基因(GenBank:NM_000601)也被插入该载体,有2A自切肽间隔,见图1质粒模式图;2A自切肽可采用来自猪捷申病毒P2A,或者来自四体病毒的T2A,马鼻炎A病毒的E2A,手足口病毒F2A,细胞质多角体病毒的BmCPV2A或者家蚕传染性软化病病毒BmIFV2A,优先采用P2A;表达载体为非病毒载体或者病毒载体,优先采用病毒载体,比如慢病毒载体,用于慢病毒的包装感染。该方法提高对原代细胞的感染效率和有效稳定表达。可采用我们构建的基因组整合型或基因组非整合型病毒载体,用于病毒的包装和感染。该载体可以含有筛选标志,比如抗生素筛选标志,本实验优先采用带嘌呤霉素筛选标志的载体进行后续的稳定表达细胞的抗性筛选。
原代细胞可采用活检组织的细胞、手术切除的组织细胞,进行体外分离培养。当活检组织较少,细胞的分选在细胞培养到一定数量后再行分选;某些难以单独培养的原代细胞,易采用混合培养,甚至是立体培养。
分选的原代细胞,或者原代细胞混合物,或者体外培养的组织,或者体外培养的组织和细胞混合物,进行永生化质粒载体的转染或者病毒感染处理。编码hTERT-SV40大T抗原-HGF的慢病毒感染细胞24-48小时后,除去病毒,继续培养,根据实验需要,可以适当加抗生素筛选,比如加0.3-5ug/ml的嘌呤霉素筛选细胞,优先采用0.3-2ug/ml的嘌呤霉素处理,以除去未感染的细胞,抗生素的筛选与否要根据原代细胞的生长速度和密度决定,以维持细胞达到一定的密度和数量,当原代细胞密度过低和数量过少的时候,抗生素筛选可以推迟或者取消。
2、CRISPR打靶质粒、乙肝基因组质粒的构建
靶向HBV基因组的gRNA设计:针对乙肝病毒聚合酶、X蛋白、乙肝病毒核心蛋白和乙肝病毒被膜蛋白设计gRNA,根据CCTop在线网站(http://crispr.cos.uni-heidelberg.de/)设计,该程序设置了强大的脱靶基因搜索,脱靶基因的相似度最低有4个基因的差异,本文选择脱靶位置在内含子和基因间序列处,脱靶位置在基因外显子上的gRNA序列一律排除。
pUC19c质粒(2686bp,GenBANK:L09137.2)多克隆位点区进行改造,KpnI和XbaI之间替换成AgeI-NheI-SpeI 3个单一酶切位点。然后将BGH-PA加尾信号用高保真PCR扩增,模板为带有BGH-PA的质粒;引物带有SpeI和XbaI酶切位点,插入改造后的pUC19质粒,由于2个酶切位点同尾,鉴定正反向,取正向者。
用上游引物带有NheI和下游引物带有SpeI的引物扩增S/MAR序列(Seq ID No.11),模板为293T细胞的基因组DNA,NheI和SpeI酶切后,产物插入连有BGH-PA的质粒,由于NheI和SpeI为同尾酶,需要鉴定正反向,取正向者。无S/MAR的序列质粒,该步省略。
然后将上述带有S/MAR-BGH-PA或的带BGH-PA的质粒进一步用AgeI和NheI酶切,用带有AgeI和NheI酶切位点的引物扩增dCAS9,酶切后插入带有S/MAR-BGH-PA的质粒。
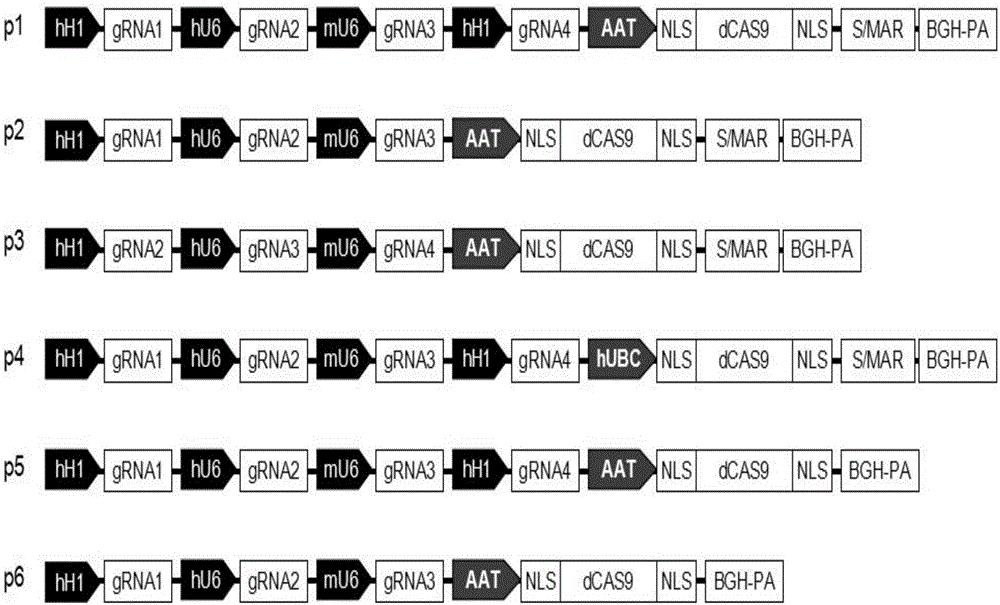
将dCAS9-S/MAR-BGH-PA用KpnI和AgeI酶切待用,人工合成针对HBV cccDNA基因组的单个gRNA及其启动子序列,两端带有KpnI和AgeI酶切位点;人工合成hH1、hU6、mU63个启动子启动的3XgRNA读码框序列,分别编码gRNA1、gRNA2、gRNA3或者gRNA2、gRNA3和gRNA4,中间由2A自切肽分割(Seq ID No.5),该多阅读框gRNA两端带有KpnI和AgeI酶切位点,hU6(Seq ID No.6)、mU6(Seq ID No.7)、hH1(Seq ID No.8)。酶切后插入带有dCAS9-S/MAR-BGH-PA的质粒;人工合成4XgRNA序列,分别带有hH1、hU6、mU6、hH1启动子,这些启动子分别启动gRNA1、gRNA2、gRNA3、gRNA4,两端带有KpnI和AgeI酶切位点。
将带有4x/3xgRNA-dCAS9-S/MAR-BGH-PA的质粒,进一步用AgeI酶切待用,将两端带有AgeI酶切位点的引物扩增AAT启动子(Seq ID No.9),模板为293T细胞基因组DNA。酶切后插入带有gRNA-dCAS9-S/MAR-BGH-PA的质粒,鉴定正反向,选择正向插入克隆。这样p4xgRNA(HBV)-dCAS9-S/MAR质粒和p4xgRNA(HBV)-dCAS9质粒就可以构建完成,关键序列皆进行过测序验证无突变。CAS9的编码框可以用通用启动子hUBC(Seq ID No.10)启动。
其中4重、3重gRNA质粒的构建模式图见图2,其中4重gRNA质粒的图谱见图3,序列为Seq ID No.12,hH1:414-793gRNA1:794-898;HU6:899-1146,gRNA2:1147-1252;mU6:1253-1567,gRNA3:1568-1673;hH1:1674-2047,gRNA4:2048-2153;AAT promoter:887bp 2166-3052;dCAS9:4176bp 3059-7234;S/MAR:7241-9434;BGH-PA:9435-9659;不带S/MAR序列的4重gRNA质粒图谱见图4,hH1:420-793gRNA1:794-898;HU6:899-1146,gRNA2:1147-1252;mU6:1253-1567,gRNA3:1568-1673;hH1:1674-2047,gRNA4:2048-2153;AAT promoter:887bp 2166-3052;dCAS9:4176bp 3059-7234;BGH-PA:7244-7468。
根据基因型B乙肝病毒全基因组(GenBank:AB775201)序列,人工合成1.3X基因组序列,保证所有乙肝基因的编码框都能表达,插入pcDNA3.1载体,构建乙肝病毒基因组载体。
PUC19多克隆位点的改造,KpnI和XbaI位点插入替换序列和酶切位点如下:
KpnI AgeI NheI SpeI XbaI
GGTACC ATAACCGGT TAA GCTAGC ACAACTAGTACT TCTAGA
3、细胞膜蛋白的提取
细胞膜的大量提取,一般采用低渗法处理细胞,低渗液中添加少许DNAse I和/或RNAaseA,机械破碎膨胀的细胞膜,然后将通过低速离心(400-1000g)除去较大细胞器,如线粒体和细胞核,将上清收集后进一步采用超高速离心法分离细胞膜,超高速离心常采用蔗糖梯度或者Percoll梯度离心,或者二者混合梯度离心,离心力在25000g-120000g,比如,蔗糖不连续梯度,分别铺53%、43%和38%蔗糖梯度,将细胞均浆后的上清液置于低密度层的上层,4℃超速离心1-12小时,最后分层收集,细胞膜一般分布在上层区、低密度区(38%层上和43-53%密度交界层),收集上层低密度区细胞膜,稀释,进一步超高速离心,收集沉淀,重悬细胞膜,适用的离心转头可以是贝克曼的SW-27、SW-28、SW-40、SW-41等。该法的细胞膜蛋白回收率在40-70%,混有少量的细胞器膜。收集的细胞膜沉淀可以放置-80℃冰箱一个月,液氮罐蒸汽中可以放置3个月到3年,可用于后续的细胞膜脂质体的制备,该法提取的蛋白混有来自内质网的膜蛋白的污染,少量高尔基体和线粒体的膜蛋白污染。
大量细胞膜的提取也可采用植物凝集素磁珠来提取,利用细胞膜蛋白具有更高的糖基化原理,可以使用一些特殊的糖基结合蛋白来纯化细胞膜,使用植物凝集素来吸附细胞膜,比如WGA、刀豆蛋白A(ConA)等。比如把植物凝集素ConA偶联到磁珠后,就可以使用磁珠沉淀细胞膜,最后用过量的甘露糖、葡萄糖竞争性与磁珠的ConA结合,可把结合的细胞膜蛋白置换,从而洗脱细胞膜蛋白。细胞的裂解可采用低渗法和等渗法,采用电动或者手动匀浆器匀浆,低速离心后的细胞膜上清液直接进行细胞膜的提取,细胞膜的回收率在25-75%,平均为30-40%左右,但细胞膜的纯度是梯度密度分离法所不能比拟的,大大减小了细胞器膜污染细胞膜的机会,本发明优先采用植物凝集素磁珠法提取肝细胞或者肝癌细胞系的膜蛋白。
细胞膜的小量提取,可采用植物凝集素磁珠试剂盒提取,相关产品有Qproteome质膜蛋白分离试剂盒(Qiagen)或者类似分离机制的试剂盒MinuteTM质膜蛋白分离试剂盒(Invent Biotechnologies)。该法用于小量制备仿生脂质体。
肝癌细胞系:PLC/PRF/5、MHCC97、Hep3B2.1-7、SNU-42、SNU-475、外生型肝癌细胞系EGHC-9901、QGY-7703、SMMC-7721、KMCH-1、RBHF-1、Mz-Hep-1、HB611、Huh6-c15、HepG2等。选择细胞系的原则,首先是肝癌的分期,选择恶性程度相同或者相近的肝癌细胞系或者表面标志相似的细胞系,本发明通常选用分泌乙肝表面抗原的PLC/PRF/5(ATCC)用于检测,使用HepG2(ATCC)作为细胞膜供体细胞株,该株细胞为乙肝阴性细胞株。
4、四氧化三铁的磁性纳米材料的制备
用2M的盐酸分别配制1M的三价铁离子和2M的二价铁离子,将20ml 1M三价铁离子和5ml的2M 2价铁离子混合,慢慢加入42ml 25%(W/W)氢氧化四甲基铵,直到PH达到13。持续剧烈搅拌15-40分钟,用磁铁将黑色的纳米铁沉淀分离,去除上清液,用去离子水清洗纳米铁沉淀2-4次,四氧化三铁纳米沉淀最后混悬于去离子水中保存备用。上述去离子水尽量用脱氧水配制,反应容器为通N2条件下操作。
5、仿生脂质体的制备
薄膜法:二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰磷脂酰胆碱(DSPC)、1,2-二油酰基磷脂酰胆碱(DOPC)、胆固醇(Avanti Polar Lipids),按一定比例(6:1:2:3)溶于氯仿:甲醇(3:1或者2:1或者1:1,V/V),脂溶性的药物可在此步骤中加入,如甲苯磺酸索拉非尼,然后在旋转蒸发器中蒸发溶剂,形成薄层。然后脂质薄层复水,从细胞中提取的膜蛋白(溶于PBS)以1:100-1:800比例(蛋白:膜脂)加入到薄层中;复水过程中开始加入亲水性的小分子药物、质粒、纳米铁磁颗粒等。40-65℃加热涡旋处理2-6分钟,重复2-5次。蛋白在40-65℃下挤过200nm孔径的醋酸纤维素滤膜或者聚碳酸酯膜,反复进行10-20次,以降低脂质体的孔径和提高脂质体的粒径均匀度,所获的单层脂质体膜泡经过半透膜透析过夜纯化,或者经过SephadexG-50柱或者类似凝胶柱纯化,以除去游离的未整合蛋白和杂质。对照空载脂质体的制作,除不包封药物外,其他步骤、工艺和内容物均相同,未包封药物的仿生脂质体,平均粒径约为142.3nM(图5)。
用于肝炎的治疗的药物,主要为靶向基因操作的质粒,针对乙肝病毒的多重gRNA和dCas9的编码质粒,和/或核苷类似物药物,如拉米夫定、阿德福韦酯、替比夫定、恩替卡韦、替诺福韦酯和克拉夫定。
用于癌细胞的药物,9-硝基喜树碱、全反式维甲酸、紫杉醇、多西紫杉醇、5-氟脲嘧啶、卡培他滨、丝裂霉素C、异环磷酰胺、环磷酰胺、甲氨蝶呤、顺铂、卡铂、长春瑞宾、长春新碱、阿霉素、表阿霉素、甲苯磺酸索拉非尼、博莱霉素、依西美坦、盐酸依利替康、TGF-β抑制剂等,上述药物可以为单体药物包封或者几种药物的组合包封。
6、脂质体特性检测
激光粒度仪检测脂质体的粒径、电位。几种代表性药物包封脂质体的数据,见表1:
7、包封率检测
测定药物的包封率,采用16000-18000g离心10-30分钟,取水相,测定水相的残留药物浓度和含量,总药物减去非包封部分的量除以总量的百分率即为包封率,质粒的测定则采用冷乙醇沉淀和高速离心法进行,测定沉淀DNA的总量,则采用360nm紫外光度计测定浓度;也可以采用直接360nm紫外光度计测定液体相的DNA残存量,计算包封率。
对于化学小分子药物,测定则主要使用HPLC法测定非脂质体液体相中的残留药物浓度,总量减去未包封残留量除以总量的百分比。
磁性颗粒的测定,则采用菲罗啉法测定仿生脂质体内铁磁性物质的含量。
药物包封浓度范围:质粒包封浓度0.3-4mg/ml,替诺福韦酯富马酸盐3-300μg/ml,阿霉素0.5-10mg/ml,顺铂20-2000μg/ml,卡培他滨40.0μg/ml-40mg/ml,5-氟尿嘧啶100mg/ml-40g/ml,长春新碱20μg/ml-2mg/ml,甲苯磺酸索拉非尼1-100μM。
结果见图6。
8、肝炎病毒阳性的肝癌细胞系内的病毒基因组的失活处理
P1质粒包封的仿生脂质体转染乙肝表面抗原阳性的细胞系,如PLC/PRF/5,转染2次或者3次,每次间隔12小时,48小时后,作克隆化接种,1-2周后ELISA测定各个克隆培养的细胞的上清中的HBsAG,挑选表达量低,与阴性细胞的背景表达量类似的细胞克隆,用于未来放大培养,作为仿生脂质体的来源。同理,除了HBV病毒外,其他病毒如HPV、EB、CMV、HIV等病毒也可以采用此法处理,确保工程细胞无有害微生物。P1质粒包封脂质体处理后,PLC/PRF/5细胞HBV基因组的剪切失活效果非常明显,结果见图10,该结果显示仿生脂质体递送质粒到肝癌细胞是有效的,同时也表明了P1多重gRNA和dCAS9系统用于失活病毒基因组是有效的和可行的方法。
9、ELISA检测单个gRNA、3重或者4重gRNA的HBV基因组剪切效果测定
基因组的靶向性剪切通过测定共转染的HBV基因组质粒产生乙肝表面抗原和乙肝E抗原的量来判定的,空载体pUC19、gRNA1、gRNA2、gRNA3、gRNA4,以及多重gRNA组合质粒分别与HBV基因组质粒共转染(摩尔比为3:1),转染72小时后,ELISA测定上清中的乙肝抗原,分别测定乙肝表面抗原(HBsAg)和乙型肝炎E抗原(HBeAg)ELISA试剂盒(珠海丽珠)。结果见图7和图8。
10、替诺福韦酯富马酸盐包封脂质体对内源性乙肝病毒基因的表达影响
包封浓度10μg/ml替诺福韦酯富马酸盐的脂质体和空载脂质体转染PLC/PRF/5,每隔24小时转染一次,72小时后测定上清中的HBsAg的含量。结果显示(图11)病毒的活性得到了有效抑制。未来可进一步优化用于动物实验和临床试验,可进一步与CRISPR打靶质粒联合包封脂质体应用。
11、MTT法检测细胞的增殖
空载体pUC19、gRNA1、gRNA2、gRNA3、gRNA4,以及多重gRNA组合质粒分别与HBV基因组质粒共转染(摩尔比为3:1),转染HepG2细胞72小时后,加入5mg/ml MTT噻唑蓝孵育4小时后,吸掉上清,加DMSO溶解,在脱色摇床上振荡10分钟,然后测490nm处吸光值,结果见图9。该实验表明所构建的质粒并未显示细胞毒性,因而排除脱靶引起的细胞毒性的存在。
抗癌药物小分子包封的仿生脂质体对HepG2的增殖影响,也采用MTT法测定细胞的生长状况,结果见图12,该结果表明仿生脂质体包裹药物递送,对肝炎细胞是有效的,未来可进一步优化用于动物实验和临床试验。
- 还没有人留言评论。精彩留言会获得点赞!