一种基于中空介孔二氧化锆纳米微球的智能药物传输体系及其制备方法与流程
本发明属于材料科学技术领域,具体涉及一种基于中空介孔二氧化锆纳米微球的智能药物传输体系及其制备方法。
背景技术:
刺激响应型纳米容器(SRNs)将“纳米阀门”和“存储池”结合在一起,一旦纳米阀门捕捉到刺激信号,迅速打开“存储池”释放夹带的药物分子,否则,药物完全密封在“存储池”内。迄今为止,pH、酶、氧化还原和光照射等刺激信号已被引入到SRNs中并使之得到激活,可控释放体系也已应用于如靶向药物递送系统、智能防腐涂层和生物活性的抗菌表面等众多领域。
中空介孔氧化锆具有突出的化学惰性、优良的机械和生物相容性,可代替硅基微球作为催化剂载体、药物运载工具和缓蚀剂容器【Chandra,P.,et al.One-Pot Synthesis of Ultrasmall MoO3Nanoparticles Supported on SiO2,TiO2,and ZrO2Nanospheres:An Efficient Epoxidation Catalyst.J.Mater.Chem.A 2014,2,19060-19066.】。首先,可控形态的介孔氧化锆的吸附能力并不逊色于硅基纳米微球;其次,介孔氧化锆表面存在的丰富的末端羟基可以共价地与三烷基的二氧化硅偶联剂结合;最重要的是,中孔氧化锆的优良耐碱性补偿了硅基纳米微球的缺点,能够在热碱性溶液中的进行官能化。然而,目前为止,还没有将氧化锆纳米粒子和超分子开关作为一个体系组装在一起。
随着应用领域的日益扩展,传统的单刺激响应型纳米容器的不足也越来越明显,单刺激响应型纳米容器已不能及时地适应复杂多变的环境。同时常规的介孔二氧化硅微球由于自身材料的限制,如装载能力较小、比重较大、不耐高温腐蚀等不足,不能满足实际应用中多样的需求。因此,开发出多元型的、性能更为优异的刺激响应型纳米容器显得越来越有必要。
技术实现要素:
本发明的目的在于提供一种响应过程快、灵敏度高、耐热碱性的基于中空介孔二氧化锆纳米微球的智能药物传输体系及其制备方法。
为了实现上述目的,本发明的技术解决方案为:
一种基于中空介孔二氧化锆纳米微球的智能药物传输体系,其结构如下:
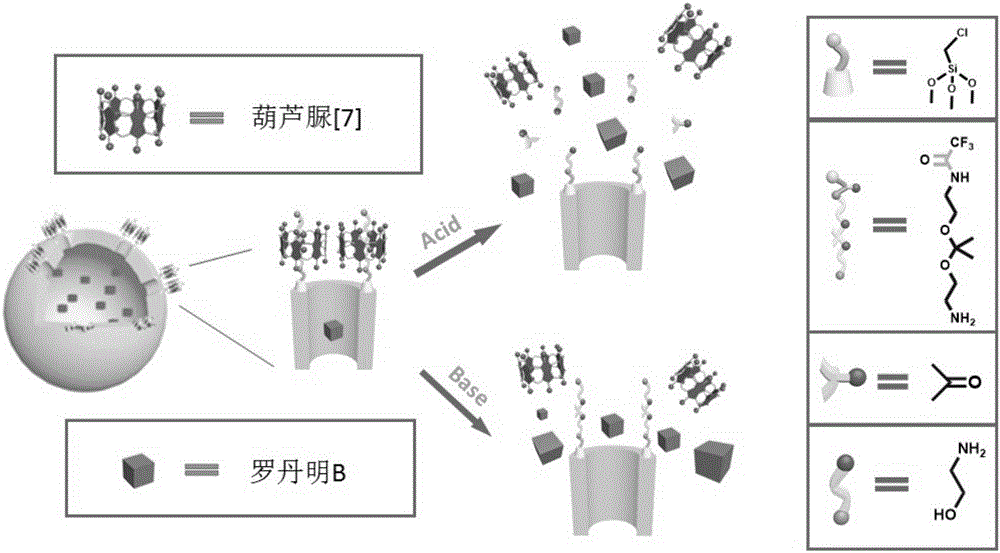
其中吸附分子吸附在中空介孔二氧化锆纳米微球内,中空介孔二氧化锆纳米微球表面依次修饰有氯甲基三乙氧基硅烷和双(2-氨基乙基)缩醛,双(2-氨基乙基)缩醛和葫芦脲[7](CB[7])形成主客体络合物将吸附分子封装。
一种基于中空介孔二氧化锆纳米微球的智能药物传输体系的制备方法,具体步骤如下:
步骤1,将中空介孔二氧化锆微球和氯甲基三乙氧基硅烷在无水甲苯中回流,氮气保护下进行脱醇反应,得到表面修饰有氯甲基三乙氧基硅烷的二氧化锆微球(CM-HMZSs);
步骤2,将N-(2-羟基乙基)邻苯二甲酰亚胺、2,2-二甲氧基丙烷和对甲苯磺酸在无水甲苯中回流反应,得到2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷;
步骤3,将2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷溶于浓度为1~6M的氢氧化钠溶液中,于100~120℃下回流反应12~24小时,反应结束后萃取,收集有机相并旋蒸得到双(2-氨基乙基)缩醛(PBAEK);
步骤4,将PBAEK溶于甲醇和三乙胺中,冷却到-78~0℃,加入三氟乙酸乙酯,搅拌6~24小时,反应结束后,旋蒸,洗涤得到N-(2-(2-(2-氨基乙氧基)丙-2-基氧基)乙基)-2,2,2-三氟乙酰胺(APYOT);
步骤5,将APYOT与CM-HMZSs在干燥的N,N-二甲基甲酰胺中回流,氮气保护下,反应得到表面修饰有氯甲基三乙氧基硅烷和N-(2-(2-(2-氨基乙氧基)丙-2-基氧基)乙基)-2,2,2-三氟乙酰胺的二氧化锆微球(AP-HMZSs);
步骤6,将AP-HMZSs分散在甲醇和浓度为1~6M的氢氧化钠溶液的混合溶液中,氮气保护,在100~120℃下回流反应过夜,离心分离,清洗,得到表面修饰有双(2-氨基乙基)缩醛和氯甲基三乙氧基硅烷的二氧化锆微球(PB-HMZSs);
步骤7,将PB-HMZSs干燥后分散在含有吸附分子和葫芦脲[7]的NaH2PO4/Na2HPO4的缓冲溶液中,得到基于中空介孔二氧化锆纳米微球的智能药物传输体系。
优选地,步骤1中,所述的中空介孔二氧化锆微球与氯甲基三乙氧基硅烷的质量比为1~2:1,氯甲基三乙氧基硅烷在甲苯中的浓度为6~20μg/mL。
优选地,步骤2中,所述的回流反应温度为110~120℃。
优选地,步骤5中,所述的APYOT与CM-HMZSs的质量比为1~2:2。
优选地,步骤6中,所述的甲醇和浓度为1~6M的氢氧化钠溶液的混合溶液中,甲醇与氢氧化钠溶液的体积比为1:9。
优选地,步骤7中,所述的吸附分子为罗丹明B,NaH2PO4/Na2HPO4缓冲溶液的pH为7.4。
本发明与现有技术相比,其显著优点在于:中空介孔二氧化锆纳米微球作为智能容器,其吸附分子的装载量显著提升,装载量可达到127mg/g;此外,以中空介孔二氧化锆为纳米容器的整个智能药物传输体系克服了硅基纳米容器热碱性环境下不稳定,无法进一步修饰的不足,能够在热碱性环境下进行官能化过程,实现中空介孔二氧化锆的改性,满足后期应用的需求。
附图说明
图1为基于中空介孔二氧化锆纳米微球的智能药物传输体系的释放效果原理图。
图2为基于中空介孔二氧化锆纳米微球的智能药物传输体系中的罗丹明B在紫外光谱仪下的释放曲线。
图3为基于中空介孔二氧化锆纳米微球的智能药物传输体系中的罗丹明B在细胞中的释放结果图。
具体实施方式
下面结合附图及具体实施例,对本发明做进一步详细说明。
本发明的原理是:
如图1所示,HMZSs表面的纳米阀门是由葫芦脲[7]环状分子和线性轴分子构成,其中线性轴分子是PBAEK。在中性条件下,缩酮链PBAEK以-NH2+形式存在,葫芦脲[7]通过离子-偶极和氢键作用紧紧的与质子化的缩酮链键合并且作为阀门阻止罗丹明B分子泄露出去。在酸性条件下,缩酮链中的缩酮键遇酸后不稳定而断开,形成丙酮与乙醇胺,线性轴分子断裂,阀门打开从而罗丹明B被释放出去。在一定范围内,当酸性越强,缩酮链断开的越多,阀门打开的越多,罗丹明B释放量也越多。而在碱性条件下,原先质子化的缩酮链部分或全部去质子化,并且去质子化的缩酮链与葫芦脲[7]的结合力急剧减小,导致包合物解离,阀门打开,从而罗丹明B得以释放。
本发明的中空介孔二氧化锆纳米微球的制备方法参考文献【Wang M.D.,Liu M.Y.and Fu J.J.,J.Mater.Chem.A,2015,3,6423-6431】,具体步骤如下:
将10mL去离子水、3.15mL的浓氨水和75mL的乙醇混合加入到250mL的三口反应瓶中,搅拌30min后向其中加入6mL硅酸四乙酯(TEOS),然后再搅拌8h。将获得的单分散的二氧化硅颗粒分散在200mL乙醇中,并加入0.42mL聚氧乙烯月桂醚和0.42mL去离子水,搅拌一小时后将1.5mL正丁醇锆加入混合物中。搅拌12h后,通过离心得到固体并用水洗涤。
将所得的固体分散在40mL去离子水中,放置陈化12h,陈化后的固体分散在100mL去离子水中,搅拌的同时加入0.1g聚乙烯吡咯烷酮(PVP),反应24h后离心得到固体,用乙醇洗涤。将得到的固体分散在10mL去离子水、3.15mL的浓氨水和75mL的乙醇混合液中,搅拌30min后向其中加入6mL硅酸四乙酯(TEOS),然后再搅拌12h。反应完成后,离心洗涤得到固体粉末。
将固体粉末置于马弗炉中煅烧,煅烧温度900℃,煅烧时间为8h,煅烧后的粉末分散于NaOH水溶液中,在60℃下搅拌反应12h。反应完成后,离心洗涤,干燥得到中空介孔二氧化锆微球。
实施例1
本发明以中空介孔二氧化锆为纳米容器构建智能药物传输体系的制备方法,步骤如下:
步骤1,氮气保护下将200mg中空介孔二氧化锆微球与100uL氯甲基三乙氧基硅烷(CMTES)在干燥过的15mL甲苯中进行脱醇反应得到CM-HMZSs。
步骤2,将2.5g N-(2-羟基乙基)邻苯二甲酰亚胺和0.7g 2,2-二甲氧基丙烷在40mL甲苯中反应,将0.055g对甲苯磺酸加入到圆底烧瓶中。将反应升高到110℃,并反应24小时。粗产品用正己烷/乙酸乙酯经柱层析纯化,真空干燥后得到2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷;
步骤3,将2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷溶于浓度为6M氢氧化钠溶液中,加热到120℃,并反应12小时,反应结束后用二氯甲烷萃取三次,收集有机相并旋蒸得到PBAEK;
步骤4,将PBAEK溶于甲醇和三乙胺中,冷却到-78℃,然后加入1.1当量的三氟乙酸乙酯,搅拌6小时,反应结束后,将溶液旋蒸出去,加入二氯甲烷,并用蒸馏水洗涤三次,再旋蒸除去二氯甲烷,粗产品用二氯甲烷/甲醇柱层析纯化,得到APYOT。
步骤5,将0.2g APYOT与200mg CM-HMZSs在干燥后的15mL N,N-二甲基甲酰胺中进行回流反应,得到AP-HMZSs。
步骤6,将100mg AP-HMZSs分散在15mL甲醇和浓度为1M的氢氧化钠溶液的混合溶液(甲醇与氢氧化钠溶液的体积比为1:9)中,氮气保护,溶液回流过夜,产物离心分离,用无水甲醇清洗,得到PB-HMZSs。
步骤7,取50mg干燥后的PB-HMZSs分散在含有罗丹明B和葫芦脲[7]的pH为7.4的NaH2PO4/Na2HPO4的缓冲溶液中,得到基于中空介孔二氧化锆纳米微球的智能药物传输体系。
罗丹明B的酸性释放
称量2mg以中空介孔二氧化锆为纳米容器构建智能药物传输体系放置在活化的半透膜中,将半透膜放置在有4mL的pH值为7的磷酸缓冲溶液中,将有智能药物传输体系的部分浸没,用紫外分光光度计检测释放曲线至平缓为止,再将半透膜分别放置在有4mL的pH=6,4和2的磷酸缓冲溶液中,将有智能药物传输体系的部分浸没,用紫外分光光度计检测释放情况,得到罗丹明B的释放量与时间的关系曲线图2(A)。从中可以看出:当pH=6.0,4.0和2.0时,随着酸性的增大,其释放量越来越多,分别为35%,57%和81%。
罗丹明B的碱性释放
通过紫外光谱在554nm处检测智能药物传输体系的释放曲线:准确称取2mg以中空介孔二氧化锆为纳米容器构建智能药物传输体系置于透析膜中,再将带有产物的透析膜放在顶部密封的比色皿中,这样可阻止固体分散在溶液中。准确量取4mL pH=7的缓冲溶液加入上述比色皿中,保证透析膜中的固体能够被溶液完全浸湿。通过调节缓冲溶液的pH=9,10和12,来实现纳米容器中罗丹明B分子的释放,最后得到罗丹明B的释放量与时间的关系曲线图2(B)。从图中可以看出:当pH=9,10和12时,碱性越来越强,释放量也越来越大,分别为27%、56%和82%。
实施例2
基于中空介孔二氧化锆纳米微球的智能药物传输体系的制备方法,步骤如下:
步骤1,氮气保护下将200mg中空介孔二氧化锆微球与79uL CMTES在干燥过的15mL甲苯中进行脱醇反应。
步骤2,将2.5g N-(2-羟基乙基)邻苯二甲酰亚胺和0.7g 2,2-二甲氧基丙烷在40mL甲苯中反应,将0.055g对甲苯磺酸加入到圆底烧瓶中。将反应升高到120℃,并反应24小时。粗产品用正己烷/乙酸乙酯经柱层析纯化,真空干燥后得到2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷;
步骤3,将2,2-双(2-邻苯二甲酰亚胺乙氧基)-丙烷溶于浓度为1M氢氧化钠溶液中,加热到100℃,并反应24小时,反应结束后用二氯甲烷萃取三次,收集有机相并旋蒸得到PBAEK;
步骤4,将PBAEK溶于甲醇和三乙胺中,冷却到0℃,然后加入1.1当量的三氟乙酸乙酯,搅拌24小时,反应结束后,将溶液旋蒸出去,加入二氯甲烷,并用蒸馏水洗涤三次,再旋蒸除去二氯甲烷,粗产品用二氯甲烷/甲醇柱层析纯化,得到APYOT。
步骤5,将0.1g APYOT与200mg CM-HMZSs在干燥后的15mLN,N-二甲基甲酰胺中进行回流反应,并氮气保护,得到AP-HMZSs。
步骤6,将100mg AP-HMZSs分散在10mL甲醇和浓度为6M的氢氧化钠溶液的混合溶液(甲醇与氢氧化钠溶液的体积比为1:9)中,氮气保护,溶液回流过夜,产物离心分离,用无水甲醇清洗,得到PB-HMZSs。
步骤7,取50mg干燥后的PB-HMZSs分散在含有罗丹明B和葫芦脲[7]的pH=7.4的NaH2PO4/Na2HPO4的缓冲溶液中,得到所述的以中空介孔二氧化锆为纳米容器构建智能药物传输体系。
药物在肿瘤细胞中释放
取对数生长的7721细胞,接种在12孔板(每孔细胞接种量为1X105)中置于培养箱中培养1d,去除培养基。向每孔加入2mL含50ug/mL以中空介孔二氧化锆为纳米容器构建智能药物传输体系的培养基,将12孔板培养0.5h,去除第一个培养孔中的培养基,用PBS(pH为7.4)缓冲溶液洗涤,加入2mL含有20uL Hoechst33342染色液的培养基继续培养15min,用PBS缓冲溶液洗涤。加入2mL 0.4%的台盼蓝浸泡30min,用培养基洗涤,用荧光显微镜观察以中空介孔二氧化锆为纳米容器构建智能药物传输体系加入1h细胞中罗丹明的释放状态。用同样的方法观察智能药物传输体系加入1h、3h、12h和1d细胞中罗丹明的释放状态,结果如图3所示。从图3中可以看出,细胞中随着时间变化荧光增强,说明载药体系一天左右药物可大量释放出来,对癌细胞可实现靶向释放。
- 还没有人留言评论。精彩留言会获得点赞!