低吸湿性阿立哌唑药物及其制备方法与流程
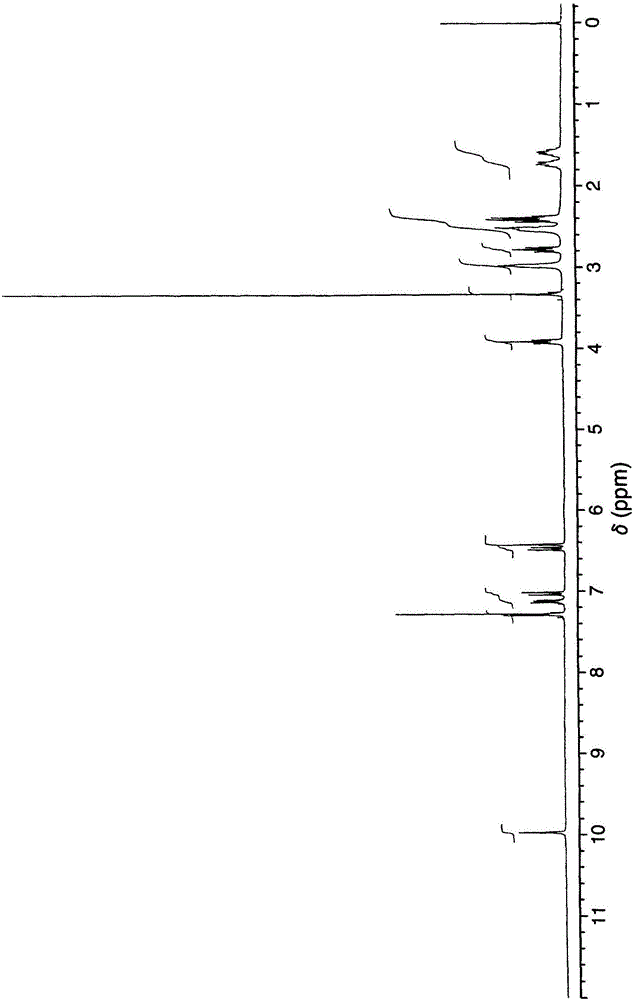
发明详述发明领域本发明涉及具有低吸湿性的阿立哌唑(aripiprazole)的改进形式和这种改进形式的制备方法。发明背景阿立哌唑,7-{4-[4-(2,3-二氯苯基)-1-哌嗪基]-丁氧基}-3,4-二氢喹诺酮或7-{4-[4-(2,3-二氯苯基)-1-哌嗪基]-丁氧基}-3,4-二氢-2(1H)-喹诺酮,是一种用于治疗精神分裂症的非典型的精神病药(U.S.4,734,416和U.S.5,006,528)。精神分裂症是一种以错觉、幻觉和完全脱离他人的常见类型精神病。精神分裂症的发作一般发生在16和25岁之间的年龄,并在全世界中影响1/100的个体。它比阿尔茨海默氏病、多发性硬化症、胰岛素依赖性糖赖病和肌肉萎缩症更为盛行。早期诊断和治疗可以导致恢复和结果的显著改善。而且,早期治疗介入可以避免昂贵的住院治疗。根据日本未审查的专利申请191256/1990的实施例1,例如通过以下方法制备阿立哌唑酐结晶:使7-(4-溴丁氧基)-3,4-二氢喹诺酮与1-(2,3-二氯苯基)哌嗪(piperadine)反应,并用乙醇重结晶所得的粗阿立哌唑酐。而且,根据第四届日本-韩国分离技术研讨会论文集(1996年10月6-8日),通过在80℃下加热阿立哌唑水合物而制备阿立哌唑酐结晶。但是,由上述方法得到的阿立哌唑酐结晶的缺点是其显著的吸湿性。这些结晶的吸湿性使它们难以加工,因为必须采取昂贵和繁重的措施确保它们在加工和配制过程中不与湿气接触。如果与湿气接触,则无水形式吸收水转化成含水形式。这带来许多缺点。第一,含水形式的阿立哌唑的缺点是比无水形式的阿立哌唑的生物利用度小和溶解度低。第二,每批含水与无水阿立哌唑药品数量的变化不能满足药品管理机构设定的规范。第三,研磨可能导致药物物质,常规的酐粘附到制造设备上,从而导致加工延迟、操作者受累增加、成本增大、维护增加和产率降低。第四,除了由于在这些吸湿性酐加工期间湿气引入导致的问题之外,在储藏和操作期间湿气吸收的可能性将不利地影响阿立哌唑药物的溶解度。因此,产品的贮藏期限显著缩短和/或包装成本显著增加。非常期望发现一种具有低吸湿性的阿立哌唑形式,从而有利于药物加工和生产具有改进的贮藏期限、适宜的溶解度和适宜的生物利用度的阿立哌唑药品所需的配制操作。而且,第四届日本-韩国分离技术研讨会论文集(1996年10月6-8日)指出,阿立哌唑酐结晶作为I型结晶和II型结晶存在;阿立哌唑酐的I型结晶可以通过使用阿立哌唑的乙醇溶液结晶或通过在80℃下加热阿立哌唑水合物而制备;而阿立哌唑酐的II型结晶可以通过在130-140℃下将阿立哌唑酐加热15小时制备。通过上述方法,不能容易地以具有良好的可重复性的工业规模制备高纯度的阿立哌唑酐II型结晶。发明概述因此,本发明提供一种具有低吸湿性并更易于药物加工和配制的形式的阿立哌唑。本发明者已发现这种低吸湿性形式的阿立哌唑是本文定义为酐B的结晶物质。这种无水结晶物质的一种具体的制备方法已被发现并构成本发明的另一方面。具体地,作为本发明的一方面,已发现为了生产具有目标药学性能的酐B和利用最有效的方法,本文定义的水合物A必须用作中间产物。还发现必须实行特定的加工顺序以形成水合物A。已发现水合物A的制备需要研磨本文定义为常规水合物的物质。然后,可以通过本文所定义的适宜的加热将水合物A转化为酐B。令人惊奇的是,如果先将常规水合物加热然后研磨,则形成严重的结块从而使这种加工在工业上不具有适宜性。本发明的一个目的是提供新的阿立哌唑酐结晶。而且,本发明的另一目的提供即使在包含阿立哌唑酐的药物组合物长期保存时,既不容易转化为水合物又基本上不降低最初溶解度的阿立哌唑酐结晶。本发明的另一目的是提供制备方法以具有良好的可重复性的工业规模获得高纯度的阿立哌唑酐结晶。本发明者已进行目标在于实现上述目的的研究工作。在此研究过程中,他们发现当在特定的温度下加热已知的阿立哌唑酐时可以获得目标阿立哌唑酐结晶。而且,本发明者已发现可以通过使用特定的溶剂重结晶已知的阿立哌唑酐而获得目标阿立哌唑酐结晶。而且,本发明者发现可以通过将已知的阿立哌唑酐悬浮在特定的溶剂中并加热如此得到的悬浮液而获得目标阿立哌唑酐结晶。因此本发明在这些发现和认识的基础上完成。附图的简要说明图1是实施例1得到的阿立哌唑水合物A的热重量/差热图(thermogravimetric/differentialthermogram)。图2表示实施例1得到的阿立哌唑水合物A的1H-NMR光谱(DMSO-d6,TMS)。图3是实施例1得到的阿立哌唑水合物A的X射线衍射图。图4表示实施例2得到的阿立哌唑酐结晶B的1H-NMR光谱(DMSO-d6,TMS)。图5是实施例2得到的阿立哌唑酐结晶B的X射线衍射图。图6是实施例3得到的阿立哌唑水合物的热重量/差热图。图7是参照实施例3得到的阿立哌唑水合物的X射线衍射。图8表示实施例11得到的阿立哌唑酐的C型结晶的热重量/差热分析吸热曲线。图9表示实施例11得到的阿立哌唑酐的C型结晶的1H-NMR光谱(DMSO-d6,TMS)。图10表示实施例11得到的阿立哌唑酐的C型结晶的X射线衍射光谱。图11表示实施例11得到的阿立哌唑酐的C型结晶的IR光谱。图12表示实施例11得到的阿立哌唑酐的C型结晶的固体13C-NMR光谱。图13表示实施例12或实施例13得到的阿立哌唑酐的D型结晶的热重量/差热分析吸热曲线。图14表示实施例12或实施例13得到的阿立哌唑酐的D型结晶的1H-NMR光谱(DMSO-d6,TMS)。图15表示实施例12或实施例13得到的阿立哌唑酐的D型结晶的X射线衍射光谱。图16表示实施例12或实施例13得到的阿立哌唑酐的D型结晶的IR光谱。图17表示实施例12或实施例13得到的阿立哌唑酐的D型结晶的固体13C-NMR光谱。图18表示实施例14得到的阿立哌唑酐的E型结晶的热重量/差热分析吸热曲线。图19表示实施例14得到的阿立哌唑酐的E型结晶的1H-NMR光谱(DMSO-d6,TMS)。图20表示实施例14得到的阿立哌唑酐的E型结晶的X射线衍射光谱。图21表示实施例14得到的阿立哌唑酐的E型结晶的IR光谱。图22表示实施例15得到的阿立哌唑酐的F型结晶的热重量/差热分析吸热曲线。图23表示实施例15得到的阿立哌唑酐的F型结晶的1H-NMR光谱(DMSO-d6,TMS)。图24表示实施例15得到的阿立哌唑酐的F型结晶的X射线衍射光谱。图25表示实施例15得到的阿立哌唑酐的F型结晶的IR光谱。图26表示实施例16-b)得到的阿立哌唑酐的G型结晶的热重量/差热分析吸热曲线。图27表示实施例16-b)得到的阿立哌唑酐的G型结晶的1H-NMR光谱(DMSO-d6,TMS)。图28表示实施例16-b)得到的阿立哌唑酐的G型结晶的X射线衍射光谱。图29表示实施例16-b)得到的阿立哌唑酐的G型结晶的IR光谱。图30表示实施例16-a)得到的玻璃形式的阿立哌唑酐的热重量/差热分析吸热曲线。图31表示实施例16-a)得到的玻璃样状态的阿立哌唑酐的X射线衍射光谱。发明详述本发明的第一方面的第一实施方案提供阿立哌唑的水合物A,其中该水合物具有与图3所示的X射线衍射光谱基本相同的X射线衍射光谱。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的X射线衍射特征峰在2θ=12.6°、15.4°、17.3°、18.0°、18.6°、22.5°和24.8°。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物具有在IR(KBr)光谱的2951、2822、1692、1577、1447、1378、1187、963和784cm-1处的特定的红外吸收谱带。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物具有与图2所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物具有特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)的1H-NMR光谱。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物具有与以下图1所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本上相同的吸热曲线。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径为50μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为40μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为35μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为30μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为25μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为20μm或更小。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为40-10μm。本发明的第一方面的另一实施方案提供阿立哌唑的水合物A,其中该水合物的平均粒径范围为36-14μm。本发明的第二方面提供一种水合物A的制备方法,其中该方法包括研磨常规水合物的步骤。本发明的第二方面的第一实施方案提供一种水合物A的制备方法,该方法包括研磨常规水合物的步骤,其中该研磨通过研磨机完成。本发明的第二方面的另一实施方案提供一种水合物A的制备方法,该方法包括研磨常规水合物的步骤,其中该研磨机是喷雾器、针磨机、喷射磨机或球磨机。本发明的第二方面的另一实施方案提供一种水合物A的制备方法,该方法包括研磨常规水合物的步骤,其中该研磨机是喷雾器。本发明的第二方面的另一实施方案提供一种水合物A的制备方法,该方法包括研磨常规水合物的步骤,其中该研磨机是使用主轴转速为5000-15000rpm,进料旋转为10-30rpm而筛孔尺寸为1-5mm的喷雾器。本发明的第三方面的多个实施方案提供根据本文所述的一个或多个实施方案定义的水合物A,其中该水合物由本文所述的方法制备。本发明的第四方面提供低吸湿性阿立哌唑药物。本发明的第四方面的第一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.5%或更小。本发明的第四方面的第一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.40%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.25%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.15%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.10%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.05%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该低吸湿性是指将该药物在保持60℃温度和100%湿度水平的干燥器中放置24小时后湿含量为0.04%或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物是本文定义的阿立哌唑酐结晶B。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物具有与图5所示的X射线衍射光谱基本相同的X射线衍射光谱。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物具有特征峰在2θ=11.0°、16.6°、19.3°、20.3°和22.1°的X射线衍射光谱。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物具有在IR(KBr)光谱的2945、2812、1678、1627、1448、1377、1173、960和779cm-1处的特定的红外吸收谱带。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物具有图4所示的1H-NMR光谱(DMSOd6,TMS)基本相同的1H-NMR光谱。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物具有特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)的1H-NMR光谱。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物在热重量/差热分析(加热速率5℃/分)中表现出一个接近大约141.5℃的吸热峰。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物在热重量/差示扫描量热法(加热速率5℃/分)中表现出一个接近大约140.7℃的吸热峰。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物是阿立哌唑酐结晶B,且当其即使适宜地长期储存时也基本上不转化为含水形式的阿立哌唑。例如,该阿立哌唑酐结晶B可以在60%相对湿度(RH)和25℃温度下储存,甚至储存期不短于1年。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物是阿立哌唑酐结晶B,且当其即使适宜地长期储存时也基本上不转化为含水形式的阿立哌唑。例如,该阿立哌唑酐结晶B可以在60%相对湿度(RH)和25℃温度下储存,甚至储存期不短于4年。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中该药物是阿立哌唑酐结晶B,且当其在75%相对湿度(RH)和40℃温度下适宜地储存不短于0.5年时,基本上不转化为含水形式的阿立哌唑。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中当配方如片剂或其它包括快速熔化配方的固体剂量配方需要小粒径时,该药物的平均尺寸为50μm或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中当配方如片剂或其它包括快速熔化配方的固体剂量配方需要小粒径时,该药物的平均尺寸为40μm或更小。本发明的第四方面的另一实施方案提供低吸湿性阿立哌唑药物,其中当配方如片剂或其它包括快速熔化配方的固体剂量配方需要小粒径时,该药物的平均尺寸为30μm或更小。本发明的第五方面提供一种阿立哌唑酐结晶B的制备方法。本发明的第五方面的第一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括加热阿立哌唑水合物A。本发明的第五方面的第一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括将阿立哌唑水合物A于90-125℃下加热大约3-50小时。本发明的第五方面的另一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括将阿立哌唑水合物A于100℃下加热大约18小时。本发明的第五方面的另一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括将阿立哌唑水合物A于100℃下加热大约24小时。本发明的第五方面的另一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括将阿立哌唑水合物A于120℃下加热大约3小时。本发明的第五方面的另一实施方案提供阿立哌唑酐结晶B的制备方法,其中该方法包括将阿立哌唑水合物A于100℃下加热大约18小时,然后于120℃下再加热大约3小时。本发明的第六方面提供根据本文所述的一个或多个实施方案定义并由本文提供的方法制备的阿立哌唑酐结晶B。本发明的第七方面提供与一种或多种药学上可接受的载体一起配制的阿立哌唑酐结晶B。本发明的其它实施方案可以包括本文公开的一个或多个实施方案和/或方面的组合。根据以下提供的说明,本发明的其它实施方案和方面将是明显的。本发明的另一方面包括发现当研磨阿立哌唑水合物(本文定义的常规水合物),它将转化为具有不同峰强度的不同X射线衍射光谱的阿立哌唑水合物(本文定义的水合物A)。而且,发现水合物A具有在热重量/差热分析中表征未研磨的常规水合物的明显的123.5℃脱水吸热峰。因此,在研磨常规水合物以后常规水合物转化为水合物A并表现出在大约60℃和120℃之间的逐步脱水吸热峰和在大约71℃的弱峰。本发明的另一方面包括发现当加热到90-125℃的特定温度持续3-50小时,这种新的阿立哌唑水合物时逐渐地脱水避免聚集现象,而这种现象在常规阿立哌唑水合物中是由快速脱水导致的,而且通过将该新的阿立哌唑水合物加热到特定的温度而得到的阿立哌唑酐结晶是具有目标性能的阿立哌唑酐结晶。水合物A的表征本文所用的“水合物A”的颗粒具有以下(1)-(5)给出的物理化学性能:(1)它具有与图1所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线。具体地,它的特征是大约71℃处的小峰和大约60-120℃的逐渐吸热峰的出现。(2)它具有与图2所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。(3)它具有与图3所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它的特征峰在2θ=12.6°、15.4°、17.3°、18.0°、18.6°、22.5°和24.8°。(4)它具有在IR(KBr)光谱的2951、2822、1692、1577、1447、1378、1187、963和784cm-1处的清楚的红外吸收谱带。(5)它具有50μm或更小的平均粒径。水合物A的制备方法水合物A通过研磨常规水合物制备。常规的研磨方法可以用于研磨常规水合物。例如,可以在研磨机中研磨常规水合物。可以使用广泛使用的研磨机,如喷雾器、针磨机、喷射磨机或球磨机。其中,优选喷雾器。考虑特定的研磨条件,当使用喷雾器时,主轴的旋转速度可以为5000-15000rpm,进料旋转为10-30rpm和而筛孔尺寸为1-5mm。通过研磨得到的阿立哌唑水合物A的平均粒径一般应为50(m或更小,优选30μm或更小。平均粒径可以通过下述的粒径测定方法来确定。阿立哌唑水合物酐结晶B的表征本文所用的本发明的“阿立哌唑酐结晶B”具有以下(6)-(12)给出的物理化学性能。(6)它们具有与图4所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱。具体地,它们的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。(7)它们具有与图5所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它们的特征峰在2θ=11.0°、16.6°、19.3°、20.3°和22.1°。(8)它们具有在IR(KBr)光谱的2945、2812、1678、1627、1448、1377、1173、960和779cm-1处的清楚的红外吸收谱带。(9)它们在热重量/差热分析(加热速率5℃/分)中表现出一个接近大约141.5℃的吸热峰。(10)它们在在热重量/差示扫描量热法(加热速率5℃/分)中表现出一个接近大约140.7℃的吸热峰。(11)本发明的阿立哌唑酐结晶B具有低吸湿性。例如,本发明的阿立哌唑酐结晶B在设定温度为60℃而湿度为100%的干燥器内24小时以后保持水含量为0.4%或更小。可以使用测定水含量的已知方法,只要它们是常用于测定结晶的水含量的方法。例如,可以使用一种方法如KarlFischer法。(12)当配方如片剂或其它包括快速熔化配方的固体剂量配方需要小粒径时,平均粒径优选为50μm或更小。酐B的制备方法在需要小粒径(小于50μm)的配方的情况下,这种制备需要研磨。但是,当研磨大量具有大粒径的常规阿立哌唑酐或酐结晶B时,研磨物质在研磨机中彼此粘着在一起。因此,存在难以工业化制备具有小粒径的阿立哌唑酐结晶B的缺点。在这些情况下,本发明者已发现可以容易地研磨常规水合物,并可以通过加热如此得到的研磨的水合物A而以高产率和良好的可操作性地获得小粒径的阿立哌唑酐B。例如通过在90-125℃下加热上述的阿立哌唑水合物A而制备本发明的阿立哌唑酐结晶B。加热时间一般为大约3-50小时,但不能说是无条件的,因为它依赖于加热的温度而有所不同。加热时间和加热温度是负相关的,因此加热温度越低则加热时间越长,而加热温度越高则加热时间越短。令人惊奇的是,如果阿立哌唑水合物A的加热温度为100℃,则加热时间一般应该为18小时或更长,优选大约24小时。另一方面,如果阿立哌唑水合物A的加热温度为120℃,则加热时间可以为大约3小时。本发明的阿立哌唑酐结晶B当然可以通过在100℃下将阿立哌唑水合物A加热大约18小时,然后在120℃下加热大约3小时而制备。如果加热时间延至更长也可以获得本发明的阿立哌唑酐结晶B,但这可能不经济。当这种配方不要求小粒径时,例如当药物制备用于注射或口服溶液配方时,阿立哌唑酐结晶B还可以通过以下方法获得。本发明者还发现可以通过将常规阿立哌唑水合物或常规阿立哌唑酐结晶加热到特定的温度而获得阿立哌唑酐结晶,但这种方法不产生适于在固体口服剂量配方中使用的酐B结晶。而且,例如通过在90-125℃下加热常规阿立哌唑酐结晶而制备本发明的阿立哌唑酐结晶B。加热时间一般为大约3-50小时,但不能说是无条件的,因为它依赖于加热的温度而有所不同。加热时间和加热温度是负相关的,因此加热温度越低则加热时间越长,而加热温度越高则加热时间越短。具体地,如果阿立哌唑酐结晶的加热温度为100℃,则加热时间可以是大约4小时,而如果加热温度为120℃,则加热时间可以为大约3小时。除了上述的阿立哌唑水合物A和阿立哌唑酐结晶B以外,本发明提供如下的阿立哌唑酐结晶C-G。1.本发明涉及具有以下物理化学性能(1)-(5)的阿立哌唑酐结晶(下文称为“阿立哌唑酐的C型结晶”):(1)与图8所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线;(2)与图9所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;(3)与图10所示的X射线衍射光谱基本相同的X射线衍射光谱;(4)具有与图11所示的IR(KBr)基本上相同的IR光谱;和(5)具有与图12所示的固体13C-NMR光谱基本上相同的固体13C-NMR光谱。2.本发明涉及具有以下物理化学性能(6)-(10)的阿立哌唑酐结晶(下文称为“阿立哌唑酐的D型结晶”):(6)与图13所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线;(7)与图14所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;(8)与图15所示的X射线衍射光谱基本相同的X射线衍射光谱;(9)具有与图16所示的IR(KBr)基本上相同的IR光谱;和(10)具有与图17所示的固体13C-NMR光谱基本上相同的固体13C-NMR光谱。3.本发明涉及具有以下物理化学性能(11)-(14)的阿立哌唑酐结晶(下文称为“阿立哌唑酐的E型结晶”):(11)与图18所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线;(12)与图19所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;(13)与图20所示的X射线衍射光谱基本相同的X射线衍射光谱;和(14)具有与图21所示的IR(KBr)基本上相同的IR光谱。4.本发明涉及具有以下物理化学性能(15)-(18)的阿立哌唑酐结晶(下文称为“阿立哌唑酐的F型结晶”):(15)与图22所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线;(16)与图23所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;(17)与图24所示的X射线衍射光谱基本相同的X射线衍射光谱;和(18)具有与图25所示的IR(KBr)基本上相同的IR光谱。5.本发明涉及上述第1项所述的阿立哌唑酐结晶的制备方法,其特征在于在高于140℃而低于150℃的温度下加热阿立哌唑酐结晶。6.本发明涉及上述第2项所述的阿立哌唑酐结晶的制备方法,其特征在于用甲苯重结晶。7.本发明涉及上述第3项所述的阿立哌唑酐结晶的制备方法,其特征在于将阿立哌唑酐结晶加热并溶于乙腈,并将其冷却。8.本发明涉及上述第4项所述的阿立哌唑酐结晶的制备方法,其特征在于加热在丙酮中的阿立哌唑酐结晶的悬浮液。9.本发明涉及一种药物组合物,所述药物组合物包含至少一种选自上述第1项所述的阿立哌唑酐结晶、上述第2项所述的阿立哌唑酐结晶、上述第3项所述的阿立哌唑酐结晶、上述第4项所述的阿立哌唑酐结晶和下述第10项所述的阿立哌唑酐结晶的阿立哌唑酐结晶和药学上可接受的载体。10.本发明涉及具有以下物理化学性能(19)-(22)的阿立哌唑酐结晶(下文称为“阿立哌唑酐的G型结晶”):(19)与图26所示的热重量/差热分析(加热速率5℃/分)吸热曲线基本相同的吸热曲线;(20)与图27所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;(21)与图28所示的X射线衍射光谱基本相同的X射线衍射光谱;和(22)具有与图29所示的IR(KBr)基本上相同的IR光谱。11.本发明涉及上述第10项所述的阿立哌唑酐结晶的制备方法,其特征在于将玻璃样状态的阿立哌唑酐置于密闭的容器中,并使其在室温下保持至少2周。12.本发明涉及一种颗粒的制备方法,其特征在于将常规阿立哌唑酐结晶或阿立哌唑酐结晶B、C、D、E、F或G湿造粒,于70-100℃下干燥所得的颗粒并分级,然后再次于70-100℃下干燥分级的颗粒。13.本发明涉及一种药用固体口服制剂的方法,其特征在于70-100℃下干燥包含常规阿立哌唑水合物结晶或阿立哌唑酐结晶B、C、D、E、F或G和一种或多种药学上可接受的载体的药用固体口服制剂。14.本发明涉及一种包含阿立哌唑酐结晶B、C、D、E、F或G和一种或多种药学上可接受的载体的药用固体口服制剂,其中该药用固体口服制剂具有至少一种选自以下的溶出率:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。15.本发明涉及一种具有至少一种选自以下的溶出率的药用固体口服制剂:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。16.本发明涉及一种通过以下方法得到的药用固体口服制剂:将常规阿立哌唑酐结晶湿造粒,70-100℃下干燥所得的颗粒并分级,然后再次于70-100℃下干燥分级的颗粒;而该药用固体口服制剂具有至少一种选自以下的溶出率:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。17.本发明涉及一种通过以下方法得到的药用固体口服制剂:70-100℃下干燥包含常规阿立哌唑酐结晶和一种或多种药学上可接受的载体的药用固体口服制剂;而该药用固体口服制剂具有至少一种选自以下的溶出率:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。18.本发明涉及一种颗粒的制备方法,其特征在于将常规阿立哌唑水合物结晶湿造粒,于70-100℃下干燥所得的颗粒并分级,然后再次于70-100℃下干燥分级的颗粒。19.本发明涉及一种药用固体口服制剂的方法,其特征在于70-100℃下干燥包含常规阿立哌唑水合物结晶和一种或多种药学上可接受的载体的药用固体口服制剂。20.本发明涉及一种通过以下方法得到的药用固体口服制剂:将常规阿立哌唑水合物结晶湿造粒,于70-100℃下干燥所得的颗粒并分级,然后再次于70-100℃下干燥分级的颗粒;而该药用固体口服制剂具有至少一种选自以下的溶出率:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。21.本发明涉及一种通过以下方法得到的药用固体口服制剂:70-100℃下干燥包含常规阿立哌唑酐结晶和一种或多种药学上可接受的载体的药用固体口服制剂;而该药用固体口服制剂具有至少一种选自以下的溶出率:在pH4.5下30分钟后溶出60%或更大,在pH4.5下60分钟后溶出70%或更大,和在pH5.0下60分钟后溶出55%或更大。本发明阿立哌唑酐的C-F型结晶对应于在JP-2001-348276中公开的阿立哌唑酐的III-VI型结晶。阿立哌唑酐的C型结晶本发明的阿立哌唑酐的C型结晶具有以下物理化学性能(1)-(5):(1)与图8所示的热重量/差热分析(加热速度5℃/分)吸热曲线基本相同的吸热曲线,更具体地,它具有大约在150.2℃的吸热峰;(2)与图9所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱。具体地,它具有在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)处的特征峰;(3)与图10所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它们的特征峰在2θ=12.6°、13.7°、15.4°、18.1°、19.0°、20.6°、23.5°和26.4°;(4)与图11所示的IR(KBr)光谱基本上相同的IR光谱。具体地,它具有在IR(KBr)光谱的2939、2804、1680、1375和780cm-1处的清楚的红外吸收谱带;和(5)与图12所示的固体13C-NMR光谱基本相同的固体13C-NMR光谱,具体地,它的特征峰在32.8ppm、60.8ppm、74.9ppm、104.9ppm、152.2ppm、159.9ppm和175.2ppm处。阿立哌唑酐的C型结晶的制备方法例如,通过在高于140℃和低于150℃的温度下加热阿立哌唑酐而制备本发明的阿立哌唑酐的C型结晶。用作原料的阿立哌唑酐可以是常规的阿立哌唑酐结晶,例如阿立哌唑酐的I型结晶、阿立哌唑酐结晶的II型结晶等等,而且这些酐可以是纯化产物或原料。可选择地,在本发明中制备的阿立哌唑酐的B型结晶、阿立哌唑酐的D型结晶、阿立哌唑酐的E型结晶、阿立哌唑酐的F型结晶或阿立哌唑酐的G型结晶可以用作阿立哌唑酐的原料。这些阿立哌唑酐可以单一或其至少两种组合使用。加热温度一般高于140℃和低于150℃,优选在142-148℃,而加热时间一般持续15分钟至3小时,优选30分钟至1小时。当在上述温度下加热阿立哌唑酐时,形成阿立哌唑酐的C型结晶。通过已知方法将如此得到的阿立哌唑酐的C型结晶分离并纯化。例如,在上述温度下加热阿立哌唑酐并冷却至室温之后,可以获得纯度为100%的阿立哌唑酐的C型结晶。阿立哌唑酐的D型结晶本发明的阿立哌唑酐的D型结晶具有以下物理化学性能(6)-(10):(6)与图13所示的热重量/差热分析(加热速度5℃/分)吸热曲线基本相同的吸热曲线;具体地,它的吸收热大约在136.8℃和141.6℃;(7)与图14所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;具体地,它具有在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)处的特征峰;(8))与图15所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它们的特征峰在2θ=8.7°、11.6°、16.3°、17.7°、18.6°、20.3°、23.4°和25.0°;(9)与图16所示的IR(KBr)光谱基本上相同的IR光谱。具体地,它具有在IR(KBr)光谱的2946、1681、1375、1273、1175和862cm-1处的清楚的红外吸收谱带;和(10)与图17所示的固体13C-NMR光谱基本相同的固体13C-NMR光谱,具体地,它的特征峰在32.1ppm、62.2ppm、66.6ppm、104.1ppm、152.4ppm、158.4ppm、和174.1ppm处。阿立哌唑酐的D型结晶的制备方法例如,通过用甲苯重结晶阿立哌唑酐而制备本发明的阿立哌唑酐的D型结晶。具体地,将阿立哌唑酐加到甲苯中,进一步加热并溶解,然后冷却如此得到的溶液。通过这些步骤,分离出本发明的阿立哌唑酐的D型结晶作为在甲苯中的结晶。用作原料的阿立哌唑酐可以是常规的阿立哌唑酐结晶,例如阿立哌唑酐的I型结晶、阿立哌唑酐的II型结晶等等,而且这些酐可以是纯化产物或原料。可选择地,在本发明中制备的阿立哌唑酐的B型结晶、阿立哌唑酐的C型结晶、阿立哌唑酐的E型结晶、阿立哌唑酐的F型结晶或阿立哌唑酐的G型结晶可以用作阿立哌唑酐的原料。这些阿立哌唑酐可以单一或其至少两种组合使用。当冷却通过加热和溶解得到的溶液时,可以加入阿立哌唑酐的D型结晶作为该溶液的晶种。而且,可以通过缓慢冷却通过加热和溶解得到的该溶液而形成晶种。在晶种存在下,可以分离出阿立哌唑酐的D型结晶。可以根据已知的方法分离和纯化如此分离出的阿立哌唑酐的D型结晶。通过这些步骤可以得到纯度为100%的阿立哌唑酐的D型结晶。阿立哌唑酐的E型结晶本发明的阿立哌唑酐的E型结晶具有以下物理化学性能(11)-(14):(11)与图18所示的热重量/差热分析(加热速度5℃/分)吸热曲线基本相同的吸热曲线,具体地,它具有大约在146.5℃的峰;(12)与图19所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱,具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H);(13)与图20所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它的特征峰在2θ=8.0°,13.7°,14.6°,17.6°,22.5°和24.0°处;和(14)具有与图21所示的IR(KBr)基本上相同的IR光谱,具体地,它具有在2943、2817、1686、1377、1202、969和774cm-1处的清楚的红外吸收谱带。阿立哌唑酐的E型结晶的制备方法例如,通过用乙腈重结晶阿立哌唑酐而制备本发明的阿立哌唑酐的E型结晶。具体地,通过将已知的阿立哌唑酐加到乙腈中,加热和溶解,然后将如此得到的溶液冷却。根据这些步骤,用乙腈分离出本发明的阿立哌唑酐的E型结晶。当将常规阿立哌唑酐加到乙腈时,分离出阿立哌唑酐的I型结晶、阿立哌唑酐的II型结晶和阿立哌唑酐的D型结晶,而不是阿立哌唑酐的E型结晶。70℃下从乙腈溶液中分离出的片状结晶为I型结晶、II型结晶和D型结晶,而E型结晶沉淀出作为针状结晶。当再次加热已经分离出这些结晶的乙腈溶液时(例如,在75℃下加热),片状结晶(I型结晶、II型结晶和D型结晶)快速溶解,相反针状结晶(E型结晶)不溶解。此外,当再次冷却乙腈溶液时,还分离出在先前作为晶种沉淀出来的针状结晶周围的针状结晶(E型结晶)。因此,阿立哌唑酐的E结晶可以在乙腈溶液中沉淀。用作原料的阿立哌唑酐可以是常规的阿立哌唑酐,例如任何一种阿立哌唑酐的I型结晶和阿立哌唑酐的II型结晶等等,且这些酐可以是纯化的产物或原料。可选择地,阿立哌唑酐的B型结晶、阿立哌唑酐的C型结晶、阿立哌唑酐的D型结晶、阿立哌唑酐的F型结晶或阿立哌唑酐的G型结晶可以用作阿立哌唑酐的原料。这些阿立哌唑酐可以单一或其至少两种组合使用。当冷却通过加热(加热和溶解)得到的乙腈溶液时,可以往该溶液中加入阿立哌唑酐的E型结晶作为该溶液的晶种。而且,可以通过缓慢冷却采用加热得到的该乙腈溶液而形成晶种。可以根据已知的方法分离和纯化如此分离出的阿立哌唑酐的E型结晶。通过这些步骤可以得到纯度为100%的阿立哌唑酐的E型结晶。阿立哌唑酐的F型结晶本发明的阿立哌唑酐的F型结晶具有以下物理化学性能(15)-(18):(15)与图22所示的热重量/差热分析(加热速度5℃/分)吸热曲线基本相同的吸热曲线,具体地,它具有大约在137.5℃和149.8℃的吸热峰;(16)与图23所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱;具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H);(17)与图24所示的X射线衍射光谱基本相同的X射线衍射光谱;具体地,它的特征峰在2θ=11.3°、13.3°、15.4°、22.8°、25.2°和26.9°;和(18)具有与图25所示的IR(KBr)基本上相同的IR光谱。具体地,它具有的2940、2815、1679、1383、1273、1177、1035、963和790cm-1处的红外吸收谱带。阿立哌唑酐的F型结晶的制备方法例如,本发明的阿立哌唑酐的F型结晶通过将阿立哌唑酐悬浮在丙酮并加热如此得到的丙酮悬浮液而制备。用作原料的阿立哌唑酐可以是常规的阿立哌唑酐,例如任何一种阿立哌唑酐的I型结晶和阿立哌唑酐的II型结晶等等,且这些酐可以是纯化的产物或原料。可选择地,阿立哌唑酐的B型结晶、阿立哌唑酐的C型结晶、阿立哌唑酐的D型结晶、阿立哌唑酐的E型结晶或阿立哌唑酐的G型结晶可以用作阿立哌唑酐的原料。这些阿立哌唑酐可以单一或其至少两种组合使用。丙酮悬浮液的加热温度一般为大约丙酮的沸点,而加热时间一般为5-10小时。当在大约丙酮的沸点处加热丙酮悬浮液时,形成阿立哌唑酐的F型结晶,通过加热过滤分离此结晶。结晶的分离可以根据已知方法完成。通过这些步骤,可以获得纯度为100%的阿立哌唑酐的F型结晶。阿立哌唑酐的G型结晶本发明的阿立哌唑酐的G型结晶具有以下物理化学性能(19)-(22):(19)与图26所示的热重量/差热分析(加热速度5℃/分)吸热曲线基本相同的吸热曲线;更具体地,它具有大约在141.0℃的吸热峰和在大约122.7℃的放热峰;(20)与图27所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H);(21)与图28所示的X射线衍射光谱基本相同的X射线衍射光谱。具体地,它的特征峰在2θ=10.1°、12.8°、15.2°、17.0°、17.5°、19.1°、20.1°、21.2°、22.4°、23.3°、24.5°和25.8°;和(22)具有与图29所示的IR(KBr)基本上相同的IR光谱。具体地,它具有在2942、2813、1670、1625、1377、1195、962和787cm-1处的清楚的红外吸收谱带。阿立哌唑酐的G型结晶的制备例如,可以通过将玻璃状阿立哌唑酐置于密闭容器中并使其在室温下放置至少二周、优选二周至六个月而制备阿立哌唑酐的G型结晶。而且,作为原料的玻璃状阿立哌唑酐可以通过在大约170℃下加热并熔化阿立哌唑酐,然后冷却到室温获得。用作原料的阿立哌唑酐可以是已知的阿立哌唑酐,例如任何一种阿立哌唑酐的I型结晶和阿立哌唑酐的II型结晶等等,且这些酐可以是纯化的产物或原料。可选择地,阿立哌唑酐的B型结晶、阿立哌唑酐的C型结晶、阿立哌唑酐的D型结晶、阿立哌唑酐的E型结晶或阿立哌唑酐的F型结晶可以用作阿立哌唑酐的原料。这些阿立哌唑酐可以单一或其至少两种组合使用。可以通过已知的方法将如此得到的阿立哌唑酐的G型结晶分离和纯化。例如,按照上述方法放置玻璃状阿立哌唑酐,则可以获得纯度为100%的阿立哌唑酐的G型结晶。本发明的阿立哌唑酐的C型结晶、阿立哌唑酐的D型结晶、阿立哌唑酐的E型结晶、阿立哌唑酐的F型结晶和阿立哌唑酐的G型结晶既不容易转化为它的水合物,又基本上不降低其最初的溶解度,即使在它们长期储存的时候。本发明提供具有高纯度的阿立哌唑酐结晶的制备方法,该方法可以具有良好的可重复性的工业规模应用。本发明提供包含阿立哌唑酐结晶的药物组合物,即使该组合物作长期储藏,它的溶解度不降低且它的稳定性保持优良。例如可以通过以下方法a或b制备作为用于制备本发明的阿立哌唑酐结晶B-G的原料的阿立哌唑酐结晶。“方法a”:粗阿立哌唑结晶的制备方法通过已知方法,如日本未审查的专利公开191256/1990的实施例中所述制备常规的阿立哌唑酐结晶。将47g7-(4-溴丁氧基)-3,4-二氢喹诺酮、35g碘化钠和600ml乙腈的悬浮液回流30分钟。往此悬浮液中加入40g1-(2,3-二氯苯基)哌嗪和33ml三乙胺,并将全部混合物再回流3小时。蒸发除去溶剂后,将如此得到残余物溶于氯仿,用水洗涤,然后用无水硫酸镁干燥。蒸发除去溶剂,并用乙醇将如此得到的残余物重结晶两次,得到57.1g7-{4-[4-(2,3-二氯苯基)-1-哌嗪基]-丁氧基}-3,4-二氢喹诺酮。无色片状结晶熔点:139.0-139.5℃“方法b”:常规酐的制备方法在前述第四届日本-韩国分离技术研讨会论文集(1996年10月6-8日)中描述了方法b。而且通过在90-125℃下加热常规阿立哌唑水合物而制备本发明的阿立哌唑酐结晶B。加热时间一般为大约3-50小时,但不能说是无条件的,因为它依赖于加热的温度而有所不同。加热时间和加热温度是负相关的,因此加热温度越低则加热时间越长,而加热温度越高则加热时间越短。具体地,如果阿立哌唑水合物A的加热温度为100℃,则加热时间一般可以为大约24小时,如果加热温度为120℃,则加热时间可以为大约3小时。例如作为制备本发明的阿立哌唑酐结晶B的原料的阿立哌唑水合物由以下方法C制备。“方法c”:常规水合物的制备方法通过将由以上方法a得到的阿立哌唑酐结晶溶于含水溶剂,并加热和冷却所得的溶液而容易地得到阿立哌唑水合物。使用这种方法,阿立哌唑水合物作为含水溶剂中的结晶发生沉淀。包含水的有机溶剂一般用作含水溶剂。该有机溶剂应该与水混溶,例如它是一种醇如甲醇、乙醇、丙醇或异丙醇,酮如丙酮,醚如甲氢呋喃、二甲基甲酰胺或它们的混合物,特别理想的是乙醇。含水溶剂中的水含量可以是溶剂的10-25体积%,优选接近20体积%。药物组合物本发明的药物组合物可以包含在药学上可接受的载体或载体的组合物中的阿立哌唑酐结晶B、C、D、E、F和G。药学上可接受的载体包括常规药用稀释剂和赋形剂,如填充剂、膨胀剂、粘合剂、增湿剂、崩解剂、表面活性剂和润滑剂。可以将本发明的药物组合物制成常规药剂,如片剂、快速熔化片剂、丸剂、散剂、液体、悬浮液、乳剂、颗粒剂、胶囊、栓剂的形式或作为注射剂(液体、悬浮液等等)。当使用片剂配方时,可以使用本领域中已知的大量载体。实例包括乳糖、蔗糖、氯化钠、葡萄糖、木糖醇、甘露醇、赤藓醇、山梨醇、尿素、淀粉、碳酸钙、高岭土、结晶纤维素、硅酸和其它赋形剂;水、乙醇、丙醇、单糖浆、葡萄糖液、淀粉液、明胶溶液、羧甲基纤维素、虫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮和其它粘合剂;无水淀粉、藻酸钠、琼脂粉、昆布糖粉(laminaranpowder)、碳酸氢钠、碳酸钙、聚氧乙烯脱水山梨糖醇脂肪酸酯、月桂基硫酸钠、硬脂酸单甘油酯、淀粉、乳糖和其它崩解剂;蔗糖、硬脂酸甘油酯、可可脂、氢化油和其它崩解抑制剂;季铵盐、月桂基硫酸钠和其它吸收促进剂;甘油、淀粉和其它保湿剂;淀粉、乳糖、高岭土、皂土、胶体硅酸和其它吸附剂;和精制滑石、硬脂酸盐、硼酸粉、聚乙二醇和其它润滑剂等等。如果需要,可以将片剂制成具有普通包衣的片剂如糖衣片、明胶包衣片、肠衣片和薄膜包衣片,以及双层片和多层片。当使用丸剂配方时,可以使用本领域内的各种载体。实例包括葡萄糖、乳糖、淀粉、可可脂、硬化植物油、高岭土、滑石和其它赋形剂;阿拉伯树胶粉、黄蓍胶粉、明胶、乙醇和其它粘合剂;和昆布糖(laminaran)、琼脂和其它崩解剂等等。当使用栓剂配方时,可以使用本领域内已知的各种载体。实例包括聚乙醇、可可脂、高级醇、高级醇的酯、明胶半合成甘油酯等等。可以通过将阿立哌唑酐结晶与上述的多种载体混合,并将它们装于硬明胶胶囊、软胶囊、羟丙基甲基纤维素胶囊(HPMC胶囊)等而制备胶囊。此外,药物组合物中可以包含着色剂、防腐剂、芳香剂、调味剂、甜味剂等等。在形成颗粒形式的药物固体口服制剂的情况下,可以通过加入液体(一般为或包含粘合剂的水溶液)将包含以下的制粒成分的混合粉末进行湿造粒而制备:阿立哌唑酐结晶(选自阿立哌唑酐B、C、D、E、F和G型结晶的常规阿立哌唑酐结晶或阿立哌唑酐结晶)和本领域中迄今已知的多种载体,如赋形剂、崩解剂、崩解抑制剂、湿润剂、吸收加速剂、吸附剂、润滑剂、着色剂等等(例如这些试剂可以指上述的物质)。关于湿造粒,包括多种方法,例如可以指出的是流化床造粒、揉捏造粒、挤出造粒、旋转造粒等等。在这些方法中,在进行流化床造粒的情况下,将包含多种载体的造粒成分与进入空气混合,然后在继续流化时将造粒成分和液体喷入以进行造粒。在进行揉捏造粒的情况下,通过搅拌混合包含多种载体的造粒成分,然后在继续搅拌造粒成分时,加入液体进行造业。在造粒之后,如果需要,通过使用适宜的筛或具有适宜筛号的研磨机将所得的颗粒分级以使它们达到目标大小。再次干燥如此得到的颗粒并在制备颗粒时进行常规干燥。关于干燥方法,可以应用多种方法,例如可以指出的是使用流化床干燥器、风力干燥器和真空干燥器等等的方法。一般地,可以在常规条件下进行干燥方法,在使用流化床干燥器的情况下,干燥过程可以0.5m3/分-50m3/分的流速、70-100℃的进入空气温度下进行10分钟至1小时。干燥后,将颗粒进行分析,然后进一步干燥。在使用流化床干燥器或风力干燥器等等的时候,干燥过程在0.5m3/分-50m3/分的流速、70-100℃的进入空气温度的条件下进行1-6小时。在使用真空干燥器的情况下,干燥过程可以在大约0-10托的真空度和70-100℃的夹套温度下进行1-6小时。如此制备的颗粒可以用于药用固体口服制剂,或者如果需要的话,它们可以成形为片剂。而且,通过常规方干燥的干燥颗粒可以成形为片剂,然后再次干燥。如此制备的包含阿立哌唑酐结晶的药用固体口服制剂即使长期保存也几乎不转变为水合物,因此可以提供如下的溶出率下几乎不降低(溶出率保持最大药物浓度(Cmax))的药用固体口服制剂:在pH4.5下30分钟后获得60%或更大的溶出率,在pH4.5下60分钟后获得70%或更大的溶出率,和在pH5.0下60分钟后获得55%或更大的溶出率。可以由以下方法提供另一种药用固体口服制剂:通过类似于上述的方法将常规阿立哌唑水合物结晶造粒,并在类似的条件下通过常规方式干燥,然后再次干燥。可选择地,将通过常规方式干燥的颗粒成形为片剂形式,然后将它们再次干燥,从而提供溶出率没有降低的药用固体口服制剂(溶出率保持最大药物浓度(Cmax):在pH4.5下30分钟后获得60%或更大的溶出率,在pH4.5下60分钟后获得70%或更大的溶出率,和在pH5.0下60分钟后获得55%或更大的溶出率。这些事实可以理解为药用固体口服制剂中包含的常规阿立哌唑酐结晶或阿立哌唑水合物结晶通过两次干燥转变为阿立哌唑酐的“B型结晶”。本发明药物组合物中应包含的阿立哌唑酐结晶B、C、D、E、F和G的数量可以选自适于治疗适应症的宽范围。一般地,阿立哌唑酐结晶B应占此药物组合物的大约1-70wt%,或者具体为大约1-30wt%。例如可以调整本发明药物组合物的给药方法使其适于药品的配方、年龄、性别和患者的其它症状(包括其严重程度)。例如在片剂、丸剂、液体、悬浮液、乳剂、颗粒剂和胶囊的情况下,采用口服给药。在注射的情况下,单独或与常规补剂如葡萄糖或氨基酸混合进行静脉内给药,或者如果需要的话,还可以单独进行肌内、皮内、皮下或腹膜内给药。在栓剂的情况下,采用直肠内给药。本发明药物组合物的剂量的选择取决于用途、年龄、性别和患者的其它症状、症状的严重程度等等,但一般阿立哌唑酐结晶的数量可以为大约0.1-10mg/1kg体重/天。作为给药单元的制剂应该包含范围为大约1-100mg的阿立哌唑酐结晶B,更具体地为1-30mg/单元剂量。本发明的药物组合物特别稳定,即使在长期储存时也基本上不降低溶解度。本发明的药物组合物有效地用于预防和治疗中枢神经系统疾病如精神分裂症,并还可以有效地用于治疗伴有认知障碍的顽固性(耐药性、慢性)精神分裂症和不伴有认知障碍的顽固性(耐药性、慢性)精神分裂症、包括轻微焦虑的焦虑症、包括双极性急性躁狂症和急性躁狂症的躁狂症、双极性疾病、包括双极性抑郁症的抑郁症、孤独症,唐氏综合征、注意缺陷多动障碍(ADHD),阿尔茨海默氏病、帕金森氏病和其它神经变性疾病、恐慌、强迫症(OCD)、睡眠障碍、性功能障碍、醇和耐药性、呕吐、晕动病、肥胖、miparticlee头痛和认知障碍。分析方法(1)在DMSO-d6中使用TMS测定1H-NMR光谱作为标准。(2)X射线衍射使用RigakuDenkiRAD-2B衍射仪,室温下使用CuKa填充管(35kV20mA)作为具有广角测角仪的X射线源、1°散射狭缝、0.15mm光截获狭缝、石墨二次单色器和闪烁计数器。在2θ连续扫描模式下,以5°/分的扫描速度、在3°-40°的范围内以0.02°的扫描步长完成数据采集。(3)通过KBr法测定IR光谱。(4)热重量/差热分析使用SeikoSSC5200控制单元和TG/DTA220同步差热/热重量测定单元完成热重量/差热分析。将5-10mg样品置于敞开的铝盘中,并在20℃-200℃和干燥氮气氛下以5℃/分的加热速率加热。α-氧化铝用作标准物质。(5)差示扫描量热法使用SeikoSSC5200控制单元和DSC220C差示扫描量热计完成热重量/差热分析。将5-10mg样品置于卷缩的铝盘中,并在20℃-200℃和干燥氮气氛下以5℃/分的加热速率加热。α-氧化铝用作标准物质。(6)粒径测定将待测定的0.1g颗粒悬浮在20ml0.5g大豆卵磷脂的正己烷溶液中,使用粒度分布仪(MicrotrackHRA,MicrotrackCo.)测定粒径。(7)吸湿性试验方法在称量瓶(直径5cm)中准确称取1g样品,用kimwipe覆盖并在60℃/100%RH环境(水/干燥器)中进行试验。24小时后,移出称量瓶,将其转移到室温和大约30%RH(氯化镁六水合物饱和的水溶液/干燥器)的环境下,放置24小时,并通过KarlFischer法测定样品的水含量。(8)固体13C-NMR光谱测定法在如下条件下测定固体13C-NMR光谱。测定仪器:CMX-360固态NMR光谱仪(由ChemagneticInc.制造)计算机:SPARCStation2(由SUNMicrosystem,Inc.制造)OS,软件:Solalis1.1.1Rev.B(注册商标:UNIX),SpinsightVer.2.5测定脉冲名:CP/MAS法中的TOSS法(TOSS是仪器的程序名)。测定脉冲宽度:在CP条件下使用90°脉冲。测定样品管:zirconia制造的试管,外径为7.5mm,而内部容量为0.8ml旋转:4250Hz(每秒的旋转)。接触时间:1msec等待时间:20sec。总次数:512次测定温度:试管外部温度大约25℃外标:使用六甲基苯的甲基(δ17.3)作为外标。以下使用参比实施例、实施例、样品制备和配方实施例更为详细的解释本发明。参比实施例1将19.4g7-(4-氯丁氧基)-3,4-二氢喹诺酮和16.2gl-(2,3-二氯苯基)哌嗪1盐酸盐加到溶于140ml水中的8.39g碳酸钾中,并在搅拌下循环3小时。反应后冷却混合物并滤出沉淀的结晶。将这些结晶溶于350ml乙酸乙酯,并在回流下除去大约210ml的水/乙酸乙酯共沸物。将残余溶液冷却,并滤出沉淀的结晶。60℃下将所得的结晶干燥14小时得到20.4g(74.2%)粗阿立哌唑。根据日本未审查的专利公开191256/1990所述的方法,用450ml乙醇重结晶以上得到的30g粗阿立哌唑,并在80℃下将所得的结晶干燥40小时得到阿立哌唑酐结晶。产率为29.4g(98.0%)。这些阿立哌唑酐结晶的熔点(mp)为140℃,与日本未审查的专利公开191256/1990所述的阿立哌唑酐结晶的熔点一致。当将这些结晶在设定在湿度100%、温度60℃的干燥器中放置24小时时,它们的吸湿性为3.28%(见下表1)。参比实施例2根据第四届日本-韩国分离技术研讨会提供的方法,将6930g参比实施例1得到的中间产物粗阿立哌唑加热溶解于138升乙醇水溶液(水含量20%),逐步(2-3小时)冷却至室温,然后急冷至接近0℃。将沉淀的结晶滤出,产生大约7200g阿立哌唑水合物(湿态)。80℃下将以上得到的湿态阿立哌唑水合物结晶干燥30小时,得到6480g(93.5%)常规阿立哌唑酐结晶。这些结晶的熔点(mp)为139.5℃。通过KarlFischer法证明这些结晶是无水的,其湿含量值为0.03%。当将这些结晶在设定在湿度100%、温度60℃的干燥器中放置24小时时,它们的吸湿性为1.78%(见下表1)。参比实施例350℃下将820g在参比实施例2中得到的湿态阿立哌唑水合物干燥2小时得到780g阿立哌唑水合物结晶。根据KarlFischer法这些结晶的湿含量值为3.82%。如图6所示,热重量/差热分析揭示吸热峰在75.0、123.5和140.5℃。因为脱水开始接近70℃,因此不存在清楚的熔点(mp)。如图7所示,通过这种方法得到的阿立哌唑水合物的X射线衍射光谱的特征峰在2θ=12.6°、15.1°、17.4°、18.2°、18.7°、24.8°和27.5°。这种阿立哌唑水合物的X射线衍射光谱与第四届日本-韩国联合分离技术研讨会提供的阿立哌唑水合物的X射线衍射光谱相同。参比实施例4制备15mg包含参比实施例2中得到的阿立哌唑酐的I型结晶的片剂将阿立哌唑酐的I型结晶(525g)、乳糖(1,995g)、玉米淀粉(350g)和结晶纤维素(350g)装入流化床制粒干燥器(FlowcoaterFLO-5,由FREUNDINDUSTRIALCO.LTD.制造),并使用70℃的进气温度和3m3/分的流速流体化混合大约3分钟。而且在相同的条件下将造粒成分进行持续流体化,并喷雾大约1,400g水溶液得到湿颗粒。在80℃的进气温度下将湿颗粒干燥15分钟。所得的干燥颗粒包含4.3%的水。(产率:99%)。通过710μm的筛将干燥的颗粒分级。将大约1wt%的硬脂酸镁加到分级的颗粒并混合,然后将这些颗粒提供给压片机(旋转单片压片机12HUK:由KIKUSUTSEISAKUSHOCO.,LTD.制造),得到每片重95mg的片剂。根据在日本药典的水含量测定方法中所述的容量滴定法(Karl-Fischer法)或电量滴定法测定片剂的水含量。水含量测定方法:准确称取样品(0.1-0.5g)(在片剂的情况下,使用1片),并使用水含量测定仪测定水含量。容量滴定法:自动水中量测定仪型号:KF-06(由MITSUBISHICHEMICALCORP.制造)电量滴定法:自动微水含量测定仪型号:AQ-7F(由HIRANUMASANGYOCO.,LTD.制造)自动水蒸发仪型号:LE-205(由HIRANUMASANGYOCO.,LTD.制造)加热温度:165±10℃氮气流速:大约150ml/分。参比实施例5制备15mg包含阿立哌唑酐的B型结晶的片剂将阿立哌唑酐的B型结晶(4,500g)、乳糖(17,100g)、玉米淀粉(3,000g)和结晶纤维素(3,000g)装入流化床制粒干燥器(NEW-MARUMERIZER型号:NQ-500,由FUJIPAUDALCO.,LTD.制造),并使用70℃的进气温度和3m3/分的流速流体化混合大约3分钟。而且在相同的条件下将造粒成分进行持续流体化,并喷雾大约12,000g羟丙基纤维素水溶液得到湿颗粒。在85℃的进气温度下将湿颗粒干燥28分钟。如此得到的干燥颗粒包含3.8%的水(通过参比实施例4的方法测定)。(产率:96%)。通过850μm的筛将干燥的颗粒分级。将大约1wt%的硬脂酸镁加到分级的颗粒并混合,然后将这些颗粒提供给压片机(旋转单片压片机12HUK:由KIKUSUTSEISAKUSHOCO.,LTD.制造),得到每片重95mg的片剂。根据在日本药典的水含量测定方法中所述的容量滴定法(Karl-Fischer法)或电量滴定法测定片剂的水含量。实施例1使用样品研磨机(小喷雾器)研磨500.3g参比实施例3得到的阿立哌唑水合物结晶。将主轴旋转速率设为12,000rpm,而进料旋转速率设为17rpm,并使用1.0mm人字筛。研磨在3分钟内完成,得到474.6g(94.9%)阿立哌唑水合物A粉末。以这种方式得到的阿立哌唑水合物A(粉末)的平均粒径为20-25μm。未测定熔点(mp),因为观察到在接近70℃时开始脱水。以上得到的阿立哌唑水合物A(粉末)具有与图2所示的1H-NMR光谱基本上相同的1H-NMR(DMSO-d6,TMS)光谱。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑水合物A(粉末)具有与图3所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=12.6°、15.4°、17.3°、18.0°、18.6°、22.5°和24.8°。这种图案与图7所示的未研磨的阿立哌唑水合物的X射线衍射光谱不同。以上得到的阿立哌唑水合物A(粉末)具有在IR(KBr)光谱的2951、2822、1692、1577、1447、1378、1187、963和784cm-1处的红外吸收谱带。如图1所示,以上得到的阿立哌唑水合物A(粉末)在热分析中具有在71.3℃处的弱峰和在60-120℃之间的宽吸热峰(观察到对应于一个水分子的重量损失)--明显不同于未研磨的阿立哌唑水合物的吸热曲线(参见图6)。实施例2100℃下使用热空气干燥器将450g实施例1得到的阿立哌唑水合物A(粉末)干燥24小时产生427g(产率98.7%)阿立哌唑酐结晶B。这此阿立哌唑酐结晶B的熔点(mp)为139.7℃。以上得到的阿立哌唑酐结晶B具有与图4所示的1H-NMR光谱基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐结晶B具有与图5所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=11.0°、16.6°、19.3°、20.3°和22.1°。以上得到的阿立哌唑酐结晶B具有显著的在IR(KBr)光谱的2945、2812、1678、1627、1448、1377、1173、960和779cm-1处的红外吸收谱带。以上得到的阿立哌唑酐结晶B在热重量/差热分析中的吸热峰接近大约141.5℃。以上得到的阿立哌唑酐结晶B在差示扫描量热法中的吸热峰接近大约140.7℃。即使当以上得到的阿立哌唑酐结晶B在设定湿度100%、温度60℃的干燥器中放置24小时时,它们的吸湿性也不超过0.4%(参见下表)。实施例3在100℃热空气干燥器中将44.29kg实施例1得到的阿立哌唑水合物A(粉末)干燥加热18小时,然后在120℃下加热3小时产生42.46kg(产率99.3%)阿立哌唑酐结晶B。所得的阿立哌唑酐结晶B的物理化学性能与实施例2中得到的阿立哌唑酐结晶B的物理化学性能相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)实施例4100℃下将40.67kg在实施例1中得到的阿立哌唑水合物A(粉末)干燥加热18小时,然后于120℃下加热3小时产生38.95kg(产率99.6%)阿立哌唑酐结晶B。所得的阿立哌唑酐结晶B的物理化学性能与实施例2中得到的阿立哌唑酐结晶B的物理化学性能相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)实施例5-10用于可注射或口服溶液配方但不用于固体剂量配方,因为它们通过加热常规酐或常规水合物而不是水合物A而制备。实施例5100℃下使用与实施例2相同的方法将在参比实施例1中得到的吸湿性阿立哌唑酐结晶加热50小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例6120℃下使用与实施例2相同的方法将在参比实施例1中得到的吸湿性阿立哌唑酐结晶加热3小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例7100℃下使用与实施例2相同的方法将在参比实施例2中得到的吸湿性阿立哌唑酐结晶加热50小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例8120℃下使用与实施例2相同的方法将在参比实施例2中得到的吸湿性阿立哌唑酐结晶加热3小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例9100℃下使用与实施例2相同的方法将在参比实施例3中得到的吸湿性阿立哌唑酐结晶加热50小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例10120℃下使用与实施例2相同的方法将在参比实施例3中得到的吸湿性阿立哌唑酐结晶加热3小时。所得的阿立哌唑酐结晶B的物理化学性能与实施例2的阿立哌唑酐结晶B的物理化学性能基本上相同。以这种方式得到的阿立哌唑酐结晶B即使在设定湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性也不大于0.4%(见下表1)。实施例11(阿立哌唑酐的C型结晶的制备)在大约145℃(±3℃)下加热在参比实施例2中得到的100毫克阿立哌唑酐的I型结晶。在这种情况下观察到一旦结晶熔化便再次结晶的现象。此后,得到100mg(产率:100%)阿立哌唑酐的C型结晶。该结晶的熔点为150℃。该结晶为无色棱晶形式。以上得到的阿立哌唑酐的C型结晶具有与图8所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。具体地,它显示的吸热曲线大约在150.2℃。如此得到的阿立哌唑酐的C型结晶表现出与图9所示的1H-NMR光谱(DMSO-d6,TMS)基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的C型结晶具有与图10所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=12.6°、13.7°、15.4°、18.1°、19.0°、20.6°、23.5°和26.4°。以上得到的阿立哌唑酐的C型结晶具有与图11所示的IR(KBr)光谱基本上相同的IR(KBr)光谱。具体地,它的特征性红外吸收谱带在2939、2804、1680、1375和780cm-1。以上得到的阿立哌唑酐的C型结晶表现出与图12所示的固体13C-NMR光谱基本上相同的固体13C-NMR光谱。具体地,它的特征峰在32.8ppm、60.8ppm、74.9ppm、104.9ppm、152.2ppm、159.9ppm和175.2ppm。根据上述热重量/差热分析(加热速率:5℃/分)的吸热曲线和X射线衍射光谱的数据,证实阿立哌唑酐的C型结晶的形成。当以上得到的阿立哌唑酐的C型结晶在条件设定为湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性不大于0.4%(见下表1)。实施例12(阿立哌唑酐的D型结晶的制备)在200ml甲苯中加入参比实施例2得到的阿立哌唑酐的I型结晶,并在74℃下加热溶解。在确认溶解完全以后,将甲苯溶液冷却至7℃,并过滤收集沉淀的结晶。将结晶风干以得到17.9g(产率:89.5%)阿立哌唑酐的D型结晶。以上得到的阿立哌唑酐的D型结晶具有与图13所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。具体地,它的吸热峰在大约136.8℃和大约141.6°。以上得到的阿立哌唑酐的D型结晶表现出与图14所示的1H-NMR光谱(DMSO-d6,TMS)基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它们的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的D型结晶具有与图15所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=8.7°、11.6°、16.3°、17.7°、18.6°、20.3°、23.4°和25.0°。以上得到的阿立哌唑酐的D型结晶具有与图16所示的IR(KBr)光谱基本上相同的IR光谱。具体地,它的特征性红外吸收谱带在2946、1681、1375、1273、1175和862cm-1。以上得到的阿立哌唑酐的D型结晶表现出与图17所示的固体13C-NMR光谱基本上相同的固体13C-NMR光谱。具体地,它的特征峰在32.1ppm、62.2ppm、66.6ppm、104.1ppm、152.4ppm、158.5ppm和174.1ppm。根据上述热重量/差热分析(加热速率:5℃/分)的吸热曲线和X射线衍射光谱的数据,证实阿立哌唑酐的D型结晶的形成。当以上得到的阿立哌唑酐的D型结晶在条件设定为湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性不大于0.4%(见下表1)。实施例13(阿立哌唑酐的D型结晶的制备)将1,200克参比实施例2中得到的阿立哌唑酐的I型结晶溶于18升甲苯并加热。将此甲苯溶液冷却至40℃,并加入36g在实施例12中得到的阿立哌唑酐的D型结晶作为晶种,然后将溶液冷却至10℃,并静置。过滤收集沉淀的结晶,于60℃下干燥18小时得到1,073g(产率:86.8%)阿立哌唑酐的D型结晶(纯度:100%)。此结晶为无色板状。以上得到的阿立哌唑酐的D型结晶具有与图13所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。具体地,它的吸热峰在大约136.8℃和大约141.6°。以上得到的阿立哌唑酐的D型结晶表现出与图14所示的1H-NMR光谱(DMSO-d6,TMS)基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它们的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的D型结晶具有与图15所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=8.7°、11.6°、16.3°、17.7°、18.6°、20.3°、23.4°和25.0°。以上得到的阿立哌唑酐的D型结晶具有与图16所示的IR(KBr)光谱基本上相同的IR光谱。具体地,它的特征性红外吸收谱带在2946、1681、1375、1273、1175和862cm-1。以上得到的阿立哌唑酐的D型结晶表现出与图17所示的固体13C-NMR光谱基本上相同的固体13C-NMR光谱。具体地,它的特征峰在32.1ppm、62.2ppm、66.6ppm、104.1ppm、152.4ppm、158.5ppm和174.1ppm。根据上述热重量/差热分析(加热速率:5℃/分)的吸热曲线和X射线衍射光谱的数据,证实阿立哌唑酐的D型结晶的形成。当以上得到的阿立哌唑酐的D型结晶在条件设定为湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性不大于0.4%(见下表1)。实施例14(阿立哌唑酐的E型结晶的制备)将40克在参比实施例2得到的阿立哌唑酐的I型结晶溶于1000ml乙腈,并在80℃下加热。大约10分钟内将乙腈溶液冷却至70℃,并使其在此温度下保持大约30分钟以沉淀晶种。然后,将该溶液的温度缓慢升至75℃,并通过保持此温度1小时而使结晶生长。然后在4小时内将溶液冷却至10℃,并过滤收集沉淀的结晶。将如此得到的结晶风干过夜,得到37.28g(产率:93.2%)阿立哌唑酐的E型结晶(纯度:100%)。这些结晶的熔点为145℃,且结晶为无色针状。该阿立哌唑酐的E型结晶具有与图18所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。具体地,它的吸收峰在大约146.5°。以上得到的阿立哌唑酐的E型结晶表现出与图19所示的1H-NMR光谱(DMSO-d6,TMS)基本相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的E型结晶具有与图20所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=8.0°、13.7°、14.6°、17.6°、22.5°和24.0°。以上得到的阿立哌唑酐的E型结晶具有与图21所示的IR(KBr)光谱基本上相同的IR光谱。具体地,它的特征性红外吸收谱带在2943、2817、1686、1377、1202、969和774cm-1。根据上述热重量/差热分析(加热速率:5℃/分)的吸热曲线和X射线衍射光谱的数据,证实阿立哌唑酐的E型结晶的形成。当以上得到的阿立哌唑酐的E型结晶在条件设定为湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性不大于0.4%(见下表1)。实施例15(阿立哌唑酐的F型结晶的制备)将140克在参比实施例2中得到的阿立哌唑酐的I型结晶悬浮在980ml丙酮并在搅拌下持续回流7.5小时。然后,在加热条件下过滤悬浮液,并在室温下将分离出的结晶风干16小时,得到86.19g(产率:61.6%)阿立哌唑酐的F型结晶(纯度:100%)。结晶为无色棱晶状。阿立哌唑酐的F型结晶具有与图22所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。具体地,它具有在大约137.5℃和大约149.8℃处的放热峰。以上得到的阿立哌唑酐的F型结晶表现出与图23所示的1H-NMR光谱(DMSO-d6,TMS)基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的F型结晶具有与图24所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=11.3°、13.3°、15.4°、22.8°、25.2°和26.9°。以上得到的阿立哌唑酐的F型结晶具有与图25所示的IR(KBr)光谱基本上相同的IR(KBr)光谱。具体地,它的特征性红外吸收谱带在2940、2815、1679、1383、1273、1177、1035、963和790cm-1。根据热重量/差热分析(加热速率:5℃/分)的吸热曲线和X射线衍射光谱数据,证实形成阿立哌唑酐的F型结晶。当以上得到的阿立哌唑酐的F型结晶在条件设定为湿度100%、温度60℃的干燥器中放置24小时时,其吸湿性不大于0.4%(见下表1)。表l样品最初湿含量(%)24小时后的湿含量(%)参比实施例10.043.28参比实施例20.041.78实施例20.040.04实施例30.020.02实施例40.020.02实施例50.040.04实施例60.040.04实施例70.040.03实施例80.040.03实施例90.030.01实施例100.050.05实施例110.030.03实施例120.040.03实施例130.040.03实施例140.060.09实施例150.040.04实施例16a)将在参比实施例2中得到的阿立哌唑酐的I型结晶(10g)装入不锈钢圆盘(直径:80mm),并加热至大约170℃以完全熔化。当冷却此熔化的液体时,它凝固成澄清带灰褐色,从不锈钢圆盘中移出固体,得到9.8g(产率:98%)玻璃状阿立哌唑酐。所得的玻璃状产物的特征是在X射线粉末测定中没有明显的峰(参照图31)。根据图30所示的热重量/差热分析(加热速率:5℃/分钟),观察到阿立哌唑酐的B型结晶的放热峰大约在86.5℃。而阿立哌唑酐的B型结晶由于熔化观察到吸热峰在大约140.1℃。b)当把实施例16-a)中得到的玻璃状阿立哌唑酐装入密闭容器并在室温下放置大约6个月时,得到颜色从灰褐色变成白色的阿立哌唑酐的G型结晶(25g,产率:100%)。熔点:138-139℃。阿立哌唑酐的G型结晶具有与图26所示的热重量/差热分析(加热速率:5℃/分)的吸热曲线基本上相同的吸热曲线。更为具体地,它具有在大约141.0℃的吸热峰和大约122.7℃的放热峰。以上得到的阿立哌唑酐的G型结晶表现出与图27所示的1H-NMR光谱(DMSO-d6,TMS)基本上相同的1H-NMR光谱(DMSO-d6,TMS)。具体地,它的特征峰在1.55-1.63ppm(m,2H),1.68-1.78ppm(m,2H),2.35-2.46ppm(m,4H),2.48-2.56ppm(m,4H+DMSO),2.78ppm(t,J=7.4Hz,2H),2.97ppm(brt,J=4.6Hz,4H),3.92ppm(t,J=6.3Hz,2H),6.43ppm(d,J=2.4Hz,1H),6.49ppm(dd,J=8.4Hz,J=2.4Hz,1H),7.04ppm(d,J=8.1Hz,1H),7.11-7.17ppm(m,1H),7.28-7.32ppm(m,2H)和10.00ppm(s,1H)。以上得到的阿立哌唑酐的G型结晶具有与图28所示的X射线衍射光谱基本上相同的X射线衍射光谱。具体地,它的特征峰在2θ=10.1°、12.8°、15.2°、17.0°、17.5°、19.1°、20.1°、21.2°、22.4°、23.3°、24.5°和25.8°。以上得到的阿立哌唑酐的G型结晶具有与图29所示的IR(KBr)光谱基本上相同的IR(KBr)光谱。具体地,它的清楚的红外吸收谱带在2942、2813、1670、1625、1377、1195、25962和787cm-1。实施例17a)制备用于再次干燥的30mg包含阿立哌唑酐的B型结晶的片剂颗粒将阿立哌唑酐的B型结晶(1,500g)、乳糖(5,700g)、玉米淀粉(1,000g)和结晶纤维素(1,000g)装入流化床制粒干燥器(FlowCoaterModelFLOSM;由FROINTSANGYOKABUSHIKIKAISHA制造),并使用60℃的进气温度和3-4m3/分的流速流体化混合大约3分钟。而且在相同的条件下将造粒成分进行持续流体化,并喷雾大约4,000g5%羟丙基纤维素水溶液得到湿颗粒。在85℃的进气温度下将湿颗粒干燥20分钟。所得的干燥颗粒包含3.8%的水。(根据参比实施例4的方法测定)。b)使用研磨机(FIOREF-0:TOKUJUCORPORATION制造)将在实施例17-a)中得到的干燥颗粒(4kg)分级。将分级的颗粒(3kg)装入流化床制粒干燥器(FlowCoaterModelFLOSM;FREUNDINDUSTRIALCO.,LTD.制造),并在并使用85℃的进气温度和2m3/分的流速流体化混合大约2小时。所得的干燥颗粒包含3.6%水(根据参比实施例4的方法测定)。将大约1wt%的硬脂酸镁加到分级的颗粒并混合,然后将这些颗粒提供给压片机(旋转单片压片机,型号VIRGO:由KIKUSUTSEISAKUSHOCO.,LTD.制造),得到每片重190mg的片剂。c)将在实施例17-a)中得到的干燥颗粒(3kg)装入真空干燥器(真空造粒干燥器型号;VG-50:KIKUSUISEISAKUSHOCO.,LTD.制造),并在70℃的夹套温度和真空度为5托的减压下干燥1小时。如此得到的干燥颗粒包含3.1%水(由参比实施例4的方法测定)。干燥颗粒通过850μm的筛进行分级。将大约1wt%的硬脂酸镁加到分级的颗粒并混合,然后将这些颗粒提供给压片机(旋转单片压片机,型号VIRGO:由KIKUSUTSEISAKUSHOCO.,LTD.制造),得到每片重190mg的片剂。实施例18a)制备30mg包含阿立哌唑酐的B型结晶的片剂阿立哌唑酐(B型结晶)(4,500g)、乳糖(17,100g)、玉米淀粉(3,000g)和结晶纤维素(3,000g)装入流化床制粒干燥器(NEW-MARUMERIZER型号:NQ-500,FUJIPAUDALCO.,LTD.制造),并使用70℃的进气温度和10-15m3/分的流速流体化混合这些造粒成分大约3分钟。而且在相同的条件下将造粒成分进行持续流体化,并喷雾大约12,000g5%羟丙基纤维素水溶液得到湿颗粒。在85℃的进气温度下将湿颗粒干燥30分钟。所得的干燥颗粒包含3.6%的水。(根据参比实施例4的方法测定)。(产率:96%)。使用研磨机(FIOREF-0:TOKUJUCORPORATION制造)将此干燥颗粒(4kg)分级。将大约1wt%的硬脂酸镁加到分级的颗粒并混合,然后将这些颗粒提供给压片机(旋转单片压片机,型号VIRGO:由KIKUSUTSEISAKUSHOCO.,LTD.制造),得到每片重190mg的片剂。b)将在实施例18-a)中得到的片剂(5kg)装入通风干燥器(AQUACOATERAQC-48T,FREUNDINDUSTRIALCO.,LTD.制造),并在90℃的进气温度和2m3/分的流速下干燥6小时。所得的干燥颗粒包含3.3%水(由参比实施例4的方法测定)。c)将在实施例18-a)中得到的干燥片剂(3kg)装入真空干燥器(真空造粒干燥器,VG-50:KIKUSUISEISAKUSHOCO.,LTD.制造),并在80℃的夹套温度和真空度为5托的减压下干燥4小时。如此得到的干燥颗粒包含2.7%水(由参比实施例4的方法测定)。干燥颗粒通过850μm的筛进行分级。实施例19a)通过类似于实施例18-a)的方法,得到片剂(包含在参比实施例2中得到的阿立哌唑酐的I型结晶),每片重190mg,b)通过类似于18-b)的方法干燥片剂,除了进气温度为100℃并干燥1小时。c)通过类似于实施例18-b)的方法干燥片剂,除了进气温度为100℃并干燥3小时。实施例20通过类似于实施例18-a)的方法得到每片重190mg、包含阿立哌唑酐的C型结晶的片剂。实施例21通过类似于实施例18-a)的方法得到每片重190mg、包含阿立哌唑酐的D型结晶的片剂。实施例22a)将在参比实施例3得到的阿立哌唑水合物结晶(156g)、乳糖(570g)、玉米淀粉(100g)和结晶纤维素(100g)装入流化床制粒干燥器(NEW-MARUMERIZER,NQ-160:FUJIPOWDALCO.,LTD.制造),并使用60℃的进气温度、1.0-1.5m3/分的流速和400rpm转速的转盘流体化混合这些造粒成分大约3分钟。而且在相同的条件下将造粒成分进行持续流体化,并喷雾大约500g4%羟丙基纤维素水溶液得到湿颗粒。将进气温度升至最高85℃,并干燥直至产物的温度达到46℃。所得的干燥颗粒通过850μm的筛分级。干燥颗粒包含4.37%水(由参比实施例4的方法测定)。b)将实施例22-a)中得到的干燥颗粒(200g)装入流化床干燥器(多路,MP-01:POWREXCORPORATION制造),并在85℃的进气温度、0.5m3/分的空气流速下干燥2小时。干燥的颗粒包含3.50%水(由参比实施例4的方法测定)。c)将实施例22-a)中得到的干燥颗粒(100g)装入真空干燥器(真空造粒干燥器LCV-232:TABAICO.,LTD.制造),并在80℃盘温、大约760mmHg真空度下干燥2小时。干燥的颗粒进一步类似地干燥6小时。干燥的颗粒包含3.17%水(产物干燥2小时:由参比实施例4的方法测定)。进一步干燥的颗粒包含2.88%水(产物干燥6小时:由参比实施例4的方法测定)。d)将大约1wt%的硬脂酸镁加到分级的在实施例22-b)中得到的颗粒并混合,然后将这些混合颗粒提供给压片机(旋转单片压片机2B号:由KIKUSUTSEISAKUSHOCO.,LTD.制造),并用冲压机制片,得到每片重191mg的片剂。e)将大约1wt%的硬脂酸镁加到分级的在实施例22-c)中得到的颗粒并混合,然后将这些混合颗粒提供给压片机(旋转单片压片机2B号:由KIKUSUTSEISAKUSHOCO.,LTD.制造),并用冲压机制片,得到每片重191mg的片剂。溶出试验将前面得到的药用固体口服制剂的每一片分别敞开在25℃/60%RH下持续6个月,40℃/75%RH下1周,然后通过以下方法测定它们的溶出率。在暴露后60分钟得到的溶出率如表2和3所示。60分钟后的溶出率,使用于40℃/75%RH的敞开条件下放置2周的片剂,如表4和5所示。60分钟后的溶出率,使用于40℃/75%RH的敞开条件下放置1周的片剂,如表6所示。溶解测试仪:USP型号:NTR-6100(TOYAMASANGYGCO.,LTD.制造)型号:DT-610(JASCOCORPORATION制造)a)15mg片剂的溶出试验方法根据USP(美国药典)(注:2)的方法,使用900ml乙酸缓冲液(pH5.0)(注:1)作为测试液,并以100rpm旋转桨来测试一个片剂(包含15mg每一种阿立哌唑酐或水合物)。将在试验开始后10分钟、20分钟、30分钟、45分钟和60分钟分别得到的测试液命名为T10、T20、T30、T45和T60。另一方面,精确称取大约0.05g阿立哌唑标准样品,将其溶于乙醇(95%)以制备精确的50ml乙醇溶液。精确移取二十(20)ml此乙醇溶液,并通过加入0.01mol/升氢氯酸试剂溶液(注:3)精确制备1000ml标准溶液。使用具有直径为10-20μm的微孔的过滤器将测试液和标准溶液分别过滤,然后将滤液引入安装流动池(池长度:10mm)的分光光度计,测定249nm波长处的吸光率和325nm波长处的吸光率,并测定分别称为At10、At20、At30、At45、At60和As的吸光率之间的差别。测定后,将T10、T20、T30和T45测试液分别放回试验容器。而且,对其它5份样品的测试液进行类似的操作。关于指示量的阿立哌唑的溶出率(%)=阿立哌唑标准样品的数量(mg)×At×As×9/5×20/C其中:At:At10、At20、At30、At45或At60As:标准溶液C:指示量的阿立哌唑(mg)(注:1)将水加到1.97g乙酸(100)和9.15g乙酸钠三水合物以制备1000ml溶液(0.1mol/l)。(注:2)桨法(注:3)将水加到100ml0.1mol/l氢氯酸(注:4)以制备1000ml溶液。(注:4)将水加到0.9ml氢氯酸以制备1000ml溶液。b)30mg片剂的溶出试验方法根据USP(美国药典)(注:6)的方法,使用900ml乙酸缓冲液(pH4.5)(注:5)作为测试液,并以75rpm旋转桨来测试每一种药用固体口服制剂一个片剂(包含30mg每一种阿立哌唑酐或水合物)。将在试验开始后10分钟、20分钟、30分钟、45分钟和60分钟分别得到的测试液命名为T10、T20、T30、T45和T60。另一方面,精确称取大约0.05g阿立哌唑标准样品,将其溶于乙醇(95%)以制备精确的50ml乙醇溶液。精确移取二十(20)ml此乙醇溶液,并通过加入0.01mol/升氢氯酸试剂溶液(注:7)精确制备1000ml标准溶液。使用具有直径为10-20μm的微孔的过滤器将测试液和标准溶液分别过滤,然后将每一份滤液引入安装流动池(池长度:10mm)的分光光度计,测定249nm波长处的吸光率和325nm波长处的吸光率,而这些吸光率之间的差别分别称为At10、At20、At30、At45、At60和As。在测量之后,分别将测试液T10、T20、T30和T45放回试验容器。而且,对其它5个样品测试液进行类似的方法。关于指定量的阿立哌唑的溶出率(%)=阿立哌唑标准样品数量(mg)×At×As×9/5×20/C其中,At:At10、At20、At30、At45或At60As:标准溶液C:阿立哌唑的指定量(mg)(注:5)将水加到1.91g乙酸和2.99g乙酸钠三水合物以制备1000ml溶液(0.05mol/l)。(注:6)桨法。(注:7)将水加到100ml0.1mol/l盐酸(注:8)以制备1000ml溶液。(注:8)将水加到0.9ml盐酸以制备100ml溶液。表2表3表4所用样品最初2周后实施例19-a)的片剂(30mg)89.8%66.9%实施例19-b)的片剂(30mg)-79.8%实施例19-c)的片剂(30mg)-85.9%表5所用样品最初2周后实施例18-a)的片剂(30mg)94.8%94.7%实施例20的片剂(30mg)93.7%93.1%实施例21的片剂(30mg)94.8%90.9%表6所用样品最初1周后实施例22-d)的片剂(30mg)96.5%84.5%实施例22-e)的片剂(30mg)(干燥2小时)92.5%74.4%实施例22-e)的片剂(30mg)(干燥6小时)96.2%83.4%(注:类似于上述“30mg片剂的溶出试验的b)方法”的步骤中进行表5的溶出试验,除了通过使用900ml乙酸缓冲液(pH4.0)作为测试液,并通过在50rpm下旋转桨。从表2所示的数据可以清楚地看出,与15mg包含常规阿立哌唑酐结晶(参比实施例4)的片剂相比,即使片剂敞开在25℃/60%RH下持续6个月并敞开在40℃/75%RH下持续1周,15mg包含阿立哌唑酐(参比实施例5)的B型结晶在pH5.0下60分钟后仍具有保持最大药物浓度(Cmax)的溶出率。从表3所示的数据可以清楚地看出,即使30mg由两次干燥的阿立哌唑酐的B型结晶的颗粒制备的片剂(实施例17-b)和17-c))和30mg由进一步干燥的包含阿立哌唑酐的B型结晶的药用固体口服制剂制备的片剂(实施例18-b)和18-c))敞开在25℃/60%RH下持续6个月或敞开在40℃/75%RH下持续1周,在pH4.5下试验60分钟后所得的这些片剂的溶出率也基本上没有降低。从表4所示的数据可以清楚地看出,当30mg包含常规阿立哌唑酐结晶的片剂(实施例19-a)、19-b)和19-c))进一步干燥并敞开在40℃/75%RH下持续2周时,在pH4.5下试验60分钟后所得的这些片剂的溶出率是保持最大药物浓度(Cmax)的溶出率。从表5所示的数据可以清楚地看出,当30mg包含阿立哌唑酐的B型结晶的片剂、30mg包含阿立哌唑酐的C型结晶的片剂、30mg包含阿立哌唑酐的D型结晶的片剂敞开在40℃/75%RH下持续2周时,在pH4.5下试验60分钟后所得的这些片剂的溶出率基本上没有降低。从表6所示的数据可以清楚地看出,当30mg由常规阿立哌唑水合物的颗粒制备的片剂(实施例22-d)和22-e))进行两次干燥并敞开在40℃/75%RH下持续1周时,在pH4.5下试验60分钟后所得的这些片剂的溶出率是保持最大药物浓度(Cmax)的溶出率。样品制备1通过药剂技术人员已知的制备方法制备每片包含上述成分的片剂。样品制备2根据常规方法,制备每片包含上述成分的片剂。样品制备3根据常规方法,制备每片包含上述成分的片剂。样品制备4根据常规方法,制备每片包含上述成分的片剂。样品制备5根据常规方法,制备每片包含上述成分的片剂。样品制备6根据常规方法,制备每片包含上述成分的片剂。配制(formulation)实施例以下实施例使用首先研磨或粉碎常规阿立哌唑的水合物然后将其加热形成无水形式(酐B)而制备的阿立哌唑药物。配制实施例1如下制备快速熔化片剂:内部颗粒:在商购V-混合器中将除了硬脂酸镁之外的成分各自等比混合5分钟直到所有成分加入。然后加入硬脂酸镁并将混合物再混合3分钟。将混合的配方在配有孔的商购压缩机中在30-35kgF/cm2下压缩以使其压缩物的呈带状。使带状物通过30目(600微米)筛形成大约150-400微米的稳定颗粒。外部颗粒成分将内部颗粒置于混合器中,向其加入PH200和聚乙烯聚吡咯烷酮并混合5分钟。然后加入硬脂酸镁并将混合物再混合3分钟以形成最终混合物。其压制的片剂的破裂力为2.3kP(3.5SCU)且在10秒内分解在5ml水中。最终的混合物配方表现出优良的流动且没有其它诸如碎片、旋盖和粘结的问题。已发现对于内部颗粒使用PH102而对于外部颗粒成分使用PH200提高所得片剂的质量。制备实施例2如下制备包含两种等级的硅酸钙的组合的快速熔化片剂。内部颗粒在商购V-混合器中将除了硬脂酸镁之外的成分各自等比混合5分钟直到所有成分加入。然后加入硬脂酸镁并将混合物再混合3分钟。将混合配方压缩,并根据制备实施例1的方法过筛形成稳定的颗粒。外部颗粒成分将内部颗粒置于混合器中,向其加入PH200和聚乙烯聚吡咯烷酮并混合5分钟。然后加入硬脂酸镁并将混合物再混合3分钟以形成最终混合物。由其压制的片剂的破裂力为2.0kP(3.1SCU)且在10秒内崩解在5ml水中。制备实施例3如下制备包含阿立哌唑,一种抗精神分裂症药物的快速熔化片剂:内部颗粒:在商购V-混合器中将除了硬脂酸镁之外的成分各自等比混合5分钟直到所有成分加入。然后加入硬脂酸镁并将混合物再混合3分钟。将混合配方压缩,并根据制备实施例1的方法过筛形成稳定的颗粒。外部颗粒成分将内部颗粒置于混合器中,向其加入PH200和聚乙烯聚吡咯烷酮并混合5分钟。然后加入硬脂酸镁并将混合物再混合3分钟以形成最终混合物。由其压制的片剂的破裂力为2.0kP(3.1SCU)且在10秒内崩解在5ml水中。制备实施例4如下制备包含阿立哌唑的快速熔化片剂:内部颗粒:在商购V-混合器中将除了硬脂酸镁之外的成分各自等比混合5分钟直到所有成分加入。然后加入硬脂酸镁并将混合物再混合3分钟。将混合配方压缩,并根据制备实施例1的方法过筛形成稳定的颗粒。外部颗粒成分将内部颗粒置于混合器中,向其加入PH200和聚乙烯聚吡咯烷酮并混合5分钟。然后加入硬脂酸镁并将混合物再混合3分钟以形成最终混合物。由其压制的片剂的破裂力为2.3kP(3.5SCU)且在10秒内崩解在5ml水中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1