富马酸二甲酯在制备预防和治疗移植物抗宿主病及移植物抗白血病药物中的应用的制作方法
本发明涉及富马酸二甲酯在制备预防和治疗移植物抗宿主病及移植物抗白血病药物中的应用。
背景技术:
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是当今治疗恶性血液病的有效手段,急性移植物抗宿主病(acute graft-versus-host-disease,aGVHD)是其重要并发症,aGVHD是移植物中以T细胞为主的淋巴细胞识别宿主抗原致敏、增殖、分化,直接或间接攻击宿主组织器官产生的病理损伤。目前临床常规防治GVHD的经典方案为环孢菌素(CSA)+短程甲氨喋呤(MTX),然而此类药物是针对整个免疫系统的,其不仅导致感染增加,而且部分患者仍会发生严重GVHD,严重影响患者的预后。因此寻找有效防治GVHD而不影响移植物抗白血病的新方法显得尤为重要。
富马酸二甲酯(Dimethylfumarate,DMF),分子式CH3OOCCH=CHCOOCH3,分子量144.13。它最初被确认为一种非常有效的缺氧细胞的放射增敏剂。后来结合三个其它富马酸酯基(FAE)的DMF在德国被授权口服治疗牛皮癣(Fumaderm)。偶见报道治疗其它疾病,如类脂质渐进性坏死,环状肉芽肿,结节病也被发现用DMF治疗。近日,III期临床试验发现,DMF(BG-12)成功地降低了多发性硬化症的残疾进程的复发率和复发时间。DMF被认为具有无重大免疫抑制的免疫调节特性。欧盟EMA在2013年3月21日批准DMF以名称“Tecfidera”推荐作为多发性硬化症MS的口服治疗剂;2013年3月27日美国FDA批准Tecfidera胶囊治疗成人复发型多发性硬化症。
目前,对于造血干细胞移植后移植物抗宿主病的预防和治疗,现有的药物存在一定的副作用,缺乏有效药物的治疗,也没有DMF对aGVHD进行预防及治疗的报道。
技术实现要素:
本发明所要解决的技术问题是提供一种富马酸二甲酯在制备预防和治疗移植物抗宿主病及移植物抗白血病药物中的应用。
为解决以上技术问题,本发明采用如下技术方案:
本发明提供一种富马酸二甲酯或含有富马酸二甲酯的药物组合物在制备药物中的用途,该药物用于预防和治疗异基因造血干细胞移植后的急性移植物抗宿主病。
具体地,该药物用于抑制异基因造血干细胞移植后活化的T细胞的增殖。
具体地,该药物用于抑制树突状细胞的增殖、活化和抗原提成能力。
具体地,该药物用于抑制Th1细胞反应。
具体地,该药物用于减轻急性移植物抗宿主病的同时保留移植物抗白血病效应。
由于上述技术方案的实施,本发明与现有技术相比具有如下优点:
本发明通过动物实验研究发现富马酸二甲酯具有明显的抑制急性移植物抗宿主病的作用,可用来制备预防和治疗移植物抗宿主病及移植物抗白血病的药物。
附图说明
附图1为小鼠的生存曲线、临床评分变化曲线图,其中,DMF组与control组相比小鼠生存时间明显延长(P=0.005);
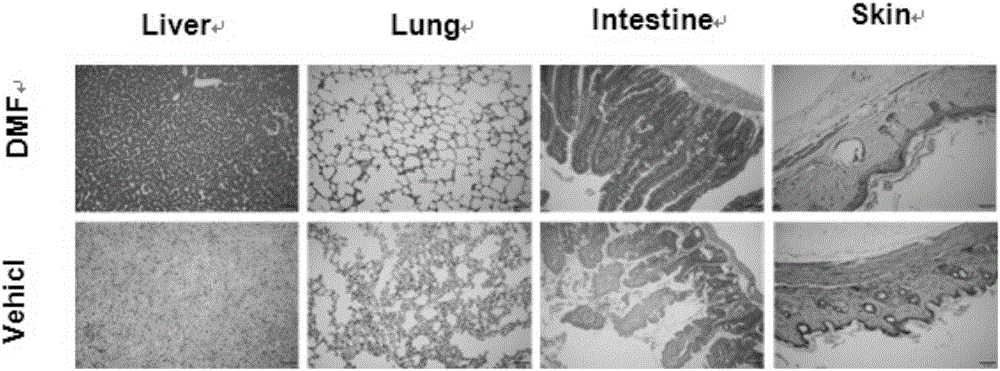
附图2为control组和DMF组小鼠肺部、肝脏和肠道、皮肤组织H&E染色图,control组小鼠肝、肺、小肠间质、皮肤可见淋巴细胞浸润,而DMF组小鼠肝、肺、小肠间质、皮肤淋巴细胞浸润明显减少;
附图3为DMF对同种T细胞反应的抑制作用图,其中,*表示P<0.05;
附图4为DMF对脾细胞增殖能力的抑制作用图,其中,*表示P<0.05;
附图5为DMF组小鼠细胞因子TNF-α的分泌抑制图;
附图6为DMF组小鼠细胞因子IFN-γ的分泌抑制图;
附图7为DMF组中对CD80的抑制作用图;
附图8为DMF组中对CD86的抑制作用图;
附图9为DMF组中对CD40的抑制作用图;
附图10为DMF组中对细胞因子IL-6的表达抑制图;
附图11为DMF组中对细胞因子TNF-α的表达抑制图;
附图12为CD4+Treg和CD8+Treg的细胞百分比图;
附图13为CD3+T、CD4+T和CD8+T的细胞百分比图;
附图14为CD4+T和CD8+T的细胞百分比图;
附图15为小鼠生存曲线图;
附图16为小鼠体内白血病细胞的活体成像图。
具体实施方式
下面结合具体实施例对本发明做进一步详细的说明,但本发明并不限于以下实施例。本发明中若无特别说明,原料均可市购获得,方法为本领域的常规方法。
一:材料和方法
(一)、动物
7~8周龄SPF级BALB/c小鼠(H-2d),体重20~24g;6~8周龄SPF级C57BL/6小鼠(H-2b),体重20~24g,购自中国上海实验动物中心。所有的程序是根据动物护理委员会和美国国立卫生研究院的关怀和使用动物的指南进行。所有实验小鼠均饲养于SPF(specific pathogen-free facility)级别的隔离笼中,饲料及垫料均经60Co辐照灭菌处理,饮用水经高温高压灭菌及酸化处理并加入庆大霉素,于苏州大学实验动物中心无菌层流房中饲养。
(二)、细胞株
小鼠B淋巴瘤细胞株A20(带luciferace)培养于含10%胎牛血清的RPMI1640完全培养基中,37℃、5%CO2饱和湿度孵箱中培养,取对数生长期细胞用于实验。
(三)、主要试剂及耗材
DMF:sigma公司,美国
甲基纤维素:sigma公司,美国
3H-TdR:中国科学院上海应用物理研究所
CD16/CD32FcR阻断抗体:BD Pharmingen,美国
PE-CD3ε单克隆抗体:BD Pharmingen,美国
FITC-CD4单克隆抗体:BD Pharmingen,美国
PE-cy5.5-CD8α单克隆抗体:BD Pharmingen,美国
APC-CD69单克隆抗体:BD Pharmingen,美国
FITC-H-2Kb单克隆抗体:BD Pharmingen,美国
PE-H-2Kd单克隆抗体:BD Pharmingen,美国
PE-IL-17单克隆抗体:BD Pharmingen,美国
APC-IFN-γ克隆抗体:BD Pharmingen,美国
PE-TNF-α克隆抗体:BD Pharmingen,美国
Foxp3染色试剂盒:ebioscience,美国
RPMI-1640培养基:Hyclone,美国
DMEM培养基:Gibco,美国
胎牛血清:Hyclone,美国
青霉素、链酶素:石家庄拜斯德医药化工有限公司
苏木精-伊红染色:碧云天生物科技有限公司
试剂盒:Promega,美国
96孔U形底培养板:Becton Dickinson,美国
96孔平底培养板:Becton Dickinson,美国
(四)、实验方法
1、小鼠脾细胞、造血干细胞悬液的制备
1.1、小鼠脾细胞悬液的制备
颈椎脱位处死小鼠,于超净台内无菌操作取出小鼠脾脏,载玻片轻柔研磨直至大部分脾脏细胞均已研出,尼龙网过滤所得细胞悬液,1200rpm 4℃离心5min,弃上清,加入2ml的1×红细胞裂解液,混匀,室温放置5min,加入5ml RPMI-1640培养基,1200rpm 4℃离心5min,弃上清,用1ml的1×PBS重悬细胞,计数。置于4℃待用。
1.2、小鼠造血干细胞悬液的制备
颈椎脱位处死小鼠,于超净台内无菌操作取出小鼠脊椎、股骨、胫骨,置于研钵轻柔挤压研磨,重复此操作,直至大部分细胞均已研出。尼龙网过滤所得细胞悬液,1200rpm、4℃离心5min,弃上清,加入3ml的1×红细胞裂解液,混匀,室温放置5min,加入5ml RPMI-1640培养基,1200rpm 4℃离心5min,弃上清,用1ml的1×PBS重悬细胞,计数,置于4℃待用。
2、急性移植物抗宿主病模型的建立
实验开始前一周,给BALB/C小鼠喂庆大霉素水溶液预防肠道感染,将小鼠分为实验组(10只)和对照组(10只),SPF级小鼠进行全身照射8.5Gy。照射4小时后尾静脉注射供鼠(C56BL/6鼠)骨髓(1×107)及脾细胞(5×106),诱导急性移植物抗宿主病模型。实验组予DMF(30mg/kg,200μl每只,-3d至+3d)灌胃,对照组予等量安慰剂(0.8%甲基纤维素)(200μl每只,3d至+3d)灌胃。
3、aGVHD临床表现观察
移植后每天观察受鼠一次,每2天测体重1次,观察体重减轻、姿势改变、活动度、体毛改变和皮肤完整性等临床aGVHD指标。表1为异基因造血干细胞移植后小鼠aGVHD临床积分评分标准表。
表1
4、aGVHD病理组织学检查
移植后10d处死部分小鼠,取肝脏、回肠、肺、皮肤,用10%中性甲醛固定48小时。用浓度递增酒精置换组织内水分,石蜡包埋并切成5μm厚度的切片,用二甲苯脱蜡,梯度酒精水化,苏木素-伊红染色,树胶封片。光学显微镜下观察。aGVHD病理学主要研究肝脏、回肠、肺、皮肤四个靶器官受损程度。肝脏GVHD病理学观察汇管区淋巴细胞浸润、胆管坏死、肝细胞灶状坏死。小肠GVHD病理学观察单个核细胞浸润、杯状细胞退化凋亡缺失、隐窝表面脓性分泌物、粘膜破损溃疡。肺部GVHD病理学观察肺间质炎症细胞浸润。皮肤GVHD病理学观察表皮界面坏死、炎症细胞浸润、脂肪萎缩、毛囊减少。
5、系谱特异性嵌合度检查
BALB/c受鼠H-2I类抗原分子为H-2d型,C57BL/6供鼠H-2I类抗原分子为H-2b型。造血干细胞移植后10d取受体鼠的脾脏,制备脾细胞悬液,FACS缓冲液(PBS+0.5%BSA+0.1%叠氮钠)重悬细胞并计数。细胞悬液先加CD16/CD32FcR阻断抗体于4℃封闭20min,然后加特异性荧光标记抗体FITC-H-2Kb单克隆抗体,PE-H-2Kd单克隆抗体于4℃孵育20分钟,离心沉淀细胞,FACS缓冲液洗涤一遍后重悬上BD流式细胞仪检测,CellQuest软件分析数据。
6、移植后小鼠脾淋巴细胞的获取
颈椎脱臼法处死小鼠,于超净台内无菌操作取出小鼠脾脏,载玻片轻柔研磨直至大部分脾脏细胞均已研出,尼龙网过滤所得细胞悬液,1200rpm 4℃离心5min,弃上清,加入2ml 1×红细胞裂解液,混匀,室温放置5min,加入5ml RPMI-1640培养基,1200rpm 4℃离心5min,弃上清,1ml RPMI-1640培养基重悬细胞。吸取10μl用于计数。所获得的无菌脾细胞可用于混合淋巴细胞反应和流式细胞术检测。
7、细胞表面染色及胞内染色
分别取方法6中获得的脾淋巴细胞按照细胞表面标记(1-5)×105/孔,胞内染色及Treg细胞标记(1-5)×106/孔进行铺板,细胞表面染色的具体步骤:PBS 100μl重悬细胞后置于96孔板中,先予CD16/CD32FcR阻断抗体于4℃封闭FcR 20min,离心沉淀细胞,PBS 200μl重悬后加入细胞表面标记抗体,根据不同荧光进行组合(CD3CD4CD8CD69/孔)(CD3CD4CD8孔),4℃避光孵育30min,1200rpm离心5min,弃上清,PBS 200μl重悬洗涤1遍,1200rpm离心5min,弃上清,PBS 200μl重悬后上BD FACS Calibur流式细胞仪检测,需同时做四种荧光的单染管及阴性管用于调补偿,CellQuest软件分析数据。
胞内染色的具体步骤:取(1-5)×105/孔的脾淋巴细胞,加入含10%FBS的RPMI-1640培养基1ml置于24孔板中混匀,加入PMA(500ng/ml)+Ionomycin(500ng/ml)+BFA(Brefeldin A,是蛋白转运抑制剂,抑制蛋白质从内质网转运到高尔基体,从而抑制其向胞外分泌),37℃、5%CO2培养箱刺激4小时,收集细胞并以FACS Buffer充分洗涤。PBS 100μl重悬后置于96孔板中,先予CD16/CD32FcR阻断抗体于4℃封闭FcR20min,离心沉淀细胞,PBS200μl重悬后加入细胞表面标记CD4和CD8抗体,4℃避光孵育30min,1200rpm离心5min,弃上清,PBS 200μl重悬洗涤1遍,1200rpm离心5min,弃上清,然后以4%多聚甲醛100μl固定细胞40min,1200rpm离心5min,弃上清,加入1%saponin(皂素)破膜20min,1200rpm离心5min,弃上清,PBS 200μl重悬洗涤1遍,1200rpm离心5min,弃上清,分别加入PE-IL-17单克隆抗体,APC-IFN-γ克隆抗体,PE-TNF-α克隆抗体各1μl,避光孵育30min,1200rpm离心5min,弃上清,PBS 200μl重悬洗涤1遍,1200rpm离心5min,弃上清,PBS 200μl重悬上BD流式细胞仪检测,需同时做四种荧光的单染管及阴性管用于调补偿,CellQuest软件分析数据。
8、混合淋巴细胞反应
制备移植后10d受体BALB/c小鼠的脾细胞作为反应细胞,移植后10d小鼠脾细胞转为供体型(H-2b),以照射后的(30Gy)BALB/c(H-2d)来源的脾细胞作为刺激细胞。细胞计数,调整效应细胞和刺激细胞的终浓度为5×106/ml 0.1ml/孔加入U形底96孔培养板,共制板3块,每块板设3个复孔。37℃、5%CO2培养箱培养3天,其中1块板加入3H-TdR 1微居/孔,继续培养。
9、乳酸脱氢酶释放法测定反应细胞杀伤活性
试剂盒检测细胞毒性作用的化学反应原理为:NAD++乳酸→丙酮酸+NADH,NADH+INT→NAD++formazan(红色)。红色化合物formaza对490nm波长光波吸收最明显。以方法6中MLR体系的反应细胞作为效应细胞,以小鼠肿瘤细胞A20(H-2b)作为靶细胞,96孔U形底培养板培养。RPMI-1640完全培养基调整A20细胞浓度为2×105/ml。实验孔中加入效应细胞和靶细胞各100μl,效应细胞对照孔加入效应细胞和完全培养基各100μl,靶细胞对照孔加入靶细胞和完全培养基各100μl。效:靶比设为12.5:1、25:1、50:1、100:1,加样后平板离心机250×g离心4min,在37℃、5%CO2饱和湿度孵箱内孵育4h。孵育后平板离心机250×g离心4min,转移50μl至新的96孔平底板,每孔加入50μl重悬的底物,盖上板盖室温下避光孵育30min,每孔加入50μl终止液,酶联免疫检测仪读取490nm吸光度值。按以下公式计算效应细胞细胞毒性:效应细胞毒性%=(实验孔OD-效应细胞自发释放OD-靶细胞自发释放OD)÷(靶细胞最发释放OD-靶细胞自发释放OD)×100。
11、GVL模型的建立
为进一步观察DMF在抑制aGVHD过程中对移植物抗白血病作用的影响,实验设计分二组,每组10只小鼠:第一组:SPF级BALB/c小鼠DMF组,予DMF(30mg/kg,-3d至+3d)灌胃;CO608.5Gy照射预处理,照射4小时后输注C57BL/6小鼠的骨髓(1×107)细胞+脾细胞(5×106)+小鼠BALB/c背景的带luciferace的A20肿瘤细胞(5×106)。第二组:SPF级BALB/c小鼠control组,对照组予安慰剂(0.8%甲基纤维素)灌胃后,CO60 8.5Gy照射预处理,照射4小时后输注C57BL/6小鼠的骨髓(1×107)细胞+脾细胞(5×106)+小鼠BALB/c背景的带luciferace的A20肿瘤细胞(5×106)。建立小鼠移植物抗白血病模型。移植后每周在小动物活体成像仪上实时观测小鼠体内的肿瘤负荷。观察时腹腔注射底物100μg,8秒后予乙醚麻醉小鼠,在小动物活体成像仪上观察注射肿瘤细胞小鼠体内的肿瘤负荷。每2天小鼠称重,aGVHD评分,对各实验组小鼠的aGVHD发病率、发病时间及症状严重程度以及小鼠体内肿瘤负荷进行比较。
12、统计学分析
采用Student-Newman-Keulsa,b检验分析数据,GraphPad Prism 5软件(GraphPad Software Inc.)作统计分析并绘图。采用Kaplan-Meier法绘制小鼠白血病生存曲线并采用log-rank检验生存期。分析所得P值小于0.05定义为有统计学意义。
二、实验结果
1.DMF具有抑制异基因移植后急性移植物抗宿主病(aGVHD)的作用
TBI预处理后所有小鼠均出现放射反应、进食饮水量减少,移植后一周左右开始出现体重减轻。安慰剂(0.8%甲基纤维素)control组小鼠6天后出现中到重度的aGVHD表现如倦怠、纳差、弓背、脱毛、腹泻等现象,并出现GVHD相关消耗性体重减轻及死亡。移植后7d出现死亡,移植后53d全部死亡,而DMF组小鼠aGVHD表现症状轻,移植后8d开始出现死亡,有6只小鼠生存60d以上。小鼠的生存曲线、临床评分变化曲线见图1。选移植后10d为研究时间点,取control组和DMF组小鼠肺部、肝脏和肠道、皮肤组织H&E染色,control组小鼠肠道的隐窝腺体扩张及上皮细胞坏死、淋巴细胞浸润,肺间质炎症细胞浸润,肝脏汇管区淋巴细胞浸润,皮肤表皮界面部分坏死、局部炎症细胞浸润、脂肪萎缩伴局部毛囊减少。而DMF组小鼠肠道隐窝腺体扩张及上皮细胞坏死、淋巴细胞浸润明显减少,肺间质炎症细胞少见,肝脏淋巴细胞减少,皮肤结构相对完整、炎症细胞少见(图2)。
2.DMF直接抑制移植后活化的T细胞增殖
2.1DMF抑制CD3/CD28活化的T细胞的增殖
取小鼠脾脏细胞,应用CD3/CD28抗体刺激T细胞增殖,用3H-UdR掺入处于DNA合成期的细胞,用液体闪烁计算仪测定每分钟脉冲数(CPM)以测知3H-TdR或3H-UdR含量,用公式计算细胞抑制率。通过与control组比较,分析DMF组对小鼠同种T细胞反应的抑制作用。数据分析见图3,相同体外实验重复3遍。
结果显示:DMF处理后脾脏T细胞增殖受到明显抑制,且其抑制作用与DMF给药浓度成正相关(P<0.05)。
2.2DMF抑制同种异基因反应性T细胞的增殖
C57BL/6小鼠脾细胞作为效应细胞(5×105/孔),经CO60 30Gy照射后的BALB/c脾细胞作为刺激细胞,混合淋巴细胞反应3天。每组加入3H-TdR 1微居/孔,继续培养16-18h,收集细胞,通过β液闪计数仪检测反应细胞的增殖情况。DMF组T细胞增殖受到抑制,其抑制程度与给药浓度呈正相关(p<0.05)(图4)。
2.3取上述混合淋巴细胞反应的培养上清,应用ELISA法检测小鼠混合淋巴细胞反应上清中细胞因子TNF-α、IFN-γ含量,结果显示:DMF组小鼠细胞因子TNF-α、IFN-γ的分泌均受到抑制(图5,6)。相同实验重复3次。
4.DMF能抑制树突状细胞的增殖、活化和抗原提成能力
DMF组中,经LPS刺激活化的树突状细胞成熟受到抑制,见图7、8、9。应用ELISA法检测小鼠细胞因子IL-6、TNF-α含量,结果显示:DMF组细胞因子IL-6、TNF-α的表达均受到抑制,见图10、11。
5.DMF能增加Treg细胞的数量,抑制Th1细胞反应
选移植后10d为研究时间点,取两组小鼠脾脏细胞,应用流式细胞仪对移植后小鼠脾脏淋巴细胞进行Treg、CD3+、CD4+、CD8+T细胞检测。从细胞百分比分析DMF对小鼠Treg细胞、Th1细胞的作用。数据分析见图12、13、14。分析比较DMF与Control两组数据,结果显示:DMF能增加小鼠脾脏Treg细胞数量,同时抑制Th1细胞的反应。差异有统计学意义(*表示P<0.05,**表示P<0.01)。相同实验重复3遍。
6.DMF能够在减轻aGVHD的同时保留GVL效应
第一组:SPF级BALB/c小鼠DMF组,予DMF(30mg/kg,-3d至+3d)灌胃;CO60 8.5Gy照射预处理,照射4小时后输注C57BL/6小鼠的骨髓(1×107)细胞+脾细胞(5×106)+小鼠BALB/c背景的带luciferace的A20肿瘤细胞(5×106)。第二组:SPF级BALB/c小鼠control组,对照组予安慰剂(0.8%甲基纤维素)灌胃后,CO60 8.5Gy照射预处理,照射4小时后输注C57BL/6小鼠的骨髓(1×107)细胞+脾细胞(5×106)+小鼠BALB/c背景的带luciferace的A20肿瘤细胞(5×106)。建立小鼠移植物抗白血病模型。结果显示,DMF在减轻aGVHD的同时,不影响GVL效应。图15,小鼠生存曲线。图16,活体成像显示小鼠体内的白血病细胞。
结论
综上所述,本发明对DMF在GVHD模型中对GVHD和GVL的作用进行评估。我们发现,DMF具有抑制异基因造血干细胞移植后急性移植物抗宿主病(aGVHD)的作用;能直接抑制移植后活化的T细胞反应;抑制树突状细胞的增殖、活化和抗原提成能力;抑制Th1细胞反应;可能是通过增加Treg细胞的数量来实现的,DMF能够在减轻aGVHD的同时不影响GVL效应。
以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,且本发明不限于上述的实施例,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!