磁共振成像造影剂的制作方法
发明领域本发明涉及一类磁共振造影剂,属于生物成像领域。
背景技术:
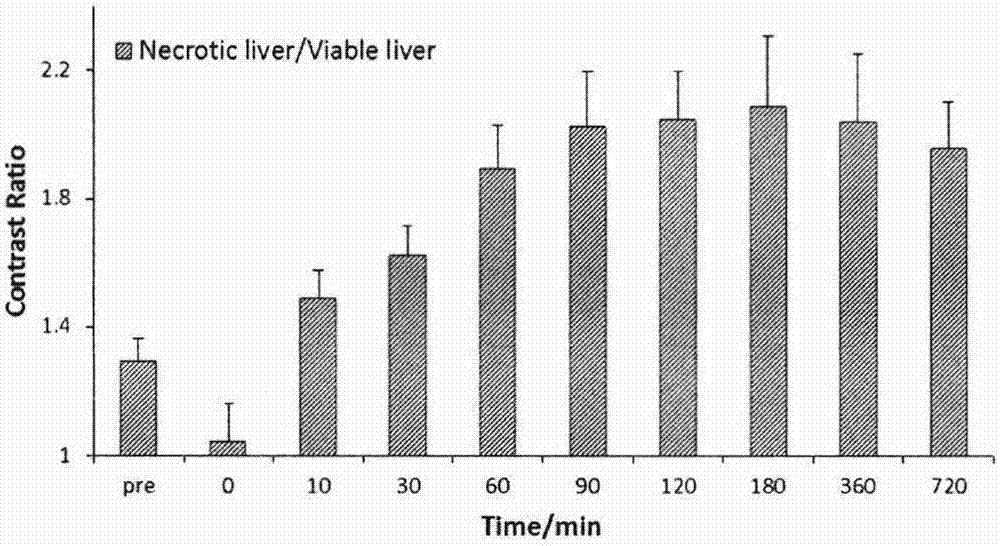
:坏死是一种细胞死亡形式,在宏观上表现出一种病理状态。组织坏死是许多种疾病的主要特征,如心血管疾病,癌症等。心肌梗死,恶性肿瘤以及肿瘤经非手术治疗后均会形成坏死,因此,针对坏死组织成像对检测坏死相关疾病具有很大的临床应用前景,如能够诊断病情,评估疾病预后,监测疾病对药物的治疗反应等,从而利于医生对病人进行有效的管理,指导医生快速选择最佳治疗策略以实现个体化治疗,将副作用降到最低,减少医疗费用等。如今,分子影像技术已经被广泛应用于体内坏死相关疾病的诊断研究,包括单光子发射计算体层摄影术(spect)、正电子成像术(pet)、磁共振成像(mri)等。相对于核医学成像模式,mri由于具有高的时空分辨率、无电离辐射等优点,在临床上广泛应用。然而磁共振成像通常需要注射造影剂来提高组织间的对比度,保证成像的灵敏度和清晰度。目前临床上常用的造影剂为小分子钆类顺磁性性造影剂,这类造影剂血浆清除快,在组织上停留时间短,导致成像时间窗过窄;弛豫率不高,通常需要多次给药,这就带来一定的毒性风险;最为关键的是这类造影剂是非特异性造影剂,无法对坏死组织进行特异性成像。前期研究的用于坏死诊断的磁共振造影剂主要是卟啉类的磁共振造影剂,但是由于卟啉具有光毒性,已经停止使用,最近几年研究越来越少。因此,基于上述的种种缺点,本发明的发明人在大量研究前人工作的基础上,提出目前我们迫切需要一种新的针对坏死组织诊断的磁共振造影剂,这些造影剂应该具有以下优点:1、具有高的坏死靶向性;2、正常组织分布低;3、无毒副作用,或毒副作用低;3、能在坏死组织停留较长的时间,具有相对长的成像时间窗;4、血浆半衰期短;5、具有相对高的弛豫率。技术实现要素:本发明的目的是提供一种磁共振成像造影剂,所述的造影剂能特异性靶向特定的坏死组织区域。所述的造影剂主要是由通式如下的化合物组成:其中:r1、r2、r3、r4、r5、r6、r7独立且任意地选自:-h、-oh、-och3、-oc2h5、-nh2、-cooh、-cooch3、-cooc2h5、-ch3、-ch2oh、-ch2och3、前述取代基的糖苷基、前述取代基的盐;-x-l-ym独立且任意取代环上位置,其中:x独立且任意选自:o、-co、-nh、-ch2、-nhco-、-conh-;l独立且任意选自:氨基酸、肽、其中,氨基酸包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸n为≥0的整数;y独立且任意选自:dota、dtpa、do3a、nota、dcdtpa、cdtpa、edta、otta、p4a、b4a、phemt、tmt;m独立且任意选自:钆(iii)、镝(iii)、铕(iii)、铁(iii)、锰(ii)、锰(iii)、铬(iii)。其中,母核部分为大黄酸、大黄素酸、蒽醌-2-羧酸、1-氨基蒽醌、2-氨基蒽醌、1,5-二氨基蒽醌、2,6-二氨基蒽醌、大黄酸-8-o-β-d-葡萄糖苷、大黄素、大黄酚、芦荟大黄素、蒽绛酚、茜草素、大黄素甲醚、大黄素甲醚-8-o-β-d-葡萄糖苷、大黄酚-8-o-β-d-吡喃葡萄糖苷、8-o-β-d-葡萄糖基大黄素、大黄酚-1-o-三葡萄糖苷、芦荟甙、1-羟基蒽醌、2-羟基蒽醌、1,8-二羟基蒽醌、2,6-二羟基蒽醌、醌茜、2-氯蒽醌、1,5-二氯蒽醌、1-氨基-4-溴基-2-甲基蒽醌、1,4-二氨基蒽醌、1-氨基-4-羟基蒽醌。优选地,所述的磁共振成像造影剂主要由式(i)~式(xxi)中的任意一种化合物组成:优选地,所述磁共振造影剂是指肿瘤内坏死细胞磁共振造影剂、坏死心肌磁共振造影剂。具体地说,诱导肿瘤坏死的治疗手段包括通过经皮注射乙醇或乙酸的化学方法或是通过栓塞、冷冻疗法、微波、聚焦超声、间质激光治疗和射频消融的物理方法;利用血管阻断剂或是细胞毒药物的化疗;以及通过外部或是内部辐射肿瘤组织的放疗。有益效果根据本发明制备的磁共振成像造影剂,经一次静脉注射,在体内能够特异性地靶向到坏死肝脏和坏死肌肉区域,在磁共振上显示坏死肝及坏死肌肉区域存在高信号,而正常肝、正常肌肉信号明显低于坏死肝、坏死肌肉。w256接种的皮下肿瘤大鼠在经ca4p治疗后造成大量坏死,此坏死区域可以通过我们的坏死靶向性造影剂进行成像。在体外坏死细胞模型上同样验证了这个结果。本发明的优点是:此类化合物分子量小,生物相容性好;具有长而稳定的成像时间窗,因此能更准确检测到坏死组织。附图说明图1所示为造影剂i在肌肉坏死、肝坏死大鼠模型的mri成像图及其对应的显微图。图2所示为造影剂i在坏死肝与正常肝的对比度(cr)直方图。图3所示为造影剂i在坏死肝与正常肝相对信号增强百分比折线图。图4所示接种w256瘤株大鼠10mg/kgca4p治疗前后给予下述造影剂iv的mri成像图。图5所示为造影剂iii在兔子心梗模型的离体mri成像图及其对应的ttc图图6所示为造影剂i在死、活细胞的成像图。具体实施方式下文将结合具体实施例详细描述本发明的内容,但并不代表本发明只限于该实施例。在本发明的实施例中所采用的设备和试剂如下:1h-nmr、13c-nmr谱采用brukeravanceiii型核磁共振仪(300mhz或500mhz)测定,tms为内标。质谱采用agilent6410triplequadlc/ms液质联用仪测定,echospeedplus1.5t磁共振仪(美国ge公司),所用的原料均购自国药化学试剂公司或是sigma公司,其余试剂均为分析纯。sd大鼠280-300g(由江苏省中医药研究院动物中心提供)。以上未提及的材料,除非实施例中特别声明,否则均为普通市售产品。本发明中室温是指20~30℃。实施例组1:造影剂的合成及配体的结构鉴定实施例1-1:式(i)造影剂的合成将200mg(0.70mmol)大黄酸,148mg(0.77mmol)edc加入到100ml二氯甲烷溶液,在室温下搅拌30min,再加入88mg(0.77mmol)nhs,室温反应24h至反应体系呈澄清时,将100μln-boc-乙二胺逐滴加入至反应液,室温搅拌24h,过滤得到黄色固体,用甲醇洗得到纯的中间体1。将200mg(0.47mmol)中间体1加入到15ml二氯甲烷/三氟乙酸(10∶1),室温反应12h,减压蒸干溶剂,得到中间体2。将421mg(0.74mmol)dota-tris(tbu)ester,280mg(0.74mmol)hbtu加入到50ml乙腈,再加入100μldipea,室温反应30min,再将241mg(0.74mmol)中间体2投入到反应体系,室温反应24h。减压除去溶剂得到粗品,经硅胶柱纯化得到中间体3。将200mg(0.23mmol)中间体3加入到20ml二氯甲烷/三氟乙酸(1∶1),室温反应24h,减压除去溶剂得到配体1。将200mg(0.28mmol)配体1,104mg(0.28mmol)六水合氯化钆加入到5ml水中,用1mnaoh调节ph至6-7,室温反应24h,减压蒸干溶剂即可。配体1:1hnmr(300mhz,dmso-d6),δ(ppm):11.91(s,2h);8.98(s,1h);8,57(s,1h);8.13(s,1h);7.87-7.82(m,1h);7.80~7.75(m,2h);7.43(d,1h,j=8.2hz);3.92~2.59(m,28h).13cnmr(75mhz,dmso-d6):δ190.91,181.32,170.29,170.19,164.10,161.41,161.36,141.39,137.19,133.57,133.25,124.33,122.99,119.15,117.96,117.50,116.18,58.40,55.52,54.80,50.49,50.14,49.85,39.05.esi-msm/z749.2for([m+k-2h]-)。实施例1-2:式(ii)造影剂的合成实施例1-1中的n-boc-乙二胺改为n-boc-丁二胺,具体制备方法同实施例1-1,得到配体2的磁共振造影剂。配体2:1hnmr(300mhz,dmso-d6),δ(ppm):11.81(s,2h);9.66(s,1h);8.18(s,1h);8.15(s,1h);7.90(s,1h);7.82~7.71(m,2h);7.40(d,1h,j=8.3hz);3.52~2.61(m,28h);1.57~1.55(m,4h).13cnmr(75mhz,dmso-d6):δ:191.39,181.20,170.22,170.15,169.84,163.78,161.37,161.24,142.03,137.39,133.44,133.33,124.40,122.70,119.31,117.87,117.30,116.11,58.77,55.37,54.65,50.92,50.05,49.94,49.88,37.93,25.98,25.65.esi-msm/z777.2for(m+k+-2h-)。实施例1-3:式(iii)造影剂的合成实施例1-1中的n-boc-乙二胺改为n-boc-己二胺,具体制备方法同实施例1-1,得到配体3的磁共振造影剂。配体3:1hnmr(300mhz,dmso-d6),δ(ppm):11.67(s,2h);9.14(s,1h);8.12(s,2h);7.83(s,1h);7.80~7.70(m,2h);7.38(d,1h,j=8.5hz);3.48~2.64(m,28h);1.56~1.32(m,8h).13cnmr(75mhz,dmso-d6):δ:191.26,181.16,170.19,169.73,163.76,161.37,161.23,141.91,137.37,133.43,133.28,124.42,122.54,119.30,117.62,58.28,55.60,54.77,51.13,50.16,50.00,39.38,38.33,28.74,28.47,25.95.esi-msm/z805.3for([m+k+2h]-)。实施例1-4:式(iv)造影剂的合成将200mg(0.70mmol)大黄酸,148mg(0.77mmol)edc溶于100ml二氯甲烷溶液,在室温下搅拌30min,再加入88mg(0.77mmol)nhs,室温反应24h至反应体系呈澄清时,停止反应,混合物经硅胶柱纯化得到羧基活化的大黄酸,溶于50mldcm中,逐滴加入到等摩尔的2,2′-氧化二乙基胺中,室温氮气保护下搅拌24h,混合物经硅胶柱纯化得到纯的中间体1。将421mg(0.74mmol)dota-tris(tbu)ester,280mg(0.74mmol)hbtu溶于50ml乙腈,再加入100μldipea,室温反应30min,再将226mg(0.61mmol)中间体1投入至反应体系,室温反应24h。减压除去溶剂得到粗品,经硅胶柱纯化得到中间体2。将200mg(0.22mmol)中间体2溶于20ml二氯甲烷/三氟乙酸(1∶1),室温反应24h,减压除去溶剂得到配体4。将200mg(0.26mmol)配体4,96mg(0.26mmol)六水合氯化钆溶于5ml水,用1mnaoh调节ph至6-7,室温反应24h,减压蒸干溶剂得到mri造影剂。配体4:1hnmr(300mhz,dmso-d6),δ(ppm):11.92(s,2h);8.99(s,1h);8,60(s,1h);8.12(s,1h);7.88-7.81(m,1h);7.80~7.74(m,2h);7.44(d,1h,j=8.2hz);4.01~2.53(m,28h).13cnmr(75mhz,dmso-d6):δ:191.39,181.20,170.22,170.15,169.84,163.78,161.37,161.24,142.03,137.39,133.44,133.33,124.40,122.70,119.31,117.87,117.30,116.11,68.85,58.77,55.37,54.65,50.92,50.05,49.94,49.88,40.03,39.99.esi-msm/z757.3for(m+h+)。实施例1-5:式(v)造影剂的合成实施例1-1中的大黄酸改为大黄酸-8-o-β-d-葡萄糖苷,具体制备方法与实施例1-1相同,得到配体5的mri造影剂。配体5:1hnmr(300mhz,dmso-d6),δ(ppm):11.65(s,2h);8.86(s,1h);7.83(s,1h);7.63(s,1h);7.40(d,1h,j=8.2hz);7.38(s,1h);7.13(d,1h,j=8.3hz);3.77-5.06(m,22h);3.70(t,2hj=7.9hz);3.57(t,2h,j=8.0hz);3.52~2.61(m,28h).13cnmr(75mhz,dmso-d6):δ:188.04,185.20,178.61,170.72,167.84,167.51,160.31,159.11,139.38,134.90,131.72,129.20,128.58,121.80,120.21,120.13,119.71,116.61,86.89,84.88,78.72,71.48,70.21,62.28,39.65,37.73,36.04,34.78,29.15,28.03.esi-msm/z911.3for([m+k-2h]-)。实施例1-6:式(vi)造影剂的合成实施例1-1中的大黄酸改为蒽醌-2-羧酸,具体制备方法与实施例1-1相同,得到配体6的mri造影剂。配体6:1hnmr(300mhz,dmso-d6),δ(ppm):8.86(s,1h);8.32(d,j=8.0hz,2h);8.29(d,j=7.9hz,3h);8.02(d,j=8.0hz,1h);7.83(s,1h);7.82(s,1h);3.92~2.59(m,28h).13cnmr(75mhz,dmso-d6):δ182.17,178.60,170.72,167.53,137.62,134.93,136.55,133.38,132.10,130.91,127.55,126.82,39.62,37.72,36.05,34.10,29.02,28.15.esi-msm/z717.2for([m+k-2h]-)。实施例1-7:式(vii)造影剂的合成实施例1-1中的大黄酸改为大黄素酸,具体制备方法与实施例1-1相同,得到配体7的mri造影剂。配体7:1hnmr(300mhz,dmso-d6),δ(ppm):11.89(s,2h);9.21(s,1h);8.93(s,1h);8,55(s,1h);8.12(s,1h);7.85-7.81(m,1h);7.80~7.77(m,2h);3.91~2.60(m,28h).13cnmr(75mhz,dmso-d6):δ190.89,181.28,170.28,170.19,164.10,163.2,161.44,161.40,141.39,133.56,133.25,124.32,122.99,119.15,117.96,117.50,116.18,58.39,55.51,54.78,50.48,50.14,49.82,39.04.esi-msm/z767.2for([m+k]+)。实施例1-8:式(viii)造影剂的合成实施例1-1中的大黄酸改为大黄素酸,n-boc-乙二胺改为n-boc-丁二胺,具体制备方法与实施例1-1相同,得到配体8的mri造影剂。配体8:1hnmr(300mhz,dmso-d6),δ(ppm):11.93(s,2h);9.21(s,1h);8.93(s,1h);8,55(s,1h);8.12(s,1h);7.85-7.82(m,1h);7.81~7.77(m,2h);3.91~2.61(m,28h)1.58~1.56(m,4h).13cnmr(75mhz,dmso-d6):δ190.89,181.28,170.28,170.19,164.10,163.2,161.44,161.40,141.39,133.56,133.25,124.32,122.99,119.15,117.96,117.50,116.18,58.77,55.37,54.65,50.92,50.05,49.94,49.88,37.93,25.98,25.65.esi-msm/z757.3for([m+k]+)。实施例1-9:式(ix)造影剂实施例1-1中的大黄酸改为大黄素酸,n-boc-乙二胺改为n-boc-己二胺,具体制备方法与实施例1-1相同,得到配体9的mri造影剂。配体9:1hnmr(300mhz,dmso-d6),δ(ppm):12.01(s,2h);9.21(s,1h);8.93(s,1h);8,54(s,1h);8.12(s,1h);7.85-7.81(m,1h);7.80~7.77(m,2h);3.91~2.60(m,28h)1.56~1.32(m,8h).13cnmr(75mhz,dmso-d6):δ190.89,181.28,170.28,170.19,164.10,163.2,161.44,161.40,141.39,133.56,133.25,124.32,122.99,119.15,117.96,117.50,116.18,58.28,55.60,54.77,51.13,50.16,50.00,39.38,38.33,28.74,28.47,25.95.esi-msm/z785.3for([m+k]+)。实施例1-10:式(x)造影剂的合成将421mg(0.74mmol)dota-tris(tbu)ester,280mg(0.74mmol)hbtu溶于5mldmf,再加入100μldipea,室温反应30min,再将165mg(0.74mmol)2-氨基-蒽醌加入至反应体系,室温反应24h。加50ml水析出固体,过滤,滤渣经硅胶柱纯化得到中间体1。将200mg(0.26mmol)中间体1溶于20ml二氯甲烷/三氟乙酸(1∶1),室温反应24h,减压除去溶剂得到配体10。将200mg(0.33mmol)配体4,85mg(0.33mmol)六水合氯化钆溶于5ml水,用1mnaoh调节ph至6-7,室温反应24h,减压蒸干溶剂得到mri造影剂。配体10:1hnmr(300mhz,dmso-d6),δ(ppm):8,81(s,1h);8.29-8.08(m,3h);7.89-7.81(m,2h);7.77~7.70(m,2h);3.35~2.53(m,24h).13cnmr(75mhz,dmso-d6):δ:185.31,182.18,177.83,169.21,141.03,136.82,133.78,133.36,132.33,126.93,125.91,122.45,117.88,65.01,61.03,55.41,54.93.esi-msm/z610.2for([m+h]+)。实施例1-11:式(xi)造影剂的合成将165mg(0.74mmol)1-氨基-蒽醌,108mg(0.74mmol)赖氨酸,280mg(0.74mmol)hbtu溶于10mldmf,加入100μldipea,室温反应24h,加入水,析出沉淀,过滤得到滤渣,滤渣经硅胶柱纯化得到纯的中间体1。将421mg(0.74mmol)dota-tris(tbu)ester,280mg(0.74mmol)hbtu溶于50ml乙腈,再加入100μldipea,室温反应30min,再投入260mg(0.74mmol)中间体1至反应体系,室温反应24h。减压除去溶剂得到粗品,经硅胶柱纯化得到中间体2。将200mg(0.22mmol)中间体2溶于20ml二氯甲烷/三氟乙酸(1∶1),室温反应24h,减压除去溶剂得到配体11。将200mg(0.27mmol)配体3,97mg(0.26mmol)六水合氯化钆溶于5ml水,用1mnaoh调节ph至6-7,室温反应24h,减压蒸干溶剂得到mri造影剂。配体11:1hnmr(300mhz,dmso-d6),δ(ppm):8.98(s,1h);8,81(s,1h);8.29-8.08(m,3h);7.89-7.81(m,2h);7.77~7.71(m,2h);4.52(m,1h);3.35-1.25(m,33h).13cnmr(75mhz,dmso-d6):δ:185.31,182.18,177.83,170.77,169.21,141.03,136.82,133.78,133.36,132.33,126.93,125.91,122.45,117.88,65.01,61.03,57.13,55.41,54.93,42.91,32.0128.55,22.52.esi-msm/z738.3for([m+h]+)。实施例1-12:式(xii)造影剂实施例1-11中的赖氨酸改为赖氨酸-甘氨酸二肽,其他制备方法与实施例1-11相同,得到配体12的mri造影剂。配体12:1hnmr(300mhz,dmso-d6),δ(ppm):9.37(s,1h);8.98(s,1h);8,81(s,2h);8.28(s,1h);8.21-8.05(m,3h);7.86-7.81(m,2h);7.76~7.70(m,2h);4.26-1.48(m,35h).13cnmr(75mhz,dmso-d6):δ:185.29,182.19,177.86,171.11,169.99,168.45,141.91,136.62,133.78,133.56,133.53,132.33,132.11,126.92,126.84,125.91,122.43,117.89,65.02,61.04,57.15,55.42,54.94,53.62,42.91,39.01,25.43,28.82,22.52.esi-msm/z795.5for([m+h]+)。实施例1-13:式(xiii)造影剂的合成将300mg(1.0mmol)大黄素酸,775mg(1.0mmol)p-nh2-bn-dtpa-penta(t-buester),380mg(1.0mmol)hbtu溶于5mldmf,再加入150μldipea,室温反应24h,终止反应。加50ml水析出固体,过滤,滤渣经硅胶柱纯化得到中间体1。将500mg(0.47mmol)中间体1溶于30ml二氯甲烷/三氟乙酸(1∶1),室温反应24h,减压除去溶剂得到配体13。将500mg(0.,62mmol)配体9,230mg(0.62mmol)六水合氯化钆溶于5ml水,用1mnaoh调节ph至6-7,室温反应24h,减压蒸干溶剂得到mri造影剂。配体13:1hnmr(300mhz,dmso-d6),δ(ppm):12.01(s,2h);9.21(s,1h);8.93(s,1h);8.12-7.89(m,5h);7.85-7.81(m,1h);7.80~7.77(m,2h);3.45~2.38(m,19h).13cnmr(75mhz,dmso-d6):δ189.01,182.13,177.38,173.11,165.44,164.69,163.28,161.37,139.05,136.46,135.21,134.02,130.98,128.69,128.33,122.23,122.04,120.14,119.22,116.99,108.91,108.54,108.04,66.48,61.13,61.07,60.02,59.02,55.04,53.18,37.49.esi-msm/z781.2for([m+h]+)。实施例1-14:式(xiv)造影剂的合成实施例1-13中的大黄素酸改为大黄酸,具体制备方法与实施例1-13相同,得到配体14的mri造影剂。配体14:1hnmr(300mhz,dmso-d6),δ(ppm):12.01(s,2h);9.18(s,1h);8.94(s,1h);8.11-7.88(m,6h);7.84-7.81(m,1h);7.80~7.76(m,2h);3.44~2.35(m,19h).13cnmr(75mhz,dmso-d6):δ189.01,182.11,177.38,173.12,165.43,164.67,163.25,161.37,139.04,136.44,135.21,134.03,130.98,128.66,128.32,122.25,122.01,120.12,119.23,116.97,108.90,108.55,108.04,66.46,61.13,61.07,60.01,59.02,55.02,53.19,37.52.esi-msm/z765.2for([m+h]+)。实施例1-15:式(xv)造影剂的合成实施例1-13中的大黄素酸改为蒽醌-2-羧酸,具体制备方法与实施例1-13相同,得到配体15的mri造影剂。配体15:1hnmr(300mhz,dmso-d6),δ(ppm):9.16(s,1h);8.95(s,1h);8.25-7.88(m,10h);7.98-7.83(m,1h);7.81~7.77(m,2h);3.44~2.35(m,19h).13cnmr(75mhz,dmso-d6):δ189.01,182.11,177.38,173.12,165.43,164.67,163.25,161.37,139.04,136.44,135.21,134.03,130.98,128.66,128.32,122.25,122.01,120.12,119.23,116.97,108.90,108.55,108.04,66.46,61.13,61.07,60.01,59.02,55.02,53.19,37.52.esi-msm/z765.2for([m+h]+)。实施例1-16:式(xvi)造影剂的合成实施例1-1中的大黄酸改为蒽醌-2-羧酸,dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-1相同。配体16:1hnmr(300mhz,dmso-d6),δ(ppm):8.88(s,1h);8.32(d,j=8.1hz,2h);8.28(d,j=8.2hz,3h);8.02(d,j=8.1hz,1h);7.83(s,1h);7.82(s,1h);3.45~2.38(m,16h).13cnmr(75mhz,dmso-d6):δ182.10,177.43,173.14,170.75,167.52,134.92,137.66,133.64,133.35,132.11,130.93,127.55,127.42,126.82,60.54,60.23,59.85,59.38,54.92,54.58,52.82,52.43,39.63,37,76.esi-msm/z670.2for([m+h]+)。实施例1-17:式(xvii)造影剂的合成实施例1-1中的dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-1相同。配体17:1hnmr(300mhz,dmso-d6),δ(ppm):11.91(s,2h);8.98(s,1h);8,57(s,1h);8.13(s,1h);7.87-7.82(m,1h);7.80~7.75(m,2h);7.43(d,1h,j=8.2hz);3.62~2.59(m,22h).13cnmr(75mhz,dmso-d6):δ190.91,181.32,170.29,170.19,164.10,161.41,161.36,141.39,137.19,133.57,133.25,124.33,122.99,119.15,117.96,117.50,116.18,66.46,61.11,61.05,60.01,59.01,55.02,53.18,37.51.esi-msm/z860.1for([m+h]+)。实施例1-18:式(xviii)造影剂的合成实施例1-1中的大黄酸改为大黄素酸,dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-1相同。配体18:1hnmr(300mhz,dmso-d6),δ(ppm):δ:11.91(s,2h);9.06(s,1h);7.32(s,1h);7.61(s,1h);6.74(s,1h);6.45(s,1h);3.65~2.35(m,22h).13cnmr(75mhz,dmso-d6):δ188.02,182.15,177.42,173.18,170.72,167.54,164.54,163.33,160.38,139.02,136.43,131.72,120.12,119.72.116.62,108.92,108.36,107.02,66.45,61.12,61.06,60.01,59.01,55.01,53.18,37.52.esi-msm/z876.1for([m+h]+)。实施例1-19:式(xix)造影剂的合成实施例1-1中的大黄酸改为大黄酸-8-o-β-d-葡萄糖苷,dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-1相同。配体19:1hnmr(300mhz,dmso-d6),δ(ppm):11.09(s,2h);8.85(s,1h);7.84(s,1h);7.62(s,1h);7.39(d,1h,j=8.2hz);7.35(s,1h);7.12(d,1h,j=8.3hz);3.77-5.06(m,22h);3.65(t,2h,j=7.9hz);3.52(t,2h,j=8.0hz);3.45~2.35(m,16h).13cnmr(75mhz,dmso-d6):δ188.02,185.23,177.43,173.15,170.72,167.55,160.38,159.10,134.98,139.02,131.72,129.02,128.63,121.85,120.23,120.12,119.72,116.60,86.63,84.86,78.76,71.54,70.23,62.23,60.54,60.35,59.82,59.26,54.92,54.56,52.85,52.46,39.63,27.77.esi-msm/z864.2for([m+h]+)。实施例1-20:式(xx)造影剂的合成实施例1-4中的大黄酸改为大黄素酸,dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-4相同。配体20:1hnmr(300mhz,dmso-d6),δ(ppm):δ:11.90(s,2h);9.07(s,1h);7.38(s,1h);7.63(s,1h);6.75(s,1h);6.48(s,1h);3.71(m,2h);3.67(m,2h);3.45~2.35(m,22h).13cnmr(75mhz,dmso-d6):δ188.02,182.15,177.42,173.18,170.72,167.54,164.54,163.33,160.38,139.02,136.43,131.72,120.12,119.72.116.62,108.92,108.36,107.02,69.92,60.23,60.58,59.98,59.26,54.94,54.52,52.85,52.43,41.03,39.93.esi-msm/z762.2for([m+h]+)。实施例1-21:式(xxi)造影剂的合成实施例1-4中的dota-tris(tbu)ester改为dtpa-tetra(tbu)ester,具体制备方法与实施例1-4相同。配体21:1hnmr(300mhz,dmso-d6)δ:11.85(s,2h);8.36(s,1h);8.12(s,1h);7.99(s,1h);7.82(s,1h);7.73-7.76(m,2h);7.40(s,1h);3.71(m,2h);3.67(m,2h);3.45~2.35(m,20h).13cnmr(75mhz,dmso-d6):δ188.02,182.15,177.42,173.13,170.78,167.52,161.98,160.35,139.04,136.21,133.12,131.72,124.14,120.18,119.75,119.43,116.65,116.32,69.98,60.25,59.82,59.27,54.97,54.53,52.82,52.47,41.06,39.95.esi-msm/z646.2for([m+h]+)。实施例组2:靶向性研究实施例2-1:大鼠肝坏死、肌肉坏死模型的磁共振成像大鼠肝坏死、肌肉坏死模型的制备:大鼠腹腔注射10%的水合氯醛麻醉、固定,取腹部正中切口,暴露肝脏,分离出右肝门管区,阻断进肝血管(肝动脉和门静脉),3h后解除阻断,右肝再灌流,分层缝合关腹。同时在大鼠的左后肢肌肉注射0.2ml无水乙醇诱导肌肉坏死,最后给每只大鼠肌肉注射16万u青霉素防止感染。模型做好后12小时进行实验。mri成像:给药前对肝脏与腿部肌肉部位进行t1wi和t2wi的扫描,给造影剂(0.1mmol/kg)后再进行ce-t1wi扫描。层厚3mm,间隔0.8mm,fov100×100cm2,矩阵224×192,nex2次。t1wfse-ir序列:tr550ms,te24ms;t2wfse序列:tr2920ms,te88ms;ce-t1wfse序列:tr550ms,te60ms。扫描后在geaw4.3工作站下处理数据。图像数据处理结果见附图1所示。其中图1a、1b均为给予造影剂3h后成像结果。其中图1a为腿部成像,白色箭头表示坏死肌肉部位;图1b为肝脏部位成像,白色箭头表示坏死肝脏部位。图1c、1d分别为坏死肌肉、坏死肝的显微图,分别为放大10倍、40倍。对比度与相对信号增强百分比计算:在给药前与给药后不同时间点的图像上分别选取坏死组织与正常组织图像最明显、连续的3个层面,选一个直径为3mm的兴趣区域(roi),自动得到平均信号强度(si)。取连续3层si的平均值,代表各组织的si,通过以下公式计算对比度:坏死组织/正常组织(cr)=si(坏死组织)/si(正常组织),结果见图2;相对信号增强百分比re%=(si(post)-si(pre))/si(pre),结果见图3。实施例2-2:大鼠皮下移植w256肿瘤模型的磁共振成像大鼠皮下移植w256肿瘤模型的制备:每只大鼠单侧皮下接种0.2ml含小鼠w256肝癌细胞的腹腔液,两周后肿瘤块形成,挑选肿瘤最大直径在0.6cm~1.2cm之间的荷瘤大鼠供实验所用。mri成像:给ca4p前后进行磁共振扫描,扫描参数:层厚3mm,间隔0.8mm,fov100×100cm2,矩阵224×192,nex2次。t1wfse-ir序列:tr550ms,te24ms;t2wfse序列:tr2920ms,te88ms;ce-t1wfse序列:tr550ms,te60ms。扫描后在geaw4.3工作站下处理数据。ca4p治疗前,模型鼠肿瘤表现为均匀增强表现。ca4p治疗后,肿瘤中心因出现坏死区域,给予造影剂0h表现为肿瘤中心未见明确强化,而在给予造影剂3h,则中间坏死区域显示明显的强化,见附图4所示。其中图4a为ca4p治疗前24h给予造影剂0h后的图像,图4b为ca4p治疗24h后给予造影剂0h的图像,图4c为ca4p治疗24h后给予造影剂3h的图像。实施例2-3:兔子心肌梗死模型的磁共振成像兔子再灌注心肌梗死模型的制备:雄性新西兰白兔体重3~4.5kg,肌内注射体积比为1∶1的盐酸氯胺酮(50mg/ml)与隆膨(2%盐酸赛拉嗪)混合溶液进行预麻,给药剂量为0.5ml/kg。固定白兔与实验桌面上,白兔进行气管插管,通以混合含氧丰富的空气,连接呼吸机及心电图持续监测。静脉注射盐酸戊巴比妥钠20~40mg/kg/h保持麻醉后,碘伏皮肤消毒后,沿胸骨左缘第五根与第六根肋间开胸,暴露心脏,剥离心包膜。使用3-0的丝线结扎左冠状动脉,结扎后,抽出胸腔空气,恢复胸腔负压,快速缝合胸腔,将可松解的结扎线留在外面。撤出气管插管,肌肉注射青霉素80000u/只。经过60min缺血后,抽出结扎线,再灌注24h。mri成像:在兔子心梗再灌注24h注射造影剂,在给药后12h将兔子心脏取出,用生理盐水将其冲洗干净,用配制好的3%的琼脂固定,再进行ce-t1wi扫描。扫描参数:层厚3mm,间隔0.8mm,fov100×100cm2,矩阵224×192,nex2次,tr550ms,te60ms。扫描结束后将心脏切成3mm厚的组织,进行ttc染色。结果见图5,图5a为mri扫描图,图5b为对应的ttc染色图。实施例2-4:死、活细胞的磁共振成像取人肺癌a549肿瘤细胞株接种于6孔细胞培养板,密度为5×105个细胞/孔,以rpmi-1640培养基加10%胎牛血清在5%co2和37℃细胞培养箱中培养过夜。在57℃烘箱培养1h诱导细胞坏死,将坏死细胞与正常细胞分别经胰酶消化取出离心,吸出上清液,用pbs清洗两次,分别加入100μl的造影剂与100μl的无血清培养基,吹打混匀放入细胞培养箱中孵育30min,再取出离心,倒掉上清液,用pbs清洗两次,再用100μl的pbs吹打细胞,取出放入样品瓶中,进行成像。结果见附图:6所示,图6a为活细胞成像图,图6b为死细胞成像图。实施例2-4:造影剂在肝坏死、肌肉坏死大鼠模型上的生物分布。在给药3h后剥离各脏器(血、肺、心、脾、胃、肾、膀胱、小肠、大肠、脑、正常肝、坏死肝、正常肌肉、坏死肌肉),样品的处理方法参考文献(chunhuaguo等.polymerchemistry.2016,7,2531-2541)用icp-ms测量,结果用%id/g表示。表1:式(i)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.45±0.03肺0.22±0.06心0.09±0.00脾0.36±0.03胃0.14±0.00肾3.35±0.05膀胱0.29±0.04小肠0.51±0.08大肠0.49±0.07脑0.02±0.00正常肝0.33±0.06坏死肝2.26±0.21正常肌肉0.10±0.01坏死肌肉0.61±0.05体内生物学分布数据显示:造影剂(i)给药3h后,在正常肝的摄取值为0.33±0.06%id/g,坏死肝的摄取值为2.26±0.21%id/g,坏死肝/正常肝坏死比为6.85;在正常肌肉摄取值为0.10±0.03%id/g,坏死肌肉摄取值为0.41±0.05%id/g,坏死肌肉/正常肌肉坏死比为6.10。表2:式(ii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.38±0.05肺0.23±0.04心0.10±0.01脾0.33±0.03胃0.20±0.02肾3.35±0.05膀胱0.40±0.03小肠0.61±0.10大肠0.62±0.10脑0.02±0.00正常肝0.30±0.05坏死肝2.15±0.28正常肌肉0.11±0.03坏死肌肉0.52±0.05体内生物学分布数据显示:造影剂(ii)给药3h后,在正常肝的摄取值为0.30±0.05%id/g,坏死肝的摄取值为2.15±0.28%id/g,坏死肝/正常肝坏死比为7.17;在正常肌肉摄取值为0.11±0.03%id/g,坏死肌肉摄取值为0.52±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.73。表3:式(iii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.23±0.03肺0.21±0.04心0.09±0.01脾0.28±0.03胃0.11±0.01肾3.72±0.18膀胱0.84±0.06小肠0.43±0.07大肠0.36±0.05脑0.02±0.00正常肝0.26±0.03坏死肝1.66±0.21正常肌肉0.09±0.01坏死肌肉0.43±0.05体内生物学分布数据显示:造影剂(iii)给药3h后,在正常肝的摄取值为0.26±0.03%id/g,坏死肝的摄取值为1.66±0.21%id/g,坏死肝/正常肝坏死比为6.38;在正常肌肉摄取值为0.09±0.01%id/g,坏死肌肉摄取值为0.43±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.78。表4:式(iv)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.26±0.04肺0.25±0.04心0.12±0.02脾0.36±0.03胃0.15±0.01肾3.92±0.11膀胱0.75±0.06小肠0.52±0.08大肠0.41±0.06脑0.02±0.00正常肝0.30±0.05坏死肝2.12±0.21正常肌肉0.11±0.03坏死肌肉0.45±0.05体内生物学分布数据显示:造影剂(iv)给药3h后,在正常肝的摄取值为0.30±0.05%id/g,坏死肝的摄取值为2.12±0.21%id/g,坏死肝/正常肝坏死比为7.07;在正常肌肉摄取值为0.11±0.03%id/g,坏死肌肉摄取值为0.45±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.09。表5:式(v)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.22±0.03肺0.25±0.05心0.12±0.01脾0.24±0.04胃0.11±0.00肾4.18±0.24膀胱1.02±0.03小肠0.42±0.08大肠0.53±0.08脑0.02±0.00正常肝0.25±0.05坏死肝1.98±0.19正常肌肉0.06±0.01坏死肌肉0.36±0.06体内生物学分布数据显示:造影剂(v)给药3h后,在正常肝的摄取值为0.25±0.05%id/g,坏死肝的摄取值为1.98±0.19%id/g,坏死肝/正常肝坏死比为7.92;在正常肌肉摄取值为0.06±0.01%id/g,坏死肌肉摄取值为0.36±0.06%id/g,坏死肌肉/正常肌肉坏死比为6.00。表6:式(vi)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.24±0.01肺0.19±0.03心0.10±0.00脾0.33±0.03胃0.15±0.00肾3.95±0.25膀胱0.67±0.04小肠0.71±0.20大肠0.66±0.06脑0.02±0.00正常肝0.32±0.06坏死肝2.28±0.20正常肌肉0.08±0.01坏死肌肉0.36±0.06体内生物学分布数据显示:造影剂(vi)给药3h后,在正常肝的摄取值为0.32±0.06%id/g,坏死肝的摄取值为2.28±0.20%id/g,坏死肝/正常肝坏死比为7.13;在正常肌肉摄取值为0.08±0.01%id/g,坏死肌肉摄取值为0.36±0.06%id/g,坏死肌肉/正常肌肉坏死比为4.5。表7:式(vii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.46±0.03肺0.25±0.05心0.13±0.00脾0.22±0.03胃0.09±0.00肾2.87±0.05膀胱0.41±0.04小肠0.85±0.11大肠0.73±0.07脑0.02±0.00正常肝0.46±0.06坏死肝2.31±0.21正常肌肉0.10±0.02坏死肌肉0.39±0.05体内生物学分布数据显示:造影剂(vii)给药3h后,在正常肝的摄取值为0.46±0.06%id/g,坏死肝的摄取值为2.31±0.21%id/g,坏死肝/正常肝坏死比为5.02;在正常肌肉摄取值为0.10±0.02%id/g,坏死肌肉摄取值为0.39±0.05%id/g,坏死肌肉/正常肌肉坏死比为3.90。表8:式(viii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.48±0.02肺0.23±0.06心0.07±0.00脾0.31±0.05胃0.11±0.00肾2.47±0.09膀胱0.38±0.04小肠0.73±0.20大肠0.78±0.07脑0.02±0.00正常肝0.43±0.07坏死肝2.25±0.20正常肌肉0.08±0.01坏死肌肉0.38±0.06体内生物学分布数据显示:造影剂(viii)给药3h后,在正常肝的摄取值为0.43±0.07%id/g,坏死肝的摄取值为2.25±0.20%id/g,坏死肝/正常肝坏死比为5.23;在正常肌肉摄取值为0.08±0.01%id/g,坏死肌肉摄取值为0.38±0.06%id/g,坏死肌肉/正常肌肉坏死比为4.75。表9:式(ix)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.26±0.02肺0.20±0.03心0.08±0.00脾0.34±0.04胃0.14±0.00肾3.28±0.15膀胱0.62±0.04小肠0.51±0.14大肠0.52±0.07脑0.02±0.00正常肝0.51±0.05坏死肝3.32±0.25正常肌肉0.11±0.01坏死肌肉0.61±0.04体内生物学分布数据显示:造影剂(ix)给药3h后,在正常肝的摄取值为0.51±0.05%id/g,坏死肝的摄取值为3.32±0.25%id/g,坏死肝/正常肝坏死比为6.51;在正常肌肉摄取值为0.11±0.01%id/g,坏死肌肉摄取值为0.61±0.04%id/g,坏死肌肉/正常肌肉坏死比为5.55。表10:式(x)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.30±0.03肺0.25±0.01心0.09±0.00脾0.33±0.03胃0.14±0.00肾3.02±0.23膀胱0.49±0.04小肠0.45±0.05大肠0.37±0.04脑0.02±0.00正常肝0.59±0.05坏死肝3.47±0.21正常肌肉0.09±0.01坏死肌肉0.56±0.05体内生物学分布数据显示:造影剂(x)给药3h后,在正常肝的摄取值为0.59±0.05%id/g,坏死肝的摄取值为3.47±0.21%id/g,坏死肝/正常肝坏死比为5.88;在正常肌肉摄取值为0.09±0.01%id/g,坏死肌肉摄取值为0.56±0.05%id/g,坏死肌肉/正常肌肉坏死比为6.22。表11:式(xi)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.26±0.03肺0.21±0.03心0.09±0.00脾0.26±0.03胃0.11±0.00肾3.15±0.22膀胱0.52±0.04小肠0.42±0.09大肠0.52±0.05脑0.02±0.00正常肝0.61±0.06坏死肝3.52±0.21正常肌肉0.09±0.01坏死肌肉0.48±0.02体内生物学分布数据显示:造影剂(xi)给药3h后,在正常肝的摄取值为0.61±0.06%id/g,坏死肝的摄取值为3.52±0.21%id/g,坏死肝/正常肝坏死比为5.77;在正常肌肉摄取值为0.09±0.01%id/g,坏死肌肉摄取值为0.48±0.02%id/g,坏死肌肉/正常肌肉坏死比为5.33。表12:式(xii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.21±0.03肺0.25±0.02心0.09±0.00脾0.33±0.03胃0.11±0.00肾3.41±0.03膀胱0.39±0.02小肠0.57±0.10大肠0.55±0.07脑0.02±0.00正常肝0.59±0.03坏死肝3.25±0.12正常肌肉0.10±0.01坏死肌肉0.48±0.04体内生物学分布数据显示:造影剂(xii)给药3h后,在正常肝的摄取值为0.59±0.03%id/g,坏死肝的摄取值为3.25±0.12%id/g,坏死肝/正常肝坏死比为5.51;在正常肌肉摄取值为0.10±0.01%id/g,坏死肌肉摄取值为0.58±0.04%id/g,坏死肌肉/正常肌肉坏死比为4.80。表13:式(xiii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.39±0.03肺0.18±0.02心0.09±0.00脾0.29±0.02胃0.09±0.00肾2.68±0.05膀胱0.42±0.02小肠0.53±0.12大肠0.64±0.07脑0.02±0.00正常肝0.51±0.02坏死肝2.79±0.16正常肌肉0.08±0.01坏死肌肉0.38±0.05体内生物学分布数据显示:造影剂(xiii)给药3h后,在正常肝的摄取值为0.51±0.02%id/g,坏死肝的摄取值为2.79±0.16%id/g,坏死肝/正常肝坏死比为5.47;在正常肌肉摄取值为0.08±0.01%id/g,坏死肌肉摄取值为0.38±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.75。表14:式(xiv)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.35±0.03肺0.25±0.06心0.08±0.00脾0.26±0.03胃0.12±0.00肾3.65±0.05膀胱0.59±0.04小肠0.53±0.20大肠0.61±0.07脑0.02±0.00正常肝0.59±0.06坏死肝3.52±0.21正常肌肉0.11±0.01坏死肌肉0.63±0.05体内生物学分布数据显示:造影剂(xiv)给药3h后,在正常肝的摄取值为0.59±0.06%id/g,坏死肝的摄取值为3.52±0.21%id/g,坏死肝/正常肝坏死比为5.97;在正常肌肉摄取值为0.11±0.01%id/g,坏死肌肉摄取值为0.63±0.05%id/g,坏死肌肉/正常肌肉坏死比为5.73。表15:式(xv)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.32±0.03肺0.11±0.05心0.09±0.00脾0.16±0.03胃0.14±0.00肾2.63±0.05膀胱0.44±0.04小肠0.31±0.04大肠0.42±0.07脑0.02±0.00正常肝0.23±0.02坏死肝1.48±0.22正常肌肉0.06±0.01坏死肌肉0.31±0.05体内生物学分布数据显示:造影剂(xv)给药3h后,在正常肝的摄取值为0.23±0.02%id/g,坏死肝的摄取值为1.48±0.22%id/g,坏死肝/正常肝坏死比为6.43;在正常肌肉摄取值为0.06±0.01%id/g,坏死肌肉摄取值为0.31±0.05%id/g,坏死肌肉/正常肌肉坏死比为5.17。表16:式(xvi)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.34±0.03肺0.28±0.04心0.12±0.00脾0.29±0.03胃0.10±0.00肾2.23±0.23膀胱0.49±0.04小肠0.76±0.13大肠0.66±0.07脑0.02±0.00正常肝0.61±0.04坏死肝3.24±0.25正常肌肉0.08±0.01坏死肌肉0.46±0.05体内生物学分布数据显示:造影剂(xvi)给药3h后,在正常肝的摄取值为0.61±0.04%id/g,坏死肝的摄取值为3.24±0.25%id/g,坏死肝/正常肝坏死比为5.31;在正常肌肉摄取值为0.08±0.01%id/g,坏死肌肉摄取值为0.46±0.05%id/g,坏死肌肉/正常肌肉坏死比为5.75。表17:式(xvii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.42±0.03肺0.19±0.02心0.09±0.00脾0.26±0.04胃0.11±0.00肾2.12±0.16膀胱0.48±0.05小肠0.82±0.20大肠0.73±0.07脑0.02±0.00正常肝0.64±0.05坏死肝3.45±0.21正常肌肉0.10±0.01坏死肌肉0.45±0.05体内生物学分布数据显示:造影剂(xvii)给药3h后,在正常肝的摄取值为0.64±0.05%id/g,坏死肝的摄取值为3.45±0.21%id/g,坏死肝/正常肝坏死比为5.39;在正常肌肉摄取值为0.10±0.01%id/g,坏死肌肉摄取值为0.45±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.5。表18:式(xviii)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.35±0.03肺0.14±0.05心0.09±0.00脾0.35±0.04胃0.12±0.00肾2.96±0.21膀胱0.52±0.04小肠0.43±0.07大肠0.65±0.06脑0.02±0.00正常肝0.59±0.06坏死肝3.46±0.21正常肌肉0.10±0.02坏死肌肉0.40±0.06体内生物学分布数据显示:造影剂(xviii)给药3h后,在正常肝的摄取值为0.59±0.06%id/g,坏死肝的摄取值为3.46±0.21%id/g,坏死肝/正常肝坏死比为5.86;在正常肌肉摄取值为0.10±0.02%id/g,坏死肌肉摄取值为0.40±0.06%id/g,坏死肌肉/正常肌肉坏死比为4.00。表19:式(xix)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.41±0.03肺0.24±0.03心0.10±0.00脾0.33±0.03胃0.12±0.00肾3.44±0.05膀胱0.65±0.07小肠0.82±0.15大肠0.63±0.05脑0.02±0.00正常肝0.42±0.07坏死肝2.52±0.18正常肌肉0.11±0.01坏死肌肉0.46±0.05体内生物学分布数据显示:造影剂(xix)给药3h后,在正常肝的摄取值为0.42±0.07%id/g,坏死肝的摄取值为2.52±0.18%id/g,坏死肝/正常肝坏死比为6.00;在正常肌肉摄取值为0.11±0.01%id/g,坏死肌肉摄取值为0.46±0.05%id/g,坏死肌肉/正常肌肉坏死比为4.18。表20:式(xx)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.42±0.03肺0.21±0.04心0.06±0.01脾0.16±0.03胃0.11±0.01肾2.88±0.05膀胱0.28±0.03小肠0.81±0.11大肠0.67±0.07脑0.02±0.00正常肝0.36±0.04坏死肝2.45±0.21正常肌肉0.09±0.01坏死肌肉0.42±0.03体内生物学分布数据显示:造影剂(xx)给药3h后,在正常肝的摄取值为0.36±0.04%id/g,坏死肝的摄取值为2.45±0.21%id/g,坏死肝/正常肝坏死比为6.81;在正常肌肉摄取值为0.09±0.01%id/g,坏死肌肉摄取值为0.42±0.03%id/g,坏死肌肉/正常肌肉坏死比为4.67。表21:式(xxi)造影剂在模型鼠体内的生物分布数据组织或器官(id%/g±sd)血0.28±0.03肺0.14±0.02心0.09±0.00脾0.35±0.04胃0.12±0.00肾2.88±0.21膀胱0.51±0.04小肠0.44±0.07大肠0.62±0.06脑0.02±0.00正常肝0.58±0.06坏死肝3.16±0.22正常肌肉0.10±0.02坏死肌肉0.42±0.06体内生物学分布数据显示:造影剂(xxi)给药3h后,在正常肝的摄取值为0.58±0.06%id/g,坏死肝的摄取值为3.16±0.22%id/g,坏死肝/正常肝坏死比为5.45;在正常肌肉摄取值为0.10±0.02%id/g,坏死肌肉摄取值为0.42±0.06%id/g,坏死肌肉/正常肌肉坏死比为4.20。综上结果表明,单蒽醌类化合物制备的造影剂具有非常好的坏死靶向性,可以在体内聚集于坏死区域(肿瘤经药物治疗后形成的坏死组织、坏死肝,坏死肌肉)。在mri图像上也可以看出。我们所举的造影剂(i)~(xxi)在坏死组织靶向性较其他化合物更好,可以长时间聚集在坏死组织,延长了成像时间窗,利于检测坏死相关疾病,从而引导临床治疗决定的实施。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1