ICAM‑1或αMβ2整合蛋白在筛选用于诊断或治疗种植转移癌的药物中的用途的制作方法
本发明属于生物医药技术领域,尤其涉及ICAM-1或αMβ2整合蛋白在筛选用于诊断或治疗种植转移癌的药物中的用途。
背景技术:
卵巢癌(Ovarian cancer,OC)是全美妇科排名第二的常见肿瘤及主要死亡原因之一。高死亡率主要是由于卵巢癌在早期(I/II)诊断困难,直至其扩散进展至晚期(III/IV)后方能确诊。我们已报道过OC患者从I期到IV的确诊率分别为7.19%、8.63%、72%和72.18%。OC患者的预后不良,各期OC患者五年平均生存率为42%。对III期和IV期患者的长期随访观察,发现其五年生存率低于10%;但对于早期(I-II)确诊的患者,特别是那些肿瘤局限于原发部分的患者,其五年生存率达92.7%。研究显示OC患者5年生存率与10年前相比上升不到2%。广泛腹腔和盆腔内种植转移是OC预后不良的主要原因,手术治疗通常不能完全将这些病灶清除干净。在这种情况下,对大多数OC患者来说肿瘤细胞减灭术成为最后的选择。到目前为止,尚没有发现有效的特定靶向药物对种植转移有所疗效,而现在用于OC的化疗药物极易诱发癌细胞耐药性,同时治疗后患者的长期预后并不理想。因此,弄清OC种植转移的机制很有必要,其对于OC种植转移靶向新药物的研发以及提高OC患者生存率都至关重要。
增大的肿物破入腹膜表面后,肿瘤细胞从原位癌上脱落下来,并随着腹水在腹腔中进行转运直至定植在腹腔中,这是目前对腹膜种植转移现象最为普遍认同的解释。许多研究认为种植转移的过程分为如下几个步骤:1)细胞脱落、存活及抵抗失巢凋亡;2)躲避免疫监视:3)上皮-间质转分化;4)球体形成;5)腹水形成6)腹膜种植。但是,自由脱落的肿瘤细胞在种植转移环境中如何生存以及种植转移初期球体形成的机制仍不清楚。目前的研究表明,种植转移情况下从原位癌上自由脱落肿瘤细胞的生存和增殖以及种植转移早期球体形成中,巨噬细胞均扮演了重要角色。因此,希望通过小鼠原位卵巢癌模型来揭示出OC种植转移的相关机制,为卵巢癌和其他腹膜转移癌的早期诊断提供相关基理。
技术实现要素:
一方面,本发明目的在于克服现有技术存在的不足之处而提供了ICAM-1或αMβ2整合蛋白在筛选用于诊断或治疗种植转移癌的药物中的用途,本发明为种植转移癌新药的设计提供了新的靶点,为植转移癌的治疗提供了新的方法和思路。
本发明采用的技术方案为:ICAM-1或αMβ2整合蛋白在筛选用于诊断或治疗种植转移癌的药物中的用途。其中,ICAM-1(Intracellular Adhesion Moleculae-1)为细胞粘附分子1。
作为对于上述技术方案的进一步改进,所述种植转移癌的种植转移与巨噬细胞相关。
作为对于上述技术方案的进一步改进,所述种植转移癌为卵巢癌、胰腺癌或大肠癌。
作为对于上述技术方案的更进一步改进,所述种植转移癌为卵巢癌。
作为对于上述技术方案的进一步改进,所述药物通过降低ICAM-1水平或降低αMβ2整合蛋白水平来治疗种植转移癌。
作为对于上述技术方案的进一步改进,所述药物通过降低ICAM-1水平或降低αMβ2整合蛋白水平而抑制EGFR阳性肿瘤细胞与TAMs的相互黏附来治疗种植转移癌。
另一方面,本发明还提供了ICAM-1抑制剂或αMβ2整合蛋白抑制剂在制备用于治疗种植转移癌的药物中的用途。
作为对于上述技术方案的进一步改进,所述ICAM-1抑制剂为ICAM-1中和抗体。
作为对于上述技术方案的更进一步改进,所述ICAM-1中和抗体为抗-ICAM-1抗体。
作为对于上述技术方案的进一步改进,所述αMβ2整合蛋白抑制剂为αMβ2整合蛋白中和抗体。
需要说明的是,本发明中出现的中和抗体也即普通抗体,之所以称为中和抗体主要从抗体的治疗角度命名。
本发明建立了小鼠原位卵巢癌模型,通过荧光标记、免疫染色和免疫印迹法观察和发现TAMs(Tumor-associated Macrophages,肿瘤相关巨噬细胞)在卵巢癌种植转移早期中起促进球体形成;M2型TAMs位于球体中央且分泌EGF(Epithelial Growth Factor,上皮细胞生长因子),EGF能上调M2型TAMs表达αMβ2整合蛋白以及上调肿瘤细胞表达ICAM-1。进一步,小鼠中去除TAMs、药物阻滞EGFR或者以抗体中和ICAM1后将阻碍球体形成及卵巢癌进展。
因此,可以利用ICAM-1和αMβ2整合蛋白,筛选出用于诊断或治疗种植转移癌的药物。
相对于现有技术,本发明的有益效果为:本发明首次在小鼠原位卵巢癌模型证实了ICAM-1和αMβ2整合蛋白在卵巢癌种植转移过程中起着重要调控作用且揭示了卵巢癌球体形成的基理,可以为筛选用于诊断或治疗种植转移癌的药物提供理论依据。
附图说明
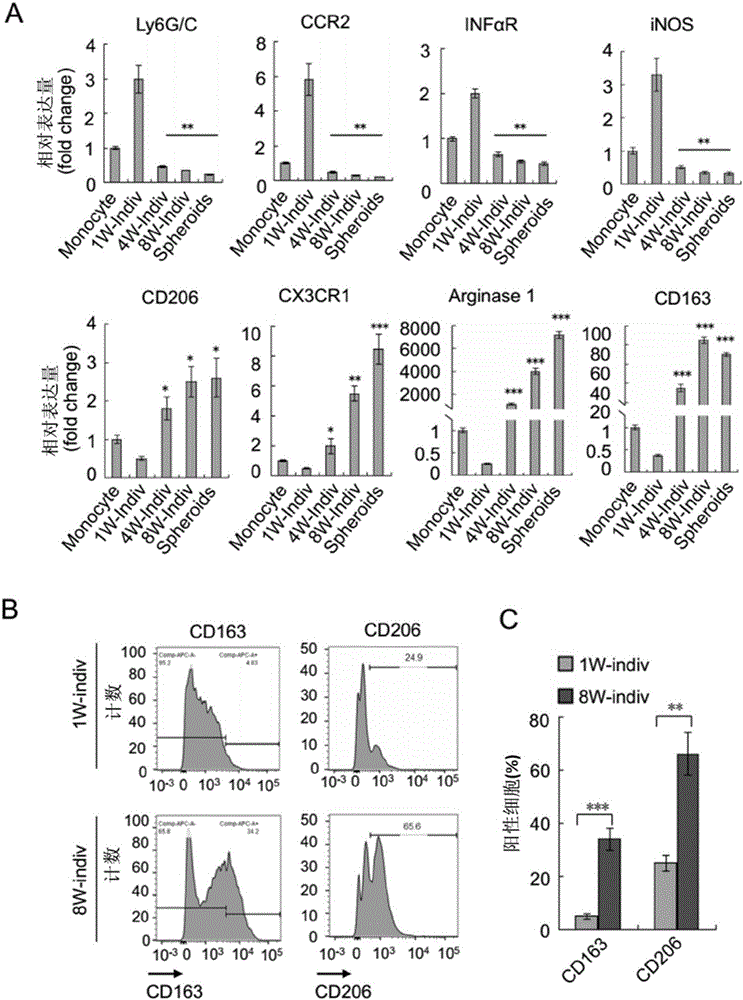
图1显示巨噬细胞(TAMs)在原位卵巢癌模型中参与球体的形成;将稳定表达mCherry荧光蛋白标记的ID8OCs植入8周大的tomatolyz-cre受体小鼠体内,在瘤细胞分别植入2,4,6及8周时检测渗入腹腔的Cherry+肿瘤细胞和GFP+细胞;其中,A为显示将腹腔细胞涂于切片上后置于荧光显微镜下观察的荧光图,每个时间点取n=5只小鼠;B为对GFP+细胞总数进行量化,插图为对从0到20天对GFP+细胞总数进行量化的统计图,每个时间点取n=5只小鼠;C为对Cherry+肿瘤细胞总数进行量化,插图为0到20天对Cherry+肿瘤细胞总数进行量化的统计图,每个时间点取n=5只小鼠;D-G显示巨噬细胞和球体形成,3至6周时的典型荧光图像如D所示,图E为对球体总数[球体/100μl腹水]的量化统计图,图F为对球体体积[细胞数/球体]的量化统计图,每个时间点取n=5只小鼠,已证实在3周时开始启动球体形成;G为用APC(647nm)-结合型抗-CD68和DAPI对8周时采集的球体进行免疫染色后以共焦成像技术所得的图像,对GFP+和CD68+巨噬细胞、Cherry+肿瘤细胞和DAPI进行细胞核染色后可见,右图所示为融合后图像,所有数据结果以均值±标准差形式表示,n=5,星号*为P<0.05,星号**为P<0.01,星号***为P<0.001。
图2显示M2型肿瘤相关巨噬细胞(TAMs)聚合与卵巢癌的进展相关;原位卵巢癌模型中F4/80+CD11b+巨噬细胞来自于指定时间(1,4和8周)点的单个细胞群或球体;A为用qRT-PCR技术对M1型特异性和M2型特异性的标志物进行检测的统计图,以外周血单核细胞作为对照,与1周内单个细胞体内的基因表达相比,所有数据结果以均值±标准差形式表示,n=5,星号*为P<0.05,星号**为P<0.01,星号***为P<0.001(双侧t分布检验);B-C为用FACS法对第1和8周个体细胞群内CD163和CD206在巨噬细胞中的表达情况的统计分析结果图,所有数据结果以均值±标准差形式表示,n=5,星号*为P<0.05,星号**为P<0.01,星号***为P<0.001。
图3显示了腹腔球体形成及卵巢癌肿瘤细胞生长所必需;将小鼠ID8细胞注入C57BL/6雌性受体小鼠腹腔内建立原位小鼠OC模型,然后小鼠分别予脂质体(ID8组)或氯膦酸二钠脂质体(ID8+LC组)治疗,一半供体小鼠接受了ID8细胞加上从患癌供体小鼠球体中分离出来的TAMs及脂质体(ID8+TAM)或者氯膦酸二钠脂质体(ID8+TAM+LC);A-D显示氯膦酸二钠脂质体和TAM对肿瘤生长的效应,A为在指定时间(0-60天)小鼠体重的增加曲线图;B-C显示在第60天时测量腹水体积和肿瘤净重的统计结果图,数据以平均值±标准差表示,n=10,星号***为P<0.001;D为监测小鼠状态对其生存率的量化统计图,每组n=24只小鼠,用对数秩和检验进行Kaplan-Meier分析,星号***为P<0.001;E-G显示氯膦酸二钠脂质体和TAM对球体形成的影响作用,图E为8周时从腹水中收集球体进行H&E染色图,图F为球体总数统计图,图G为球体大小统计图;H-J显示氯膦酸二钠脂质体和TAM对肿瘤细胞生长作用,H为采集8周时单个细胞群和球体,用抗-Ki67、抗-CD68和DAPI对其进行免疫染色后以共焦成像技术观察的染色结果图,H显示在ID8组内CD68+巨噬细胞被Ki67+肿瘤细胞包围,而在ID8+LC组未见,比例尺为25μm;图I为对单个细胞群总体和总的球体中Ki67+进量化的统计结果图;图J为对单个细胞群总体和总的球体中CD68+细胞进行量化的统计结果图,n=5只小鼠,每只小鼠提供10个球体,所有数据结果以均值±标准差形式表示,星号***为P<0.001(双侧t分布检验)。
图4显示TAMs中EGF与肿瘤细胞中EGFR表达相互上调对卵巢癌生长起到关键作用;A-C显示TAMs促进体外ID8细胞增殖,当肿瘤细胞植入8周后从OC-模型小鼠体内腹水中采集球体。将TAMs与ID8肿瘤细胞(PE-ID8)分离开,单独培养PE-ID8细胞或者与TAMs在transwell中一起培养但不与其直接接触,原始ID8细胞作为对照;A为在指定时间细胞总数的统计结果图;B为细胞生长用Ki67染色后的染色结果图,比例尺25μm;C为对Ki67+肿瘤细胞进行量化的统计结果图,n=9;D为qRT-PCR检测PE-ID8以及球体中EGF、FGF、PDGFs、HGF及VEGFs的基因表达量;E为TAMs中的EGF与PE-ID8细胞中的EGFR的表达情况统计图,用qRT-PCR对TAMs及PE-ID8组中的EGF和EGFR基因表达进行检测,外周血单核细胞和原始ID8肿瘤细胞分别作为对照组,相关基因表达呈现倍数增长,将单核细胞数作为1.0,n=3;F为用EGF或EGFR对分离自OC小鼠腹水中的球体CD68细胞进行免疫染色的染色图,n=5只小鼠,其球体的典型图像如图所示;G为ELISA检测4周和8周腹水上清的EGF蛋白表达量,血浆作为阴性对照;H为ELISA检测肿瘤细胞、巨噬细胞或肿瘤细胞加巨噬细胞共培养的培养基上清中EGF蛋白表达水平;I-J通过siRNAs使EGF沉默表达,TAMs被EGF siRNAs或参照siRNA转染48小时,I为经qRT-PCR法检测TAMs中EGF mRNA水平的统计结果图;J为用ELISA法检测TAMs与ID8细胞共培养体系上清液中的EGF蛋白水平的统计结果图;K-L显示分别在无EGFR拮抗剂及存在拮抗剂(10或20μM)的情况下用EGF处理ID8细胞12小时,以相应抗体通过蛋白质印迹法对磷酸化的和总的EGFR以及ERK1/2进行检测,总EGFR、ERK1/2和GAPDH均进行了检测,对相对磷酸化水平进行了量化,K为蛋白质印迹结果图,L为统计结果图;M-N显示TAMs用参照siRNA或EGFsiRNA进行了预转染,将PE-ID8细胞单独或与TAMs在缺乏或存在EGF(20ng/ml)或EGFR拮抗剂(20μM)的情况下进行共培养12小时,图M为用Ki67对增生的PE-ID8细胞进行染色的染色结果图,比例尺100μm;图N为对Ki67细胞进行量化的统计结果图,所有试验均进行了三组独立实验,数据以平均数±SEM来表示,星号**为P<0.01,星号***为P<0.001。
图5显示OC患者EGF+TAMs及EGFR+肿瘤细胞与球体形成间的临床相关性;A为对从OC患者中分离出来的原位肿瘤和球体进行H&E及CD68IHC染色的染色结果图,比例尺分别为50μm(H&E)和25μm(CD68);B为对OC患者原位肿瘤和球体中CD68阳性细胞的统计分析结果图,n=128,数据用平均值±标准差表示,星号***为P<0.001(双侧t分布检验);C-D显示巨噬细胞和癌细胞在球体中生长的相关性;C为分别对人的小、中和大体积OC球体中CD68和Ki67进行免疫染色的染色结果图,其中DAPI用于细胞核染色,比例尺5μm;D为对球体内CD68和Ki67阳性细胞进行量化的统计结果图,n=30,小球体(0-50个细胞/球体),中等细胞集群(50-500个细胞/球体),大球体(≥500个细胞/球体),数据以平均值±标准差表示,星号**为P<0.01,星号***为P<0.001,小体积球体与中、大体积球体相比较P<0.001(双侧t分布检验);E为对OC患者腹水中的球体进行免疫荧光染色的荧光染色图,采用EGF或EGFR与CD68联合染色,来自n=128例OC患者球体的典型图像如图所示,箭头所指位置为球体中央的CD68+EGF+TAMs,比例尺10μm;F为在不同分化程度的OC球体中其CD68+细胞的统计结果图;G为128例OC患者球体中低(<14.5%)或高(≥14.5%)CD68+细胞百分比与总体存活率Kaplan-Meier曲线间关系图(以对数秩和检验进行分析)。
图6显示在小鼠模型中阻断EGFR减少球体形成、细胞增殖及卵巢癌生长;通过向雌性受体裸鼠腹腔内注射人SKOV3OCs建立起原位小鼠模型,接着对小鼠不做处理(CON)或给予厄洛替尼治疗,LC作为治疗对照组;A-E显示厄洛替尼对SKOV3肿瘤生长的影响;A为在相应时间点监测小鼠体重的统计结果图,箭头所指为使用LC治疗的不同起始治疗时间(在肿瘤细胞植入2,4或8周时);B为在相应时间点监测小鼠体重的统计结果图,箭头所指为使用厄洛替尼治疗的不同起始治疗时间(在肿瘤细胞植入2,4或8周时);C为CON、LC及厄洛替尼治疗组小鼠的全身典型照片;D为14周时称量小鼠腹水体积的统计结果图;E为14周时称量小鼠肿瘤净重的统计结果图;其中A-E中数据以平均值±标准差表示,每组中n=10,星号***为P<0.001;ns:无显著性差异;F为厄洛替尼组合对照组的总体存活率Kaplan-Meier曲线间关系图;G-I显示厄洛替尼对SKOV3球体形成的作用,G为14周时收集腹水中的球体并置于涂片上,对球体进行H&E染色的染色结果图,比例尺100μm;H为对球体总数进行量化的统计结果图;I为对球体体积进行量化的统计结果图;J-K显示厄洛替尼对SKOV3肿瘤细胞增殖的作用,对14周时采集的球体用抗-Ki67、抗-CD68和DAPI进行免疫染色,接着以共焦成像技术进行观察;J为含有Ki67+肿瘤细胞和CD68+巨噬细胞球体的免疫荧光染色图;K为对球体内Ki67+和CD68+细胞进行量化的统计结果图,n=5只小鼠,每只小鼠中采集10个球体,数据以平均值±标准差表示,星号***为P<0.001。
图7显示TAMs通过分泌EGF促进肿瘤细胞的迁移;A-B为PE-ID8细胞在transwell小室单独培养,或与小鼠单核细胞或TAMs共培养,用划痕实验定量分析PE-ID8细胞的迁移能力;其中,肿瘤细胞迁移如图A所示,D为统计分析结果;n=3,标尺为100μm;C-D为PE-ID8细胞在transwell小室单独培养,或与小鼠单核细胞或TAMs共培养,计数穿过transwell小室的细胞数来定量分析PE-ID8细胞的迁移能力;其中,C显示穿过transwell小室的肿瘤细胞的苏木素染色结果,D为统计分析结果;n=3,标尺为50μm;E-F为TAMs与参照siRNA或EGF siRNAs预转染48小时,进而PE-ID8细胞与转染的TAMs细胞在transwell小室共培养,在PE-ID8培养液体系中加或不加EGF(20ng/ml)或EGFR抑制剂厄洛替尼(20μM);其中,E显示穿过transwell小室的肿瘤细胞的苏木素染色结果,F为统计分析结果;标尺为100μm,数据以平均值±标准误表示,n=3,星号***为P<0.001(双尾t检验)。
图8显示EGF上调OC肿瘤细胞中VEGF-C-VEGFR3信号;A-B显示用qRT-PCR检测从小鼠体内分离的TAMs和PE-ID8肿瘤细胞中VEGF-C和VEGFR3的mRNA表达量;相关基因表达呈现倍数增长,将单核细胞数的mRNA表达水平作为1.0,n=3;C显示通过ID8和PE-ID8肿瘤细胞中特异性抗体用蛋白印迹法来检测肿瘤细胞中VEGF-C、磷酸化VEGFR和总VEGFR3的的蛋白表达量,以用加和不用VEGF-C(20ng/ml)处理的淋巴内皮细胞(LECs)为阳性对照;D为定量测定VEGF-C和磷酸化VEGFR3的蛋白相对表达量;E-F为小鼠ID8细胞和人SKOV3卵巢癌细胞通过EGF(20ng/ml)处理不同时间(0-12h),用qRT-PCR检测两组VEGF-C的mRNA表达量,以未处理组的VEGF-C的mRNA表达量为1,其他时间点VEGF-C表达量以倍数变化显示;G-H为不同时间点时用EGF处理ID8细胞;其中,G为对VEGF-C、磷酸化VEGFR3和总VEGFR3蛋白水平进行检测,H为对VEGF-C和磷酸化VEGFR3相对蛋白表达水平进行量化;I显示分别在EGFR拮抗剂(20μM)或ERK拮抗剂(PD98059,20μM)加入及缺失的情况下,EGF对SKOV3细胞进行12小时的处理,用qRT-PCR检测VEGF-C mRNA表达量,将未处理组结果作为1.0,以GADPH作为内参EGFR拮抗剂或ERK拮抗剂组的VEGF-C相对mRNA表达量呈倍数变化;J显示分别在EGF、VEGF-C、EGFR拮抗剂厄洛替尼(20μM)或VEGFR3结抗剂(MAZ51,10nM)存在及缺失的情况下,对ID8细胞处理12小时,用蛋白印迹法检测对磷酸化VEGFR3和总VEGFR3蛋白表达量化看,以GAPDH作为对照;所有数据以均值±标准误表示,n=3,星号***为P<0.001(双侧t检验)。
图9显示EGF通过自分泌VEGF-C/VEGFR3信号途径促进EGFR+肿瘤细胞迁移;A为对OC小鼠腹水球体中的VEGF-C或VEGFR3与CD68进行免疫荧光染色的染色结果图,来自n=5只小鼠的球体典型图像;B-C显示PE-ID8细胞与EGF或VEGF-C(20ng/ml)分别在不加入或加入EGFR拮抗剂厄洛替尼或VEGFR3拮抗剂MAZ51(10nM)的情况下进行12小时的transwell迁移实验;B为采用苏木素染色的染色结果图,比例尺150μm;C为细胞迁移实验的统计结果图;D-F显示从荷瘤tomatolyz-cre小鼠球体中分离出的小鼠GFP+F4/80+CD206+TAMs与参照siRNA或EGF-siRNA进行48小时的预转染,接着将TAMs与ID8细胞在厄洛替尼或MAZ51(20nM)存在的情况下于3D共培养体系中进行联合培养,D为荧光结果图,比例尺50μm,可见局部GFP+细胞(TAMs)位于对照组球体中央但未见于siEGF组,E为48小时后对球体数量(每孔)进行量化的统计结果图,F为48小时后对球体大小(面积)进行量化的统计结果图;G-I显示从人卵巢癌患者球体分离出的CD14+TAMs与参照siRNA或EGF-siRNA进行了48小时的预转染,用于与人OC SKOV3细胞进行3D共培养,G为荧光结果图,比例尺为25um;H为对48小时的球体数量进行量化的统计结果图;I为对48小时的球体体积进行量化的统计结果图,所有试验均进行了三次独立实验,数据以平均值±标准差的形式记录,星号***为P<0.001。
图10显示CD11a、CD11b、CD11c及ITGβ2在TAMs的mRNA表达量;在第8周从球体中分离出原位卵巢癌模型的TAMs和PE-ID8细胞;A为用qRT-PCR检测TAMs以及PE-ID8细胞中的CD11a、CD11b、CD11c和ITGβ2整合蛋白的mRNA表达量,以原始ID8细胞作为对照;所有数据以平均值±标准误的形式表示,n=5,星号**为P<0.01,星号***为P<0.001(双侧t检验);B为用FACS技术对腹腔内CD11b+和CD11c+巨噬细胞进行分析;C为分别对CD11b+和CD11c+细胞以百分比进行统计;n=5,星号***为P<0.001,ns:无显著性差异(双侧t检验);所有实验重复三次,数据以平均值±标准误表示,星号**为P<0.01,星号****为P<0.001。
图11显示EGF/EGFR-VEGF-C/VEGFR3信号通路诱导球体ICAM-1表达;在指定时间(8周时)从球体中分离出原位卵巢癌模型的TAMs和PE-ID8细胞;A为用qRT-PCR检测ICAM-1和ICAM-2的mRNA表达量,以外周血单核细胞作为对照。所有数据以平均值±标准误表示,n=5,星号**为P<0.01(双侧t检验);B为EGF处理ID8细胞不同时间,用qRT-PCR技术分析ICAM-1的mRNA表达量并统计ICAM-1的mRNA相对表达量;三次独立重复试验,数据以平均值±标准误表示,星号**为P<0.01,星号***为P<0.001(双侧t检验);C-E为EGF(C)或VEGF-C(E)对ID8细胞进行处理不同时间,用免疫印迹方法检测ICAM-1的蛋白表达;(D,F)定量统计分析ICAM-1的蛋白表达水平;所有实验重复三次,数据以平均值±标准误,n=3,星号***为P<0.001(双侧t检验);G为分别在加入VEGFR3拮抗剂(MAZ51)及其缺失的情况下,EGF或VEGF-C对ID8细胞进行24小时的处理,用qRT-PCR检测ICAM-1的mRNA表达量;所有实验重复三次,数据以平均值±标准误表示,星号**为P<0.01,星号***为P<0.001(双侧t检验)。
图12显示TAMs通过整合蛋白αMβ2与ICAM-1相互作用促进与EGFR+肿瘤细胞相黏附;A为对CD68以OC小鼠腹水球体中提取的ICAM-1进行免疫荧光染色的染色结果图,来自n=5只;B-C显示PE-ID8细胞与EGF分别在缺乏或存在EGFR拮抗剂厄洛替尼或ERK拮抗剂PD98059(10nM)的情况下处理24小时,B为用免疫印迹法检测ICAM-1蛋白表达的免疫印迹图,C为对ICAM-1相对含量进行量化的统计结果图;D-E显示ID8细胞与EGF或VEGF-C分别在缺乏或存在MAZ51(VEGFR3拮抗剂)的情况下处理24小时,D为用免疫印迹法检测ICAM-1蛋白表达的免疫印迹图,E为对ICAM-1相对含量进行量化的统计结果图;F-K显示ICAM-1中和抗体对球体形成的影响,F-H为加入抗小鼠ICAM-1情况下对小鼠TAM–ID8进行3D共培养,F为免疫荧光结果图,比例尺50μm;G为48小时后检测球体数量的统计结果图;H为48小时后检测球体大小的统计结果图;I-K为加入抗人ICAM-1情况下对人TAM-SKOV3进行3D共培养,I为免疫荧光结果图,比例尺25μm;J为48小时后检测球体的数量的统计结果图;K为48小时后检测球体的大小的统计结果图,统计结果均进行3项独立实验,数据以平均值±SEM表示,星号**为P<0.01,星号***为P<0.001;L-Q显示通过给C57BL/6雌性受体小鼠腹腔内注入小鼠ID8OCs细胞而建立原位小鼠模型,接着将小鼠予腹腔注入IgG或抗小鼠ICAM-1抗体治疗,L为在指定时间(0-50天)测量小鼠体重增加情况的曲线图;M为在指定时间(0-50天)测量小鼠腹水体积的统计结果图;N为在指定时间(0-50天)测量小鼠肿瘤重量的统计结果图;O为对球体进行H&E染色的染色结果图;P为对球体的总数进行量化的统计结果图;Q为对球体的大小进行量化的统计结果图,数据以平均值±SEM形式表示,n=10,星号***为P<0.001。
图13显示球体形成中TAM-肿瘤细胞相互作用模型,A为EGF、VEGF-C、ICAM-1、αMβ2相互作用调节的示意图,显示在OC种植转移和肿瘤生长的早期,脱落的OC细胞诱导巨噬细胞浸润到腹腔中,在腹腔环境下巨噬细胞与OC细胞相互作用形成球体同时诱导巨噬细胞为M2亚型肿瘤相关巨噬细胞(TAMs),TAMs位于球体中央或许为OC逃避失巢凋亡提供了最初的基质支持,重要的是,TAMs能分泌大量EGF从而激活EGFR,这会上调肿瘤细胞的表达,激活的EGF/EGFR信号通路能诱导VEGF-C表达,其反过来激活VEGFR3信号转导通路和诱导肿瘤细胞内整合蛋白/ICAM-1表达从而形成一个正向自分泌反馈环路,因而促进了肿瘤迁移、粘附和球体形成;B为TAMs和OC细胞分子间相互作用的示意图。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例及附图对本发明作进一步说明。
实施例
1.材料与方法
1.1研究批准
所有动物实验均由耶鲁大学动物管理委员会机构批准后进行。从知情同意患者提供的腹水中采集晚期(即III-IV期)卵巢癌患者的人肿瘤球体,以上完成于耶鲁大学医学院,纽黑文,康涅狄格州(HIC协议#1111003959)。临床石蜡标本由中国哈尔滨医科大学附属肿瘤医院伦理审查委员会批准后使用。
1.2动物模型
所有动物实验均由耶鲁大学动物管理委员会批准后施行。所有的小鼠均为C57BL/6系列。溶菌酶Cre小鼠与tomato(mT/mG)小鼠进行杂交以便用谱系标记溶菌酶提取细胞。裸鼠购于Jackson实验室。将细胞培养基上100μl小鼠卵巢癌ID8或人卵巢癌SKOV3细胞(1×106/ml)注入到C57BL/6系小鼠或裸鼠的腹腔内。小鼠体重增加、腹水体积和肿瘤重量变化情况均由电子天平称量。9周后将小鼠处死,肿瘤球体和肿瘤移植物进行组织学分析。
1.3临床样本
经资格审查委员会批准,2005年1月至2009年12月在哈尔滨医科大学附属肿瘤医院就诊的共128例晚期上皮性卵巢癌(EOC)患者其中符合我们纳入标准的入组我们的研究对象。纳入合格标准包括如下几方面:(1)病理检查证实为III期EOC;(2)有完整的基本临床资料;(3)癌症尚未经过任何治疗;(4)未出现严重并发症或其他恶性疾病;(5)告知病人及其家属病情且在治疗前签署知情同意书。所有患者均进行了完整的肿瘤细胞减灭术治疗。晚期(即III-IV期)卵巢癌患者的肿瘤球体通过自愿的形式从患者腹水中采集得到(HIC协议#1111003959)。
1.4细胞培养
ID8(小鼠卵巢癌上皮细胞株)来自Drs.Jack Lawler和哈佛医学院贝斯以色列女执事医疗中心的Carmelo Nucera的赠送,SKOV3(人卵巢腺癌细胞株)从ATCC取得。SK-OV-3对肿瘤坏死因子及几种细胞毒药物包括白喉毒素,顺铂和阿霉素等具有抵抗力。ID8和SKOV3细胞在达尔伯克氏改良伊格尔氏培养基(DMEM)(美国加利福利亚,生命科技公司)中培养,其中再加入10%小牛血清(FBS)、100U/ml青霉素以及100μg/ml的链霉素,保持温度37℃并置于5%CO2与95%空气混合的湿润环境中。每隔2天更换一次培养基,当80-90%的细胞发生融合时将其分离。所有试验中,细胞以合理密度种植且在实验开始进行前达到80-90%的细胞融合。C57BL/6系小鼠在不同时间点上予腹腔注入ID8细胞,此后从其腹腔中分离得到原代小鼠的肿瘤相关巨噬细胞(TAMs)和PE-ID8细胞。
1.5统计方法
Western-blot、qRT-PCR、细胞增殖实验、免疫染色、FACS以及肿瘤生长均采用T检验分析。OC患者人口因素差异由卡方检验或Fisher’s精确检验进行统计分析。Kaplan-Meier法用于评估OS,同时,用单因素分析法的对数秩和检验校正预后因素间可能存在的差异。多变量Cox回归(比例分析模型)用于确定预后和独立因子CD68水平对OS。此项研究使用SAS软件进行统计学分析(9.1.4版本,SAS软件研究所,北卡罗莱纳州,新喀里多尼亚)。所有统计检验均采用双侧检验同时以P值小于0.05认为有统计学意义。
1.6重组蛋白及拮抗剂
重组人和小鼠EGF、VEGF-C采购自R&D Systems。MAZ51(VEGFR3拮抗剂)购买于EMD Millipore公司。厄诺替尼(EGFR拮抗剂)从Roche公司购买。用于清除巨噬细胞的中性氯氟松氯膦酸二钠脂质体购自FormuMax Scientific公司(产品代码#:F70101-N)。
1.7免疫染色
用于免疫组化和免疫荧光染色的抗体列于表一中。共聚焦显微镜图像由Zeiss-LSM700显微镜拍摄并由ZEN2010软件进行处理。对于平均荧光强度的测量、共聚焦显微镜图像分析由ImageJ软件负责。细胞切片用蔡司Axiovert200荧光显微镜观察(卡尔蔡司缩微成像;索恩伍德,纽约),图像由Openlab3软件捕捉(Improvision,列克星敦,马萨诸塞州)。在冰冻、OCT包埋的组织上进行5μm连续切片后将其置于-20℃条件下用丙酮固定10分钟、干燥15分钟。
1.8蛋白提取及蛋白质印迹分析
将新鲜切割未固定的组织在裂解缓冲液中均质化,裂解产物在4℃、13,000g条件下,离心10分钟,收集的上清液用Bradford蛋白浓度测定试剂盒(Bio-Rad公司,赫拉克勒斯,加利福利亚州)进行滴定。将细胞裂解物用SDS-PAGE分析,然后与特异性抗体一起以免疫印迹法处理(Immobilon P;Millipore公司,米尔福德,马萨诸塞州),最后以增强化学发光试剂盒(Amersham生命科学公司,阿灵顿高地,伊利诺伊州)进行检测。所有用于蛋白免疫印迹法的抗体均在表一中列出。
表一为抗体信息表
1.9荧光激活细胞分离技术(FACS)
通过FACS分析小鼠细胞表面CD11b、F4/80、CD3e、CD206和CD163以及人细胞表面CD14和CD326的表达,此前已有文献报道。将小鼠的TAMs混悬剂与小鼠CD11b-FITC,F4/80-PE,CD3e-APC,PE-CD206,APC-CD163和人CD14,CD326抗体在冰上短暂地混合15分钟。同种抗体作为阴性对照。流式细胞用FACSCalibur(BD生命科学)完成。数据用BD CellQuestPro软件进行分析。所有用于FACS的抗体息列于表一中。
1.10迁移实验
使用transwell离体细胞培养系统(Corning公司,孔径尺寸,0.3或8μm)对巨噬细胞和肿瘤细胞的迁移能力进行检测,为了完成ID8细胞的驱化迁移实验,将1x104ID8细胞接种于transwell小室表面上。不同的化学趋化物(VEGFC或EGF)或巨噬细胞(TAM)置于小室下方位置。在12小时孵化期后,用棉签拭去transwell膜上层的ID8细胞,在transwell膜底面的细胞用4%PFA进行固定后用苏木素-伊红染色,然后在显微镜(200X)下随机选取5个视野进行迁移细胞的计数。
1.11定量聚合酶链反应(qRT-PCR)
所有从人体中提取的RNA使用RNeasy Plus Mini Kit(74134,Qiagen公司),然后在生产商说明书指导下用High Capacity cDNA反转录试剂盒(4368814,Applied Biosystems公司)将其转变为cDNAs。定量PCR使用RT2SYBR Green(330500,SA Biosciences)试剂盒及CFX-96(Bio-Rad)仪器完成。qRT-PCR中用到的所有引物均在表二中列出。所有的值均以GAPDH的丰度进行标准化。数据以三组平均值±标准差的形式表示。
1.12TAM和ID8细胞3D共培养系统
小鼠F4/80+CD206+TAMs通过FACS从患癌供体tomatolyzM-cre小鼠的球体中分拣而来,采集到晚期(即III-IV期)卵巢癌患者的人肿瘤球体后(IH协议#1111003959),接着用FACS鉴定和分拣出CD14+TAMs。如上所述在24孔板上铺基质胶,TAMs和ID8cells(比例为1:10,细胞总数固定为40,000细胞/孔)的混合物直接接种在铺满基质胶的24孔板上。细胞在37℃下培养48小时保证聚合物/球体的形成。在共培养6小时后加入EGFR拮抗剂厄洛替尼、VEGFR3拮抗剂MAZ51(每次20nM)或抗-ICAM-1抗体(20ug/ml)。从6-48小时拍摄荧光显微图像进行形态学分析。没有细胞的小孔含有培养基作为实验的阴性对照。所有实验至少做3次且每次要做三份。使用蔡司Axiovert 200荧光显微镜(卡尔蔡司微缩成像;索恩伍德,纽约)观察所有显微镜图像,图像由Openlab3软件捕捉(Improvision,列克星敦,马萨诸塞州)。
表二为引物信息表
2.结论
2.1巨噬细胞在卵巢癌生长过程中参与球体形成
为了确定巨噬细胞是否在种植转移过程中参与OC肿瘤细胞的存活、增殖以及定植等环节,本申请人将小鼠ID8细胞注入C57BL/6雌性受体小鼠腹腔内从而建立原位小鼠OC模型;为了追踪观察这段时期内癌细胞及受体小鼠的单核/巨噬细胞情况,将ID8OC细胞以稳定表达的mCherry荧光蛋白进行标记,与此同时,将作为受体小鼠的tomatolyzM-cre小鼠体内包括巨噬细胞在内的髓细胞以绿色荧光蛋白进行标记(GFP)。
结果如图1的A-B所示,处于基础状态下(在肿瘤细胞注入前)或在肿瘤细胞注入早期时间段内(<1周)的受体tomatolyzM-cre小鼠腹腔内几乎不能检测出GFP+细胞,但是,在注入瘤细胞后的第2、4、6及8周时渗入腹腔内的GFP+细胞有了大幅增加,在2、4、6及8周时GFP+细胞总数分别为3×106、16×106、18×106及20×106。
如图1中C-D所示,我们亦在晚期(6周)腹水中检测到CD11b+Gr1+髓源性抑制细胞(MDSCs)的数量有所增加,这组原位卵巢癌模型中,注入的癌细胞首先进入休眠期(0-2周)随后进入快速增长期(在癌细胞注入2-8周时)(如图1C),酷似人卵巢癌的II-III期。有趣的是,我们观察到在注入瘤细胞的最初2小时至2周时间内腹膜内肿瘤细胞数量有所减少,可能为失巢凋亡所致。
如图1中D-F所示,显微镜下观察发现球体包含GFP+巨噬细胞与mCherry肿瘤细胞,二者比例为1:10;球体数量与体积随肿瘤生长而增加。有趣的是,如图1G所示,球体切面免疫染色显示大球体内的mCherry肿瘤细胞围绕在位于球体中心位置的GFP+CD68+巨噬细胞周围,在CD11b+Gr1+MDSCs中得到同样的结果。
以上结果均提示髓系细胞和ID8细胞的相互作用促进卵巢癌种植转移过程中球体的形成。
2.2M2型肿瘤相关巨噬细胞(TAMs)聚合与卵巢癌的进展相关
在将瘤细胞注入小鼠体内2小时后我们在其腹腔内发现了巨噬细胞,但巨噬细胞似乎在瘤细胞进入机体3周形成巨噬细胞-肿瘤球体后才能促进肿瘤细胞的生长,此前有报道在体内外环境下卵巢癌细胞都将巨噬细胞极化为M2型,我们推测巨噬细胞在球体形成期与初始期相比有不同的基因表达谱和表现型。为了证明这点,我们采集卵巢癌不同生长阶段(肿瘤细胞注入1,4和8周时)的F4/80+CD11b+巨噬细胞,通过qRT-PCR检测一组M1型-特异标志物和M2型-特异标志物,将外周血单核细胞作为对照组。
结果显示最初由肿瘤细胞诱导产生的浸润性巨噬细胞(1周时)大量表达M1样标记基因(Ly6G/C,CR2,FNαR,NOS),但这些标志物在4周后逐渐消失。但是,浸润性巨噬细胞在肿瘤进展过程中(4-8周时)逐渐获得表达M2型标记基因[CD206(甘露糖受体),3CR1,精氨酸酶1和CD163(清道夫受体,富含半胱氨酸1型蛋白质M130)]的能力。显然,如图2A所示,无论是单个还是球体相关性巨噬细胞在末期(8周时)均有相似的基因表达谱;如图2A、2B和2C所示,FACS分析确定了早期CCR2+和晚期CD163+,D206+及CX3CR1+肿瘤诱导的巨噬细胞不同的表达方式。
以上结果表明在卵巢癌进展过程中TAMs在腹腔微环境下极化为M2亚型。
2.3TAMs为腹腔球体形成及卵巢癌肿瘤细胞生长所必需
为了探讨TAMs在卵巢癌种植转移过程中所起作用,我们用氯膦酸二钠脂质体对荷瘤小鼠进行处理。如图3A-C所示,表型分析显示氯膦酸二钠脂质体明显减少小鼠体重、腹水体积以及从腹水中分离出来的肿瘤细胞湿重,因此,经过氯膦酸盐治疗的小鼠生存率大大提高(图3D),尤其是氯膦酸盐组的球体数量及平均大小与脂质体组相比都明显减少(图3,E-G),进一步研究表明球体中Ki67+是围绕在CD68+TAMs周围的肿瘤细胞,经过氯膦酸盐治疗后CD68+TAMs和Ki67+细胞数量均有减少(图3,H-J)。
进而我们对TAMs能否促进球体形成及卵巢癌进展进行了直接检测。为达到目的,将从供体患癌小鼠球体中分离出的F4/80+CD206+M2TAMs(1×106)与ID8细胞(1×106)一起注入新的受体小鼠腹腔中,受体小鼠以脂质体或氯磷酸二钠脂质体治疗,注入TAMs或ID8细胞作为对照组。单独注入TAMs不引起肿瘤,说明分离的为纯粹未受ID8污染的TAMs细胞。TAMs+ID8组与ID8组相比,前者明显增大肿瘤体积、增加腹水以及肿瘤湿重。但是,氯膦酸二钠脂质体治疗组与TAM+ID8相比而言,前者体重、腹水以及肿瘤质量的增加不及后者,甚至低于ID8组(图3,A-C)。以上数据说明磷酸二钠脂质体能削弱内外源性TAMs对卵巢癌生长的影响。TAMs同时也缩短了荷瘤小鼠的存活时间,但氯膦酸二钠脂质体却能将时间延长(图3D)。此外,TAMs明显增加球体的数量和体积、球体内CD68+巨噬细胞和Ki67+肿瘤细胞但氯膦酸钠盐能削弱上述作用(图3,E-G)。TAMs同样增加粘附或围绕在球体内CD68+巨噬细胞周围的Ki67+肿瘤细胞数量。但是,氯膦酸钠盐治疗能减少Ki67+细胞以及CD68+巨噬细胞的数量(图3,H-J)。
以上结果说明,巨噬细胞为卵巢癌腹腔内球体形成和细胞增殖所必需。
2.4TAMs中EGF与肿瘤细胞中EGFR表达相互上调对卵巢癌生长起到关键作用
为了研究TAMs促进OC增殖的分子机制,我们通过transwell实验测定F4/80+CD206+M2TAMs对分离自腹腔中球体ID8细胞(PE-ID8)的作用效应,实验过程中巨噬细胞和肿瘤细胞没有直接接触。体外已培育好的ID8OC细胞(原始ID8)作为对照组。如图4A所示,虽然F4/80+CD206+TAMs对原始ID8细胞仅有微弱作用,计算细胞总数后发现F4/80+CD206+TAMs明显增加PE-ID8细胞生长。使用Ki67免疫染色发现F4/80+CD206+TAMs促进肿瘤细胞增殖(图4,B-C)。
我们推断球体内TAMs提供生长因子EGF促进球体形成和肿瘤细胞增殖。因而我们采用定量RT-PCR法对从腹腔中提取的TAMs和ID8(PE-ID8)癌细胞内的多种生长因子表达方式进行筛选。发现仅仅EGF能在TAMs中被检测到,而其他生长因子如FGFs,HGF,IGF,TNF-α,TGF-β或VEGFs却不能(图4D)。通过定量RT-PCR检测发现EGF在球体源性的F4/80+CD206+TAMs而非球体源性的PE-ID8中大量表达。相反,EGFR在球体源性PE-ID8细胞中高表达,而非TAMs内(图4E)。对球体免疫染色发现在TAMs中能特异性检测到被EGFR+肿瘤细胞包围的EGF(图4F)。的确,ELISA法检测发现腹水中分泌型EGF与血浆中EGF相比保持在较高浓度(图4G)。与qRT-PCR得出的结果一致,在培养球体源性PE-ID8的上清液中未检测到EGF。EGF在F4/80+CD206+TAMs的上清液中检测到,并且通过与ID8肿瘤细胞共培养后数量明显增加(图4H)。
接下来我们对F4/80+CD206+TAMs是否通过EGF–EGFR信号促进PE-ID8肿瘤细胞增殖进行测定。为此,用siRNAs降解EGF在TAMs中的表达,相反PE-ID8中的EGFR信号转导通路用EGFR拮抗剂厄洛替尼阻断。通过两套siRNAs使TAMs中的EGF基因表达沉默并用qRT-PCR和ELASA法检验核实(图4,I-J)。通过EGFR和ERK1/2的磷酸化作用验证厄洛替尼对ID8细胞内EGF–EGFR信号通路的作用(图4,K-L)。重要的是,无论是使TAMs中的EGF沉默表达还是用厄洛替尼对ID8进行治疗都能完全钝化TAMs刺激的PE-ID8肿瘤细胞增殖(图4,M-N)。
2.5OC患者EGF+TAMs及EGFR+肿瘤细胞与球体形成间的临床相关性
为了探讨我们所观察到的球体形成与EGF+TAMs和OC患者体内存在的EGFR+肿瘤细胞有关,我们对128例从OC患者腹水中提取的球体进行了检测。对CD68进行IHC染色显示巨噬细胞几乎出现在我们采集的所有球体中。此外,球体中巨噬细胞的数量明显多于原位癌中巨噬细胞的数量(图5,A-B)。与小鼠模型相似,大部分CD68+巨噬细胞采集自球体中心(图5C),说明巨噬细胞在OC种植转移中球体初始形成过程中起重要作用。对从腹水不同大小(小,中和大)球体中分离得到的CD68和Ki67进行染色,它们为巨噬细胞和增殖细胞的标记物,发现TAMs和增生肿瘤细胞间呈明显正相关性(图5,C-D)。
为了解卵巢癌中TAM相关球体和临床病理间可能存在的联系,我们对128例高、中、低组织分化的OC患者球体中TAMs所占百分比进行了分析。OC患者球体中CD68+细胞数量与淋巴血管侵犯(LVI;p=0.013)、腹水体积(p=0.009)以及血清癌胚抗原125(CA-125:一种女性卵巢癌早期标志物与疾病发生风险有较高相关性)(p=0.0043)呈正相关性。对高、中、低分化OC患者球体中的CD68阳性细胞进行量化可看出:从高到低分化球体中其CD68阳性细胞百分比明显增加,说明与高分化OC相比低分化OC在球体形成中能吸引更多的巨噬细胞(图5,E-F)。生存分析显示球体中CD68阳性细胞占较高百分比(>14.5%)的患者其5年总体生存率(OS)明显低于CD68阳性细胞占较低百分比(<14.5%)的患者(图5G)。
2.6在小鼠模型中阻断EGFR减少球体形成及卵巢癌生长
考虑到球体形成与EGF+TAMs和EGFR+肿瘤细胞的相互作用有关,这在小鼠模型和人OC患者中皆如此,我们对EGFR阻滞剂能否阻断球体形成和肿瘤生长进行检测。厄洛替尼(EGFR阻滞剂)抑制大多数卵巢癌细胞系生长,与其相反,吉非替尼和西妥昔单抗则抑制部分卵巢癌细胞系。我们选择厄洛替尼来说明EGFR在卵巢癌种植转移过程中所起的作用。为此,我们首先在上述ID8模型和异种移植小鼠模型中验证了厄洛替尼对OC进展的作用情况,异种移植即SKOV3人OCs经腹腔注入雌性受体小鼠模型中所得,厄洛替尼与肿瘤细胞一起注入受体小鼠腹腔内。类似同系小鼠模型,用氯膦酸二钠脂质体(LC)清除TAMs后人OC的生长速度明显减慢。此外,与晚期(4-8周)注射LC相比而言早期予LC治疗(肿瘤细胞植入2周后)时其对肿瘤生长的抑制作用更为显著(图6A)。与LC类似,早期注射EGFR阻滞剂厄洛替尼对彻底钝化卵巢癌生长有更好效果(图6B)。两组小鼠模型中厄洛替尼治疗组与未治疗组相比,前者腹水体积和肿瘤重量明显减少同时伴随着生存率的提高(图6,C-F)。
我们进一步分析厄洛替尼治疗组的球体形成、癌细胞增殖以及卵巢癌进展情况。接受厄洛替尼治疗的小鼠组其球体数量和体积均明显减少(图6,G-I)。厄洛替尼能大幅减少游离或在球体中TAMs与Ki67+增殖型癌细胞的总数(图6,J-K)。这些结果说明TAM分泌的EGF在卵巢癌早期种植转移球体的形成、癌细胞增殖以及肿瘤生长等方面起到重要作用。
2.7EGF通过VEGF-C/VEGFR3信号途径促进EGFR+肿瘤细胞迁移和肿瘤-TAM球体形成
接下来我们对TAMs产生的EGF如何介导球体形成进行实验,EGF对最初OC的生长是必不可少的。数据显示TAMs位于细胞群中央,OC模型中EGFR抑制剂厄洛替尼能明显减少球体的数量和体积。基于上述发现,我们作出TAMs分泌型EGF介导肿瘤细胞向TAMs迁移和黏附的假设,这是球体形成的先决条件之一。为了搞清楚TAMs促进OC迁移的分子机制,我们分别用划痕法和transwell法检测F4/80+CD206+TAMs对腹腔中球体分离的ID8细胞(PE-ID8)作用。F4/80+CD206+TAMs,而非单核细胞,在两组实验中均明显促进PE-ID8细胞迁移(图7,A-D)。但是,当TAMs中EGF基因沉默表达或ID8接受厄洛替尼治疗后,TAMs刺激下的肿瘤迁移效应将变迟钝(图7,E-F)。这些结果表明TAMs中EGF与肿瘤细胞中EGFR表达相互上调在TAMs促使的卵巢肿瘤细胞迁移中起关键作用。
有报道称VEGF-C/VEGFR3信号转导通路在肺癌模型中促进肿瘤细胞迁移。我们发现在ID8细胞中VEGFR3处于较高水平。有趣的是,我们在腹腔源性的ID8(PE-ID8)中检测到VEGF-C,而在原始ID8细胞或TAMs中却没有此发现(图8,A-B)。进一步免疫染色结果显示VEGF-C和VEGFR3在PE-ID8肿瘤细胞中高表达而在球体TAMs中却没有(图9A)。免疫印迹分析法显示PE-ID8与未活化的ID8细胞相比,前者细胞内VEGF-C和磷酸化VEGFR3水平增加(图8,C-D)。我们推测EGF诱导VEGF-C表达,其反过来又激活瘤细胞中的VEGFR3。的确,经过EGF治疗8周或更长时间后,经qRT-PCR(图8,E-F)和蛋白印迹法(图8,G-H)检测后发现小鼠ID8和人SKOV3OC细胞中的VEGF-C水平明显增加;这种诱导能被EGFR阻滞剂或ERK/2阻滞剂所阻断(图8,I)。一如既往的,经过EGF或VEGF-C治疗能使VEGFR3磷酸化,这种活化作用被EGFR拮抗剂厄洛替尼或VEGFR3拮抗剂MAZ51所阻断。但是,由VEGF-C诱发的VEGFR3激活却不能被EGFR阻滞剂阻断(图8,J),说明EGF/EGFR信号转导通路于VEGF-C/VEGFR3信号通路上游发挥作用。在功能上,EGF和VEGF-C均能促进ID8细胞转移,这与信号转导结果一致,VEGFR3拮抗剂阻断EGF和VEGF-C-诱导的ID8细胞迁移(图9,B-C)。这些结果说明EGF–EGFR–VEGF-C–VEGFR3信号旁路在调剂OC细胞迁移中起到关键作用。
最后,我们确定了TAMs怎样促进球体形成。为此,我们通过标准3D共培养系统建立起一个体外球体试验,人CD14+TAMs和从患癌供体tomatolyzM-cre小鼠球体中分离出的GFP+F4/80+CD206+TAMs与ID8细胞在含有2%基质胶的培养基中混合(TAM:ID8比例为1:10)接着接种到铺有基质胶的24孔培养板上。在这个模型中,48小时共培养后我们检测到球体形成。为确定肿瘤细胞迁移是否需要球体形成,我们在3D共培养体系中对TAMs内EGF siRNA以及球体EGFR或VEGFR3特异型拮抗剂效应进行了检验。在小鼠细胞3D共培养系统中,EGF基因在TAMs中沉默表达以及阻断EGFR或VEGF-C/VEGFR3信号通路都能大幅度减少球体体积和数量(图9D-F)。更重要的是,人OC患者中分离出的TAMs与SKOV3细胞在3D共培养体系下进行实验(图9,G-I),得出了类似结果。我们在人和小鼠细胞进行EGF siRNA,检测到散在分布有活性的TAMs和小型肿瘤细胞群(图9,D和G),说明TAMs与肿瘤细胞间的联系通过抑制EGF/EGFR和VEGF-C/VEGFR3信号通路而被阻断。
2.8EGF通过ICAM-1-αMβ1整合蛋白的相互作用促进EGFR+肿瘤细胞与TAMs相互黏附
我们推测肿瘤细胞与TAM相互黏附是球状体形成的必须前提。有报道指出球状体中的TAMs提供整合蛋白促进其与肿瘤细胞间的黏附。因此我们通过荧光定量PCR技术对从腹腔中分离出的ID8卵巢癌细胞(PE-ID8)和TAMs中的多种整合蛋白表达方式进行了筛选。不出所料,我们发现整合蛋白αM(也称为CD11b)及β2在球状体相关的F4/80+CD206+TAMs中高表达,而非在肿瘤细胞内(图10A)。FACS分析显示CD11b以及CD11c同样在TAM高表达(图10B-C)。众所周知巨噬细胞在靠近炎性组织的过程中通过Mac-1(由整合蛋白αMβ2形成)结合到血管内皮细胞上的细胞黏附分子-1(ICAM-1)或ICAM-2上。我们检测ICAM-1及ICAM-2在球状体内的表达后发现了ICAM-1,但不是ICAM-2,通过qRT-PCR检测后发现ICAM-1在球状体内高表达(图11A)。接下来我们通过免疫染色技术确定究竟是哪种类型的细胞在球状体内表达ICAM-1。令我们惊讶的是,ICAM-1并非在TAMs里而是在ID8肿瘤细胞中高表达(图12A)。ICAM-1在原始ID8细胞中的基线表达水平是非常低的,但在EGF作用下无论是mRNA还是蛋白质水平均大幅度上调(图11B-D)。EGFR-或ERK1/2阻滞剂能阻止EGF诱导的ICAM-1表达(图12,B-C)。有趣的是,EGF诱导的ICAM-1表达也能通过VEGFR3阻滞剂而被阻断。VEGF-C诱导的ICAM-1在ID8细胞中的表达是相一致的(图12,D-E)。
此后我们对TAMs上的整合蛋白αMβ2和肿瘤细胞上的ICAM-1间相互作用是否对初始球体形成起关键作用进行了检测。为此,我们测定了ICAM-1中和抗体在3D球体形成实验中的作用,ICAM-1中和抗体显著减少小鼠(图12,F-H)和人细胞(图12,I-K)在3D共培养体系中球体的数量和体积,但作为参照的IgGs却没有此现象。值得注意的是,抗-ICAM-1抗体对球体的作用影响比起使EGF基因沉默表达或阻断EGFR/VEGFR3传导通路更为深刻,说明TAM–肿瘤细胞联合是球体形成中早期的一步。为了探求ICAM-1中和抗体在卵巢癌治疗中的效果,在已建立的原位小鼠模型中,ID8荷瘤小鼠予抗-ICAM-1抗体或作为对照的IgGs进行治疗。表型分析显示抗-ICAM-1抗体组明显减少小鼠体重、腹水体积和从腹水中分离得到的肿瘤细胞湿重(图12,L-N)。与EGFR阻滞剂效果类似,抗-ICAM-1抗体明显减少球体的数量和体积(图12,O-Q)。这些结果说明整合蛋白-ICAM-1介导的TAM-肿瘤联合在球体形成和卵巢癌种植转移过程中起着重要作用。
3.结论分析
种植(腹腔)转移几乎发生在所有OC患者身上(超过90%),尤其常见于晚期癌症患者并由此导致死亡。种植转移亦发生于其他许多癌症如胰腺癌(50%)及大肠癌(32%)。因此,研究种植转移的共同机制对提高OC以及其他种植转移癌患者的预后至关重要。考虑到腹膜有其独特的特点譬如空间较大、无血管或淋巴管道。脱落OC细胞怎样得到必需的基质供养而避免失巢凋亡现象的发生、其避免免疫细胞攻击的适度保护机制以及哪些特异性生长因子能维持他们迅速生长及着床目前仍未研究清楚。曾有报道OC细胞能激活细胞存活通路如活化RAB25从而获得贴壁依赖性生存能力同时上调表面免疫抑制分子(如B7-H4及补体C1抑制物)来躲避免疫系统的攻击(如T细胞或补体)。球状体形成是OC腹膜种植转移得以启动的另一基本步骤。但是,关于球状体形成的详细机制尚不明确。通过对128例III期OC患者腹水中分离的组成球状体的细胞成分进行分析,我们发现巨噬细胞存在于所有球状体中。我们还观察到从腹水中分离的球状体中所含巨噬细胞数目显著多于原发肿瘤中的巨噬细胞数量。另外,我们发现巨噬细胞数量与其在球状体内的增生呈正相关,但与OC患者的预后呈负相关。我们的结果显示球状体相关TAMs也许在人类OC进展中起到重要作用。
TAMs在实体瘤中能通过分泌促血管新生因子和化学诱导物来促进肿瘤血管形成以及癌症转移,TAMs亦能分泌细胞因子促进肿瘤转移前微环境的形成。巨噬细胞在OC中所起作用在此前建立的小鼠模型中已进行过研究。Toni等报道腹腔内炎症扩散时卵巢癌腹膜转移的危险性将增加;消耗掉腹膜巨噬细胞,但不包括中性粒及自然杀伤细胞,能减少腹膜种植转移发生的机率。这些结果与我们从人体样本上观察到的结果均提示我们做出一种假设:巨噬细胞在腹膜转移发生前球状体形成过程中起到至关重要的作用。人及小鼠的OC样本中TAMs均位于球状体中央(图13A:TAM-癌细胞在球状体内相互作用模型一例),这一有趣发现大力支持了我们的假设。我们进一步提供有力证据表明TAMs在球状体形成起始步骤中必不可少。在使用GFP转基因受体小鼠建立的OC原位癌模型中,我们观察到渗入腹腔的巨噬细胞约有80%出现在球体中。当TAMs使用氯膦酸盐疗法后球体细胞的大小和数目显著减少,反过来,腹腔定植被抑制存活时间延长。相反,当孤立的TAMs注入小鼠腹腔内后球体的体积与数量有明显增加。有趣的是,渗入腹腔中的巨噬细胞逐渐获得M2样表现型。
在OC小鼠模型中,我们观察到在种植转移发生后3周内肿瘤细胞数目的增长与肿瘤球状体形成有关。的确,在小鼠及人OC样本中观察到TAM相关球状体能促进肿瘤细胞的增生。另外,体外transwell试验中发现TAMs能直接促进肿瘤细胞增殖,表明TAMs 通过释放某些调节因子来调控肿瘤的生长。通过筛选TAMs和球体相关肿瘤细胞内的一组生长因子及它们的同源受体,我们已确认EGF/EGFR调控通路对TAM刺激下的OC增生和肿瘤进展有至关重要的作用。前期研究已报道EGFR在腹腔内游离肿瘤细胞内的表达和定肿瘤细胞内相比明显增加,说明EGFR通路在腹腔游离肿瘤细胞内起到重要作用。众所知周,卵巢癌患者腹腔内腹水中有大量巨噬细胞和T淋巴细胞。此外,有报道称来自巨噬细胞的EGF能促进乳腺癌细胞的侵袭性。我们的研究清楚的说明TAM是EGF的主要来源,其诱导EGFR阳性的OC增殖,这已在体外及小鼠模型中通过EGF基因沉默和EGFR阻滞剂得以证实。腹腔微环境下EGF在TAM中是如何被调控的尚待进一步研究。TAM-OC细胞在球体内的相互作用很有可能增加了EGF的表达。同样地,从腹水中分离出来的球体相关OC细胞内的EGFR水平显著上调。
有趣的是,在球体中EGFR-阳性OC细胞环绕在EGF-阳性TAMs周围。这种紧密接触说明球体中心的TAMs不仅为OC细胞避免失巢凋亡提供了最初的基质支持,还通过EGF-EGFR旁分泌环路促进了OC细胞的增殖。此外,我们证实EGF/EGFR信号不仅对OC增殖起重要作用,还诱导VEGF-C在OC细胞内的表达,其反过来激活VEGFR3自分泌旁路进而提高整合蛋白/ICAM-1的表达、OC细胞的迁移和球体形成(图13B)。这个结论通过以下研究得出:1)在transwell中与TAMs细胞进行共培养时发现通过降低EGF值或使用EGFR阻滞剂厄洛替尼能显著抑制OC细胞的增殖。此外,在两只OC小鼠模型中观察到EGFR阻滞剂能彻底钝化球状体形成、OC细胞增殖及肿瘤生长;2)TAM产生的EGF诱导OC细胞内VEGF-C的表达,其反过来激活VEGFR3旁路;通过阻滞EGFR-ERK信号转导能消除OC细胞内由EGF诱导产生VEGF-C。重要的是,EGF与VEGF-C均能刺激ICAM-1在OC细胞中的表达以及OC细胞的分化;上述所有效应在使用VEGFR3阻滞剂后均能被削弱。因此,在OC细胞内VEGF-C/VEGFR3作用于EGFR信号转导的下游部位(见图9B)。
我们的数据表明在早期消耗掉TAMs或用厄洛替尼阻滞OC细胞中的EGFR能有效预防卵巢癌的种植性转移,但在晚期上述措施无效。这项研究结果也许能解释为何晚期OC患者使用EGF抗体单药治疗未能取得成果。因此,OC的治疗应包括早期诊断、去除TAMs及EGF抗体疗法的使用。此外,我们建立的EGF/EGFR、VEGF-C/VEGFR3和ICAM-1–αMβ2整合蛋白模型要求OC细胞增殖、迁移、粘附和球体形成具有临床意义。因此,ICAM-1中和抗体,类似于阻断EGF和VEGFR3信号转导,强烈抑制体外球体的形成。而且,ICAM-1中和抗体明显减少小鼠模型中球体的大小、数量以及肿瘤的进展。本研究表明中和ICAM-1 可能为治疗OC提供新的疗法。
总的说来,我们的研究表明TAMs在卵巢癌种植转移球状体形成过程中起到必不可少的作用。TAM能分泌大量EGF从而激活周围肿瘤细胞中的EGFR。激活的EGF/EGFR信号通路能上调VEGF-C其反过来又上调整合蛋白和ICAM-1从而形成自分泌正反馈环路,从而促进肿瘤细胞增生、分化、粘附、形成球状体及腹膜转移(见图13B)。我们目前的研究揭示出球状体形成的关键机制、为抑制种植转移提供了一种新策略以及改善OC患者的预后情况。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质。
- 还没有人留言评论。精彩留言会获得点赞!
- 羧酸衍生物及以其作为有效成分的粘连分子抑制剂的制作方法
- 一种新的多肽——p24蛋白(膜泡运输相关蛋白)33.55和编码这种多肽的多核苷酸的制作方法
- 肿瘤抑制蛋白的制作方法
- 一种新的多肽——人整合蛋白胞质域相关蛋白(ICAP-1alpha)26.51和编码这种多肽的 ...的制作方法
- 一种新的多肽——人p24蛋白-12和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人血管上皮钙粘着蛋白9和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——连环蛋白10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人红细胞内收蛋白alpha亚基11和编码这种多肽的多核苷酸的制作方法
- 通过给予整合蛋白α的制作方法
- α1β1整合蛋白受体抑制剂和TGF-β1抑制剂在治疗肾病中的用途的制作方法