天然纳米囊泡外秘体用于制备调控细胞对索拉非尼敏感性以及c‑Met信号通路制剂的制作方法
本发明涉及生物医药和分子靶向治疗领域,具体涉及天然纳米囊泡外秘体、制备方法及其用途。
背景技术:
外泌体(exosome)作为物质运输载体在细胞内和细胞间的信息交流中发挥重要作用,它们可以传递多种生物分子调控细胞微环境,包括mRNA,miRNA及蛋白等。既往研究发现,肿瘤来源的外泌体在上皮间质转化(EMT)、肿瘤血管生成、肿瘤转移等方面发挥调控作用。
本发明,我们发现来源于肿瘤细胞的外泌体可在体内和体外降低细胞对索拉菲尼的敏感性,肿瘤来源外泌体可通过保护索拉菲尼引起的细胞凋亡以及促进细胞激活HGF/c-Met/Akt信号通路激发药物敏感性的降低抵抗。因此,本发明获得的外泌体具有以下应用:1、在体外细胞上诱导发生对索拉非尼的敏感性降低;2、在体内动物荷瘤模型上诱导发生对索拉非尼的敏感性降低;3、在体内外将该外秘体用于保护细胞免受药物引起的细胞凋亡;4、在体内外将该外秘体用于激活细胞的HGF/c-Met/Akt信号通路。
技术实现要素:
本发明公开并提供了一种来源于肿瘤细胞的天然脂质纳米囊泡结构即外秘体的制备方法,及其在制备调控肝细胞癌对索拉非尼敏感性以及c-Met信号通路制剂中的应用。本发明通过差速离心的方法提取获得肿瘤细胞的外泌体,这些外泌体可以在体内和体外明显诱导肝癌细胞对索拉菲尼的抵抗,且高侵袭肿瘤细胞来源的外泌体作用更强。肿瘤来源的外泌体可通过保护化疗药物引起的细胞凋亡以及促进肿瘤细胞激活HGF/c-Met/Akt信号通路,诱导药物抵抗。因此,本发明获得的外泌体具有以下应用:1、在体外细胞上诱导发生对索拉非尼的敏感性降低;2、在体内动物荷瘤模型上诱导发生对索拉非尼的敏感性降低;3、在体内外将该外秘体用于保护细胞免受药物引起的细胞凋亡;4、在体内外将该外秘体用于激活细胞的HGF/c-Met/Akt信号通路。
以下通过实施例对本发明作进一步详细的说明,但本发明的保护范围不受具体实施例的任何限制,而是由权利要求加以限定。
附图说明
图1不同细胞系来源的外泌体的特征
图2荧光显微镜检测示MHCC-97H来源的外泌体被肝癌细胞内化、吸收
图3肝癌细胞来源的外泌体诱导肝癌索拉非尼抵抗,索拉菲尼联合肝癌细胞来源的外泌体组裸鼠皮下肿瘤体积明显大于单独应用索拉菲尼组,且高侵袭肝癌细胞来源的外泌体促索拉菲尼抵抗效果强于低侵袭来源的外泌体组
图4肝癌来源的外泌体体外诱导SMMC-7721细胞索拉菲尼抵抗
图5肝癌细胞来源的外泌体体外逆转索拉菲尼引起的肝癌细胞凋亡
图6 TUNEL法检测肝癌来源的外泌体体内对索拉菲尼引起的肝癌细胞凋亡的影响
图7肝癌细胞来源的外泌体降低索拉菲尼引起的凋亡相关蛋白caspase和PARP水平
图8肝癌细胞来源的外泌体通过HGF/c-Met/Akt信号通路影响索拉菲尼抵抗
具体实施方式
实施例 外秘体的制备及对索拉非尼敏感性调控的体内外效应研究
1材料和方法
1.1细胞系和细胞培养
人肝癌细胞系SMMC-7721来自上海生科院细胞库,MHCC-97H,MHCC-97L和LO2来自复旦大学肝癌研究所。MHCC-97H,MHCC-97L用含10%胎牛血清的DMEM培养基培养,LO2用含10%胎牛血清的RPMI-1640培养基培养。所有细胞系培养在37℃、含5%二氧化碳的培养箱中。
1.2外泌体抽提
MHCC-97L,MHCC-97H和LO2细胞培养在含10%胎牛血清(超速离心过夜去除外泌体)的相应培养基中。48小时后,收集细胞培养基,按先前文献描述的通过差速离心的方法提取相应的外泌体[Thery C,Amigorena S,Raposo G,Clayton A:Isolation and characterization of exosomes from cell culture supernatants and biological fluids.Curr Protoc Cell Biol 2006,Chapter 3:3-22.]。最后,采用BCA蛋白浓度测定外泌体内的蛋白含量;Western blotting方法检测外泌体标志蛋白CD9和CD63。提取的外泌体存放于80℃备用。
1.3动物模型
所有的实验程序都遵循中国实验动物相关法规。25只雄性裸鼠(4-6周龄)购于海实验动物中心。所有裸鼠经利多卡因局部浸润麻醉后(0.25%)在右腋窝皮下注射SMMC-7721细胞(1×107细胞/200μL PBS每只)。当肿瘤达到体积50-100mm3时,将鼠随即分为5组(n=5,分别为对照组,索拉菲尼组,索拉菲尼+LO2外泌体组,索拉菲尼+MHCC97L外泌体组,索拉菲尼+MHCC97H外泌体组)。索拉非尼(100mg/kg,Selleck,USA)经裸鼠腹腔注射,同时裸鼠瘤体皮下注射不同来源的外泌体(100μg总蛋白/100μL PBS)。皮下注射等体积PBS作为对照。每2天检查裸鼠肿瘤体积。皮下注射处理二十五天后,所有小鼠经水合氯醛(5%,100μL/10g)麻醉后颈椎脱臼法处死。
1.4细胞活力分析
用MTT法检测细胞存活率。简言之,5×103接种在96孔板上。经索拉菲尼单独或联合不同来源外泌体共同孵育24或48小时,20μL MTT溶液(0.5%)添加到培养基中,培养4h后,培养基中取出,150μL DMSO添加到每孔并摇床震荡10min。最后用分光光度计测定490nm的有色溶液的吸光度。所有的实验重复三遍。
1.5Western blot分析
肝癌细胞经含1%蛋白酶抑制剂(Thermo,USA)的RIPA裂解缓冲液(碧云天,中国)裂解,等量的蛋白质经10%SDS-PAGE电泳。CD9、CD63、GAPDH、caspase-9,caspase-3,PARP,c-Met,p-met,AKT,P-AKT、VEGFR2和p-VEGFR2等抗体来自美国CST公司。MET抑制剂crizotinib(PF-02341066)和磷酸化Akt抑制剂MK-2206 2hcl购自中国Selleck化学公司。一抗孵育后经与辣根过氧化物酶标记的二次抗体孵育4h。蛋白条带采用增强化学发光(Millipore,USA)显示。
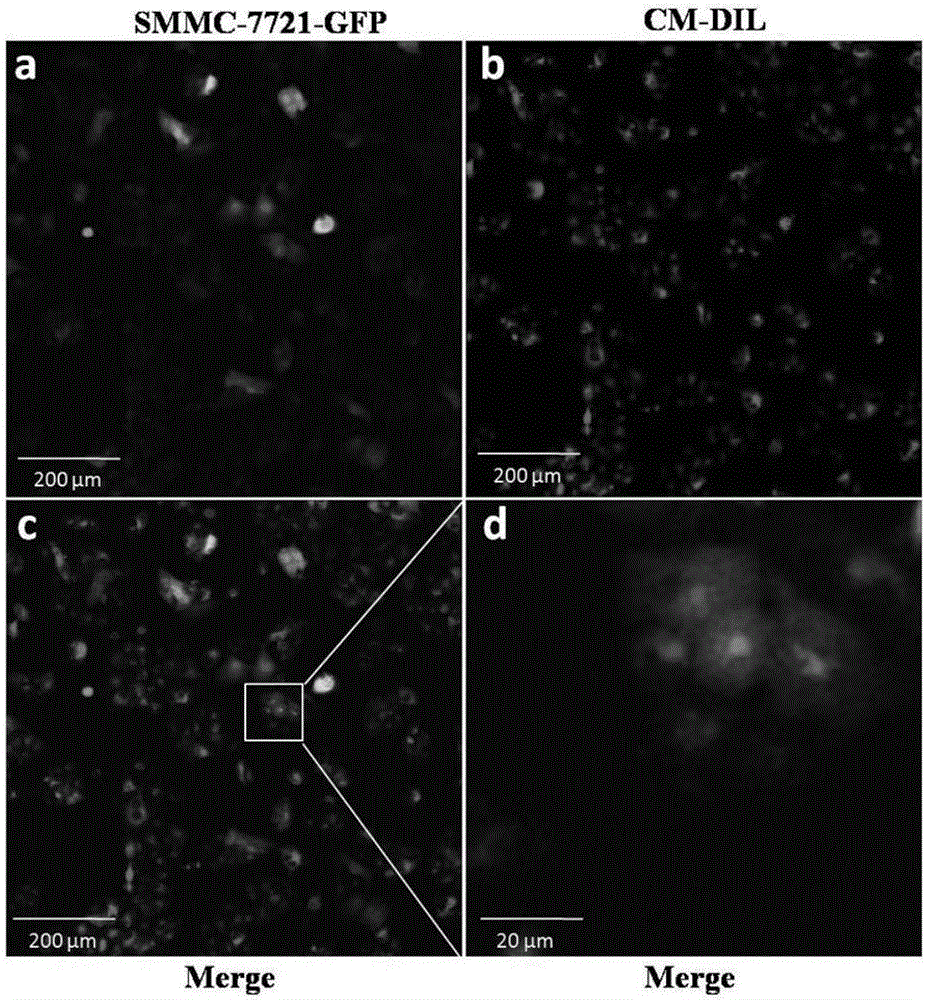
1.6荧光显微镜分析
MHCC-97H来源的外泌体经CM-DIL(Sigma,USA)标记,方法如下,100μg MHCC-97H来源的外泌体经1ml PBS稀释,2μl CM-DIL与1ml外泌体悬液室温孵育15min。然后加入18mL PBS,4℃下120000g离心2小时,除去上清,沉淀经20mL PBS重悬,再次4℃下120000g离心2小时。含CM-Dil标记的外泌体沉淀经200μl PBS重悬。SMMC-7721-GFP细胞培养于细胞爬片上至汇合度约80%。在培养基中加入含CM-Dil标记的外泌体溶液,在37℃含5%CO2的细胞培养箱中孵育4小时。培养后的细胞,PBS洗两次,然后经4%多聚甲醛固定10分钟。爬片经抗淬灭剂处理,利用荧光显微镜观察分析。
1.7TUNEL分析
裸鼠皮下肿瘤标本经常规方法石蜡包埋、切片。凋亡细胞采用TUNEL法检测。操作步骤按照原位细胞凋亡检测试剂盒(凯基生物,中国)指示。简言之,20mg/mL的蛋白酶K试剂在室温下与细胞孵育30min,经平衡溶液孵育10秒钟。细胞用PBS洗一遍后,37℃下经100ul Streptacidin-FITC处理1小时。然后,细胞再次经PBS洗涤三遍,每个样本滴加100ul的DAPI工作液,避光室温5min。PBS浸泡5min,清洗3次。最后细胞经荧光显微镜(Olympus BX41,日本)观察拍照。
1.8ELISA分析
细胞上清中的肝细胞生长因子浓度检测应用ELISA试剂盒方法(依科赛,中国),操作步骤按照试剂盒指示。简而言之,在细胞经索拉非尼和肝癌细胞来源的外泌体处理48h后,5000rpm离心5分钟收集细胞上清。含10%FBS上清作为实验对照。
1.9统计分析
所有数据均用平均值±标准差表示。组间差异分析应用t检验或ANOVA法分析。P值小于0.05,被认为有统计学意义。
2.结果:
2.1肿瘤来源外泌体提取及特征鉴定
为了检测肿瘤细胞来源的外泌体在肝癌细胞索拉菲尼耐药中的作用,我们首先从两种不同侵袭潜力的肝癌细细胞培养上清中分离外泌体。我们选择MHCC97H和MHCC97L两种普通的肝癌细胞系。MHCC97H细胞在本研究代表较高侵袭潜力。我们应用超速离心方法从上述两种肿瘤细胞中提取外泌体,利用透射电镜及qNano instrument检测,见外泌体镜下成圆形,直径约40-120nm(图1)。两种肿瘤细胞来源的外泌体均表达标志蛋白CD9和CD63(图 1)。
由本部分结果可知我们成功分离制备获得了肿瘤细胞来源的外秘体。
2.2肿瘤来源的外泌体可被肝癌细胞吸收
为检测外泌体是否可被肝癌细胞吸收内化,我们采用MHCC-97H来源的外泌体,进行CM-DIL染料标记,具体操作步骤过程间材料和方法部分。荧光显微镜观察发现CM-Dil标记的外泌体可像胞内囊泡一样被SMMC-7721-GFP细胞吸收内化(图2)。研究表明,肝癌细胞来源的exosomes可以被细胞吸收和内化。
由本部分结果可知我们分离制备获得的肿瘤细胞来源的外秘体可以被细胞吸收和内化。
2.3肿瘤来源的外泌体体内诱导肝癌细胞对索拉菲尼抵抗
为检测肿瘤来源外泌体是否可诱导肝癌化疗抵抗,我们建立了裸鼠皮下移植瘤模型,然后联合注射索拉菲尼和肿瘤来源的外泌体。如图3所示,索拉菲尼联合MHCC97H和MHCC97L外泌体注射组肿瘤明显大于单独索拉菲尼注射组;联合外泌体注射组明显抑制索拉菲尼化疗效果,肿瘤生长更快。有意思的是,高侵袭肝癌来源的外泌体(MHCC97H)组效果较低侵袭组(MHCC97L)效果更明显。各组肿瘤体积及重量见图3。高侵袭肝癌来源的外泌体组肿瘤体积几乎是对照组肿瘤体积2倍,重量约为3倍。
由本部分结果可知我们分离制备获得的肿瘤细胞来源的外秘体可以下调体内动物模型移植荷载的细胞对索拉非尼的敏感性。
2.4肿瘤来源的外泌体体外诱导肝癌细胞对索拉菲尼抵抗
为检测体外实验中肿瘤来源的外泌体是否可诱导肝癌细胞系SMMC-7721对索拉菲尼抵抗,我们首先明确了索拉菲尼可剂量依赖的抑制SMMC7721细胞增殖。然后我们将SMMC7721细胞加入特定浓度的索拉菲尼,并根据目的与不同来源的外泌体共培养。然后应用MTT法检测细胞增殖情况。我们发现应用MHCC97H和MHCC97L外泌体处理组较单独应用索拉菲尼组细胞增殖率明显升高。并且。MHCC97H外泌体组较MHCC97L外泌体组促细胞增殖效果更明显(图4)。
由本部分结果可知我们分离制备获得的肿瘤细胞来源的外秘体可以下调体外细胞对索拉非尼的敏感性。
2.5肿瘤来源的外泌体抑制索拉菲尼诱导的肝癌细胞凋亡
为检测肿瘤来源的外泌体是否可影响索拉菲尼促细胞凋亡作用,我们应用流式和TUNEL方法分别检测肝癌来源的外泌体在体内、体外对索拉菲尼引起的肝癌细胞凋亡的影响。并应用Western blot检测不同浓度的索拉菲尼对SMMC7721细胞cleaved caspase-9,cleaved caspase-3和cleaved PARP等凋亡蛋白的影响,我们发现应用MHCC97H和MHCC97L外泌体处理后,体外、体内索拉菲尼引起的肝癌细胞凋亡率明显降低(图5,6)。cleaved caspase-9,cleaved caspase-3和cleaved PARP等凋亡蛋白较索拉菲尼处理组表达降低,肝癌来源的外泌体可一定程度的逆转索拉菲尼引起的促凋亡作用(图5-7),并且高侵袭肝癌细胞系MHCC97H来源的外泌体较低侵袭肝癌细胞系MHCC97L来源的外泌体效果更明显。
由本部分结果可知我们分离制备获得的肿瘤细胞来源的外秘体在体内和体外可以抑制索拉菲尼诱导的细胞凋亡。
2.6肿瘤来源的外泌体通过HGF/c-Met/Akt通路影响索拉菲尼抵抗
为探究肿瘤来源的外泌体对索拉菲尼抵抗的作用因素,我们检测了不同处理组细胞培养上清中HGF的水平。我们结果显示,肿瘤来源的外泌体处理48小时后,细胞培养上清HGF含量较对照组增高3倍(图8),我们用Western blot法检测了各组磷酸化的Met,Akt的表达,发现应用MHCC97H和MHCC97L外泌体处理后,p-Met和p-Akt较索拉菲尼组升高(图8)。
由本部分结果可知我们分离制备获得的肿瘤细胞来源的外秘体在体外细胞上可以激活HGF/c-Met/Akt通路。
- 还没有人留言评论。精彩留言会获得点赞!