双特异性磷酸酶14(Dusp14)在肝缺血再灌注损伤中的应用的制作方法
本发明属于基因的功能与应用领域,涉及双特异性磷酸酶14(Dusp14)在肝缺血再灌注损伤中的应用,具体涉及Dusp14在筛选或制备预防、缓解和/或治疗肝缺血再灌注损伤药物中的应用。
背景技术:
肝脏缺血再灌注(ischemia reperfusion, I/R)损伤是在肝脏外科手术或者肝脏移植中,因肝脏血流阻断或肝脏供体的体外灌注引起肝脏缺血,当肝脏血流灌注恢复后,导致肝脏损伤加重甚至功能障碍的生理病理过程[1]。肝脏I/R损伤根据缺血情况的不同分为热缺血和冷缺血两种,热缺血常发生在常规肝脏手术及肝脏创伤中,也可能发生于某些类型的中毒性肝损伤,肝血窦阻塞以及Budd-Chiari综合征等[2];冷缺血主要发生于器官移植前的低温保存[3]。肝脏I/R损伤在临床上常表现为肝功能的损害,术后并发症发生率及死亡率增加,外科医生常需要在减少术中出血和降低肝脏I/R损伤发生风险之间做出艰难的选择。导致肝缺血再灌注损伤的机制比较复杂,研究表明,Kupffer细胞的激活、氧化应激以及炎症性细胞信号通路的激活等都参与了这一病理生理过程[4]。
关于肝脏缺血再灌注损伤的机制及其预防措施的研究,对于减少肝脏I/R损伤的发生或减轻I/R损伤的程度,减少肝脏手术的并发症,提高肝移植成功率,促进术后肝功能的恢复,具有重要的临床意义。针对这一难题,临床医生探索了众多控制和减轻I/R损伤的方法,包括低温麻醉、控制性灌注、肝脏原位降温冷却以及使用抗自由基损伤的药物等。但是,临床条件和病人实际情况限制了上述方法的应用和效果。
在细胞中,很多蛋白在合成以后都会发生蛋白翻译后的修饰。而在这些蛋白修饰中,蛋白的可逆性的磷酸化修饰就是一种作用非常广泛的蛋白翻译后的修饰。蛋白激酶(protein kinase, PK)能够将细胞内游离的磷酸基团连接到底物蛋白分子上,介导底物蛋白发生磷酸化。蛋白磷酸酶(protein phosphatase, PP)和蛋白激酶的作用是相反的,蛋白磷酸酶能够介导底物蛋白发生去磷酸化。在真核细胞中,有三种氨基酸残基是最容易发生磷酸化作用的,分别是酪氨酸(tyrosine, tyr)、苏氨酸(threonine, thr)和丝氨酸(serine, ser)。发生磷酸化作用的氨基酸位点不一样,那么所对应的去磷酸化作用的酶也是不一样的,分别是酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)以及丝氨酸/苏氨酸磷酸酶(protein serine/threonine phosphatases, PSPs)。双特异性蛋白磷酸酶(dual specificity protein phosphatases, DUSPs)具备酪氨酸磷酸酶以及丝氨酸/苏氨酸磷酸酶的双重作用,不仅可以催化酪氨酸位点上的去磷酸化作用,也可以催化丝氨酸、苏氨酸位点上的去磷酸化作用。
Dusp14是双特异性磷酸酶(DUSP)家族中的一员,Dusp14蛋白分子全长198个氨基酸,其中包含了一个双特异性磷酸酶的催化结构域DSPs(Dual-specificity phosphatase catalytic domain, DSPs)。Dusp14分子上能够介导磷酸基团结合的催化活性区域是H110CAAGVSR117,其中催化活性位点是第111位的半胱氨酸(cysteine111)。Dusp14最初作为CD28的胞质尾区互作蛋白,广泛表达于心、肝、胎盘等组织器官中[5]。研究表明,Dusp14能够调节原代T细胞内ERK、JNK和P38的磷酸化水平[5];Dusp14活性位点突变(C111S)可以激活ERK,促进β细胞增殖[6];Dusp14通过TAK1-P38/JNK信号通路在主动脉缩窄引起的心肌肥厚中发挥重要的保护作用[7],而其在肝脏缺血再灌注损伤中的作用尚不清楚。
参考文献:
1. Kapoor S. Hepatic ischemia-reperfusion injury from bench to bedside (Br J Surg 2010; 97: 1461-1475). Br J Surg. 2011; 98(3):459, 459-460.
2. Lentsch A B, Kato A, Yoshidome H, et al. Inflammatory mechanisms and therapeutic strategies for warm hepatic ischemia/reperfusion injury. Hepatology. 2000; 32(2):169-173.
3. Busuttil R W, Tanaka K. The utility of marginal donors in liver transplantation. Liver Transpl. 2003; 9(7):651-663.
4. Massip-Salcedo M, Rosello-Catafau J, Prieto J, et al. The response of the hepatocyte to ischemia. Liver Int. 2007; 27(1):6-16
5. Marti F, Krause A, Post NH, Lyddane C, Dupont B, Sadelain M, King PD (2001) Negative-feedback regulation of CD28 costimulation by a novel mitogen-activated protein kinase phosphatase,MKP6. J Immunol. 2001; 166:197–206
6. Klinger S, Poussin C, Debril MB, et al. Increasing GLP-1-induced b-cell proliferation by silencing the negative regulators of signaling cAMP response element modulator-α and Dusp14. Diabetes. 2008; 57:584–593.
7. Li CY, Zhou Q, Yang LC, et al. Dual-specificity phosphatase 14 protects the heart from aortic banding-induced cardiac hypertrophy and dysfunction through inactivation of TAK1-P38MAPK/-JNK1/2 signaling pathway. Basic research in cardiology. 2016; 111(2):19。
技术实现要素:
为解决临床防治肝缺血再灌注损伤现有技术的缺陷和不足,本发明的目的在于确定Dusp14基因的表达与肝缺血再灌注损伤之间的相互关系,提供一种用于治疗肝缺血再灌注损伤的靶基因Dusp14的新应用,即Dusp14作为药物靶标在筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用,以及Dusp14在制备用于预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用,进而把Dusp14基因应用于肝缺血再灌注损伤的治疗。
本发明的目的通过下述技术方案实现:
本发明以肝细胞特异性Dusp14基因敲除小鼠和Dusp14转基因小鼠为实验对象,通过肝缺血再灌注损伤模型研究Dusp14基因的功能。结果表明:与野生型C57BL/6小鼠相比,肝细胞特异性Dusp14基因敲除小鼠肝脏坏死面积明显增加;与非转基因小鼠相比,Dusp14转基因小鼠的肝脏坏死面积则明显减小。这提示Dusp14基因具有保护肝功能的作用,为研究Dusp14在防治肝缺血疾病的新靶点和新策略中所发挥的作用提供了理论依据和临床基础。
本发明的研究证明了:在肝缺血再灌注损伤模型中,Dusp14具有抑制肝脏坏死、减少肝细胞凋亡、保护肝功能的作用。
一种Dusp14基因在肝缺血再灌注损伤中的功能,主要体现在Dusp14具有保护肝功能的作用,特别是Dusp14具有改善肝缺血再灌注损伤的作用。
针对Dusp14改善肝缺血再灌注损伤的功能,Dusp14具有如下应用:
Dusp14作为药物靶标在筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用。该应用是非诊断和治疗的目的;所述的筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物,是指筛选够促进Dusp14表达的药物。
Dusp14在制备预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现Dusp14基因的新功能,即Dusp14基因能够抑制肝组织缺血再灌注损伤,且与肝细胞凋亡密切相关。
(2)基于Dusp14在抑制肝缺血疾病中的作用,其可以用于筛选或制备预防、缓解和/或治疗肝缺血再灌注损伤的药物。
附图说明
图1是肝细胞特异性Dusp14基因敲除小鼠和Dusp14转基因小鼠构建策略图。A为肝细胞特异性Dusp14基因敲除小鼠的构建策略图;B为肝细胞特异性Dusp14转基因小鼠的构建策略图。
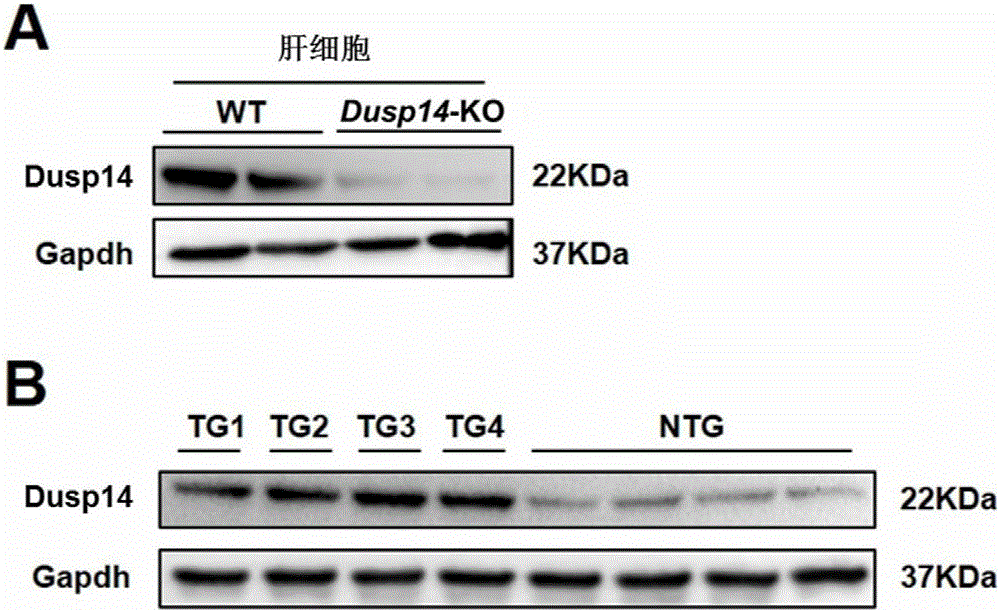
图2是Western Blot检测肝细胞特异性Dusp14基因敲除小鼠和Dusp14转基因小鼠肝脏组织中Dusp14表达量的结果图。A为肝细胞特异性Dusp14基因敲除小鼠的检测结果图;B为肝细胞特异性Dusp14转基因小鼠的检测结果图(TG1、TG2、TG3、TG4表示不同的转基因小鼠个体)。
图3是小鼠在不同时间点肝脏的坏死情况对比图。A为WT和Dusp14-KO小鼠在不同时间点肝脏HE染色图及坏死面积统计柱状图;B为NTG和Dusp14-TG小鼠在不同时间点肝脏HE染色图及坏死面积统计柱状图(#:P<0.05 vs 对应I/R组)。
图4小鼠在不同时间点血清中ALT及AST的含量统计比较图。A为WT和Dusp14-KO小鼠在不同时间点肝脏血清中ALT及AST的含量统计柱状图;B为NTG和Dusp14-TG小鼠在不同时间点肝脏血清中ALT及AST的含量统计柱状图(*:P<0.05 vs WT Sham组;#:P<0.05 vs WT/NTG对应时间点I/R组)。
图5小鼠缺血在再灌注24h时TUNEL细胞数的柱状统计图。A为WT和Dusp14-KO小鼠在再灌注24h时TUNEL免疫荧光柱状统计图;B为NTG和Dusp14-TG小鼠在再灌注24h时TUNEL免疫荧光柱状统计图(#:P<0.05 vs 对应I/R组)。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实验用动物及饲养:
实验动物:选用8-10周龄、体重在24g-27g、背景为雄性C57BL/6品系的野生型小鼠(WT,购自北京华阜康生物科技股份有限公司)、肝细胞特异性Dusp14基因敲除小鼠(Dusp14-KO)和Dusp14转基因小鼠(Dusp14-TG)(由武汉大学动物实验中心李红良老师实验室构建)、非转基因小鼠(NTG,同窝对照非转基因小鼠)为实验对象。
饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SRF级小鼠饲料购自北京华阜康生物科技股份有限公司。饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。
实施例1 肝细胞特异性Dusp14基因敲除小鼠以及Dusp14转基因小鼠的构建
(1)肝细胞特异性Dusp14基因敲除小鼠的构建(构建策略见图1A)
根据Dusp14基因的信息,利用CRISPR Design分别在内含子2和3中各设计一个CRISPR的打靶位点。靶序列分别为:
Dusp14-sRNA1:ggATAAGTCATTTTCTATTGACCAT TGG;
Dusp14-sRNA2:GGTTCTCCCGAGAGGGTTTCTACGC TGG。
此外还设计了一个用于同源修复的供体载体(Donor Vector),它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。
1)打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4 DNA连接酶连入经过限制性内切酶BsaI处理过的pUC57-sgRNA(Addgene 51132)载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。
2)条件性敲除骨架载体pBluescript SK(+)-2loxp的构建:
分别合成4条寡聚单链核苷酸序列:
loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT;
loxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;
loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA;
loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;
上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescript II SK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescript SK(+)-2loxp。
3)供体载体(Donor Vector)的构建:根据引物设计原则,设计如下引物(表1),以小鼠gDNA为模板,扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。上述扩增得到的产物及pBluescript SK(+)-2loxp载体经表1中所示限制性内切酶酶切后连接,得到供体载体。
表1构建供体载体所需引物序列及对应酶切位点
4)打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体pST1374-Cas9(Addgene 44758)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7 mMESSAGE mMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A) Tailing 试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscript™ Kit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasy Micro Kit(Qiagen,217084)进行纯化。
5)Dusp14-floxed条件性敲除小鼠的制作
将上述成熟的mRNA产物与供体载体一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得Dusp14-floxed纯合小鼠。
6)肝细胞特异性Dusp14基因敲除小鼠的制作
将上述Dusp14-floxed小鼠与肝脏特异性Alb-Cre(购自The Jackson Laboratory,货号003574)转基因小鼠交配,筛选得到Dusp14floxed/floxed/Alb-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到肝细胞特异性Dusp14基因敲除小鼠。
通过蛋白质印迹法(Western Blot)实验检测肝细胞特异性Dusp14基因敲除小鼠肝脏中Dusp14蛋白的表达量。提取肝细胞蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证Dusp14表达,结果见图2A。相比于野生型小鼠,肝细胞特异性Dusp14基因敲除小鼠肝细胞中Dusp14蛋白几乎不表达。
(2)肝细胞特异性Dusp14转基因小鼠的构建(构建策略见图1B)
以野生型C57BL/6小鼠Dusp14基因cDNA为模板,用上游引物(5’-TGCTCTAGAGCCACCATGAGCTCCAGAGGTCACAG-3’)、下游引物(5’-TGCTCTAGACTAAATCCCCCAATAAGGCA-3’)扩增小鼠Dusp14基因(NCBI,Gene ID:56405,NM_019819.3),把扩增得到的产物以及pCAG-CAT-LacZ载体(北京协和医学院基础学院杨青林老师实验室提供,制备过程参见参考文献:Kim T, Zhelyabovska O, Liu J, et al. Generation of an Inducible, Cardiomyocyte-Speci fi c Transgenic Mouse Model with PPAR b/d Overexpression[J]. Peroxisome Proliferator-Activated Receptors (PPARs), 57.)用XbaI(NEB,# R0145L)酶切后连接,得到转基因载体pCAG-loxP-CAT-loxP-Dusp14-hGHpA,Dusp14的表达由CAG启动子驱动得到。将构建的载体通过显微注射构造成受精胚胎(C57BL/6J背景),得到Dusp14-floxed转基因小鼠。肝细胞特异性Dusp14转基因小鼠由Dusp14-floxed转基因小鼠和Alb-Cre(购自The Jackson Laboratory,货号003574)小鼠杂交繁殖得到。
通过蛋白质印迹法(Western Blot)实验检测不同转基因小鼠肝脏中Dusp14蛋白的表达量。提取不同转基因小鼠肝脏组织蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证Dusp14过表达,结果见图2B。相比于野生型小鼠,肝细胞特异性Dusp14转基因小鼠肝脏组织中Dusp14蛋白表达含量显著提高。
实施例2 小鼠肝缺血再灌注损伤(ischemia/reperfusion injury,I/R)模型的获得
(1)实验动物分组:雄性C57BL/6品系野生型小鼠、肝细胞特异性Dusp14基因敲除小鼠及Dusp14转基因小鼠、非转基因小鼠,通过肝脏缺血再灌注建立肝缺血再灌注损伤模型(I/R)。随机分为8组:C57BL/6J品系野生型小鼠假手术组(WT Sham)及I/R手术组(WT I/R)、肝细胞特异性Dusp14基因敲除小鼠假手术组(KO Sham)及I/R手术组(KO I/R)、非转基因小鼠假手术组(NTG Sham)及I/R手术组(NTG I/R)、肝细胞特异性Dusp14转基因小鼠假手术组(TG Sham)及I/R手术组(TG I/R)。
(2)肝缺血再灌注损伤I/R模型手术(采用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血)操作流程:
1)手术前12h给小鼠禁食,可自由饮水。
2)手术前用3%戊巴比妥钠成功麻醉小鼠后,将其平卧固定肢体,用剃毛器将小鼠腹部术区毛刮净,用10%碘酒和75%乙醇对术区消毒。
3)取腹正中切口进腹,暴露肝脏左、中叶之肝蒂。
4)用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血,以防止发生严重肠系膜静脉淤血。0.5min后,与非阻断的右叶相比,可见阻断叶变白,说明阻断成功。此时,注意记录缺血开始时间,维持缺血约60分钟,期间用湿的盐水纱布覆盖切口,并注意小鼠的保温(Sham组的小鼠在阻断成功即刻去除血管夹,恢复缺血肝血流)。
5)缺血60分钟后去除血管夹,恢复缺血的肝脏血流,然后关闭腹腔,分两层关腹,先把内层缝好,再缝皮,将手术后的小鼠置于干净的笼子中单独饲养,观察。
实施例3 肝脏坏死面积及肝功能指标(AST,ALT)的测定
肝脏缺血再灌注损伤严重程度的评估指标主要包括肝脏坏死面积和肝功能指标(AST,ALT),这些指标均与肝脏缺血再灌注损伤严重程度正相关。
(1)取材
分别于术后1h、3h、6h、24h取假手术组(Sham)以及缺血再灌注组小鼠,颈椎脱臼处死,立即自下腔静脉取血1mL,分离血清。同时统一取缺血区肝左叶组织大小约1.5cm×1cm×0.2cm于10%中性福尔马林中固定24h后脱水,包埋,进行石蜡切片后进行HE染色。
分离血清:收集血液的EP管于室温下静置1-2h使血液自然凝固。4℃、4000rpm/min离心30min,充分分离血清。用微量移液器分别吸取血清20μL、20μL、30μL、30μL置0.2mL无菌EP管中,对EP管进行标记,随后保存于-80℃冰箱备用。
(2)制备石蜡标本切片
1)主要操作程序包括:包埋框处理→流水冲洗→脱水→透明→浸蜡→包埋→切片→摊片→晾干或烘烤后备用。
2)用石蜡切片机的标准程序切5μm的石蜡切片备用。
(3)HE染色
主要步骤为:55℃烘烤30min→二甲苯5min,3次→100%酒精1min→95%酒精1min→70%酒精1min→双蒸水1min→苏木素溶液5min→水洗1min→1%盐酸酒精1-3s→水洗1min→Scott液(碳酸氢钠0.35g,硫酸镁2g,蒸馏水100mL)1min→水洗1min→伊红溶液3-5min→蒸馏水洗去浮色→70%酒精1s→95%酒精1s→100%酒精30s,3次→二甲苯2min,3次→趁二甲苯未干立即封片→通风橱内吹干,显微镜拍照。
(4)小鼠血清ALT、AST含量测定
1)从-80℃冰箱中取出血清样本,迅速置于冰上,在室温下待样品融化;
2)在室温下,4000转/分钟离心1分钟,让EP管壁的血清聚集至管底。
3)按照操作流程,打开全自动生化分析仪(Sysmex,Chemix 180i),清洗加样器。
4)按照全自动生化分析仪样品盘的标记顺序,逐一放入待测的EP管。
5)准确安装试剂检测盘,开始使用全自动生化分析仪检测ALT、AST水平。
Dusp14-KO、WT、Dusp14-TG和NTG组在肝脏缺血再灌注损伤后的HE染色结果见图3:显微镜下可见Sham组肝组织基本正常,肝组织结构整齐,无明显的纤维组织增生。I/R组随着再灌注的时间的延长,肝组织结构模糊,排列紊乱。其内有大小不等、形状不规则的坏死灶,坏死灶内肝细胞结构模糊,排列紊乱,离断,与正常肝脏比较,坏死肝脏的肝小叶内见大片坏死灶,坏死组织边缘可见炎性反应带,肝细胞核发生典型的坏死改变,可见核固缩。这种现象在缺血再灌注后24h达到高峰。实验结果表明,给予Dusp14-KO小鼠I/R后的梗死面积明显大于WT组小鼠(图3A);同样Dusp14-TG小鼠I/R后的梗死面积明显小于NTG组小鼠(图3B),因此,Dusp14在肝脏缺血再灌注引起的损伤中起到重要作用。
血清中ALT及AST的含量统计结果见图4。结果表明在I/R组各时间点ALT、AST水平均明显高于Sham组,在再灌注后6h达到高峰,随后下降,Dusp14-KO小鼠I/R后的ALT、AST水平明显高于WT组小鼠(图4A);Dusp14-TG小鼠I/R后的ALT、AST水平显著低于NTG组小鼠(图4B)。
实施例4 缺血再灌注后肝细胞凋亡情况测定
用TUNEL试剂盒染色检测凋亡,UNEL试剂盒:ApopTag® Plus In Situ Apoptosis Fluorescein Detection Kit(S7111,Chemicon)。具体过程为:
1)将石蜡切片置于烤箱中,60℃烤片30分钟;
2)二甲苯,5分钟×3次;
3)100%乙醇,5分钟×2次;95%乙醇,5分钟;70%乙醇,5分钟;
4)ddH2O漂洗,5分钟×2次;
5)蛋白酶K 37℃孵育15分钟;
6)PBS漂洗5min×2次;
7)直接滴加Equilibration Buffer于组织上(13μL/cm2),室温孵育至少10s;
8)弃去Equilibration Buffer,滴加TdT Enzyme工作液(77μL Reaction Buffer +33μL TdT Enzyme)于组织上(11μL/cm2),置湿盒于37℃孵育1h;
9)将切片置于盛有Stop/Wash Buffer工作液(1mL Stop/Wash Buffer+34mL ddH2O)的染色缸中振荡15s后室温孵育10min(等待过程中,将适当量的Anti-Digoxigenin Conjugate吸出,至于EP管中,避光放置在室温下,使其平衡至室温);
10)PBS漂洗1min×3次;
11)轻轻甩去组织多余残留的液体,将组织周围液体吸3滴加Anti-Digoxigenin Fluorescein工作液(53%Blocking Solution+ 47%Anti-Digoxigenin Conjugate)于组织上(13μL/cm2),置湿盒中室温避光孵育30min;
12)PBS漂洗2min×4次(每次换新的PBS);
13)SlowFade Gold antifade reagent with DAPI(Invitrogen,S36939)封片;荧光镜下观察,拍照。若需保存,于暗湿盒中4℃保存。
通过TUNEL试剂盒检测了各组小鼠I/R术后24小时肝细胞凋亡情况,结果如图5所示, Dusp14-KO小鼠肝细胞凋亡数量明显比野生型小鼠增加(图5A),Dusp14-TG小鼠肝细胞凋亡数量明显比非转基因小鼠减少(图5B),这表明Dusp14与肝细胞缺血再灌注时的细胞凋亡相关。这些结果表明,增加Dusp14表达可以抑制肝组织缺血再灌注损伤,且与肝细胞凋亡密切相关。
上述结果表明,在肝脏缺血再灌注引起的损伤中,肝细胞特异性Dusp14基因敲除小鼠肝脏坏死面积显著增加,肝功能明显降低,肝细胞凋亡数量也明显增多;而肝细胞特异性Dusp14转基因小鼠的肝脏坏死面积明显减少,肝功能增强,肝细胞凋亡数量明显减少。证明 Dusp14基因在肝脏缺血疾病模型中有着重要的保护作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉大学
<120> 双特异性磷酸酶14(Dusp14)在肝缺血再灌注损伤中的应用
<130> 1
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 28
<212> DNA
<213> Mus musculus
<400> 1
ggataagtca ttttctattg accattgg 28
<210> 2
<211> 28
<212> DNA
<213> Mus musculus
<400> 2
ggttctcccg agagggtttc tacgctgg 28
<210> 3
<211> 54
<212> DNA
<213> Artificial Sequence
<220>
<223> loxp1-F
<400> 3
agcttgacgt cataacttcg tatagcatac attatagcaa tttataccgg tgat 54
<210> 4
<211> 50
<212> DNA
<213> Artificial Sequence
<220>
<223> loxp1-R
<400> 4
atcaccggta taaattgcta taatgtatgc tatacgaagt tatgacgtca 50
<210> 5
<211> 52
<212> DNA
<213> Artificial Sequence
<220>
<223> loxp2-F
<400> 5
gatcccttaa gataacttcg tatagcatac attatagcaa tttatacgcg ta 52
<210> 6
<211> 52
<212> DNA
<213> Artificial Sequence
<220>
<223> loxp2-R
<400> 6
ctagtacgcg tataaattgc tataatgtat gctatacgaa gttatcttaa gg 52
<210> 7
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 LA-F
<400> 7
ggggtacccc ggctcaatga tttcctct 28
<210> 8
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 LA-R
<400> 8
gcgtcgacca ttgggagatg tagcctgca 29
<210> 9
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 M-F
<400> 9
tctaccggtg tcaatagaaa atgacttata tgcttc 36
<210> 10
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 M-R
<400> 10
gaccttaagt agaaaccctc tcgggagaac 30
<210> 11
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 RA-F
<400> 11
cgacgcgtcg ctgggtgttc gggtt 25
<210> 12
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Dusp14 RA-R
<400> 12
ataagaatgc ggccgccctg gctgataaaa gggaaa 36
<210> 13
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> 上游引物
<400> 13
tgctctagag ccaccatgag ctccagaggt cacag 35
<210> 14
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> 下游引物
<400> 14
tgctctagac taaatccccc aataaggca 29
- 还没有人留言评论。精彩留言会获得点赞!