Toll样蛋白相互作用蛋白在治疗血管损伤后再狭窄中的功能和应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种Toll样蛋白相互作用蛋白(Toll Interacting Protein,Tollip)在制备预防、缓解和/或治疗血管损伤后再狭窄的药物中的应用。
背景技术:
随着人类社会经济的不断发展,人民生活水平以及饮食结构的不断变化,心血管疾病的发病率保持着逐年上升的趋势,严重影响着公众的健康状况,并成为我们国家主要的致死原因之一。在动脉粥样硬化(atherosclerosis,AS)、肺动脉高压、经皮冠状动脉介入治疗(percutaneous transluminal coronary intervention,PCI)术后再狭窄(RS)、移植后动脉病以及肺动脉高压等血管增生性疾病的发生过程中都伴随着新生内膜的形成。并且现阶段在能有效的疏通阻塞的动脉,改善血供能的外科手术如球囊扩张、支架置入以及动脉旁路手术等进行后,再狭窄的发生率同样较高(30~60%),极大地影响了治疗效果。研究表明,在损伤形成的过程中,新生内膜及中膜组织过度增生以及同时伴随的细胞外基质形成,是造成血管重建后再狭窄的主要病理基础。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)表型转化在新生内膜形成过程中扮演着重要的角色。VSMCs由收缩型向合成型转化时,增殖、迁移能力增强并分泌、合成大量的细胞外基质,从而形成新生内膜,进而导致严重的血管增生性疾病的发生。因此,现阶段,寻求新的有效抑制血管再狭窄的靶点以及治疗方法极为重要。
TLR受体是激活天然免疫系统的关键作用分子,其介导的信号通路参与了多种心血管疾病的发生发展中,包括动脉粥样硬化、缺血再灌注损伤、心肌重构[1-3]。Toll样蛋白相互作用蛋白(Tollip),作为Toll-白细胞介素-1受体(IL-1R)的衔接蛋白,可以在多种组织、细胞中表达,包括心脏、脑、平滑肌细胞[4]等。同时作为负性调控TLR信号通路的内源性蛋白[5],Tollip可以通过直接调控TLR信号通路或者抑制IL-1R相关联的激酶(IRAK)的活性,来抑制TLR2和TLR4介导的细胞信号。近来研究发现,利用IL-1诱导心肌细胞肥大的模型中,发现过表达Tollip可以通过下调依赖于MyD88的NF-Kb信号通路可以明显的抑制心肌细胞肥大反应[6]。尽管如此,Tollip对内膜增生是否有影响,其作用机制如何,目前知之甚少。
参考文献:
1.Xu XH,Shah PK,Faure E,Equils O,Thomas L,Fishbein MC et al.Toll-like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized ldl.Circulation 2001;104:3103–3108.
2.Arslan F,Smeets MB,O’Neill LA,Keogh B,McGuirk P,Timmers L et al.Myocardial ischemia/reperfusion injury is mediated by leukocytic Toll-like receptor-2 and reduced by systemic administration of a novel anti-Toll-like receptor-2 antibody.Circulation 2010;121:80–90.
3.Topkara VK,Evans S,ZhangW,Epelman S,Staloch L,BargerPMet al.Therapeutic targeting of innate immunity in the failing heart.J Mol Cell Cardiol 2011;51:594–599.
4.Nishimura M,Naito S.Tissue-specific mRNA expression profiles of human Toll-like receptors and related genes.Biol Pharm Bull 2005;28:886–892.
5.Burns K,Clatworthy J,Martin L,Martinon F,Plumpton C,Maschera B et al.Tollip,a new component of the IL-1RI pathway,links IRAK to the IL-1 receptor.Nat Cell Biol 2000;2:346–351.
6.Hu Y,Li T,Wang Y,Li J,Guo L,Wu M et al.Tollipattenuated the hypertrophic response of cardiomyocytes induced by IL-1beta.Front Biosci 2009;14:2747–2756
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于确定Tollip的表达和血管损伤后再狭窄的相互关系,提供一个用于预防、缓解和/或治疗血管损伤后再狭窄的靶基因Tollip的新用途。
本发明的目的通过下述技术方案实现:
本发明以野生型C57BL/6小鼠与Tollip基因敲除小鼠(Tollip-KO小鼠)为实验对象,通过颈动脉导丝损伤模型诱导获得小鼠血管损伤模型(vascular injury,VI),进行了血管损伤模型(VI)小鼠内膜新生测定、血管壁细胞增殖水平的检测和平滑肌细胞表型的检测的研究,结果表明:与野生型C57BL/6小鼠对比,Tollip基因敲除小鼠表现出内膜新生及细胞增殖明显大于WT小鼠;Tollip基因敲除可以促进细胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)和细胞周期蛋白(Cyclin D1)的表达,可促进平滑肌细胞的增殖和内膜增生;Tollip基因敲除可以抑制平滑肌细胞分化特异性抗原(smoothelin)、平滑肌肌动蛋白(Smooth Muscle Actin,SMA)和平滑肌22α(smooth muscle 22 alpha,SM22α)的表达,可促进平滑肌细胞由收缩型向合成型的表型转换,从而促进内膜增生。上述结果表明Tollip基因敲除会促进血管损伤后再狭窄的发生,Tollip能够抑制血管损伤后再狭窄的形成,为研究预防、缓解和/或治疗血管损伤后再狭窄的新靶点和新策略提供了理论依据和临床基础。
本发明人的研究证明了:在颈动脉导丝损伤诱导的血管损伤模型中,Tollip具有抑制平滑肌细胞的增殖和内膜增生,抑制内膜增生的作用。
一种Tollip基因在血管损伤后再狭窄中的功能,主要体现在Tollip具有抑制平滑肌细胞的增殖和内膜增生,抑制平滑肌细胞由收缩型向合成型的表型转换,抑制血管损伤后再狭窄发生的作用。
针对Tollip的具有抑制血管损伤后再狭窄的发生的功能,提供一种Tollip在制备用于预防、缓解和/或治疗血管损伤后再狭窄的药物的应用。
一种预防、缓解和/或治疗血管损伤后再狭窄的药物,包含Tollip。
一种预防、缓解和/或治疗血管损伤后再狭窄的动脉支架,其包被有Tollip。
在本发明中,所述血管损伤主要是动脉血管损伤。
在本发明中,所述血管损伤是指动脉粥样硬化引起的血管损伤,或者在治疗动脉粥样硬化时引起的血管损伤,例如通过球囊扩张或放入支架引起的血管损伤,或者移植后动脉病或肺动脉高压引起的血管损伤。
在本发明中,所述动脉粥样硬化既包括动脉粥样硬化较早期阶段的血管狭窄期,也包括动脉粥样硬化严重时的血管梗塞期。
在本发明中,所述动脉支架是指用于支撑人体内因病变而狭窄、闭塞的血管,恢复血液流通的管状器件,采用金属或高分子材料加工制成,可长期或暂时留于人体血管内。在管腔球囊扩张成形的基础上,在病变段置入支架以达到支撑狭窄闭塞段血管、减少血管弹性回缩及再塑形、保持管腔血流通畅的目的,既包括外周动脉支架,也包括冠状动脉支架。
在本发明中,所述再狭窄是指在局部血管发生损伤时,所作出的导致血管管腔再狭窄的普遍性生物学反应。这里主要指医源性损伤引起的血管再狭窄,损伤过程主要由动脉重塑和内皮增生组成。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现Tollip基因的新功能,即Tollip基因具有能够抑制血管内膜增生,抑制血管损伤后再狭窄的发生的作用。
(2)基于Tollip在抑制血管损伤后再狭窄中的作用,其可以用于制备预防、缓解和/或治疗血管损伤后再狭窄的药物。
(3)Tollip可用于制备预防、缓解和/或治疗血管损伤后再狭窄的动脉支架。
附图说明
图1是WT和Tollip-KO小鼠术后14、28天的EVG染色及内膜面积结果统计柱状图;
其中,A:EVG染色图,B:内膜面积统计柱状图(*:p<0.05vs WT VI组)。
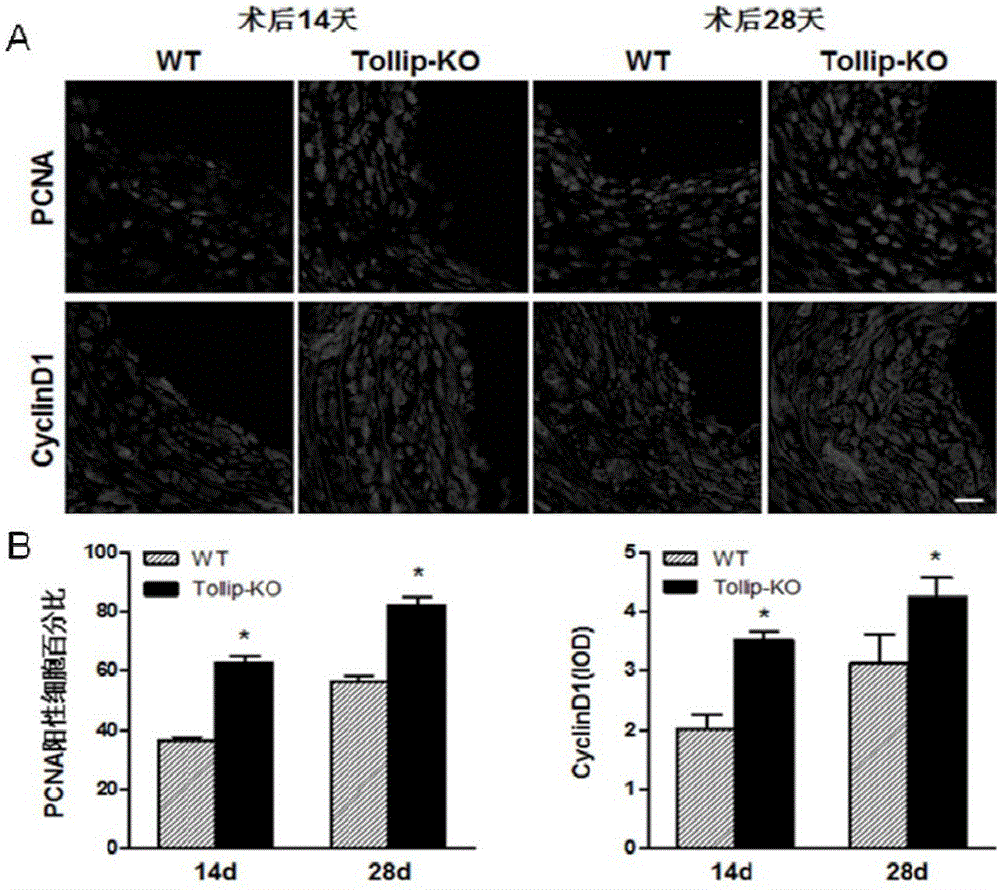
图2是WT和Tollip-KO小鼠术后14、28天血管壁细胞增殖水平标志物PCNA、CyclinD1表达的免疫荧光染色及结果统计柱状图;
其中,A:免疫荧光染色,B:结果统计柱状图(*:p<0.05vs WT VI组)。
图3是WT和Tollip-KO小鼠术后14、28天平滑肌细胞表型转化标志物SMA、SM22α表达的免疫荧光染色及结果统计柱状图;
A:免疫荧光染色,B:结果统计柱状图(*:p<0.05vs WT VI组)。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
实验用动物及饲养
实验动物:选用8-10周龄、体重在24-27g,雄性,C57BL/6小鼠(WT小鼠,购自北京华阜康生物科技有限公司),Tollip基因敲除小鼠(Tollip-KO,购自欧洲EMMA公司,货号:01970)。
饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SPF级小鼠饲料购自北京华阜康生物科技有限公司,饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。
【实施例1】小鼠血管损伤模型(VI)获得
1.实验动物分组:使用8-10周龄,体重24-27g的WT和Tollip-KO小鼠,共分为2组:WT血管损伤组,Tollip-KO血管损伤组,每组各20只小鼠。分别在手术后14天和28天处死小鼠,取损伤节段血管进行分析。
2.小鼠血管损伤模型操作流程:
1)用电子天平于动态模式下准确称取小鼠体重(g),用双蒸水准备配置3%戊巴比妥钠溶液,轻轻摇动使其充分溶解,采用80mg/kg体重剂量,计算所需戊巴比妥钠溶液体积后用1mL注射器准确抽取相应体积溶液,行腹腔注射麻醉小鼠,待小鼠充分麻醉倒(约3min)后,8%硫化钠颈部脱毛。
2)分离颈内和颈外动脉。
3)在颈内动脉和颈外动脉分叉处用8-0线结扎颈外动脉,同时用血管夹(WPI,501784-G)暂时性阻断颈内动脉及颈总动脉供血。
4)用显微剪(WPI,501839)在颈外动脉结扎线的上方横向剪一个小口。经此血管切口插入直径0.015英寸的导丝(No.C-SF-15-15,Cook,Bloomington,Indiana),旋转导丝进退5-6次。
5)在切口进心端结扎颈外动脉,松开颈内及颈总动脉置留的血管夹,剪断线头,清理术野,缝合颈部切口。
【实施例2】血管损伤模型(VI)小鼠内膜新生测定
1.小鼠取材
1)麻醉小鼠,剪破心脏放血。
2)从颈动脉近分叉处剪下颈动脉,取0.5-0.6cm长,保留颈外动脉线结。
3)将颈动脉放入PBS中,用显微镊轻柔排干官腔内的残血。
4)将血管放入装有1mL 4%多聚甲醛的1.5mL EP管中固定。
2.病理学检测
2.1制备石蜡标本切片
由实验室专业病理工作人员制备石蜡标本切片,主要操作程序包括:4%多聚甲醛中隔夜固定后,将血管用滤纸小心包好,放入包埋框→流水冲洗→脱水→透明→浸蜡→包埋→切片(3μm)→摊片→晾干或烘烤后备用。
2.2EVG染色
主要步骤为:55℃烘烤30min→二甲苯5min,3次→100%酒精3min,2次→95%酒精3min,1次→70%酒精3min,1次→双蒸水1min→高锰酸钾溶液5min(珠海贝索,BA-4083B)→水洗1min→草酸溶液5min(珠海贝索,BA-4083B)→水洗1min→95%酒精分化2-3秒→Elastin染液(珠海贝索,BA-4083B)8-24小时→95%酒精迅速分化1s→流水冲洗10min→双蒸水1min→Van Gieson染液(珠海贝索,BA-4083B)1min→95%酒精迅速分化2-3s→100%酒精2min,2次→二甲苯2min,3次→趁二甲苯未干立即封片→通风橱内吹干,显微镜拍照。
以血管内弹力纤维和外弹力纤维为界,内弹力板以内为血管内膜,外弹力板以外为血管外膜,内外弹力板之间为血管中膜。用Image-Pro Plus 6.0软件分别圈各血管管腔面积。
内膜面积大小的计算参照公式如下:
新生内膜面积=内弹力板面积-管腔面积;
中膜面积=外弹力板面积-内弹力板面积。
小鼠EVG染色后的血管内膜新生的结果如图1。正常的血管壁结构完整,排列整齐,血管内膜为单层内皮细胞,结构完整,中膜平滑肌细胞排列整齐。通过HE染色观察到,血管损伤组(VI组)血管壁结构不完整,血管内皮细胞缺失,新生内膜增生明显,并伴有大量炎细胞浸润;Tollip-KO组在术后14、28天新生内膜面积明显比WT小鼠要增大。同样,内膜面积/中膜面积的比值在VI术后Tollip-KO组要高于WT组。这说明Tollip基因的缺失可以促进血管损伤后引起的内膜新生。
【实施例3】血管壁细胞增殖水平的检测
免疫荧光染色检测细胞增殖核抗原(Proliferating Cell Nuclear Antigen,PCNA)、细胞周期蛋白(CyclinD1)的表达。所需一抗信息:PCNA(#2586;1:100;mouse;Cell Signaling Technology),cyclin D1(#2978;1:25;rabbit;Cell Signaling Technology);所需二抗信息:Alexa Fluor 568-conjugated goat anti-rabbit IgG(A11011;Invitrogen,Carlsbad,CA),Alexa Fluor 568-conjugated goat anti-mouse IgG(A11004;Invitrogen,Carlsbad,150d,CA)。
主要步骤为:
1)烤片:将石蜡切片置于55℃烤箱中60min以上。
2)脱蜡:二甲苯8min×3。
3)水合:100%乙醇5min×2;95%乙醇5min;70%乙醇5min;ddH2O浸洗5min×2。
4)柠檬酸盐组织抗原修复(高压修复):取一定量的pH6.0柠檬酸盐抗原修复工作液(购自福州迈新生物科技有限公司,货号MVS-0100)于修复盒中,修复工作液的量必须能足够浸没整张切片,将修复盒放入已加入适量自来水的高压锅中,大火加热至沸腾,将脱蜡水合后的组织切片置于耐高温染色架上,再将染色架缓慢放入修复盒中,盖上锅盖,扣上压力阀,继续加热至喷气,开始计时5min后,压力锅断开电源,去阀开盖,取出修复盒;室温放置20min自然冷却后取出切片。
5)ddH2O漂洗5min×2次,PBS漂洗5min×2次。
6)组化笔划圈,滴加10%驴血清(GTX27481,GeneTex)封闭,于湿盒中37℃封闭60min。
7)弃封闭液,滴加适当比例稀释的一抗,4℃孵育过夜,37℃复温30min,弃去一抗,PBS洗8min×4次。
8)滴加二抗,于湿盒中37℃孵育60min,弃去二抗,PBS浸洗5min×4次。
9)SlowFade Gold antifade reagent with DAPI(S36939,Invitrogen)封片。
10)荧光镜下观察,拍照。若需保存,于暗湿盒中4℃保存。
荧光统计方法:PCNA免疫荧光染色统计采用IPP软件计数,PCNA阳性细胞百分比=PCNA阳性细胞个数/(内膜+中膜)的总DAPI个数*100%;CyclinD1免疫荧光染色统计采用IPP软件直接测阳性吸光度。
免疫荧光法观察平滑肌细胞增殖标志物PCNA、CyclinD1在WT和Tollip-KO小鼠血管损伤后的表达变化,结果见图2。PCNA、CyclinD1在血管组织中有表达,Tollip-KO小鼠在术后14、28天PCNA阳性细胞个数及CyclinD1的荧光强度均要增大于同组的WT小鼠,表明Tollip-基因敲除可以促进PCNA、CyclinD1的表达,可促进平滑肌细胞的增殖和血管内膜新生。
【实施例4】平滑肌细胞表型的检测
免疫荧光染色检测平滑肌细胞分化标志物:平滑肌细胞分化特异性抗原(smoothelin)、平滑肌肌动蛋白(Smooth Muscle Actin,SMA)、平滑肌22α(smooth muscle 22 alpha,SM22α)的表达。所需一抗信息:SMA(ab5694;1:100;rabbit;Abcam)and SM22α(ab14106;1:100;rabbit;Abcam);所需二抗信息:Alexa Fluor 488-conjugated goat anti-rabbit IgG(A11008;Invitrogen,Carlsbad,CA)。
主要步骤参照实施例3。
荧光统计方法:采用IPP软件直接测阳性吸光度。
在正常生理状态下,血管平滑肌细胞处于静止状态,主要表现为收缩型;血管损伤后,血管平滑肌细胞由中膜向内膜迁移,平滑肌细胞的增殖凋亡失去平衡,表型由收缩型向合成型转变,血管壁不适重塑,从而引起内膜增生。免疫荧光观察SMA、SM22α在WT和XX-KO小鼠血管损伤后的表达变化,结果见图3。Smoothelin、SMA、SM22α在血管组织中有表达,XX-KO小鼠在术后14、28天smoothelin、SMA、SM22α的荧光强度均要低于同组的WT小鼠,表明Tollip基因敲除可以抑制smoothelin、SMA、SM22α的表达,可促进平滑肌细胞由收缩型向合成型的表型转换,从而促进内膜增生。
以上述实施例结果显示,野生型小鼠和Tollip-KO小鼠在血管损伤模型(VI)的诱导下均发生血管损伤后再狭窄。Tollip基因敲除小鼠的内膜新生、细胞增殖水平以及平滑肌细胞表型转换均比野生型小鼠要显著。这些结果表明,Tollip可以改善血管损伤诱导的平滑肌细胞的增殖、表型转化和血管新生内膜形成。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!