DJ‑1在治疗或诊断成体神经干细胞损伤或异常分化所致疾病中的用途的制作方法
本发明涉及DJ-1的新的药理用途,尤其涉及DJ-1在治疗或诊断成体神经干细胞损伤或异常分化所致疾病中的用途,属于DJ-1的新医药用途领域。
背景技术:
帕金森病(Parkinson′s disease,PD)是严重影响人类健康的第二大神经退行性疾病,影响着全球数百万人的健康。PD是以黑质纹状体多巴胺能通路神经退行性病变为主要特征,伴随相应的四大运动障碍,包括静止性震颤、肌肉强直、运动迟缓和姿势步态异常。长期以来,临床上对PD的关注聚焦于它的运动症状,目前PD的治疗方法和手段包括药物治疗、手术治疗、运动疗法、心理疏导及照料护理等,其中,药物治疗为首选,且是整个治疗过程中的主要治疗手段,其目的是增加脑内多巴胺水平或提高多巴胺受体活性。手术治疗则是药物治疗的一种有效补充。目前应用的治疗手段,无论是药物或手术治疗,只能改善其主要的运动症状,但不能阻止其病情的发展,更无法治愈。近年来,越来越多的证据显示PD的临床表现谱更为广泛,除上述运动症状外还包括非运动症状(non-motor symptoms,NMS),如各种认知、精神、睡眠、自主和感觉功能障碍。一些NMS如嗅觉障碍、焦虑、抑郁以及学习记忆功能减退等会早发于经典的运动症状几年甚至十几年并贯穿疾病始终,称为先兆PD(prodromal PD)。其中嗅觉障碍是最早出现的NMS,被认为是PD运动症状期前的标志,最终可影响90%的患者。目前,NMS已是公认的PD症状的重要组成部分,也是导致患者残障和生活质量下降的主要原因。
PD一旦发生将随着时间的推移而渐进性加重,有证据显示在疾病早期阶段的病程进展较后期阶段要快。因此,早期诊断、尽早开始治疗、争取掌握疾病的修饰时机,对今后帕金森病的整个治疗成败起关键性作用。由于上述NMS出现在PD发病的起始阶段,所以对PD的早期诊治有着重要的意义,但目前临床上对此类症状的治疗效果欠佳。已有研究表明,PD的这些早发的NMS与嗅球(Olfactory Bulb,OB)和海马的功能密切相关,而且这些症状的发生与存在于这两个脑区的成体神经干细胞微生境——侧脑室室管膜下区(Subventricular Zone,SVZ)/OB和海马齿状回颗粒下层(Subgranular,SGZ)出现的成体神经发生的异常变化相平行。正常的嗅觉以及认知和学习记忆功能依赖于OB和海马内的成体神经干细胞的持续的增殖和分化成成熟的神经元,以维持正常神经元的数量。由此可见,PD的NMS发生与成体神经发生有着紧密的联系。可以通过有效调控这两个脑区的内源性成体神经干细胞的增殖与分化,功能性修复受损变性神经元,实现疾病的精准个体化自身治愈过程。
成体神经干细胞在大多数时间处于静止状态,保持着低代谢率。尽管在受损和病理状态下,成体神经干细胞反应性增殖和分化,但只有很少一部分进入分化阶段,大部分新生细胞死亡。而能进入神经网络的新生神经元也只占很小的一部分,其他的则分化成为星形胶质细胞和少突胶质细胞。近年来,研究者采取多种干预手段调节不同脑实质损伤情况下内源性成体神经干细胞的增殖及分化以期达到更好的治疗效果。
DJ-1/PARK7基因最早是在1997年被发现,被认为是一种丝裂原依赖性癌基因(Nagakubo D,Taira T,Kitaura H,Ikeda M,Tamai K,Iguchi Ariga S M,et al.DJ-1,a novel oncogene which transforms mouse NIH3T3cells in cooperation with ras[J].Biochem Biophys Res Commun,1997,231:509-513.)。它的表达产物DJ-1是一种多功能蛋白,涉及多种细胞过程,包括抗氧化应激、蛋白酶活性、转录调节和信号通路调节、分子伴侣以及肿瘤生成和迁移,其功能性突变可导致常染色体隐性遗传早发家族性PD的发生。DJ-1以同型二聚体的形式广泛存在于哺乳动物的组织中。在脑内,DJ-1在基底节、丘脑、小脑、海马、皮质回路以及嗅球中表达较高。在亚细胞水平,DJ-1主要分布在细胞质,在线粒体和细胞核也有一定的分布。目前已报道的研究认为,DJ-1主要是通过保护线粒体功能和抑制氧化应激损伤而发挥神经保护作用。DJ-1基因发生突变(如L166P和M26I),迁移至线粒体的DJ-1蛋白即为无效的单体,或者其他原因引起DJ-1蛋白功能缺失时,可导致线粒体膜电位降低以及线粒体片段化等,也会使线粒体产生功能障碍或者引发氧化应激;DJ-1蛋白可通过自身氧化、阻止细胞凋亡而发挥保护细胞免受氧化应激损伤的作用。而迄今为止,尚未有文献报道DJ-1能够调节成体神经干细胞的增殖和分化,以抵抗成体神经干细胞损伤或分化异常,更未有报道DJ-1能够应用于治疗或诊断成体神经干细胞损伤或异常分化所致疾病。
技术实现要素:
本发明所要解决的主要技术问题是提供一种治疗或诊断由成体神经干细胞损伤或异常分化所致疾病的药物或试剂。
为解决上述技术问题,本发明所采取的技术方案是:
本发明首先构建了1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的PD小鼠模型,通过实验观察发现,在MPTP诱导的PD小鼠模型大脑的海马齿状回颗粒下层(Subgranular Zone,SGZ)和侧脑室的室脑膜下区(Subventricular Zone,SVZ)的增殖的细胞(BrdU+)中,细胞核内DJ-1水平增加,而BrdU+的数量保持不变,这说明了DJ-1的核转位维持了正常的神经发生。在嗅球(Olfactory Bulb,OB)区,BrdU+细胞中并没有出现DJ-1的核转位,提示了DJ-1的核转位可能仅发生于神经发生的早期,而随着细胞的分化迁移将逐渐消失。
本发明的实验中采用了MPTP诱导的动物模型。MPTP是一种神经毒素,它穿过血脑屏障后会被星形胶质细胞和5-羟色胺能神经元内的单胺氧化酶B作用,代谢成有毒性的1-甲基-4-苯基吡啶(MPP+),释放到细胞外后不能穿越血脑屏障。MPP+与多巴胺转运体高度亲和,可由此进入多巴胺能神经元,直接破坏大脑特别是黑质中多巴胺能神经元。该模型在神经生化和运动行为学表现方面都与PD极其相似,是目前研究PD最理想的动物模型。
此外,本发明还发现迁移到嗅小球层的BrdU+数量增多,而且在一些BrdU-的球旁细胞中发现了DJ-1的核转位,这些实验结果说明DJ-1通过核转位也可能保护了嗅小球层的非增殖细胞的功能。
本发明发现MPTP并未影响小鼠大脑SGZ区BrdU+阳性细胞数,进一步发现DJ-1转移到了SGZ和SVZ的BrdU+细胞的细胞核,这表明DJ-1的核转位保持了增殖细胞(即成体神经干细胞)的数量以抵抗MPTP引起的神经元损伤,是机体的一种自我修复机制。在成年的大脑中,SVZ的成体神经干细胞可经过早期的增殖分化生成神经祖细胞,并沿吻侧迁移流(rostral migratory stream,RMS)输入OB的中心区域——颗粒细胞层,再进一步分化、成熟、迁移到OB的其他区域。正常嗅觉功能取决于新生神经元的持续性输入。本发明发现在MPTP组OB的颗粒细胞层和嗅小球层BrdU+细胞中并没有发现DJ-1的核转位,说明DJ-1的核转位发生在了成体神经干细胞增殖分化的早期。本发明还发现,在OB的嗅小球层部分BrdU-细胞中出现DJ-1的核转位,这可能与上述其他区域的核转位的发生依赖于不同的机制。
本发明认为通过注射MPTP建立急性PD模型激活了DJ-1参与的自我修复机制,维持了正常的神经发生,SGZ和SVZ/OB依靠不断产生新生神经元以维持正常生理功能,而这两个脑区与PD非运动症状密切相关。
综合本发明的上述实验成果,DJ-1可具有以下几方面的用途:
首先,DJ-1可制成治疗或诊断成体神经干细胞损伤或异常分化所致疾病的药物或试剂;其中,所述的成体神经干细胞损伤或异常分化所致疾病包括帕金森病;优选的,所述的帕金森病是帕金森病的非运动症状。例如,可以将DJ-1构建到腺病毒载体等基因治疗载体中制备得到基因治疗药物,该基因治疗药物可以有效的治疗成体神经干细胞损伤或异常分化所导致的疾病,尤其是对于帕金森病的非运动症状具有非常好的疗效。现有的治疗帕金森病的药物大多对于帕金森病的非运动症状疗效不佳,本发明将对于帕金森病的非运动症状的临床治疗具有重要的意义。
另外,可以将DJ-1应用于诊断成体神经干细胞损伤或异常分化所致疾病,尤其是应用诊断早期帕金森病。例如,可以将DJ-1蛋白制成抗体,通过免疫组织化学分析等手段,对早期帕金森病进行准确的诊断。也可以DJ-1为靶基因设计引物,通过定量PCR方式对检测样品中的DJ-1的表达水平进行检测,进而达到诊断早期帕金森病的目的,由此,本发明提供了以下各种检测试剂盒:
一种用于诊断成体神经干细胞损伤或异常分化所导致疾病的检测试剂盒,该检测试剂盒中含有DJ-1蛋白或用DJ-1蛋白所制备的抗体。
一种用于诊断成体神经干细胞损伤或异常分化所致疾病的检测试剂盒,该检测试剂盒中含有DJ-1蛋白编码基因或含有扩增DJ-1蛋白编码基因的引物。
附图说明
图1本发明的实验流程示意图以及SGZ和SVZ区中BrdU+细胞数量统计结果;A:实验流程示意图;B:SGZ和SVZ区中BrdU+细胞数量统计结果,与生理盐水组比较p>0.05(n=5)。
图2 MPTP诱导了SGZ区和SVZ区BrdU+细胞及OB嗅小球层BrdU-细胞中DJ-1核转位实验结果;SGZ(A),SVZ(B),OB的颗粒细胞层(D)和OB的嗅小球层(E)的免疫荧光染色成像;下方4张图像为上方图中白色方框区域的放大图像;红色荧光标记BrdU,绿色荧光标记DJ-1,蓝色荧光标记细胞核,第4列图像为前3者的重叠,白色箭头指示的DJ-1核转位。C:OB的尼氏染色结果,右图为左图中方框区域的放大图像,显示OB的颗粒细胞层。
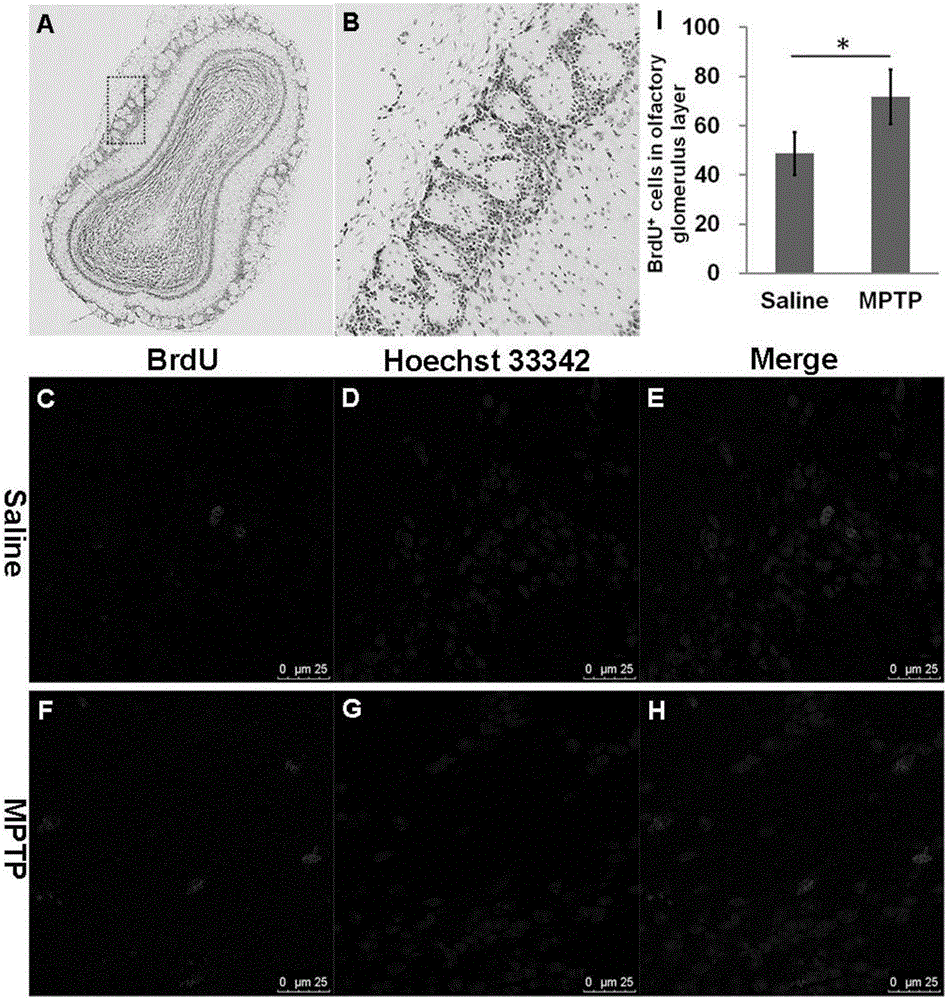
图3 MPTP增加了BrdU+细胞向OB的嗅小球层区域迁移;A:OB冠状切片的尼氏染色;B:A图中的黑框内嗅小球层区域放大图像;C~H:脑组织切片进行免疫荧光染色;红色荧光标记BrdU,蓝色荧光标记细胞核,第3列图像为前2者的重叠;I:嗅小球层区BrdU+细胞数量的统计分析,*与生理盐水组比较p<0.05(n=5)。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
1实验方法
1.1动物分组及处理
20只10周龄的C57BL/6小鼠随机分为生理盐水对照组和MPTP处理组。MPTP处理组每次腹腔注射20mg/kg MPTP,共4次,间隔2小时,生理盐水对照组腹腔注射等体积的生理盐水。14天后处死取脑,处死前24小时腹腔注射150mg/kg 5-溴脱氧尿嘧啶核苷(BrdU)用于标记增殖的成体神经干细胞(图1A)。
1.2脑冰冻切片的制备
腹腔注射60mg/kg戊巴比妥钠麻醉小鼠。经心脏灌流40ml PBS后再灌流40ml 4%多聚甲醛。取出小鼠大脑置于4%多聚甲醛中固定12小时,然后分别用20%和30%的梯度蔗糖溶液脱水,在干冰中快速冷冻后用OCT包埋制备连续冰冻冠状切片,厚度为20μm。
1.3免疫荧光染色
每6张连续切片取1张进行免疫荧光染色,每只取8张,每组5只,观察在SGZ、SVZ和OB区的BrdU+的数量以及DJ-1在BrdU+细胞中的分布情况。染色前先对脑组织切片进行DNA变性处理:1N HCl冰上孵育10min后再用2N HCl室温孵育10min,然后置于37℃孵箱继续孵育20min,随后用0.1M的硼酸盐缓冲液室温孵育10min,最后用含0.1%Triton X-100的PBS清洗3次,每次10min。接下来进行免疫荧光染色。先用含10%的正常羊血清和0.3%Triton X-100的PBS在37℃封闭1小时,然后用抗BrdU抗体和抗DJ-1抗体(溶于含2%的正常羊血清和0.3%TritonX-100的PBS)4℃孵育过夜。用PBS清洗3遍后,用Alexa555标记的羊抗大鼠lgG和Alexa488标记的羊抗兔lgG(溶于含2%的正常羊血清和0.3%Triton X-100的PBS)37℃孵育1小时。用PBS清洗3遍后,Hoechst 33342(5μg/ml)室温孵育5min标记细胞核。最后用防荧光淬灭封片剂封片。染色完成后利用荧光共聚焦扫描显微镜SP8-Confocal-MP-FLIM进行观察。
1.4统计分析
数据用mean±SD表示。利用统计软件SPSS 22对组间差异进行单因素方差分析检测,p<0.05被认为具有统计学差异。
2实验结果
2.1MPTP处理组的小鼠大脑SGZ和SVZ区中BrdU+细胞数量保持不变
BrdU作为胸腺嘧啶脱氧核苷的类似物可以掺入到处于细胞周期S期的增殖细胞的DNA中,通过荧光标记BrdU以识别增殖的细胞。实验结果显示,与生理盐水对照组(SGZ:203±30.05;SVZ:80.00±7.00)相比MPTP处理组(SGZ:187.33±27.21;SVZ:74.00±8.89)的小鼠大脑SGZ区中BrdU+细胞数量没有显著差异(SGZ:p=0.54;SVZ:p=0.41,n=5)(图1B)。
2.2MPTP处理后的DJ-1核转位情况
本实验观察了在SGZ、SVZ和OB区BrdU+细胞中的DJ-1亚细胞分布。免疫荧光染色结果发现,MPTP处理14天后在BrdU+细胞(红色)中DJ-1(绿色)表达增加区域与核区(蓝色)重叠,提示BrdU+细胞中DJ-1发生了核转位(图2A和B)。在OB颗粒细胞层(图2C,尼氏染色指示颗粒细胞层位置)的BrdU+细胞中未发现DJ-1核转位(图2D)。但在OB的嗅小球层发现,DJ-1在部分BrdU-细胞中发生了核转位(图2E)。
2.3MPTP增加了BrdU+细胞向OB的嗅小球层区域迁移
免疫荧光染色结果发现,与生理盐水对照组(48.67±8.62)相比,MPTP处理组(71.67±11.15)中BrdU+细胞(红色)向OB的嗅小球层迁移的数量显著增加(p=0.048,n=5)(图3)。
- 还没有人留言评论。精彩留言会获得点赞!