一种骨髓支撑装置的制作方法
本发明涉及医疗器械技术领域,特别是涉及一种骨髓支撑装置。
背景技术:
目前骨折事故呈上升趋势,通过手术接骨治疗是最主要的治疗骨折的手段。对于粉碎性骨折而言,由于骨折块数比较多,现有技术中通过固定板固定骨折位置操作难度大,并且在骨腔内的骨髓也容易流失,导致骨头再生慢,患者的恢复期时间长,恢复效果不好。
技术实现要素:
本发明的目的是提供一种骨髓支撑装置,在骨折治疗时,一方面用于骨髓的收集,另一方面对碎骨实现支撑,方便接骨手术的操作。
为解决上述技术问题,本发明采用的一个技术方案是:一种骨髓支撑装置,包括呈圆筒形的支撑本体,所述支撑本体的筒壁厚度为0.3mm~0.6mm,所述支撑本体的筒壁上均布有通孔,所述通孔为菱形通孔,所述支撑本体的筒内还设置有用于调整所述支撑本体直径大小的撑缩机构。
可选的,所述撑缩机构包括撑设在所述支撑本体筒内壁上的沿所述支撑本体周向均布的撑杆,以及驱动所述撑杆在所述支撑本体的径向上移动、以调节所述支撑本体直径的调节组件。
进一步的,所述调节组件包括与所述撑杆的下端固设的具有中空结构的基台,所述基台的外周面旋设有调节螺母,所述撑杆的下部逐渐向内收缩围成上大下小的锥面,所述调节螺母的上端与所述锥面压紧配合。
可选的,所述撑杆的上端与所述支撑本体筒内壁固连。
优选的,所述支撑本体和所述撑缩机构均采用可生物降解医用植入体材料,所述材料由镁合金基体和涂设在所述镁合金基体外表面的掺锶羟基磷灰石涂层构成;所述镁合金基体由组分Mg、Ca、Sr和Zn组成,各组分的重量百分比含量分别为:Ca 0.25%、Sr 0.35%、Zn 2.65%、余量的Mg;所述掺锶羟基磷灰石涂层的涂设厚度为0.1mm~0.3mm,掺锶羟基磷灰石涂层中Sr的重量百分比含量为8%~12%。
作为本发明的一个较佳的实施方式,所述材料通过包括以下步骤的制备方法制得:
S1:采用井式坩埚电阻炉,在混合气体保护下熔炼制备Mg-Zn-Ca-Sr合金,首先将坩埚预热至700~720℃,然后加入高纯镁锭,之后升温至750℃,保温条件下加入预热到220~260℃的高纯钙,静置5min后搅拌、扒渣,然后降温至720℃,加入高纯锌粒,静置3min后搅拌、扒渣,之后再加入高纯锶,然后升温至760~800℃,熔炼10~15min,熔炼得到的熔体静置5~10分钟,然后浇铸在预热到300℃的模具中,浇铸后1h取出,空冷,得到Mg-Zn-Ca-Sr合金,所述Mg-Zn-Ca-Sr合金中各组分的重量百分比含量分别为:Ca 0.25%、Sr 0.35%、Zn 2.65%、余量的Mg;
S2:将制得的所述Mg-Zn-Ca-Sr合金进行热处理,热处理采用箱式电阻炉,热处理过程中将所述Mg-Zn-Ca-Sr合金用铝箔包裹埋入分析纯的石墨粉中,热处理升温速率为3℃/min,升温至380℃后保温均匀化处理10h,之后降至200~300℃,采用热挤压机挤压成型,保温时间50分钟,挤压比12:1,挤压压头下降速度为3mm/s,制得镁合金基体;
S3:将制得的镁合金基体表面用砂纸打磨,然后放入丙酮溶液中超声波清洗5~10分钟,再用去离子水冲洗干净,烘干备用;
S4:打磨烘干后的镁合金基体作为阴极,铂作阳极,在所述打磨烘干后的镁合金基体外表面电沉积制备掺锶羟基磷灰石涂层,采用的电解液中SrCl2的浓度为1.5~3.4mmol/L、CaCl2的浓度为1.4~3.3mmol/L、NH4H2PO4的浓度为2.5~3.0mol/L,电沉积反应电压为3.0~3.5V,反应温度为50~65℃,反应时间为0.5~3小时,得到涂设有掺锶羟基磷灰石涂层的镁合金,掺锶羟基磷灰石涂层的涂设厚度为0.1mm~0.3mm,掺锶羟基磷灰石涂层中Sr的重量百分比含量为8%~12%。
优选的,所述掺锶羟基磷灰石涂层的涂设厚度为0.25mm。
优选的,所述掺锶羟基磷灰石涂层中Sr的重量百分比含量为10%。
优选的,所述混合气体为氩气和SF6的混合气体,所述混合气体中SF6的体积比为5%。
优选的,所述电解液中还添加有NaCl,NaCl的浓度为0.1mol/L。
本发明提供的骨髓支撑装置,在骨折治疗时,一方面用于骨髓的收集,另一方面对碎骨实现支撑,方便接骨手术的操作。具体的,在粉碎性骨折手术中,将该支撑装置放入到骨折位置处,支撑装置的支撑本体上端与骨折位置上端骨头衔接,将粉碎性骨折的骨片固定在支撑本体的外周面上,将骨髓放置到支撑本体的中空腔内,首先骨髓不会流失,保证了骨髓的完整性,其次由于支撑本体的筒壁上设置有通孔,支撑本体内的骨髓能够与外周面的骨片连接,促进了骨头生长和骨块的愈合,骨头再生快,缩短了恢复期,恢复效果良好。
本发明提供的骨髓支撑装置,其支撑本体的筒壁厚度薄,只有0.3mm~0.6mm,且支撑本体的筒壁上均布有菱形通孔,由于菱形孔在受到剪切力后更容易发生弹性形变,因此增大了支撑本体的弹性,可以适用于不同大小的骨骼。支撑本体的筒内还设置有用于调整所述支撑本体直径大小的撑缩机构,能够将支撑本体撑开或收缩,以适应骨折位置骨头的粗细不同,进一步增加了适用性,并且方便调整,便于接骨手术的操作。
本发明提供的骨髓支撑装置,其采用的材料可体内生物降解,不用取出,减少了患者的痛苦。此外,本发明提供的骨髓支撑装置采用的材料通过合理的成分设计,以及加工制备工艺,制得的可生物降解医用植入体材料具有合适的力学性能和优异的耐腐蚀性能。经研究发现,合金元素对镁合金的力学性能及耐腐蚀性能影响较大。适量的Zn元素可以改善镁合金的力学性能,微量的Ca元素能够显著细化镁合金的显微组织,提高镁合金的力学性能,增加镁合金的抗腐蚀性能。适量的锶元素则能够提高成骨细胞的活性,加快骨组织愈合。通过在镁合金基体外表面涂设掺锶羟基磷灰石涂层,可以进一步提高材料的耐腐蚀性能,同时显著改善材料的生物相容性。本发明提供的骨髓支撑装置采用的材料力学性能和耐腐蚀性能好,含锶的羟基磷灰石涂层对合金起到了一定的保护防腐蚀作用,提高了合金的耐腐蚀性能,同时渗出的锶元素能够提高骨形成能力,帮助患者恢复骨折,缩短修复期。经动物体内相容性试验表明,本发明骨髓支撑装置采用的材料还具有良好的组织相容性。植入体内1个月后,无炎症反应,出现纤维包被和新生骨组织;植入2个月后,出现大量新生骨小梁,骨生长活跃。植入体与骨组织结合良好。
附图说明
图1是本发明的骨髓支撑装置实施例中支撑本体的结构示意图;
图2是本发明的骨髓支撑装置实施例的剖视图;
图3是本发明的骨髓支撑装置实施例中撑缩机构的结构示意图。
具体实施方式
在本发明的具体实施方式的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”等的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,除非另有说明,“多个”的含义是指两个或两个以上。本说明书所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解。例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以通过具体情况理解上述术语在本发明中的具体含义。
为了便于理解本发明,下面结合附图和具体实施例,对本发明进行更详细的说明。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本说明书所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
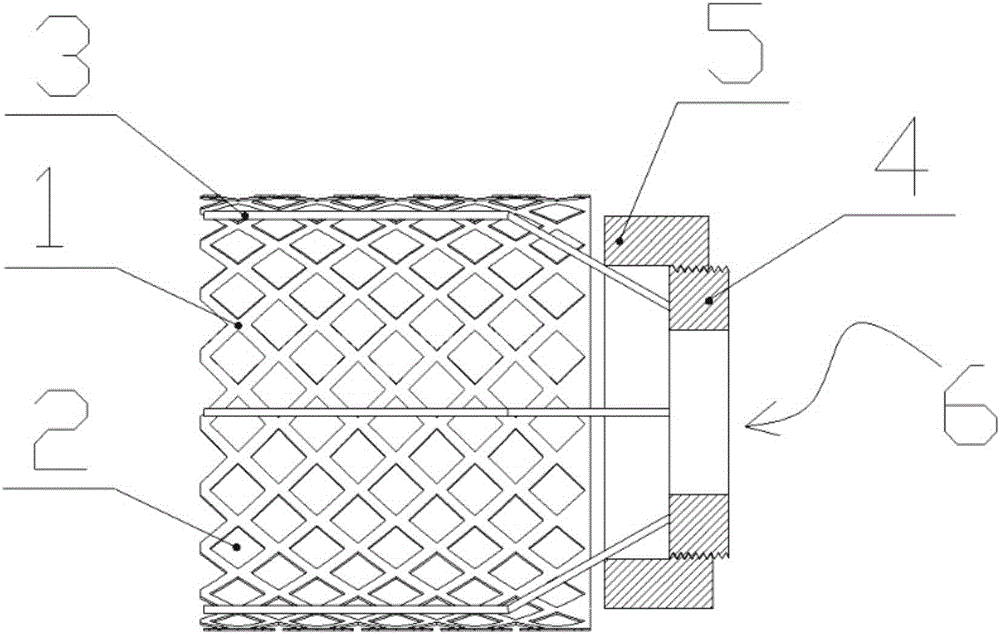
如图1-图3所示,本发明提供的一种骨髓支撑装置的实施例,包括呈圆筒形的支撑本体1,支撑本体1的筒壁厚度为0.3mm~0.6mm,支撑本体1的筒壁上均布有通孔2,通孔2为菱形通孔,支撑本体1的筒内还设置有用于调整支撑本体1直径大小的撑缩机构7。
本发明提供了一种撑缩机构7的实施例,结构简单,方便操作。具体的,撑缩机构7包括撑设在支撑本体1筒内壁上的沿支撑本体1周向均布的撑杆3(撑杆3至少有3根),以及驱动撑杆3在支撑本体1的径向上移动、以调节支撑本体1直径的调节组件。具体的,调节组件包括与撑杆3的下端固设的具有中空结构的基台4,基台4的外周面上旋设有调节螺母5,基台4与调节螺母5之间螺纹配合设置,撑杆3的下部逐渐向内收缩围成上大下小的锥面,调节螺母5的上端与该锥面压紧配合。当调节螺母5向该锥面方向旋拧时,调节螺母5的上端会进一步压紧该锥面,从而使各个撑杆3向内收缩,此时支撑本体1的筒内径相应减小,相反,当调节螺母5向远离该锥面的方向旋拧时,调节螺母5的上端对该锥面的压紧力减小,从而使各个撑杆3向外扩张,此时支撑本体1的筒内径相应增大。优选的,撑杆3的上端与支撑本体1筒内壁固连,可以使撑杆3的径向运动与支撑本体1的筒内径变化趋于一致。
采用本实施例提供的骨髓支撑装置,在粉碎性骨折手术中,将该支撑装置放入到骨折位置处,支撑装置的支撑本体1上端与骨折位置上端骨头衔接,将粉碎性骨折的骨片固定在支撑本体1的外周面上,将骨髓放置到支撑本体1的中空腔内,支撑本体1中空腔内的骨髓可以与骨折位置上端骨头内的骨髓连通,支撑本体1中空腔内的骨髓还可以通过中空结构的基台4中心具有的圆孔6与骨折位置下端骨头内的骨髓连通,骨髓不会流失,保证了骨髓的完整性,其次由于支撑本体的筒壁上设置有通孔,支撑本体内的骨髓还能够与外周面的骨片连接,促进了骨头生长和骨块的愈合,骨头再生快,缩短了恢复期,恢复效果良好。
本实施例提供的骨髓支撑装置,其支撑本体1的筒壁厚度薄,只有0.3mm~0.6mm,且支撑本体1的筒壁上均布有菱形通孔2,由于菱形孔在受到剪切力后更容易发生弹性形变,因此增大了支撑本体1的弹性,可以适用于不同大小的骨骼。支撑本体1的筒内还设置有用于调整支撑本体1直径大小的撑缩机构7,能够将支撑本体1撑开或收缩,以适应骨折位置骨头的粗细不同,进一步增加了适用性,并且方便调整,便于接骨手术的操作。
进一步的,支撑本体1和撑缩机构7均采用可生物降解医用植入体材料,该材料由镁合金基体和涂设在镁合金基体外表面的掺锶羟基磷灰石涂层构成;镁合金基体由组分Mg、Ca、Sr和Zn组成,各组分的重量百分比含量分别为:Ca 0.25%、Sr 0.35%、Zn 2.65%、余量的Mg;掺锶羟基磷灰石涂层的涂设厚度为0.1mm~0.3mm,掺锶羟基磷灰石涂层中Sr的重量百分比含量为8%~12%。
优选的,材料通过包括以下步骤的制备方法制得:
S1:采用井式坩埚电阻炉,在混合气体保护下熔炼制备Mg-Zn-Ca-Sr合金,混合气体为氩气和SF6的混合气体,混合气体中SF6的体积比为5%;首先将坩埚预热至700~720℃,然后加入高纯镁锭,之后升温至750℃,保温条件下加入预热到220~260℃的高纯钙,静置5min后搅拌、扒渣,然后降温至720℃,加入高纯锌粒,静置3min后搅拌、扒渣,之后再加入高纯锶,然后升温至760~800℃,熔炼10~15min,熔炼得到的熔体静置5~10分钟,然后浇铸在预热到300℃的模具中,浇铸后1h取出,空冷,得到Mg-Zn-Ca-Sr合金,该Mg-Zn-Ca-Sr合金中各组分的重量百分比含量分别为:Ca 0.25%、Sr 0.35%、Zn 2.65%、余量的Mg;
S2:将制得的Mg-Zn-Ca-Sr合金进行热处理,热处理采用箱式电阻炉,热处理过程中将所述Mg-Zn-Ca-Sr合金用铝箔包裹埋入分析纯的石墨粉中,热处理升温速率为3℃/min,升温至380℃后保温均匀化处理10h,之后降至200~300℃,采用热挤压机挤压成型,保温时间50分钟,挤压比12:1,挤压压头下降速度为3mm/s,制得镁合金基体;
S3:将制得的镁合金基体表面用砂纸打磨,然后放入丙酮溶液中超声波清洗5~10分钟,再用去离子水冲洗干净,烘干备用;
S4:打磨烘干后的镁合金基体作为阴极,铂作阳极,在打磨烘干后的镁合金基体外表面电沉积制备掺锶羟基磷灰石涂层,采用的电解液中SrCl2的浓度为 1.5~3.4mmol/L、CaCl2的浓度为 1.4~3.3mmol/L、NH4H2PO4的浓度为 2.5~3.0mol/L、NaCl的浓度为0.1mol/L(添加NaCl可以增大电解液的电导率),电沉积反应电压为3.0~3.5V,反应温度为50~65℃,反应时间为0.5~3小时,得到涂设有掺锶羟基磷灰石涂层的镁合金,掺锶羟基磷灰石涂层的涂设厚度为0.1mm~0.3mm,掺锶羟基磷灰石涂层中Sr的重量百分比含量为8%~12%。
优选的,掺锶羟基磷灰石涂层的涂设厚度为0.25mm。掺锶羟基磷灰石涂层中Sr的重量百分比含量为10%。在该条件下,得到的材料的耐腐蚀性能更佳,同时渗出的锶元素可明显提高骨形成能力,帮助患者恢复骨折,缩短修复期。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构变换,或直接或间接运用在其他相关的技术领域,均包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!