一种玻璃海鞘多肽的应用的制作方法
本发明属于生化与生物医药领域,具体的说是一种玻璃海鞘多肽的应用。
背景技术:
恶性肿瘤是人类健康的第一杀手,其发病率和致死率均居各中疾病之首。抗癌药物的研究和开发已成为本世纪新药研究的重大课题。从海洋中分离纯化抗肿瘤活性物质已经成为抗癌药物研究的热点之一。我们在筛选抗肿瘤药物过程中发现从玻璃海鞘中分离纯化的一种多肽(PI5931)具有很强的抑制肿瘤细胞生长的作用,对发展成为新的抗癌药物具有很大潜力。
海鞘(Ascidian)属于脊索动物门(Chordates),尾索动物亚门(Urochordata),海鞘纲(Ascidiacea),全世界大约有1600种。从中发现了许多具有新的结构和生物学功能的环肽、线性肽及desipeptides。Didemnins(膜海鞘素)最早是从加勒比海鞘中分离的,是desipeptides的家族,具有抗肿瘤,抗病毒和免疫抑制作用,其中Didemnins B是抗肿瘤活性最强的环肽(体外对L1210的IC50为2.5ng/ml),也是第一种进入临床试验的海洋天然产物。由两种海鞘Didemnum cuculiferum和Polysyncranton lithostrotum中发现的一种13个氨基酸的环肽可显著抑制微管聚合,并能延长小鼠p388淋巴细胞白血病的生存期;但由玻璃海鞘(Ciona intestinalis)中分离出抗肿瘤蛋白一直未见报道。
玻璃海鞘属于内性目、玻璃海鞘科,为我国北方海水养殖产业的主要生物污染物,国内有关玻璃海鞘的研究仅仅局限于胚胎发育,生理生化,脂肪酸提取上。董平原等从玻璃海鞘中分离得到了一种具有抗新生血管生成活性和抗肿瘤作用的玻璃海鞘多肽BLF-2,对斑马鱼胚胎血管生成具有显著的抑制活性,对人脐静脉内皮细胞的迁移和管腔形成具有显著的抑制作用。
由玻璃海鞘中提取分离出抗肿瘤多肽一直未见报道,本发明采用多种分离纯化手段从玻璃海鞘中分离得到一种新的具有抗肿瘤作用的多肽PI10,实验证实,该多肽在体外具有诱导人肝癌细胞株BEL-7402凋亡的活性,并对多种肿瘤细胞均具有良好的细胞毒活性。与现有的化疗药物相比,抗肿瘤多肽类药物具有毒副作用小、不易产生耐药性等优点,有望成为新型的抗肿瘤药物。
技术实现要素:
本发明目的在于提供一种玻璃海鞘多肽的应用。
为实现上述目的本发明采用的技术方案为:
玻璃海鞘多肽的应用:玻璃海鞘多肽在制备抗肿瘤药物中的应用。
所述玻璃海鞘多肽在制备抗人肺癌细胞、人宫颈癌上皮细胞、人肝癌细胞、人结肠癌细胞、人乳腺癌细胞和人神经胶质瘤细胞药物中的应用。
所述玻璃海鞘多肽按如下方法制备
1)将新鲜的海鞘通过有机溶剂以4-20℃进行沉淀提取1-3次,沉淀物通过滤膜进行超滤截留大于5KDa物质,待用;
2)将上述截留大于5KDa物质,以0.05-0.5M的NaCl缓冲液作为洗脱液进行DEAE阴离子交换柱层析,收集0.15M NaCl缓冲液洗脱组分,待用;
3)将上述收集的洗脱组分经Superdex75分子筛凝胶层析,用超纯水做洗脱液,流速为0.8-1.2ml/min,收集洗脱组分,待用;
4)将上述洗脱组分经HPLC C-18反相柱分离纯化,洗脱液为A液和B液,进行梯度洗脱,起始洗脱液中A液占总洗脱液体积的90%,B液占总洗脱液体积的10%,B液每分钟1%的速率上升,流速为0.5-0.8ml/min,当B液占总洗脱液体积的28.4%时出现活性组分,即得到N-末端序列为YQPDKFMLRGELRNN,分子量为5931Da的单一组分玻璃海鞘多肽;其中A液为A液总体积0.1%的TFA和A液总体积99.9%的超纯水,B液为B液总体积0.1%的TFA和B液总体积99.9%的乙腈。
所述步骤1)通过有机溶剂沉淀时采用体积百分含量为10%-90%的丙酮水溶液,并且每次沉淀时间为12小时。
所述步骤1)通过有机溶剂沉淀时采用体积百分含量为60%-80%的丙酮水溶液。
本发明所具有的优点:
1.本发明中涉及的多肽是一种海洋来源的物质,由于海洋生态环境的特殊性,使得海洋生物具有某些陆上生物所没有的活性物质,这些活性物质往往具有结构新颖、高活性、耐药性低等特点,可以为新药研究和开发提供模式结构和医药前体。
2.该多肽在提取过程中经过了70℃高温加热,加热后仍保持活性不变说明该多肽具有热稳定性,将来制成药后能延长药品的货架寿命。
3.本发明将玻璃海鞘多肽经MTT测定、扫描电镜观察、细胞核染色观察、线粒体膜电位变化等体内外方法证明了该多肽对多种肿瘤细胞具有显著的抗肿瘤作用,可引起肿瘤细胞凋亡,其诱导机理系通过细胞凋亡途径,说明了此玻璃海鞘多肽在预防和治疗肿瘤方面的作用和新途径。具体地说,就是通过体外实验阐明了玻璃海鞘多肽诱导细胞凋亡的途径,确定此多肽在恶性肿瘤的预防和治疗方面的用途。
附图说明
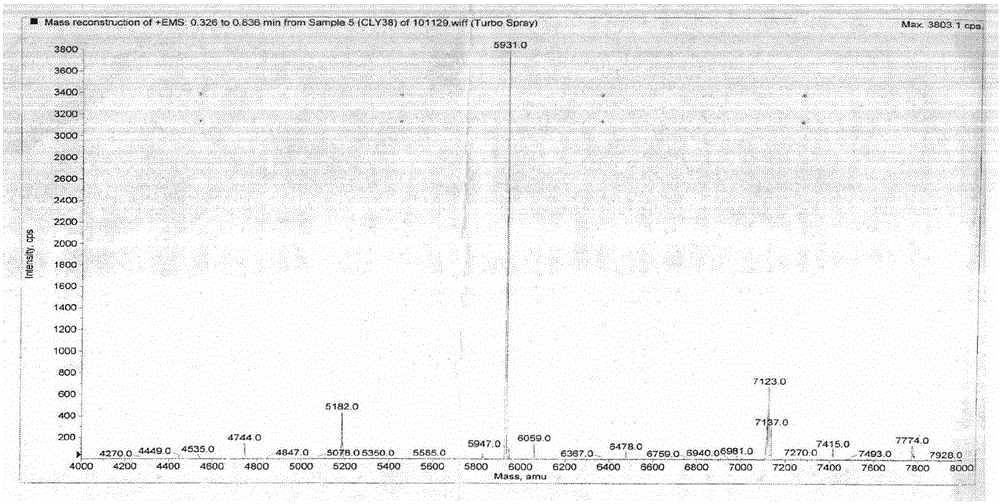
图1为本发明实施例提取的多肽PI5931用ABI公司的Q Trap离子喷雾质谱仪(Applied Biosystems,Foster City,CA,USA)以增强的方式测定其分子量。质谱仪配以TurbolonSpray source并以阳离子模式操作
图2为本发明实施例提取的多肽PI5931的Tricine-SDS-Page电泳分析图。
图3为本发明实施例提取的多肽PI5931处理BEL-7402癌细胞,扫描电镜下正常细胞与细胞凋亡形态变化。(其中图3A为正常细胞,图3B为处理12小时后细胞)
图4为抗肿瘤多肽PI5931处理BEL-7402癌细胞,DAPI染色,观察凋亡小体的出现。(其中1.正常细胞2.PI5931处理12小时3、PI5931处理18小时,4.PI5931处理24小时(可清晰看见凋亡小体))
图5为抗肿瘤多肽PI5931处理BEL-7402癌细胞,AO/EB染色观察凋亡细胞细胞核颜色变化图。
具体实施方式
实施例1
玻璃海鞘多肽的制备方法:
1)丙酮沉淀制备粗提物:取新鲜海鞘洗净、粉碎、分散匀浆机匀浆,在70℃下加热30min,而后以10000rpm,离心20min,得上清,上清液中加入清液体积三倍的体积百分含量为70%的丙酮,在4℃静置过夜;静置过夜后以1000rpm离心20min,取沉淀。沉淀重新溶解后通过5KDa的滤膜进行超滤截留,保留大于5KDa的部分,待用。
2)DEAE SepharoseTMFast Flow阴离子交换柱层析:
首先,将粗提物装入分子截留量为3.5kD的透析袋,采用纯水进行初步透析,而后将其对起始缓冲溶液充分透析;将透析好的样品取出,10000rpm离心去除不溶物,准备上柱;起始缓冲溶液为0.02M Tris-Cl,pH8.0。
其次,取适量的DEAE SepharoseTMFast Flow填料(GE公司生产),加入超纯水中,用玻璃棒轻微搅拌均匀后,玻璃棒引流,装入16×26规格的层析柱,用起始缓冲溶液平衡3-4个柱体积,基线稳定后方可使用。
再次,将样品上柱后,用起始缓冲溶液冲洗,待不挂柱蛋白完全穿透后,开始洗脱,洗脱液为Tris-Cl、NaCl溶液,即在起始缓冲液的基础上,分别配制0.05M、0.1M、0.15M、0.2M、0.3M和0.5MNaCl溶液,而后进行分步洗脱,流速为5ml/分钟,整个层析过程采用280nm检测蛋白质洗脱峰。
最后,将由六个不同浓度浓度NaCl洗脱所得到的组分用纯水充分透析后冻干,用纯水溶解;每个组分质量浓度为200ug/ml,MTT试验检测各组份活性,0.15M NaCl洗脱组分为活性组分,将活性组份置于-20℃保存,待用。
3)superdex 75分子筛凝胶层析:
首先,取适量的superdex 75分子筛凝胶填料(GE公司生产),清水浸泡24小时,用玻璃棒轻微搅拌均匀后,玻璃棒引流,装入1.6×80cm规格的层析柱,用纯水平衡3-4个柱体积,基线稳定后方可使用。
其次,将上述0.15M NaCl洗脱组分上柱,用清水以1ml/min的速度冲洗层析柱,整个层析过程采用280nm检测蛋白质洗脱峰,共得四个洗脱峰,每个洗脱峰为一个组分,将各个组分冷冻干燥,采用BCA法测定蛋白浓度后,MTT试验检测各组份活性,第四个洗脱组分为活性组分,即截取1小时40分钟至1小时55分钟的洗脱液。将活性组份置于-20℃保存。
4)将上述洗脱组分经HPLC C-18反相柱(4.6×250mm规格的层析柱)分离纯化,洗脱液为A液和B液,进行梯度洗脱,起始洗脱液中A液占总洗脱液体积的90%,B液占总洗脱液体积的10%,B液每分钟1%的速率上升,流速为0.5ml/min,当B液占总洗脱液体积的28.4%时出现活性组分,经质谱鉴定即得到N-末端序列为YQPDKFMLRGELRNN,分子量为5931Da的单一组分玻璃海鞘多肽(参见图1);活性组分由等电聚焦电泳测定等电点为PI=7.25。其中A液为A液总体积0.1%的TFA和A液总体积99.9%的超纯水,B液为B液总体积0.1%的TFA和B液总体积99.9%的乙腈。
5)海鞘多肽的Tricine-SDS-Page电泳分析鉴定:配置4%的浓缩胶和16.5%的分离胶。取过C-18反相柱组分点样,用低分子量蛋白Marker为对照,进行Tricine-SDS-Page蛋白电泳,浓缩胶采用50V电压,分离胶采用60V电压进行电泳,电泳后用考马斯亮蓝染色液进行染色,在样品泳道能够发现6KD左右大小的一条亮带,说明该多肽的分子量在6KD左右(参见图2)。
实施例2:抗瘤谱的测定
细胞:人宫颈癌上皮细胞(Hela)、人肝癌细胞(BEL-7402)、人结肠癌细胞(HCT-116)、人乳腺癌细胞(MCF-7)、人肺癌细胞(A549)、人神经胶质瘤细胞(U8T)。以上细胞均为中科院海洋所海洋药物实验室提供。
药品及试剂:玻璃海鞘多肽:中科院海洋所海洋药物实验室提供;5-氟脲嘧啶(5-FU)江苏南通精华制药有限公司产品,批号为100402;MTT(SIGMA,USA);DMSO(SIGMA,USA);胰蛋白酶(SIGMA,USA);RPMI1640(GIBCO,Invitragen Co.,USA);DMEM(GIBCO,Invitragen Co.,USA);优级胎牛血清(GIBCO,Invitragen Co.,USA);特级胎牛血清Fetal BovineSerum(Hyclone)。
仪器:超低温冰箱(Nature,USA),细胞培养箱(SANYO,Japan),倒置显微镜(NIKON,Japan),酶标仪(Bio-Tek Instruments,Inooski,VT,USA),PH计(Thermo orion,USA),超净工作台(FLC-哈尔滨东联仪器厂)。
而后通过MTT法进行检测抗肿瘤效果,取各种人的肿瘤细胞株按照常规方法培养传代,收集对数生长期细胞,调节细胞悬液浓度5×104个/ml左右。将细胞悬液加入96孔培养板中,每个孔加入180μl。置于37℃恒温培养箱中培养24h后,实验组加入各浓度上述实施例所得多肽提取物20μl/孔,并以5-FU作为阳性对照组,每组各设4个平行孔,并分别设清水对照以调零。在培养箱37℃,培养48h后,用移液枪将96孔板中液体洗净后每孔加入MTT(1mg/ml)30μl,置CO2培养箱37℃培养4h,弃去上清,每孔加入DMSO 150μl,置摇床摇匀30min,用酶标仪在492nm下检测,利用SPSS统计软件,计算细胞死亡率,求取IC5(参见表1)0。
实验结果表明,经SPSS软件统计,玻璃海鞘多肽对用于试验的6种肿瘤细胞,均有不同程度的抑制作用,并且呈一定的剂量依赖关系,不同浓度的玻璃海鞘多肽对各种肿瘤细胞的抑制率、IC50值详见表1。
表1不同浓度的玻璃海鞘多肽对5种肿瘤细胞的抑制率
实验结果显示,活性组分在50ug/ml浓度时能够强烈抑制人肝癌细胞(BEL-7402)、人宫颈癌上皮细胞(Hela)、人结肠癌细胞(HCT-116)、人乳腺癌细胞(MCF-7)、人神经胶质瘤细胞(U8T)、人肺癌细胞(A549)生长,抑制率达到50%-75%,说明本发明实施例所得物质能够抑制癌细胞的增值。
实施例3:扫描电镜观察凋亡现象
用六孔板做细胞爬片→37℃培养24小时→加入上述实施例制备所得终浓度100ug/ml的玻璃海鞘蛋白提取物→37℃培养20小时→PBS冲洗→2.5%戊二醛固定→30%、50%、70%、80%、90%、100%乙醇梯度脱水→扫描电子显微镜下观察。
扫描电镜观察凋亡细胞的外部形态:扫描电镜下观察BEL-7402处理细胞,与正常细胞相比,经过上述实施例制备所得海鞘多肽处理细胞表面微绒毛减少或者消失,细胞变圆皱缩,细胞表面出现蜂窝状空洞,少数细胞能发现凋亡小体存在(参见图3)。
实施例4:细胞核染色观察
1)DAP I染色,观察凋亡小体的出现,DAPI染色:用六孔板做细胞爬片→37℃培养24小时→加入上述实施例制备所得终浓度100ug/ml的玻璃海鞘蛋白提取物→37℃培养20小时→PBS冲洗→多聚甲醛固定→PBS冲洗→Triton-100破膜→PBS冲洗→DAPI染色20min→荧光显微镜下观察。
经DAPI染色后,在荧光显微镜下观察发现正常细胞细胞核内染色质均匀,经过上述实施例制备所得海鞘多肽处理细胞核内染色质发生固缩,可见细胞核分成大小不同的圆形,是凋亡小体的典型形状(参见图4)。
2)AO/EB染色观察凋亡细胞细胞核颜色变化:用六孔板做细胞爬片→37℃培养24小时→加入上述实施例制备所得终浓度100ug/ml的玻璃海鞘蛋白提取物→37℃培养20小时→PBS冲洗→多聚甲醛固定→PBS冲洗→Triton-100破膜→PBS冲洗→AO/EB混合液染色→荧光显微镜下观察。
经AO/EB染色后,在荧光显微镜下观察发现正常细胞发出绿色荧光,经过上述实施例制备所得海鞘多肽处理细胞发出橙红色荧光。正常细胞细胞核内染色质均匀,药物处理细胞核内染色质发生固缩,可见细胞核分成大小不同的圆形,是凋亡小体的典型形状(参见图5)。
实施例5
线粒体膜电位检测(JC-1):
A细胞培养瓶细胞传代37℃培养24小时
B加入上述实施例制备所得终浓度50ug/ml的玻璃海鞘蛋白提取物,37℃培养20小时
C收集细胞,取10-60万细胞重悬于0.5ml细胞培养液中
D加入JC-1染色工作液,混匀,37℃培养20分钟。
E 600g离心4分钟,弃上清
F用JC-1染色缓冲液洗涤2次
G再用JC-1染色缓冲液重悬后,用荧光分光光度计检测(激发波长490nm)。
经玻璃海鞘多肽处理过的细胞在荧光分光光度计激发波长为490nm时,在530nm处出现强烈激发光,在590nm处激发光很弱或者没有。而正常细胞相比在激发波长为490nm时,在530nm出现的激发光弱于590nm出现的激发光。由此可见玻璃海鞘多肽处理过的细胞,线粒体膜电位明显下降,说明玻璃海鞘诱导肿瘤细胞凋亡走的是线粒体途径。
- 还没有人留言评论。精彩留言会获得点赞!