甘草酸二铵在治疗脱毛中的用途的制作方法
发明背景
脱发是临床上常见的一种以毛发减少为特征的皮肤疾病,主要包括雄激素源性脱发、斑秃以及先天性脱发[黄伟苹,顾军. 脱发性疾病的遗传学研究进展[J]. 中国中西医结合皮肤性病学杂志,2004,3(2):120-122.]。在一项最近的调查中发现,我国有超过20%的男性受脱发困扰,且脱发年轻化趋势越来越严重,尤其是斑秃。斑秃 (Alopecia alopecia,AA)是一种人类相当普遍的损容性的自身免疫疾病,主要侵犯生长期毛囊的最常见脱发疾病之一。流行病学调查发现,大约40-50%的斑秃病人在21岁之前发病,20%的患者于40岁以后发病,虽然AA无自觉症状,但对患者的心理、精神带来很大的负面影响,严重影响他们的生活质量。长期以来,人们一直致力于寻找和研发治疗AA的药物,然而到目前为止,尚没有一种药物能完全治愈AA。如外用2%和5%米诺地尔(一种钾离子通道阻滞剂)虽然通过美国FDA用于脱发患者的治疗[Olsen EA, Whiting D, Bergfeld W, et al. A multicenter, randomized, placebo-controlled, double-blind clinical trial of a novel formulation of 5% minoxidil topical foam versus placebo in the treatment of androgenetic alopecia in men[J]. J Am Acad Dermatol, 2007, 57(5):767-774.杨雪源,刘训荃,许爱娥,等. 米诺地尔酊治疗斑秃和男性型秃发的临床观察[J]. 中国皮肤科杂志,2003,36(5):230-231.],但临床发现停药后,患者仍将会继续脱发,需要继续使用维持疗效以及出现体毛增多,干燥等副作用[陈声利,孙建方. 米诺地尔治疗脱发的药理与临床研究[J]. 国外医学.皮肤性病学分册,2004,30(5):276-278.]。激素疗法亦是治疗脱发最为常用、可靠及有效的方法之一,皮损内注射作为治疗的首选[王洪军. 复方倍他米松注射液治疗斑秃的临床疗效观察[J]. 临床皮肤科杂志,2004,33(6):381.]。Das等[Das S, Ghorami RC, Chatterjee T, et al. Comparative assessment of topical steroids, topical tretenoin (0.05%) and dithranol paste in alopecia areata[J]. Indian J Dermatol, 2010, 55(2):148-149.]比较类固醇、维甲酸以及蒽三酚糊治疗斑秃的效果,发现类固醇治疗效果最好,达70%,维甲酸次之55%。但类固醇局部注射会引起头皮短暂性萎缩、长期应用易诱发痤疮、体重增加、满月脸、女性月经减少等不良反应的产生,限制了他们在临床中的应用。因此如何开发出副作用小,疗效确切的药物,特别是利用发病机理,从天然植物中寻找治疗AA的药物,是科研工作者面临的新的挑战。
目前关于斑秃的病理机制尚未阐明,可能的原因主要与局部感染、神经毒物、精神抑郁、内分泌因素等因素相关。近年来随着遗传、基因、分子水平的不断发展,国内外诸多学者认为的AA主要是一种由细胞免疫介导的自身免疫性炎症疾病,由于毛囊异常暴露于潜在免疫活性的免疫系统,在通过毛囊的抗原物质激活强大的免疫系统,诱发炎症,从而产生脱发。CD8+T细胞是一种调节性T细胞,具有耐受性免疫调节的作用,研究发现,将斑秃小鼠的脾脏中分离取得的CD8+等T细胞注射到正常小鼠皮下,发现CD8+T细胞注射的部位出现斑秃,且联合CD8/CD25-T细胞出现脱发的概率更高,表明CD8+T细胞可能是斑秃发病环节的关键因子[Gilhar A, Landau M, Assy B, et al. Mediation of alopecia areata by cooperation between CD4+ and CD8+ T lymphocytes: transfer to human scalp explants on Prkdc(scid) mice[J]. Arch Dermatol, 2002,138(7):916-922.]。因此通过抑制CD8+T细胞表达水平,是治疗AA的一个重要途径之一。另外在最近的研究显示,毛囊局部淋巴细胞浸润与细胞因子(IL-2、IL-4,IL-12,TNF-α、IFN-γ等)的表达情况有一定的相关性[Gregoriou S, Papafragkaki D, Kontochristopoulos G, et al. Cytokines and other mediators in alopecia areata[J]. Mediators Inflamm, 2010, 2010:928030. Rossi A, Cantisani C, Carlesimo M, et al. Serum concentrations of IL-2, IL-6, IL-12 and TNF-α in patients with alopecia areata[J]. International journal of immunopathology and pharmacology, 2011, 25(3):781-788.],如给予IL-2表达缺陷和表达正常的小鼠分别移植斑秃皮损,发现前者淋巴细胞浸润明显比后者少,表明IL-2与斑秃的严重程度有一定的相关性[Freyschmidt-Paul P, McElwee KJ, Hoffmann R, et al. Reduced expression of interleukin-2 decreases the frequency of alopecia areata onset in C3H/HeJ mice[J]. J Invest Dermatol, 2005,125(5):945-951.],受到许多皮肤科研究者的广泛认同。因此通过局部调节细胞因子将会成为一种新的治疗AA的重要手段,这为深入开展AA药物治疗的研究提供了新的方向,也为本课题的开展提供了立题依据。
中药甘草为豆科植物甘草、胀果甘草或光果甘草的干燥根及根茎,具有补心脾气、止咳祛痰平喘、清热解毒等功效,有效活性成分主要是三萜类化合物甘草酸。研究发现,其在体内经代谢转变为甘草次酸,后者与△4-5-β还原酶(一种类固醇代谢酶)具有较强的亲和力,可阻碍醛固酮和皮质醇的灭活,产生抗炎、抗过敏,增强自然杀伤性细胞活性等明显的皮质激素样效应[金敏,吴红金.甘草次酸药理作用的研究进展[J].医学综述,2009,15(11):1712-1715.],与传统的肾上腺皮质激素相比,不良反应要小的多。因此,近年来开发了许多甘草类药物制剂,复方甘草酸苷、甘草锌、甘草酸二铵等。其中甘草酸二铵是以甘草次酸的左旋构型及其生物的基础上研究和应用的第三代产品,具有胃肠吸收好,生物利用度高等特点[ 金悠,杨俊,魏磊,等. 甘草酸二铵胶囊人体相对生物利用度研究[J]. 医药导报,2008, 27(8):915-917.]。该药在临床肝病的治疗中有广泛应用,张琼华等[ 张琼华,施光峰,李谦等. 甘草酸二铵肠溶胶囊治疗慢性肝炎2396例[J]. 中华传染病杂志,2007,25(3):175-176.]通过对2396例伴有ALT升高的慢性肝炎患者随访临床症状,发现甘草酸二铵保护剂改善肝功能的作用明显,口服疗效满意,无明显不良反应,适合长期护肝治疗。近期的临床发现,甘草酸二铵在脱发的疾病治疗中,也有一定疗效。在43例脱发的治疗中发现,甘草酸二铵肠溶胶囊联合养血生发胶囊可促进脱发患者的毛发生长,疗效确切,有效率为90.70%,且安全性高[刘效筠. 甘草酸二铵肠溶胶囊联合养血生发胶囊治疗斑秃43例[A]. 中国药理学会. 2011年全国医药学术论坛交流会暨临床药学与药学服务研究进展培训班论文集[C].中国药理学会: 2011:2.],但目前甘草酸二铵对脱发的基础药理研究尚不够深入,其治疗脱发的确切药理作用机制仍不明确。因此,本项目基于甘草酸二铵对于临床脱发疾病有一定疗效的基础上,拟开展甘草酸二铵治疗脱发的药理作用的研究,拟采用环磷酰胺诱导小鼠脱发,建立小鼠脱发动物模型,通过电镜、组织病理学观察毛囊生长情况,观察甘草酸二铵对IL-2、CD8+,CD4+,IL-4以及INF-γ表达作用,及对脱发处组织中CD8+,CD4+,INF-γ表达影响,在组织学、免疫学水平,探讨甘草酸二铵治疗脱发的药理作用机制,以期探寻对脱发治疗的的新策略,同时为临床甘草酸二铵治疗脱发这一难治疾病提供又一新的法定适应症,促进临床甘草酸二铵的合理用药,保证患者用药安全、有效,从而更好的服务于患者。
发明概述
本发明涉及治疗脱毛动物模型的方法,该方法包括给脱毛动物给予药学上有效量的甘草酸二铵。
另外,在本发明的方法中,治疗还可以包括给予药学上的安慰剂组;所述的安慰剂为生理盐水。
本发明涉及其中治疗机制是通过甘草酸二铵的免疫调节活性而起作用的方法。
附图说明
参考以下附图将更好的理解本发明。
图1显示了用甘草酸二铵50、100mg/kg,每日一次,给予1,2,4,8周(N=20)或安慰剂(N=20)治疗的脱毛小鼠中,光镜下脱毛区毛囊生长情况。
图1是给药后1,2,8周,比较小鼠脱毛区皮肤组织病理形态学变化(HE×400)图
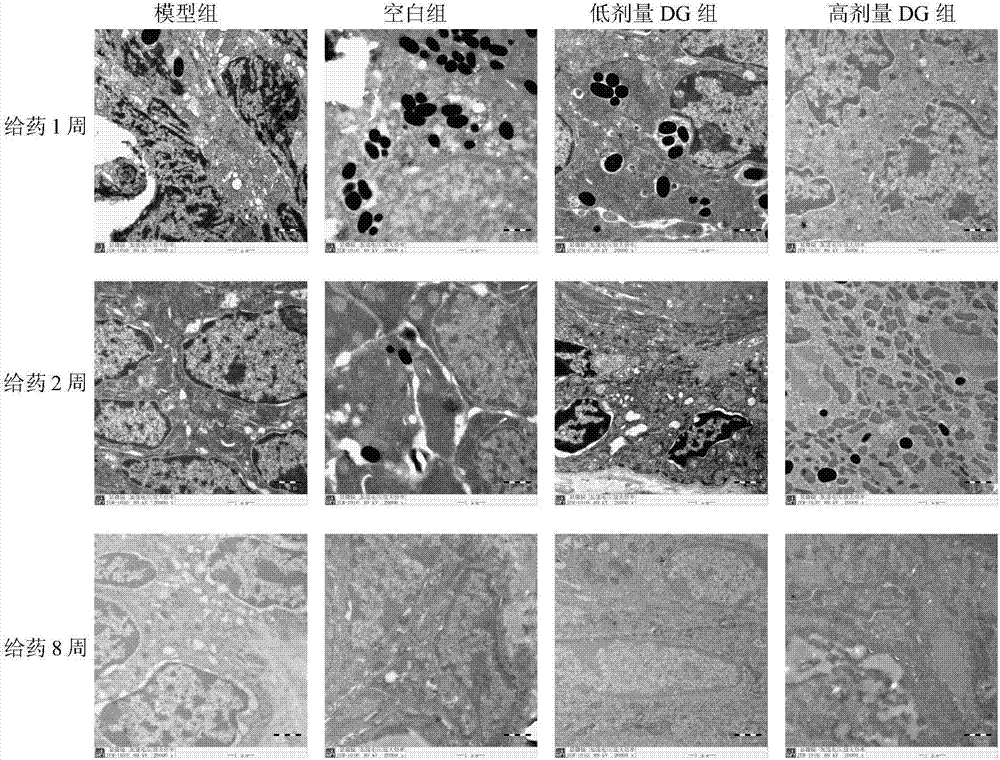
图2显示了用甘草酸二铵50、100mg/kg,每日一次,给予1,2,4,8周(N=20)或安慰剂(N=20)治疗的脱毛小鼠中,电镜下脱毛区毛囊生长变化。
图2是给药后1,2,8周,比较各组小鼠毛囊超微结构变化(电镜×20000)图
图3显示了用甘草酸二铵100mg/kg,每日一次,给予1,2,4,8周(N=20)或安慰剂(N=20)治疗的脱毛小鼠中,毛发生长的基本情况。
图3是模型组、生理盐水组和DG组小鼠毛发生长的影响图
图4显示了用甘草酸二铵100mg/kg,每日一次,给予1,2,4,8周(N=20)或安慰剂(N=20)治疗的脱毛小鼠中,光镜下脱毛区毛囊生长情况。
图4是模型组、生理盐水组和DG组小鼠病理形态学变化(×400) 图
图5显示了用甘草酸二铵100mg/kg,每日一次,给予1,2,4,8周(N=20)或安慰剂(N=20)治疗的脱毛小鼠中,电镜下脱毛区毛囊生长变化。
图5是模型组、生理盐水组和DG组小鼠毛囊超微结构变化(×20000)图
具体实施方式
实施例1:甘草酸二铵促进脱毛小鼠毛发生长的作用
一、实验方法
1材料
动物SPF级(Specific Pathogen Free,无特定病原体),雄性,C57BL/6小鼠,体质量18-20g,合格证号:SCXK(沪) 2012-0002,上海斯莱克实验动物有限公司提供。饲养环境:室温控制在24~26℃,光线每12 h明暗交替,自由进食,隔日更换垫料。
药品与试剂 甘草酸二铵肠溶胶囊原料(正大天晴药业集团股份有限公司,甘草酸二铵含量为50%,批号:140214241);环磷酰胺(江苏恒瑞医药股份有限公司,规格:0.2g/瓶,批号:11100521)。
仪器 BX41奥林巴斯显微镜,日本OLYMPUS;JEM-1010型电镜,日本电子公司;70D型佳能单反相机,日本Canon。
2 分组、模型制备与给药方式[张敏, 朱晓文, 王雪儿, 等. C57BL/6小鼠皮肤毛囊发育的实验研究[J]. 中国临床解剖学杂志, 2010, 28:74-77.]
分组:根据随机数字表,将小鼠分为模型组、空白组和DG低剂量、高剂量组,每组8只。
模型制备:C57BL/6 小鼠用麻醉机进行麻醉。麻醉后,将松香和石蜡按1:1的比例混合加热融化,并均匀涂抹于项背部,凝固变硬后揭去,诱导生长期毛发,每只小鼠脱毛面积约为2.0 cm×2.0 cm。脱毛后9 d(小鼠背部皮肤诱导生长期毛囊产生),所有小鼠脱毛区单次皮下注射CTX 150 mg•kg-1,即建立小鼠脱毛模型。
给药:模型组造模后,不做任何处理,任其自然生长;空白组给予生理盐水灌胃,剂量为100 mg•kg-1•d-1,体积为10 mL•kg-1,持续8周;DG低、高剂量组给予DG灌胃,剂量分别为50,100 mg•kg-1•d-1,连续8周。
指标观察
肉眼观察脱毛区毛发生长情况[黄云英, 张德芹, 沈丽, 等. 骨碎补外用对环磷酰胺致小鼠斑秃模型的影响[J]. 天津中医药, 2012, 29:375-377.]:分别在给药前1天和给药后1,2,8周,通过肉眼观察模型组、空白组和DG低剂量、高剂量组小鼠的脱毛区毛发生长情况,并用70D型佳能单反相机图像采集、保存备用。
氏HE染色观察毛囊形态学及数目变化:分别在给药后1,2,8周,随机选取模型组、空白组和DG低剂量、高剂量组小鼠各2只,立即处死,取其脱毛区域皮肤组织。经10 %福尔马林固定,常规石蜡包埋,石蜡切片,切片厚4~5 µm,-80 ℃下保存备用。利用Harris氏HE染色方法对脱毛区域皮肤组织进行染色,梯度乙醇脱水,中性树胶封片,使用BX41奥林巴斯显微镜观察脱毛区皮肤组织形态学变化。同时,在各个时间点,随机选取5个高倍视野(×400)进行毛囊计数,取其平均值。
电镜观察毛囊超微结构变化:模型组、空白组和DG低剂量、高剂量组分别在给药后1,2,8周,随机选取2只动物处死,取项背部脱毛区的皮肤组织修成<1mm3小块。置于5%戊二醛溶液中4℃下,前固定2h;于0.1M PBS冲洗4次,每次15 min;于1 %锇酸4 ℃下,后固定2 h;于0.1M PBS冲洗2次,每次5 min;于2%醋酸铀水溶液浸染2 h;梯度丙酮脱水;100 %丙酮:包埋剂(1:1)室温下,浸渍1.5 h;100 %丙酮:包埋剂(1:2)室温下,浸渍1.5 h;纯包埋剂,37 ℃下,浸渍3 h;包埋(准备标签、包埋模具)、聚合(36 h 60℃恒温箱)、超薄切片。切片厚度50-80nm。使用日本电子公司JEM-1010型电镜进行观察。
统计学处理:结果±s表示。采用SPSS17.0统计软件分析数据,组间比较应用单因素方差分析。
二、结果
1 体重变化和毛发生长情况
小鼠经松香石蜡法诱导毛发生长期至给药前一天,各组小鼠脱毛区已有毛发自然生长,呈灰色。经CTX诱导脱毛至实验结束,各组小鼠体重无明显变化(P>0.05),见表1。
给药1周后,各组小鼠脱毛程度最为严重,背部毛发基本脱尽,皮肤呈粉色。给药2周后,小鼠脱毛区局部皮肤由粉色逐渐转变成灰黑色,与模型组和空白组相比,DG高剂量组小鼠脱毛区皮肤灰黑色区域明显增大,而DG低剂量组灰黑色区域变化没有明显区别;给药8周后,各组小鼠脱毛区呈黑色,且已有较多毛发逐渐长出、伸长。相对于模型组、空白组,DG高剂量组毛发生长更为致密,而DG低剂量组致密程度不明显。
表1 比较给药后几组小鼠在各时间点体重变化
Tab 1 Weight changes of mice in each group was compared at each time point
DG:Diammonium Glycyrrhizinate;Compared with model group, *P <0.05, Compared with control group, #P<0.05.
2 DG对脱毛小鼠脱毛区皮肤组织病理形态学变化的影响
给药1-2周后,模型组和空白组脱毛区真皮层毛囊结构基本完整,但毛囊管变得膨大,呈退行中期改变,毛囊数目、毛囊细胞黑素形成程度较DG高剂量组相对减少,与DG低剂量组无明显差异;给药8周后,模型组和空白组脱毛区真皮层毛囊数目重度减少,分布稀疏,毛囊细小,皮脂腺明显减少;相比之下,DG高剂量组脱毛区真皮层毛囊数目轻度减少,残存毛囊结构基本完整,皮脂腺略有减少;而DG低剂量组没有明显改善。
3 DG对脱毛小鼠脱毛区毛囊数目变化的影响
毛囊数目变化如表2所示。脱毛后,各组小鼠毛囊数目逐渐减少。在各时间点,与模型组、空白组小鼠相比,DG高剂量组毛囊数目在统计学上均具有显著性差异(P<0.05),而DG低剂量组,虽略有增加,但无显著性差异(P>0.05)。
表2 比较给药后各组小鼠不同时间点毛囊数目变化(±s,n=10)
Tab 2 Hair follicle number changes in each group was compared at each time point(±s,n=10)
Compared with model group, *P <0.05, Compared with control group, #P<0.05.
4 DG对脱毛小鼠脱毛区毛囊超微结构的影响
给药1周后,模型组和空白组线粒体肿胀、空泡化明显。DG低剂量组,线粒体肿胀、空泡化改善程度不明显,而DG高剂量组线粒体轻度肿胀,少部分空泡样化,空泡样化减轻程度明显。给药后2周后,模型组和空白组线粒体模糊,核周间隙轻度增宽,尤其胞质空泡较多,DG高剂量组和DG低剂量组少有泡状结构。给药8周后,模型组和空白组线粒体嵴明显减少、模糊,空泡化趋于严重,核周间隙轻度增宽。与模型组、空白组相比,DG高剂量组核周间隙基本无增大,鞘粒基本正常,线粒体模糊、空泡样程度明显减轻,而DG低剂量组没有明显改善。
三、讨论
脱发动物模型的成功复制在脱发基础研究与治疗药物开发中起到关键作用。脱发动物模型按其各自特点,分为自发性脱发、全厚皮肤移植诱导脱发、药物诱导性脱发三种模型。C3H/HeJ、DEBR大鼠等啮齿类动物是自发性脱发模型的理想实验动物。C3H/HeJ小鼠较早应用于自发性脱发模型,但该模型存在脱发率较低,且难以预测脱发各个阶段的缺陷,实际中应用受限。与C3H/HeJ小鼠相比,DEBR成年大鼠(一种BDIX大鼠和wistar大鼠杂交)脱发率明显要高,常被用于脱发免疫机制、遗传机制以及药物的安全性和有效性研究[ Sun J, Silva KA, McElwee KJ, et al. The C3H/HeJ mouse and DEBR rat models for alopecia areata: review of preclinical drug screening approaches and results[J]. Exp Dermatol, 2008, 17(10): 793-805. ]。该模型在1991年由Michie等[ Michie HJ, Jahoda CA, Oliver RF, et al. The DEBR rat: an animal model of human alopecia areata[J]. Br J Dermatol, 1991, 125 (2): 94-100.]首次报道,他们发现DEBR大鼠在出生后3.5-4个月时皮毛就开始渐渐脱落,在此后3-4个月里,保持毛发稀少状态。缺点是DEBR大鼠体型较大,开展药物治疗学研究费用较贵。全厚皮肤移植诱导脱发模型是在1998年由McElwee等[ McElwee KJ, Boggess D, King LE Jr, et al. Experimental induction of alopecia areata-like hair loss in C3H/HeJ mice using full-thickness skin grafts[J]. J Invest Dermatol, 1998, 111(5):797-803.]利用皮肤移植技术制备的。与自发性脱发小鼠(C3H/HeJ)相比,该模型脱发率明显上升,接近100%。但此法最终依赖于自发性脱发小鼠,限制大规模应用,且操作复杂,移植失败可能性大。相比于自发性脱发模型、全厚皮肤移植诱导脱发模型,药物诱导脱发模型具有周期短优势、操作简单的优势。CTX诱导动物脱发模型是常见的化疗脱发(CIA)模型。早在1992年,Jimenez等[ Jimenez JJ, Yunis AA. Protection from chemotherapy-induced alopecia by 1,25-dihydroxyvitamin D3[J]. Cancer Res, 1992, 52(18): 5123-5125.]应用CTX腹腔注射诱导成功建立CIA模型。随后,有研究者对此法进行改良,在该模型中,CTX是通过诱导生长期毛囊营养不良性改变,或造成更严重的损害使毛囊过早地向退行期改变的[ Paik SH, Yoon JS, Ryu HH, et al. Pretreatment of epidermal growth factor promotes primary hair recovery via the dystrophic anagen pathway after chemotherapy-induced alopecia[J]. Exp Dermatol, 2013, 22(7): 496-499.]。此法为急性弥漫性、可逆的脱发模型,与临床密切相关,适用于化疗药物引起的脱发病理生理研究以及药物治疗学研究[ Paus R, Handjiski B, Eichmüller S, et al. Chemotherapy-induced alopecia in mice. Induction by cyclophosphamide, inhibition by cyclosporine A, and modulation by dexamethasone[J]. Am J Pathol, 1994, 144(4): 719-734.]。本研究,所采用的动物模型是CTX诱导的化疗型脱毛模型,部分模拟了脱发的发病机理。研究中,所有小鼠经CTX诱导脱毛后至实验结束,体重均无明显改变,无厌食、烦躁现象发生。肉眼观察到脱毛区毛发稀疏,这与试验中脱毛区毛囊数目变化较为一致。同样,病理形态学观察到小鼠毛囊结构随着时间延长逐渐模糊,甚至萎缩,黑素细胞表达异常的“死亡”受体,同时凋亡改变;此外,电镜观察到线粒体受损,空泡化加剧,表明单次大剂量CTX对小鼠毛发生长有抑制作用,可能的原因与CTX直接损伤毛囊细胞有一定关联,这与文献报道一致[邢飞, 姜波, 涂亚庭, 等. 环磷酰胺对小鼠血清和局部毛囊内ICAM-1及ELAM-1水平的影响[J]. 中国皮肤性病学杂志, 2010, 24:314-317.]。与空白组和模型组相比,经高剂量DG灌胃治疗8周后,电镜观察到线粒体受损、空泡化程度明显缓解,这与其毛发生长情况变化较为一致,而低剂量DG对此改善不明显,提示DG可促进CTX脱毛小鼠毛发生长的作用,可能呈一定的剂量相关性。
综上所述,大剂量CTX可诱导C57BL/6小鼠毛发显著脱落,皮肤毛囊细胞萎缩、甚至破坏,而DG维持治疗后可促进毛发生长,这种效果可能是通过减少毛囊内线粒体损伤,保护包囊细胞不受破坏来发挥作用的,且与一定的剂量相关。
实施例2:甘草酸二铵对脱毛小鼠治疗的药理作用机制研究
一、实验方法
1 材料
实验动物 SPF,♂,C57BL/6小鼠,体质量18-20g,合格证号:SCXK(沪) 2012-0002,上海斯莱克实验动物有限公司提供。饲养环境:室温控制在24~26℃,光线每12 h明暗交替,自由进食,隔日更换垫料。
试剂 甘草酸二铵(正大天晴药业集团股份有限公司,批号:140214241);环磷酰胺(江苏恒瑞医药股份有限公司,批号:11100521);CBA检测试剂盒(美国,BD公司,批号:3304776);CD4检测试剂盒(批号:04/2014)、CD8检测试剂盒(批号:04/2014)均购自上海颖心实验室设备有限公司。
仪器 JEM-1010型电镜(日本,日本电子公司)、C6型流式细胞仪(美国,BD公司)、MK3型酶标仪(美国,Thermo公司)。
模型制备:同实施例1
分组:根据随机数字表,将小鼠分为模型组、生理盐水组和DG 组,每组20只。
给药:模型组任其自然生长,DG 组给予甘草酸二铵(100mg/kg)灌胃治疗,持续8周,生理盐水组给予生理盐水(100mg/kg)灌胃治疗,持续8周。
指标观察
组织取材:分别在给药后1周、2周、4周、8周,随机选取模型组、生理盐水组和DG组小鼠各5只,行眼眶采血,每只1-2 mL。用于ILISA检测:每组取2个血样,加入EDTA抗凝,3000转离心30 min取上清,于-20 ℃保存备用。用于流式细胞术检测:每组取3个血样,分离血清,于-70 ℃保存备用。所有动物取血后立即处死,取其脱毛区域皮肤组织。经10 %福尔马林固定,常规石蜡包埋,石蜡切片,切片厚4~5 µm,-80 ℃下保存备用。
流式细胞术检测血清IL-2、IL-4和INF-γ表达水平:用反应稀释液分别将3种细胞因子标准品按照梯度法稀释为5000、2500、1250、625、312、156、80、40、20、10、5和0 pg/mL共12个质量浓度。按每个测试每种微球1 μL的量吸取3种捕获微球混匀,成为混合捕获微球,加0.5 mL洗液,以200 g的转速,离心5 min,吸去上清,用血清/血浆捕获微球稀释液重悬微球,并使终体积达50 μL/测试,室温孵育15 min。按每个测试每种微球1 μL的量混合3种PE标记的检测抗体,稀释至终体积达50 μL/测试。取待测血清和标准品50 μL置于上样管,加入50 μL混合捕获微球,室温避光孵育1 h,然后加入50 μL检测抗体,室温避光孵育2 h,加入1 mL洗液,以200 g的转速,离心5 min,去上清,洗2次后每管加入300 μL洗液重悬微球,4 h内,上流式细胞仪检测。
ILISA检测外周血CD4+、CD8+表达水平:样本室温下平衡20 min。设置标准品孔、样本孔和空白孔。空白孔什么都不加,标准品孔各加不同浓度的标准品50 μL。待测样本先加样本稀释液40 μL,再加待测样本10 μL,随后标准品孔和样本孔(空白孔不加)加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃恒温箱孵育60 min。弃去液体,吸水纸上拍干,每孔加洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,重复5次。所有孔加入底物A、B各50 μL,37℃避光孵育15 min。加终止液50 μL,15 min内,在450 nm波长处测定各孔OD值。统计CD4和CD8的OD值,将CD4/CD8均值作为结果进行统计分析。
电镜观察:同实施1.
形态学观察:利用Harris氏HE染色方法对脱毛区域组织进行组织染色,梯度乙醇脱水,中性树胶封片,镜下观察脱毛区皮肤组织形态学变化。
免疫组织化学:石蜡切片脱蜡、水化、PBS冲洗3次。于3%双氧水-甲醇溶液中,室温下孵育10 min。PBS冲洗3次。于5%正常羊血清溶液中,37 ℃下浸泡30 min。滴加一抗(大鼠抗小鼠CD8+(1:200)或大鼠抗小鼠CD4+(1:100)或大鼠抗小鼠INF-γ,(1:100))中,4 ℃下湿盒内孵育过夜。于PBS中浸泡2次。滴加生物素标记的羊抗大鼠IgG(1:100),于湿盒内室温下孵育1-2 h。于PBS中浸泡2-3次,每次5 min。DAB显色10 min。苏木素复染、梯度乙醇脱水,中性树胶封片。染色结果进行图片采集观察,对每只动物脱毛区皮肤组织标本随机选取3个视野进行拍照,每组为5小样本。统计总阳性浸润细胞数和毛囊个数,将总阳性浸润细胞数/毛囊个数的均值作为单个毛囊的阳性细胞浸润数。
统计学处理:结果以均数±标准差(±s)表示。采用SPSS17.0统计软件分析数据,组间比较应用单因素方差分析。
二、结果
1体重变化和毛发生长情况
小鼠经CTX诱导脱毛至实验结束,各组小鼠体重无明显差异(P>0.05),见表1。脱毛小鼠经DG给药后1-2周,各组小鼠脱毛区局部皮肤由粉色逐渐转变成灰黑色,DG组小鼠脱毛区皮肤灰黑色区域明显比模型组和生理盐水组要大;给药至4-8周,各组小鼠脱毛区呈黑色,且有毛发逐渐长出、伸长。DG组毛发相对于模型组和生理盐水组,毛发更为致密。
表1 模型组、生理盐水组和DG组小鼠给药后各时间点体重变化
Tab 1 Weight changes of mice at each time point in model group, saline group and DG group
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
2 皮肤病理形态学变化
实验期间脱毛小鼠项背部皮肤表皮为复层鳞状上皮,细胞无变性、坏死、糜烂或溃疡形成。真皮为结缔组织,可见正常的皮肤附件。皮下组织可见脂肪,无充血、水肿。给药1-2周后,各组小鼠脱毛区真皮层毛囊结构基本完整,结构清晰,但模型组和生理盐水组脱毛区毛囊数目、毛囊细胞黑素形成较DG组相对减少;给药4周后,各组小鼠脱毛区真皮层毛囊继续减少,分布稀疏,毛囊细小、萎缩,皮脂腺减少,DG组表皮增厚、毛囊萎缩、破坏程度明显比模型组和生理盐水组要轻;给药8周后,模型组和生理盐水组脱毛区真皮层毛囊重度减少,分布稀疏,毛囊细小,皮脂腺明显减少,DG组脱毛区真皮层毛囊轻度减少,残存毛囊结构基本完整,皮脂腺略有减少。见图2。
电镜观察
给药后第1周,模型组和生理盐水组部分线粒体空泡化明显。DG组线粒体嵴减少,少部分空泡样化。至给药后第2周,模型组和生理盐水组线粒体模糊,核周间隙轻度增宽,尤其胞质空泡较多。DG组少有泡状结构。至给药后第4-8周,模型组和生理盐水组线粒体嵴明显减少、模糊,空泡化日趋严重,核周间隙轻度增宽。DG组核周间隙基本无增大,鞘粒基本正常,线粒体模糊、空泡样程度比模型组和生理盐水组要轻。见图3。
外周血CD4+/CD8+比值表达水平
各组小鼠外周血CD4+/CD8+比值比较,见表2。模型组、生理盐水组外周血CD4+/CD8+比值在各个时间点几乎无明显变化。DG组外周血CD4+/CD8+比值随着时间的延长,呈下降趋势。与模型组、生理盐水组相比,在各个时间点,DG组外周血CD4+/CD8+比值显著降低,差异具有统计学意义(P<0.05)。生理盐水组外周血CD4+/CD8+比值在各个时间点与模型组比较,差异无统计学意义(P>0.05)。
表2 DG对小鼠外周血CD4+/CD8+的影响
Tab 2 Effects of DG on mice peripheral blood CD4+/CD8+ ratio
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
5血清IFN-γ、IL-2、IL-4表达水平
各组小鼠血清IL-2、IL-4、IFN-γ水平比较,见表3-5。模型组、生理盐水组血清IL-2、IFN-γ水平在给药2周后达到最高峰,随后趋于平稳,血清IL-4表达在各个时间点几乎无明显变化。DG组血清IL-2、IFN-γ水平随着时间的延长,呈下降趋势,而血清IL-4水平则相反。与模型组、生理盐水组相比,在各个时间点,DG组血清IL-2、IFN-γ水平显著降低,IL-4水平显著升高,差异具有统计学意义(P<0.05)。生理盐水组血清IL-2、IL-4、IFN-γ水平在各个时间点与模型组比较,差异无统计学意义(P>0.05)。
表3 DG对小鼠外周血IFN-γ表达的影响
Tab 3 Effects of DG on mice peripheral blood IFN-γ
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
表4 DG对小鼠外周血IL-2表达的影响
Tab 4 Effects of DG on mice peripheral blood IL-2
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
表5 DG对小鼠外周血IL-4表达的影响
Tab 5 Effects of DG on mice peripheral blood IL-4
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
6脱毛区CD4+、CD8+、INF-γ表达水平
免疫组织化学结果显示,各组小鼠脱毛区毛囊周围CD4+、CD8+、IFN-γ阳性表达水平,见表6-8。模型组、生理盐水组和DG组随着时间的延长,总体呈下降趋势,至4周后逐渐平稳。在各个时间点,DG组脱毛区毛囊周围CD4+、CD8+、INF-γ表达水平明显多于模型组和生理盐水组,具有显著性差异(P<0.05)。与模型组比较,生理盐水组脱毛区毛囊周围CD4+、CD8+、INF-γ表达水平没有明显变化,差异无统计学意义(P>0.05)。
表6 DG对小鼠脱毛区毛囊周围CD4+浸润的影响
Tab 6 Effects of DG on CD4+, CD8+ infiltration of mice in hair removal area around hair follicles
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
表7 DG对小鼠脱毛区毛囊周围CD8+浸润的影响
Tab 7 Effects of DG on CD4+, CD8+ infiltrationof mice in hair removal area around hair follicles
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
表8 DG对小鼠脱毛区毛囊周围IFN-γ表达的影响
Tab 8 Effects of DG on IFN-γ expression of mice in hair removal area around hair follicles
注:与模型组比较,1)P<0.05,与生理盐水组比较,2)P<0.05。
Note: Compared with model group, 1)P <0.05, Compared with saline group, 2)P<0.05.
三、讨论
脱毛模型最常用实验动物为C57BL/6小鼠,由于其为有色种属,皮肤颜色随毛囊的发育而表现不同的颜色,是研究毛囊发育和再生一种很好的实验动物。脱毛的种类较多,其动物模型尚无法充分制备,本次实验所采用的动物模型是CTX诱导的化疗型脱毛模型,只是部分模拟了脱发的发病机理,从严格意义上讲,不能完全等同于人类的发病过程。研究中,所有小鼠经CTX诱导脱毛后至实验结束,体重均无明显改变,无厌食、烦躁现象发生。病理形态学观察到模型组小鼠毛囊结构随着时间延长逐渐模糊,甚至萎缩,肉眼观察到脱毛区毛发稀疏,表明CTX(150mg/kg)对小鼠毛发生长有抑制作用,与文献报道一致。经DG灌胃治疗8周后,毛发生长相对较为致密,明显好于生理盐水组和模型组,提示DG可改善CTX脱毛小鼠毛发生长的作用。
目前关于脱发的病理生理机制尚未明确,可能的原因主要与局部感染、神经毒物、精神抑郁、内分泌因素等因素相关。近年来随着遗传、基因、分子水平的不断发展,国内外诸多学者认为脱发主要是一种由T细胞免疫介导的自身免疫性炎症疾病,由于毛囊异常暴露于潜在免疫活性的免疫系统,再通过毛囊的抗原物质激活强大的免疫系统,诱发释放大量炎症,继而引起脱发。CD4+和CD8+在脱发患者毛囊内及周围的浸润是引起毛发脱落的关键,CD8+一直被认为对毛囊发挥直接的细胞毒作用[Bodemer C, Peuchmaur M, Fraitaig S, et al. Role of cytotoxic T cells in chronic alopecia areata [J]. J Invest Dermatol, 2000, 114(1): 112-116.],而CD4+起辅助细胞作用,在脱发的发病过程中两者是共同发挥作用的。Gilhar等[Gilhar A, Landau M, Assy B, et al. Mediation of alopecia areata by cooperation between CD4+ and CD8+ T lymphocytes: transfer to human scalp explants on Prkdc(scid) mice [J]. Arch Dermatol, 2002, 138(7): 916-922.]发现注射未分离T细胞的移植物出现明显的毛发脱落,而仅单独注射CD4+或CD8+的移植物不会引起毛发的脱落。本研究发现,单次大剂量CTX给药1周后,模型组脱毛区毛囊周边CD4+、CD8+和INF-γ有高表达,外周血CD4+/CD8+、INF-γ亦持续处于高表达状态,尤其以CD4+过度表达更为明显[宋雁, 贾旭东, 崔文明, 等. 不同途径和剂量环磷酰胺建立小鼠免疫抑制模型的对比研究 [J]. 中国食品卫生杂志, 2013, 25(3): 218-225.]。经DG治疗后,脱毛小鼠皮损处毛囊周边CD4+、CD8+和INF-γ表达水平明显低于模型组(P<0.05),而生理盐水组与模型组相比较,无明显差异(P>0.05)。由此推测,CTX作为一种应激原,经大剂量给药后,引起淋巴细胞亚群稳定性的改变,尤其以Thl细胞为主,使其活化、浸润,并释放大量的IFN-γ[10胡松. 复方鹰不泊对环磷酰胺免疫抑制小鼠血清 IFN-γ、IL-2 及血 T 淋巴细胞亚群影响的研究 [D]. 湖南中医学院, 2004.],促进局部的免疫反应,使毛球部的免疫赦免位点破坏,进一步活化CD8+,促使毛乳头细胞失去维持生长期毛囊的作用而导致脱毛[Sato-Kawamura M, Aiba S, Tagami H. Strong expression of CD40, CD54 and HLA-DR antigen and lack of evidence for direct cellular cytotoxicity are unique immunohistopathological features in alopecia areata [J]. Arch Dermatol Res, 2003, 294(12): 536-543.]。然而DG通过下调CD4+和CD8+表达水平,在一定程度上减少IFN-γ的释放,来发挥免疫调节作用,以此可能缓解脱毛演变进程,防止脱毛进一步恶化。
最近研究显示,毛囊局部淋巴细胞浸润与细胞因子的表达有一定的相关性[Gregoriou S, Papafragkaki D, Kontochristopoulos G, et al. Cytokines and other mediators in alopecia areata[J]. Mediators Inflamm, 2010, 2010: 928030. Rossi A, Cantisani C, Carlesimo M, et al. Serum concentrations of IL-2, IL-6, IL-12 and TNF-α in patients with alopecia areata [J]. Int J Immunopathol Pharmacol, 2012, 25(3): 781-788.],根据细胞因子分泌模式,Th细胞激活后分化为Thl、Th2两个亚群,Thl细胞分泌IFN-γ、IL-2等,Th2细胞分泌IL-4、IL-10等。正常生理情况下,Thl和Th2细胞处于互相抑制、互相转化的平衡状态,一旦平衡被打破,机体就会处于Thl优势或Th2优势的漂移状态,引起细胞因子异常表达而脱发。如Hoffmann等[ Hoffmann R, Wenzel E, Huth A, et al. Cytokine mRNA levels in Alopecia areata before and after treatment with the contact allergen diphenylcyclopropenone [J]. J Invest Dermatol, 1994, 103(4): 530-533.]研究发现经二苯基环丙烯酮治疗后,虽然能显著下调全秃患者IFN-γ mRNA水平、但上调IL-2 mRNA及TNF-α水平。本研究,CTX皮下注射后1周,小鼠血清IL-2和INF-γ水平增高,这与外周血和脱毛区CD4+的异常增高交相呼应。据此,推测环磷酰胺导致脱发的原因可能是由于机体内细胞因子平衡打破,即促炎因子和Th1细胞因子相对剩余以及抗炎因子(IL-4和IL-10等)相对不足引起的。经DG治疗1周后,脱毛小鼠即表现出IL-2和INF-γ水平的下调, IL-4水平的上调。由此可见,DG可能通过调节Th1细胞因子和Th2细胞因子之间的平衡,促进脱毛小鼠的毛发生长。
综上所述,DG维持治疗对脱毛小鼠具有明显疗效,显著改善了小鼠脱毛区的毛发生长情况,这种效果可能是通过调节Thl(INF-γ、IL-2)和Th2(IL-4)细胞因子水平,使其趋于平稳状态,下调外周血CD4+/CD8+比值和脱毛区毛囊周边CD4+、CD8+和INF-γ的表达水平来发挥作用,为临床脱发的药物治疗策略的提供一定实验指导和理论依据。
- 还没有人留言评论。精彩留言会获得点赞!