MIIP作为前列腺癌的调控分子和药物靶点的应用的制作方法
本发明涉及生物医药技术领域,具体涉及前列腺癌调控分子及其应用。
背景技术:
前列腺癌(prostatecancer,PCa)是男性最为常见的恶性肿瘤,在欧美国家,位居男性肿瘤发病率第一位和死亡率第二位。近年来,随着人口老龄化和诊断技术的提高,我国前列腺癌的发病率亦呈逐年上升趋势。最新统计数据显示中国人群发病率为4.3/10万,且大约5%患者首次诊断时已经出现了远处转移。PCa发病机制至今仍不完全清楚,研究表明86-98%的PCa属于激素依赖性肿瘤。
雄激素剥夺治疗(androgen deprivation therapy,ADT)是治疗首发PCa的主要方法,但大多数PCa病人尤其是发生转移的Gleason分值高的PCa,都会进展成转移性去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)。转移性CRPC是PCa进展的最终阶段,在现有的医疗条件下,生存时间一般小于2年,是导致PCa病人死亡的首要原因。因此阐明CRPC进展的分子机制,发现有效的信号分子治疗靶点,已成为当前的研究热点。
CRPC进展的分子机制十分复杂,已有的研究揭示AR信号通路的紊乱是导致CRPC发病的主要原因。瘤内的雄激素合成、AR受体的表达上调、突变和剪切变异体,都会导致AR信号通路的敏感性增加和异常激活,导致CRPC的发生。目前基于AR信号调控通路的药物阿比特龙(Abiraterone)和恩扎鲁胺(Enzalutamide)已用于临床CRPC的治疗,二者虽能缓解CRPC的病情进展,延长病人生存时间,但并不能最终阻止CRPC的进展。说明CRPC的进展受到更多更复杂的分子调控,只有找到关键的调控分子作为治疗靶点,才能从根本上治疗CRPC。
MIIP(migration and invasion inhibitory protein)是2003年科研人员在胶质瘤研究中利用酵母双杂交发现的与IGFBP2(insulin-like growth factor binding protein 2)相互作用的一个蛋白,由于其分子量约为45kDa,又称为IIp45(invasion inhibitory protein45)。MIIP基因位于染色体1p36.2区域,全长12595bp,共含10个外显子,其编码产生的mRNA为2024bp,蛋白含388个氨基酸残基,在人体内各组织广泛表达。对全长MIIP蛋白结构分析发现其含有3个SEG(segments of low compositional complexity)域和一个RGD(精氨酸-甘氨酸-天冬氨酸肽)模体;另有42个丝氨酸、6个苏氨酸及1个潜在的苏氨酸磷酸化位点。
关于MIIP的功能研究充分显示,MIIP基因是一个新的抑癌基因,依据如下:①MIIP基因所在的染色体区域1p36.2在多种类型肿瘤中缺失,包括胶质瘤、乳腺癌等。②在胶质瘤和肺癌组织中,MIIP表达明显低于正常组织,且其表达水平与肺癌的病理分期和预后负相关。目前认为MIIP的作用机制包括:A.MIIP结合并拮抗IGFBP-2的作用,抑制细胞迁移侵袭;B.结合并促进HDAC6降解,使后者去乙酰化酶活性受抑,从而影响微管形成、抑制细胞迁移;C.通过与Cdc20直接结合而阻断Cyclin B1的降解,使细胞停滞在有丝分裂的中期,从而抑制细胞周期进程和细胞增殖。
但目前关于MIIP在前列腺癌中的表达状态及其作用尚未见报道。
技术实现要素:
本发明的目的在于提供MIIP作为前列腺癌的调控分子和药物靶点的应用。
为达到上述目的,本发明采用了以下技术方案:
迁徙和浸润抑制蛋白MIIP在制备前列腺癌抗肿瘤药物中的应用。
所述抗肿瘤药物选自包含MIIP过表达载体的基因治疗药物。
迁徙和浸润抑制蛋白MIIP的激动剂在制备前列腺癌抗肿瘤药物中的应用。
迁徙和浸润抑制蛋白MIIP作为前列腺癌分子诊断标志物的应用。
迁徙和浸润抑制蛋白MIIP作为前列腺癌进展调控分子的激动剂或抑制剂的应用。
以迁徙和浸润抑制蛋白MIIP作为靶分子筛选前列腺癌治疗药物的应用。
以迁徙和浸润抑制蛋白MIIP作为检测指标评价前列腺癌治疗药物的应用。
以迁徙和浸润抑制蛋白MIIP作为靶分子筛选前列腺癌分子诊断标志物的应用。
本发明的有益效果体现在:
本发明通过实验首次发现MIIP在前列腺癌中表达降低,并且与CRPC进展相关,揭示了MIIP可以作为一种新的前列腺癌调控因子,不仅为前列腺癌的发病机制提供新的理论依据。更为重要的是,可以为前列腺癌药物研制提供新的途径,用MIIP作为靶分子筛选新的前列腺癌的治疗药物,同时也可以用MIIP作为检测指标评价前列腺癌的治疗药物。
附图说明
图1为部分前列腺癌患者(Patients)癌组织与癌旁组织中MIIP表达水平比较;其中:ANT(adjacent non-cancerous tissues):癌旁组织,CT(cancerous tissues):前列腺癌组织。
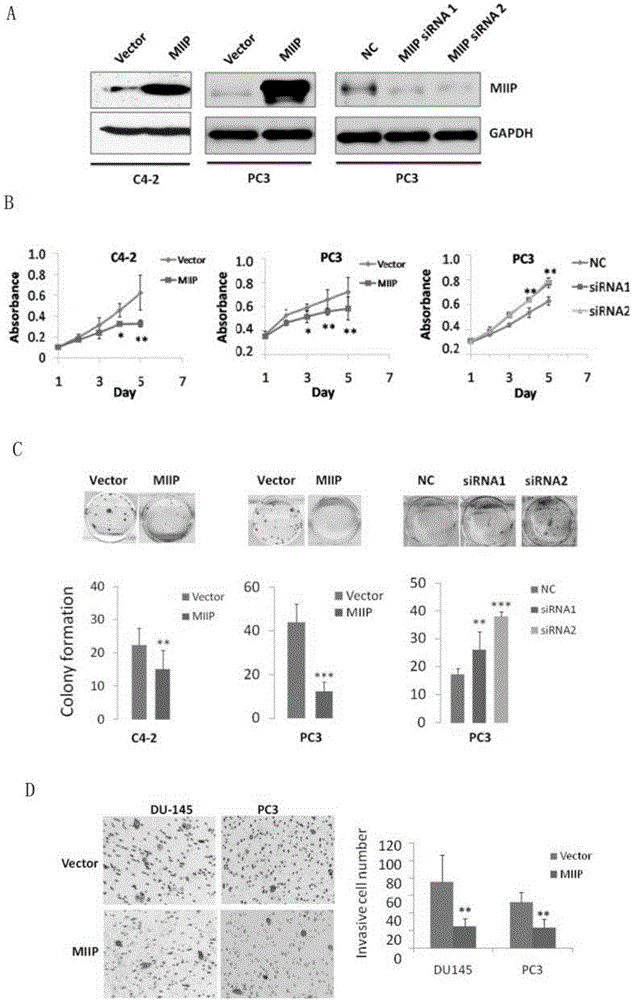
图2为MIIP对CRPC细胞恶性表型的影响;其中:A.免疫印迹检测的MIIP过表达质粒或小干扰核糖核酸(siRNA)转染后MIIP表达水平;B.MIIP表达调控对细胞生长的影响;C.MIIP表达调控对细胞克隆形成的影响;D.MIIP表达调控对细胞侵袭能力的影响。
图3为MIIP稳定敲减对小鼠成瘤恶性表型的影响;其中:A.瘤体体积比较结果;B.肿瘤生长速度比较;C.前列腺癌荷瘤鼠模型肿瘤组织中细胞增殖比较。
具体实施方式
下面结合附图和实施例对本发明做进一步详细说明。
本发明公开了迁徙和浸润抑制蛋白MIIP在前列腺癌中的调控机制和作为药物靶点的应用。
本发明通过以下实验:(1)在前列腺癌人群样本中检测MIIP;(2)MIIP过表达和MIIP shRNA敲减载体的构建,MIIP cDNA和MIIP shRNA的慢病毒包装,MIIP稳定过表达和MIIP shRNA稳定敲减前列腺癌细胞株的建立,前列腺癌细胞生物学行为检测;(3)MIIP shRNA稳定敲减前列腺癌荷瘤鼠模型构建,荷瘤鼠肿瘤生长以及瘤组织细胞增殖的检测。结果发现,在部分前列腺癌患者中,MIIP在癌组织中的表达较癌旁组织明显降低;细胞水平研究证实在CRPC细胞系PC-3、DU-145、C4-2中分别过表达MIIP,可显著的抑制细胞生长、克隆形成和侵袭能力;同时在PC-3和DU-145中采用siRNA敲减MIIP,则显著增强细胞生长、克隆形成和侵袭能力。这些结果表明MIIP可明显抑制CRPC的恶性表型。动物水平研究发现,注射MIIP稳定敲减的CRPC细胞系(PC-3-shMIIP和DU-145-shMIIP)行裸鼠成瘤实验,与正常组相比,实验组呈现肿瘤生长速度增加、侵袭性增强等恶性表型。因此,本发明指出,MIIP在前列腺发生进展过程中,尤其在CRPC恶性演化过程中发挥极其重要的作用,为前列腺癌提供了新的发病机制理论依据和治疗靶点。
本发明中除非另外说明,将使用本领域技术人员已知的化学、生物化学和重组DNA技术。这些技术在文献中有完整的解释。参见,A.L.Lehninger,《生物化学》(Biochemistry)(Worth Publishers,Inc.最新版);Sambrook等,《分子克隆:实验室手册》(Molecular Cloning:a Laboratory Manual),第二版,1989。
(1)免疫印迹(Western Blot,WB)检测前列腺癌病人癌组织中MIIP蛋白的表达水平。
病人组织标本来自西京医院泌尿外科,采用强RIPA裂解液(碧云天)裂解细胞,裂解前加入蛋白酶抑制剂PMSF和Cocktail(Sigma)。所有操作冰上进行,超声破碎8秒,提取的蛋白于-80℃保存,蛋白分装防止反复冻融。跑胶前加入上样缓冲液,混匀,直接上样。10%SDS PAGE胶分离MIIP蛋白,分子量大小约42.8kD。以GAPDH(Sigma)作为内参。具体实验结果见图1,可见MIIP在前列腺癌组织中的表达较癌旁组织明显降低。
(2)构建MIIP shRNA稳定敲减和MIIP过表达前列腺癌细胞株,检测MIIP对前列腺癌细胞恶性表型的影响
1)MIIP shRNA和MIIP过表达载体构建和慢病毒包装
首先从上海吉凯化学技术有限公司订购MIIP siRNA,参照前期实验中应用并证实有效的siRNA序列,选择其中2对针对MIIP的RNAi靶序列(siRNA1、siRNA2),合成正向与反向寡核苷酸;退火以后形成寡核苷酸双链,经过酶切、连接克隆入pLKO.1-TRC载体(购自Addgene公司,货号:10878),构建为pLKO.1-MIIP shRNA(酶切位点:AgeⅠ,EcoRⅠ),该重组质粒与包装质粒psPAX2和pMD2.G(Addgene)共转染入细胞293T(购自:中科院细胞库,目录号:GNHu17)进行病毒包装,产生pLKO.1-sh MIIP病毒颗粒分泌到细胞外的培养基中。收集含有pLKO.1-sh MIIP病毒颗粒的上清液,-80℃保存,可直接用于细胞感染。
MIIP过表达系统采用Thermo Scientific公司的pLEX-MCS慢病毒包装系统。采用PCR技术和分子克隆技术购建pLEX-MCS-MIIP过表达载体(酶切位点:SpeⅠ,XhoⅠ)。扩增重组质粒,分别与另2种辅助/包装质粒混合物(TLP4616/TLP4617,Thermo Scientific)共转染293T细胞,进行病毒包装,产生pLEX-MCS-MIIP病毒颗粒分泌到细胞外的培养基中。收集含有pLEX-MCS-MIIP病毒颗粒的上清液,-80℃保存,可直接用于细胞感染。
2)MIIP shRNA和MIIP过表达稳定细胞株的建立
①细胞培养
本实验选用细胞包括激素非依赖性/CRPC细胞系(C4-2、DU-145、PC3)以及人胚肾细胞(293T细胞),常规培养。其中C4-2是LNCaP(来源于PCa患者淋巴结转移灶)移植于瘤鼠并经去势筛选而获得,为AR阳性;DU-145和PC3分别来源于CRPC患者的脑和骨转移灶,均为AR阴性。细胞系DU-145、PC3和293T均购自中科院细胞库(目录号:TCHu222、SCSP-532和GNHu17),C4-2源自第四军医大学西京医院泌尿外科。(参考文献:[1]Murphy G,editor.Models for prostate cancer.37.New York:Liss;1980,pp.115-132.[2]Gibas Z,et al.A high-resolution study of chromosome changes in a human prostatic carcinoma cell line(LNCaP).Cancer Genet.Cytogenet.11:399-404,1984.[3]Papsidero LD,et al.Prostate antigen:a marker for human prostate epithelial cells.J.Natl.Cancer Inst.66:37-42,1981.[4]Stone KR,et al.Isolation of a human prostate carcinoma cell line(DU 145).Int.J.Cancer 21:274-281,1978.[5]Kaighn ME,et al.Establishment and characterization of a human prostatic carcinoma cell line(PC-3).Invest.Urol.17:16-23,1979.[6]Chen TR.Chromosome identity of human prostate cancer cell lines,PC-3 and PPC-1.Cytogenet.Cell Genet.62:183-184,1993.[7]El Etreby MF,et,al,Antitumor activity of mifepristone in the human LNCaP,LNCaP-C4,and LNCaP-C4-2 prostate cancer models in nude mice.Prostate.2000 Feb 1;42(2):99-106.[8]Xie BX,et,al.The radiation response of androgen-refractory prostate cancer cell line C4-2 derived from androgen-sensitive cell line LNCaP.Asian J Androl.2010 May;12(3):405-14.doi:10.1038/aja.2009.91.)
②药物浓度的筛选
转染后细胞筛选用的药物主要有博莱霉素和嘌呤霉素。建立稳定细胞系之前,需要确定能够在7-10天杀死细胞的最佳药物浓度。方法如下:在24孔板中接种细胞,细胞密度达到50%-70%融合时,将药物按照递增的浓度,加至培养孔内。观察细胞死亡情况,隔一天换液,确定杀伤细胞的最佳浓度用于后续筛选稳定细胞株。
③病毒感染与稳定细胞株的建立
分别在CRPC细胞系C4-2、DU-145和PC3中过表达或敲减MIIP:细胞培养过夜,达到约70%汇合时用于病毒转染。取已制备好的包含pLEX-MCS-MIIP或pLKO.1-shMIIP的病毒上清液,以1:1体积比加入正在培养的处于对数生长期的细胞,24小时后加入最优浓度药物筛选,建立MIIP过表达的稳定细胞系(MIIP组)和MIIP敲减的稳定细胞系(MIIP siRNA1组、MIIP siRNA2组);同时以pLEX-MCS(Vector)或pLKO.1-scramble shRNA(NC)感染和筛选的细胞作为相应的对照组,参见图2A。
(3)前列腺癌细胞生物学行为检测
1)MTT法检测细胞生长
收集对数期细胞,调整细胞悬液浓度加入96孔板(2×103/孔),5%CO2、37℃孵育细胞24h,每孔加入20μL新配制的MTT(0.5mg/mL),37℃继续孵育4h,弃MTT液,置摇床上低速振荡10min,使结晶物充分溶解。在酶标仪490nm处测量各孔的吸光值。每组设6个重复,连续测5-7天,绘制细胞生长曲线,参见图2B,可以看出,过表达MIIP抑制细胞生长,而敲减MIIP促进细胞生长。
2)克隆形成实验
取对数生长期的细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,将细胞悬浮在培养液中备用。将细胞悬液作梯度倍数稀释,取100-200细胞数均匀接种于60mm培养皿。置37℃、5%CO2静置培养2-3周,出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加甲醇固定15min,适量Giemsa应用染色液染10-30min,空气干燥。将平皿倒置并叠加一张带网格的透明胶片,肉眼计数克隆数或计算克隆形成率,参见图2C,可以看出,过表达MIIP抑制细胞克隆形成,而敲减MIIP促进细胞克隆形成。
3)Transwell检测细胞迁移和侵袭能力
将Matrigel与无血清的DMEM培养液以1:6混合,铺于Transwell小室中,37℃孵箱放置2h,使其凝固;各组细胞以胰酶消化,细胞计数,制备2×104/mL单细胞悬液,每个Transwell小室接种100μL;24孔板中加入含有血清的DMEM新鲜培养液,将Transwell小室放入24孔板中,37℃孵箱继续培养24h;擦除上层未穿膜的细胞及Matrigel,乙醇固定,Giemsa染色,倒置显微镜下随机选取10个视野并计数,取均值,参见图2D,可以看出,过表达MIIP抑制细胞侵袭。
根据以上实验,可以得出,在CRPC细胞系中分别过表达MIIP,发现MIIP可显著抑制癌细胞的生长、克隆形成和侵袭能力;而采用siRNA敲减MIIP,则促进细胞生长、克隆形成和侵袭能力。这些结果表明了MIIP对前列腺癌细胞增殖、迁徙和浸润过程的调控作用,通过对MIIP的表达调控可明显抑制CRPC的恶性表型。
(4)前列腺癌荷瘤鼠模型中验证MIIP的在体功能
1)前列腺癌荷瘤鼠模型建立
选取5-7周龄,体重18-22g的雄性裸鼠为实验对象(10只/组),于皮下接种MIIP稳定敲减的CRPC细胞系(PC-3-shMIIP和DU-145-shMIIP),建立前列腺癌荷瘤鼠模型。具体如下:将上述MIIP稳定敲减的CRPC细胞以1×107接种于裸鼠后肢近端皮下。
2)荷瘤鼠肿瘤生长以及标本采集
a)肿瘤生长曲线
每日常规监测荷瘤鼠的饮食、行为表现和肿瘤形成情况。隔日用卡钳测量肿瘤的大小以监测其体积V变化,V=d×D2×0.5(d:肿瘤的长径,D:肿瘤的短径)。5周后处死小鼠,取瘤组织称重,并根据测量结果绘制出肿瘤生长曲线,不同组别之间进行t检验统计分析。参见图3A、B,可以看出,MIIP shRNA稳定敲减前列腺癌荷瘤鼠模型(shRNA1组由siRNA1敲减,shRNA2组由siRNA2敲减)中,瘤体重量较对照组Scramble增加,肿瘤生长速度加快。
b)Ki-67染色检测细胞增殖
标本收集处死小鼠的同时,留取部分瘤组织制作石蜡切片。常规处理并固定,以10%BSA/PBS室温封闭1h,加入抗Ki-67抗体,温育1h,洗涤后滴加生物素标记二抗,室温1h,滴加过氧化物酶偶联的抗生物素蛋白,再加入0.1%DAB+0.05%H2O2,处理10-30min,苏木精复染,显色。显微镜下观察,计数阳性细胞比例,参见图3C,Ki-67染色揭示MIIP shRNA稳定敲减前列腺癌荷瘤鼠模型,与对照组Scramble相比细胞增殖加快。
以上实验揭示了MIIP在前列腺癌细胞成瘤过程中的调控作用,在CRPC细胞系中稳定敲减后,小鼠成瘤恶性表型明显增强。
总之,本发明发现MIIP在前列腺癌病人瘤组织样本中表达显著降低,细胞学实验和荷瘤裸鼠实验都证实MIIP具有抑制前列腺癌进展的功能。揭示MIIP可作为一个调控前列腺癌进展和(或)CRPC演化的关键调控分子。以MIIP作为靶向分子可用于筛选前列腺癌治疗、预防药物以及相关分子诊断标志物。
- 还没有人留言评论。精彩留言会获得点赞!