一种纳米生物质基抗癌缓释凝胶及其制备方法与流程
本发明属于生物质医用材料领域,具体涉及一种纳米生物质基抗癌缓释凝胶及其制备方法。
背景技术:
凝胶材料是溶液中的胶体粒子或高分子在一定条件下相互连接形成的三维网状结构,具有极高的孔隙率、极低的密度以及高表面积的多孔材料。目前,广泛应用于分离、吸附、催化、光电、传感器、生物医药等方面。生物质凝胶材料因其在具备传统凝胶特性的同时融入了自身的优异性能,如良好的生物相容性和可降解性,在制药业和化妆品等方面具有很大的应用,俨然成为研究热点。
纤维素是自然界最富含的生物质材料,其良好的生物兼容性能使其在医学领域广泛应用。纤维素经过一系列的化学或物理过程可以得到纤维素微纤以及纳米纤维素,纳米纤维素中纤维素分子链近乎完美的排列,使纳米纤维素具有良好的机械性能,同时纤维素微纤又具有成本低、密度低、较好的生物兼容性、容易分离、可再生、封存二氧化碳、可生物降解、易化学或物理改性等优点。
专利CN105524956A公布了一种医用细菌纤维素凝胶,该专利以能分泌细菌纤维素的菌株活化制备成种子液;将明胶加入水中,加热搅拌制得明胶溶液;将海藻酸用氢氧化钠溶液加热溶解,配制成海藻酸钠黄色乳状溶液;将制备的种子液、明胶溶液和海藻酸钠溶液混合,搅拌均匀,将丙三醇添加至上述的混合溶液中,将共混液进行过滤、静置制得纤维素凝胶,该凝胶可以较好的应用于生物医用领域,但制备过程较为复杂。专利CN102666669A公开了一种纤维素纳米粒气凝胶、水凝胶和有机凝胶的制备方法,该专利将纳米纤维素与水、有机溶剂以及金属纳米粒子复合制备出各种不同类型的复合水凝胶和气凝胶,该专利提供的纳米纤维素气凝胶和水凝胶应用广泛,但由于成凝方法是通过直接的浓度控制的方法实现凝胶,因此相对力学性能较差,且在纳米纤维素中复合金属粒子等使其在医学领域应用受到限制。专利CN106084259A公开了一种纤维素水凝胶的制备方法,该方法将普通的植物纤维溶解浆置于由甲醇、乙醇、N‐N二甲基乙酰胺、异丙醇或水其中两种溶剂组成的混合溶液中,然后加入NaOH或KOH。反应后加入醋酸钠、氯乙酸钠或硫代乙酸钠中的一种或两种,反应;过滤后的纤维溶于水制成纤维水溶液,并将溶液置于高速乳化机进行分散;将分散液旋转蒸发至粘稠状态常温搅拌,烘干得到,该方法在纤维素凝胶过程中引入了过多的化学试剂使最后的溶剂置换和洗涤更加困难且引入过多的化学试剂不利于凝胶在医用领域的应用。
技术实现要素:
针对传统纤维素凝胶材料制备复杂,成胶过程需借助重金属粒子或化学引发以致造成纤维素凝胶的应用和清洗困难的问题,本发明提供一种通过在TEMPO氧化的带有负电荷的纳米纤维素中加入一定比例的部分脱乙酰带有正电荷的纳米甲壳素作为物理交联剂,通过正负电荷相互组装的物理交联方法生成纳米纤维素/纳米甲壳素水凝胶并将抗癌药物负载到该水凝胶中制备出纳米生物质基的抗癌缓释凝胶,该方法操作简单,成本低,成胶效果显著。
本发明通过以下技术方案实现。
一种纳米生物质基抗癌缓释凝胶的制备方法,包括如下步骤:
(1)在漂白的浆板中加入水,使水漫过浆板,然后在纤维素解离机中疏解,再化学氧化疏解后的纤维素分散液;
(2)测定氧化后纤维素的固含量,配制纤维素分散液置于超细胞粉碎机中超声即得到带负电荷的纳米纤维素分散液,低温密封保存;
(3)将甲壳素原料去蛋白、去矿物质、漂白后烘干,将烘干后的甲壳素进行部分脱乙酰处理,然后加入质子酸调节PH=3-4之间对部分脱乙酰的甲壳素进行质子化处理;
(4)测定质子化后的甲壳素的固含量,配制甲壳素分散液置于超细胞粉碎机中超声即得带正电荷的纳米甲壳素分散液,低温密封保存;
(5)将纳米甲壳素分散液加入纳米纤维素分散液中,并搅拌使纳米甲壳素与纳米纤维素相互物理交联形成纳米纤维素/纳米甲壳素水凝胶;
(6)将纳米纤维素/纳米甲壳素水凝胶干燥,然后置于抗癌药物的PBS溶液中浸润,再将润胀的纳米纤维素/纳米甲壳素水凝胶再次干燥得到纳米生物质基抗癌缓释凝胶。
优选的,步骤(1)所述漂白的浆板的原料为秸秆、阔叶木、麦草、针叶木、甘蔗渣等一切含有纤维素的生物质原料。所述化学氧化所用试剂为2,2,6,6-四甲基哌啶氧化物0.012-0.020g/g纤维素、次氯酸钠8-22mmol/g纤维素、溴化钠0.10-0.20g/g纤维素;所述化学氧化的温度为30-40℃,PH=10-10.5。
优选的,步骤(1)、(4)所述密封保存的温度为4℃。
优选的,步骤(2)所述纤维素分散液的质量浓度为1.5-2%;所述超声的时间为30-60min。
优选的,步骤(3)所述甲壳素原料来源于废弃的虾壳、蟹壳或鱿鱼顶骨;所述质子酸为醋酸、抗坏血酸、葡萄糖酸、葡萄糖醛酸、乙醇酸、乳酸、天冬氨酸、衣康酸、苹果酸、丙二酸、琥珀酸、酒石酸和柠檬酸等中的一种以上。
优选的,步骤(3)中采用0.1-0.5mol/L氢氧化钠溶液浸泡甲壳素原料1-3h去除残余蛋白,然后用去离子水洗至中性,再采用2-4mol/L的盐酸浸泡2-5h去除矿物质,然后用去离子水洗至中性,再采用0.02-0.05mol/L的亚氯酸钠溶液浸泡1-3h对处理后的甲壳素进行漂白;烘干漂白后的甲壳素,然后将烘干后的甲壳素在60-95℃下浸泡在质量分数为25-33%的氢氧化钠溶液中1-3h进行部分脱乙酰处理。
优选的,步骤(4)所述甲壳素分散液的质量浓度为1.5-2%;所述超声的时间为30-60min。
优选的,步骤(5)所述纳米甲壳素与纳米纤维素的相互交联是通过正负电荷的自组装交联方式形成网状水凝胶结构。
优选的,步骤(5)所述搅拌是机械搅拌10-20min。
优选的,步骤(5)所述纳米甲壳素分散液的质量占混合分散液质量的10-90%,所述纳米纤维素分散液的质量占混合分散液质量的10-90%,所述混合分散液纳米是甲壳素分散液和纳米纤维素分散液的混合液。
优选的,步骤(6)所述干燥为在50-60℃真空干燥5-8h;所述浸润的时间为18-24h,进一步优选为24h。
优选的,步骤(6)所述抗癌药物为5-氟尿嘧啶、紫杉醇和多西他赛等中的一种以上;所述抗癌药物的PBS溶液的浓度为0.2-0.5mg/ml;用量为20ml-40ml。
由以上所述的制备方法制得的一种纳米生物质基抗癌缓释凝胶。
与现有技术相比,本发明具有以下优点:
1、由于本发明使用的制备、反应、干燥设备简单常见,不需要添加贵重设备,因此可低成本地实现制备工艺。
2、本发明所提供的纳米生物质基抗癌缓释凝胶,是由TEMPO氧化后带负电荷的纳米纤维素和部分脱乙酰后带正电荷的纳米甲壳素通过正负电荷的组装物理交联得到,是天然的生物质基凝胶。
3、本发明所提供的一种纳米生物质基抗癌缓释凝胶的制备方法,工艺简单,所需材料来源广泛,制备成本低,得到的凝胶属于高附加值产品。该制备方法可高效利用自然生物质原料,提高其使用价值,为高效纳米生物医学材料的制备提供另一条思路和途径。
附图说明
图1a是纯纳米甲壳素的电镜图。
图1b是纯纳米纤维素的电镜图。
图1c是20%纳米甲壳素/80%纳米纤维素水凝胶的电镜图。
图1d是40%纳米甲壳素/60%纳米纤维素水凝胶的电镜图。
图1e是60%纳米甲壳素/40%纳米纤维素水凝胶的电镜图。
图1f是80%纳米甲壳素/20%纳米纤维素水凝胶的电镜图。
图2是纳米纤维素/纳米甲壳素混合凝胶的弹性模量性能图。
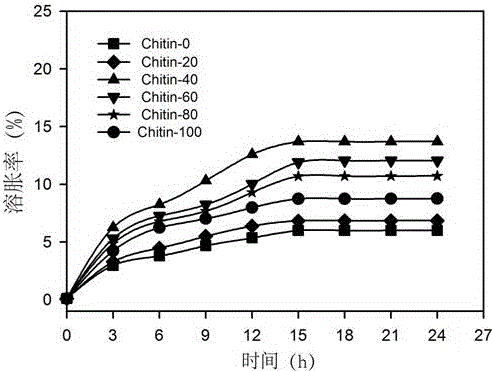
图3是纳米纤维素/纳米甲壳素混合凝胶的溶胀性能图。
图4是5-氟尿嘧啶溶液的吸光度与浓度关系曲线图。
图5是负载5-氟尿嘧啶的凝胶药物释放曲线图。
具体实施方式
下面结合本发明实施例与附图对本发明的具体实施作进一步地说明,但本发明的实施方式不限于此。
实施例1
将10g漂白的桉木浆板加蒸馏水,使其漫过浆板,然后在纤维素解离机中疏解,每克浆料采用0.016gTEMPO、20mmol次氯酸钠、0.16g溴化钠,所述氧化温度为30℃,在PH=10.5下氧化疏解后的纤维素直到使其PH值保持稳定。测定氧化后纤维素的固含量,加去离子水配制质量浓度为1.6%的纤维素分散液置于超细胞粉碎机中超声30min即得到表面带负电荷的纳米纤维素分散液,置于4℃下密封保存,该纳米纤维素表面带电荷量为-42.56mv,纳米纤维素的羧基含量为1.2mmol/g。
将10g废弃的虾壳浸泡在0.1mol/L氢氧化钠溶液中1h去除残余蛋白,然后用去离子水洗至中性,接着浸泡在2mol/L的盐酸中3h去除矿物质并用去离子水洗至中性,最后浸泡在0.02mol/L亚氯酸钠溶液中1h对处理后的甲壳素进行漂白,漂白后烘干,将烘干后的甲壳素浸泡在33 wt%的NaOH溶液中2h在90℃下进行部分脱乙酰处理,然后加入醋酸调节pH=3.5对部分脱乙酰的甲壳素质子化处理,测定质子化后的甲壳素的固含量,加去离子水配制质量浓度为1.6%的甲壳素分散液置于超细胞粉碎机中超声30min即得到表面带正电荷的纳米甲壳素分散液,置于4℃下密封保存,该纳米甲壳素带电荷量为+43.25mv。
实施例2
将实施例1制备的纳米甲壳素分散液在55℃下真空干燥5h,称取0.1g干燥的纳米甲壳素,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液中,浸润24h使其完全润胀,然后将润胀的纳米甲壳素再次在55℃下真空干燥5h,得到载药纳米甲壳素,其带电荷量为+43.25mv,载药量为341微克,图1a为冷冻干燥后纳米甲壳素的电镜图,纳米甲壳素分散液的弹性模量见图2,图2中,cellulose表示纳米纤维素,Chitin表示纳米甲壳素,Chitin-20表示纳米甲壳素20%的混合凝胶,Chitin-40表示纳米甲壳素40%的混合凝胶,Chitin-60表示纳米甲壳素60%的混合凝胶,Chitin-80表示纳米甲壳素80%的混合凝胶。
实施例3
将实施例1制备的纳米纤维素分散液在55℃下真空干燥5h,称取0.1g干燥的纳米纤维素,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液,浸润24h使其完全润胀,然后将润胀的纳米纤维素再次在55℃下真空干燥5h,得到载药纳米纤维素,其带电荷量为-42.56mv,载药量为233.6微克,图1b为冷冻干燥后纳米纤维素的电镜图,纳米纤维素分散液的弹性模量见图2。
实施例4
将实施例1制备的2ml纳米甲壳素分散液加入8ml纳米纤维素分散液中机械搅拌20min使其相互交联形成20%纳米甲壳素/80%纳米纤维素水凝胶,将20%纳米甲壳素/80%纳米纤维素水凝胶在55℃下真空干燥5h,称取0.1g干燥的凝胶,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液,浸润24h使其完全润胀,然后将润胀的纳米纤维素/纳米甲壳素水凝胶在55℃下再次真空干燥5h得到纳米生物质基抗癌缓释凝胶,该凝胶的带电荷量为-17.47mv,凝胶载药量为267微克,图1c为冷冻干燥后20%纳米甲壳素/80%纳米纤维素水凝胶的电镜图,20%纳米甲壳素/80%纳米纤维素水凝胶的弹性模量见图2。
实施例5
将实施例1制备的4ml纳米甲壳素分散液加入6ml纳米纤维素分散液中机械搅拌20min使其相互交联形成40%纳米甲壳素/60%纳米纤维素水凝胶,将40%纳米甲壳素/60%纳米纤维素水凝胶在55℃下真空干燥5h,称取0.1g干燥的凝胶,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液,浸润24h使其完全润胀,然后将润胀的纳米纤维素/纳米甲壳素水凝胶在55℃下再次真空干燥5h得到纳米生物质基抗癌缓释凝胶,该凝胶的带电荷量为+1.21mv,凝胶载药量为533.70微克,图1d为冷冻干燥后40%纳米甲壳素/60%纳米纤维素水凝胶的电镜图,40%纳米甲壳素/60%纳米纤维素水凝胶的弹性模量见图2。
实施例6
将实施例1制备的6ml纳米甲壳素分散液加入4ml纳米纤维素分散液中机械搅拌20min使其相互交联形成60%纳米甲壳素/40%纳米纤维素水凝胶,将60%纳米甲壳素/40%纳米纤维素水凝胶在55℃下真空干燥5h,称取0.1g干燥的凝胶,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液,浸润24h使其完全润胀,然后将润胀的纳米纤维素/纳米甲壳素水凝胶在55℃下再次真空干燥5h得到纳米生物质基抗癌缓释凝胶,该凝胶的带电荷量为+10.19mv,凝胶载药量为469.80微克,图1e为冷冻干燥后60%纳米甲壳素/40%纳米纤维素水凝胶的电镜图,60%纳米甲壳素/40%纳米纤维素水凝胶的弹性模量见图2。
实施例7
将实施例1制备的8ml纳米甲壳素分散液加入2ml纳米纤维素分散液中机械搅拌20min使其相互交联形成80%纳米甲壳素/20%纳米纤维素水凝胶,将80%纳米甲壳素/20%纳米纤维素水凝胶在55℃下真空干燥5h,然后置于20ml 0.5mg/ml的5-氟尿嘧啶的PBS溶液,浸润24h使其完全润胀,称取0.1g干燥的凝胶,然后将润胀的纳米纤维素/纳米甲壳素水凝胶在55℃下再次真空干燥5h得到纳米生物质基抗癌缓释凝胶,该凝胶的带电荷量为+37.79mv,凝胶载药量为417.50微克,图1f为冷冻干燥后80%纳米甲壳素/20%纳米纤维素水凝胶的电镜图,80%纳米甲壳素/20%纳米纤维素水凝胶的弹性模量见图2。
实施例8
在PBS中分别配制浓度为0.02mg/ml、0.04mg/ml、0.06mg/ml、0.08mg/ml、0.10mg/ml、0.12mg/ml的5-氟尿嘧啶溶液,采用UV-分光光度仪测定配制溶液在266nm处的吸光度,建立吸光度与浓度的标准曲线,曲线方程为y=31.7502x+0.1483,其中x为浓度,y为吸光度,图4为5-氟尿嘧啶溶液吸光度与浓度的关系曲线图。
实施例 9
将实施例4-7制备的纳米生物质基抗癌缓释凝胶在未进行药液吸收前,在55℃下真空干燥5h,称取干燥后的凝胶0.1g,然后分别浸入20ml去离子水中,并以150rpm磁性搅拌,其中每间隔3h取出水凝胶并将其置于滤纸上静置5min,然后用滤纸吸去凝胶表面的去离子水,称取凝胶的吸液重量,依次重复上述实验直至凝胶达到溶胀平衡即吸液量保持稳定,然后得到凝胶的溶胀曲线,图3为纳米生物质基抗癌缓释凝胶的溶胀曲线图,其中Chitin-0表示纳米纤维素,Chitin-100表示纳米甲壳素,Chitin-20表示纳米甲壳素20%的混合凝胶,Chitin-40表示纳米甲壳素40%的混合凝胶,Chitin-60表示纳米甲壳素60%的混合凝胶,Chitin-80表示纳米甲壳素80%的混合凝胶。
实施例 10
将实施例4-7制备的纳米生物质基抗癌缓释凝胶分别浸入20mlPBS溶液中,并以150rpm磁性搅拌24h,其中每间隔3h取4ml溶液并加入4ml PBS新鲜溶液,确保缓释溶液体积不变,采用UV-分光光度仪测定配制溶液在266nm处的吸光度,计算不同时间药物缓释量,图5为纳米生物质基抗癌缓释凝胶的药物缓释曲线,由图5可知,本发明的纳米生物质基抗癌缓释凝胶具有缓释效果。
各位技术人员须知:虽然本发明已按照上述具体实施方式做了描述,但是本发明的发明思想并不仅限于此发明,任何运用本发明思想的改装,都将纳入本专利专利权保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!