一种岩藻多糖在制备PC‑12细胞或MKN‑45细胞活性抑制剂中的应用的制作方法
本发明涉及一种岩藻多糖在抗肿瘤中的应用,特别涉及一种岩藻多糖在制备PC-12细胞或MKN-45细胞活性抑制剂中的应用。
(二)
背景技术:
海洋藻类作为一种新的生物活性物质的来源正在迅速被研究,我国藻类资源十分丰富,特别是褐藻(Phaeophyta)资源,是海藻生产和消费大国。褐藻(Phaeophyta)是海洋藻类中的第二大种群,分为25个属,大约有1500种,是生长在海洋中的低等植物,在很多国家,褐藻(Phaeophyta)如墨角藻(Fucus),海带(Laminaria japonica),羊栖菜(Hizikiafusifarme)等作为食品来食用。褐藻中含有的多糖成分,如褐藻胶,岩藻多糖,褐藻淀粉等,均已在医药原料中广泛的应用。
岩藻多糖(Fucoidan)是Kylin在1913年首次从掌状海带中提取的,它是褐藻中所固有的细胞间多糖,存在于细胞壁基质中。研究表明岩藻多糖具有广泛的生物活性如抗氧化,抗肿瘤,抗凝血,抗病毒等。岩藻多糖不仅能够增强人体免疫力,还可以诱导肿瘤细胞凋亡,被认为是重要的自由基清除剂和抗氧化剂,岩藻多糖在功能性食品和药品行业具有很大的发展潜力。
岩藻多糖是以L-岩藻糖和硫酸基为主要特征的一类水溶性多糖,并伴有其他单糖(如半乳糖、甘露糖、木糖、葡萄糖醛酸、阿拉伯糖、鼠李糖)的杂多糖。岩藻多糖结构十分复杂,一方面不同褐藻的岩藻多糖,化学组成不尽相同,除了主要成分岩藻糖、硫酸基、其他单糖(甘露糖、半乳糖、葡萄糖等)以及糖醛酸外,有些还具有乙酰基和蛋白质;另一方面不同种褐藻中的岩藻多糖的结构也不相同,并且由不同提取方法得到的岩藻多糖分子量和结构也会不同。褐藻中的岩藻多糖,单糖组成以L-岩藻糖为主,L-岩藻糖通过α-(1→2),α-(1→3)或α-(1→4)连接构成主链,主链除了由岩藻糖构成还含有其他单糖,并且有较多的分支。硫酸基主要结合在C-2或C-4位上,平均每两个岩藻糖基含有一个硫酸基。
(三)
技术实现要素:
本发明目的是提供一种岩藻多糖在制备PC-12细胞或MKN-45细胞活性抑制剂中的应用,本发明从海带中获得纯度高达71%-92%岩藻多糖的方法,提供测定岩藻多糖抗氧化及抗肿瘤活性的方法。
本发明采用的技术方案是:
本发明提供一种岩藻多糖在制备PC-12细胞或MKN-45细胞活性抑制剂中的应用。
进一步,所述岩藻多糖按如下方法制备:将干海带粉与溶剂混合,在60-100℃浸提1-5h,将提取液5000-10000r/min离心,取上清液50℃-70℃减压浓缩至1/2-1/15体积(优选浓缩至1/10),然后加1M CaCl2水溶液至无沉淀产生,搅拌4h,离心,取上清液,加入无水乙醇至乙醇体积浓度为60-90%(优选75%),搅拌,在4℃下静置过夜,离心,沉淀冻干,得粗岩藻多糖;将粗岩藻多糖用纯水制成质量浓度为2%(m/m)的溶液,上样DEAE-52纤维素阴离子交换柱(3.2cm×22cm),分别用纯水,1.0M NaCl水溶液,2.0M NaCl水溶液进行洗脱,分别收集三种洗脱馏分的流出液,经透析(14KDa),冻干(6-10小时),获得岩藻多糖;所述溶剂为体积浓度95%乙醇水溶液或纯水;所述溶剂体积用量以干海带粉质量计为25-50ml/g。
进一步,优选所述溶剂为纯水。
进一步,优选所述溶剂体积用量以干海带粉质量计为40ml/g;所述浸提条件为90℃浸提3h。
本发明取岩藻多糖的原料可以是人工养殖的海带,也可以是野生褐藻马尾藻(Scagassum)。
本发明所述纯水是指去离子水。
与现有技术相比,本发明有益效果主要体现在:
1)采用本发明的制备方法制取岩藻多糖作为抗肿瘤(PC-12,MKN-45)及抗氧化剂,具备纯度高(71%-92%),操作简单,反应条件易于控制、工艺成本低等特点。
2)本发明的制备方法制取分离得到的岩藻多糖(FCSP,FCSP-1,FCSP-2,FCSP-3),其抗肿瘤(PC-12,MKN-45)抑制率要高于市售岩藻多糖(纯度80%,来自于陕西天然原料汇)对PC-12,MKN-45的抑制率。
3)采用本发明制备的岩藻多糖作为抗肿瘤(PC-12,MKN-45)及抗氧化剂,也可以用于食品添加剂产品可制成粉剂、水剂、针剂等剂型。
(四)附图说明
图1为FCSP,FCSP-1,FCSP-2,FCSP-3的羟基自由基清除活性图,a为FCSP的羟基自由基清除活性,b为FCSP-1的羟基自由基清除活性,c为FCSP-2的羟基自由基清除活性,d为FCSP-3的羟基自由基清除活性。
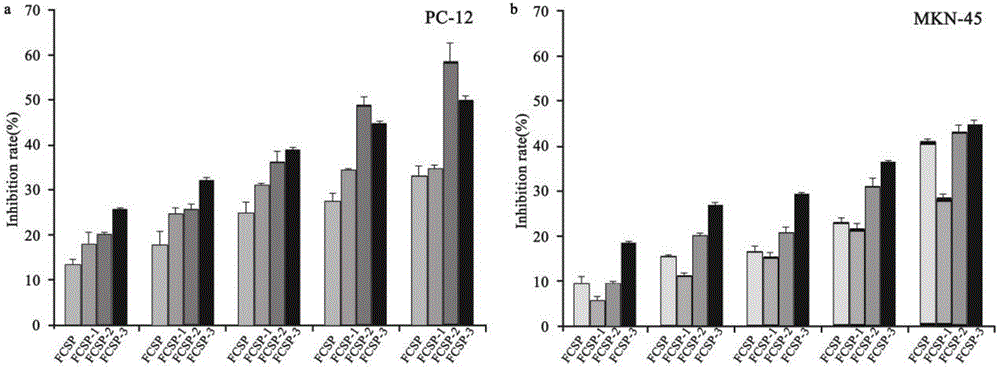
图2为FCSP,FCSP-1,FCSP-2,FCSP-3抗肿瘤(PC-12、MKN-45)抑制率图,a为FCSP,FCSP-1,FCSP-2,FCSP-3抗PC-12抑制率,b为FCSP,FCSP-1,FCSP-2,FCSP-3抗MKN-45抑制率。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:水煮法工艺优化提取岩藻多糖
(1)溶剂体积对多糖得率的影响:分别称取15份1.00g干海带粉(80目),分五批。每一批加入纯水的体积为25.0mL,30.0mL,35.0mL,40.0mL,45.0mL,50.0mL。在90℃下,水浴2h。离心,取上清液,用纯水纯水定容至250.0mL,作为储备液,60℃下减压烘干计算多糖得率。取2.0mL储备液,用纯水定容至100.0mL,作为待测液,使用硫酸苯酚法测定多糖含量。
(2)时间对多糖得率的影响:分别称取15份1.00g干海带粉(80目),分五批,分别加入纯水35mL。每一批设置提取时间分别为1h,2h,3h,4h,5h。温度为90℃,料液比为1:35。离心,取上清液,用纯水定容至250.0mL,作为储备液,60℃下减压烘干计算多糖得率。取2.0mL储备液,用纯水定容至100.0mL,作为待测液,使用硫酸苯酚法测定多糖含量。
(3)温度对多糖得率的影响:分别称取15份1.00g干海带粉(80目),分五批,分别加入纯水35mL。每一批温度设置为60℃,70℃,80℃,90℃,100℃。料液比1:35,时间3h。离心,取上清液,用纯水定容至250.0mL,作为储备液,60℃下减压烘干计算多糖得率。取2.0mL储备液,用纯水定容至100.0mL,作为待测液,使用硫酸苯酚法测定多糖含量。
上述待测液分别使用硫酸苯酚法测定多糖含量(参照Dubois,M.,et al.(2002).Colorimetric Method for Determination of Sugars and Related Substances.Analytical Chemistry,28(3):p.350-356.),以多糖储备液减压蒸干得到固体质量与投料质量之比计算多糖得率。
表1水煮法提取,料液比,提取时间,提取温度对岩藻多糖提取的影响
在单因素提取优化基础上,以多糖含量和多糖得率为评价指标,采用L9(33)正交设计,研究A(提取温度,℃)、B(提取时间,h)、C(料液比)对岩藻多糖水煮法提取的影响,确定最佳提取工艺条件。
表2为本发明正交试验的表头设计
表3为正交试验数据确定最佳提取工艺条件
本发明中海带岩藻多糖的水煮最佳提取工艺条件为A3B2C3,即提取温度90℃,提取时间3h,料液比为1:40。在此条件下,岩藻多糖得率最大。显著性分析(表4)。
表4显著性分析
实施例2:水煮法提取岩藻多糖以及分离纯化
(1)称取干海带粉(80目)40.0g,加入1600mL水(即料液比1:40),在90℃下,提取3h,然后在8000rpm下离心10min,过滤,滤渣加入1600ml水在同样条件下重新再提取一次,取离心后的上清液,两次合并,即为提取液。将提取液体积浓缩至1/10,然后加1M CaCl2水溶液至无沉淀产生,搅拌4h,离心,取上清液,加入无水乙醇至乙醇体积浓度为75%,搅拌,在4℃下静置过夜,离心,沉淀冻干,得粗岩藻多糖FCSP4.5g。
(2)称取步骤(1)1.0g粗岩藻多糖FCSP,用纯水配置浓度为2%(m/m)的溶液,上样DEAE-52纤维素阴离子交换柱(3.2cm×22cm),分别用纯水,1.0M NaCl水溶液,2.0M NaCl水溶液进行洗脱,得到馏分FCSP-1,馏分FCSP-2,馏分FCSP-3,每个馏分用硫酸苯酚法检测,然后用14KDa的透析袋截留透析10h,取截留液冻干,即为岩藻多糖。
表5岩藻多糖馏分成分含量
实施例3:岩藻多糖抗氧化活性
(1)DPPH自由基清除实验:称取4mg 1,1-二苯基-2-三硝基苯肼(DPPH),用无水乙醇定容至100mL,浓度为0.1mM。配置0.1mL样品溶液(实施例2制备的粗岩藻多糖FCSP,馏分FCSP-1,馏分FCSP-2,馏分FCSP-3用纯水配制浓度0.20-3.00mg/mL,表6),分别加入3mL、0.1mM的DPPH/乙醇溶液,在暗处30℃下培养30min,在紫外波长517nm处,测吸光度。DPPH/乙醇溶液作为空白对照。
计算公式DPPH清除率(%)=(1-As/Ac)
As是样品吸光值,Ac是用无水乙醇做空白吸光值。
表6为岩藻多糖FCSP作为抗氧化剂DPPH自由基清除率
(2)羟基自由基清除实验:配置样品浓度为1.00-4.50mg/mL(实施例2制备的粗岩藻多糖FCSP,馏分FCSP-1,馏分FCSP-2,馏分FCSP-3用纯水配制),移取0.5mL样品于0.5mL水杨酸-乙醇体系(9.0mM)中,然后加入7.5mM FeSO4(溶剂是水)(1.0mL),质量浓度0.1%H2O2(溶剂是水)(1.0mL),在37℃水浴下保持30min,在紫外波长510nm处,测定吸光度。
FCSP,FCSP-1,FCSP-2,FCSP-3的羟基自由基清除活性如图1。
清除率(%)=(Ac-As)/Ac
As是样品吸光值,Ac是用无水乙醇做空白吸光值。
结果如图1,FCSP抑制效率最高,其EC50是3.4mg/mL。FCSP-1,FCSP-2,FCSP-3在4.5mg/mL时,羟基自由基抑制率分别为20.26±0.08%,17.57±0.11,19.89±0.07%。
实施例4:岩藻多糖抗肿瘤活性
(1)细胞复苏:从液氮罐中取出冷冻的鼠嗜铬细胞瘤PC-12细胞(由浙江大学药学院提供),37℃水浴解冻,将鼠嗜铬细胞瘤PC-12细胞转移到含10mL含10%胎牛血清的DMEM-1640培养基的15mL离心管中,3000r/min,离心1min,倒掉液体,加入5mL含10%胎牛血清的DMEM-1640培养基,并吹散细胞,随后转移到细胞培养瓶中,将培养瓶放置在37℃,含有5%的CO2培养箱中培养24h;(2)细胞培养:将步骤(1)中培养24h的细胞进行换液,倒掉培养基,加入5mLPBS清洗,倒掉PBS,再加入5mL含10%胎牛血清的DMEM-1640培养基,放置在37℃,含有5%的CO2培养箱中培养24h;(3)细胞传代:将步骤(2)中培养的细胞进行传代,倒掉培养基,加入5mLPBS清洗,倒掉PBS,加入1mL胰酶,进行消化,直到细胞变圆脱离培养瓶壁,转移出胰酶,再加入15mL含10%胎牛血清的DMEM-1640培养基,再分别转移出5mL培养基到两瓶培养瓶中,将三瓶培养瓶放置在培养箱中,放置在37℃,含有5%的CO2培养箱中培养48h;(4)细胞种板:将步骤(3)中培养的细胞转移到96微孔板中,5×104个/mL,每孔100μL含10%胎牛血清的DMEM-1640培养基,放置在37℃,含有5%的CO2培养箱中培养24h;(5)细胞加药:将步骤(4)中的培养基转移出来,加入200μL样品溶液(样品溶液是将实施例2制备的粗岩藻多糖FCSP,馏分FCSP-1,馏分FCSP-2,馏分FCSP-3用含10%胎牛血清DMEM-1640培养基溶解制成终浓度分别为62.5μg/mL,125μg/mL,250μg/mL,500μg/mL,1000μg/mL的样品溶液),放置在37℃,5%的CO2培养箱中培养24h;(6)加MTT:向步骤(5)中细胞加入15μL MTT(5mg/mL)进行染色,放置在37℃,含有5%的CO2培养箱中培养4h,然后将培养基转移出去,加入150μL DMSO,振荡10min,在紫外波长570nm处测定吸光度,结果见图2。
同样条件下,将上述鼠嗜铬细胞瘤PC-12换成人胃癌细胞MKN-45(由浙江大学药学院提供),将含10mL含10%胎牛血清的DMEM-1640培养基换成含10%胎牛血清的RPMI-1640培养基,以市售岩藻多糖为对照,结果见图2。
细胞抑制率(%)=(1–As/Ac)×100%As样品组570nm吸光值,Ac空白组570nm吸光值。
结果表明,在浓度为1000μg/mL时,馏分FCSP-2对PC-12、MKN-45的抑制率分别为58.93±3.93%、42.18±0.55%,而市售岩藻多糖(纯度80%,来自于陕西天然原料汇)抑制率分别为33.27±1.26%,20.87±2.78%。FCSP、FCSP-1和FCSP-3对PC-12也有较高的抑制率(33.34±2.02%、35.17±0.47%、50.06±0.77%)。FCSP-3对MKN-45的抑制率最高为45.18±1.44%。因此,本发明制备的岩藻多糖(FCSP-2)对(鼠嗜铬细胞瘤(PC-12),人胃癌细胞(MKN-45)的抑制活性比市场上岩藻多糖对这两种细胞的抑制活性高25%,22%。
- 还没有人留言评论。精彩留言会获得点赞!