在流体增强消融中用于塑形治疗的装置和方法与流程
相关申请
此申请要求2011年4月12日提交的序列号为61/474,574且名称为 "Improvement in Ablation Catheters(消融导管的改进)"的美国临时申请的优先权。此申请还分别地涉及申请号为13/445,034名称为"Devices and Methods for Remote Temperature Monitoring in Fluid Enhanced Ablation Therapy(用于流体增强消融治疗中的远程温度监控的装置和方法)"的、申请号为13/445,036名称为"Methods and Devices for Heating Fluid in Fluid Enhanced Ablation Therapy(在流体增强消融治疗中用于加热流体的方法和装置)"的、申请号为13/445,373名称为"Methods and Devices for Controlling Ablation Therapy(用于控制消融治疗的方法和装置)"的以及申请号为13/445,040名称为"Devices and Methods for Use of Degassed Fluids with Fluid Enhanced Ablation Devices(通过流体增强消融装置使用去气流体的装置和方法)"的美国申请,并且这些申请与本申请同时提交。这些申请中的每个的公开内容都通过引用而全部并入本文。
技术领域
本发明总体涉及流体增强消融,例如SERFTM消融技术(盐增强射频TM消融)。更具体地,本发明涉及用于控制在流体增强消融期间所产生的处理区的形状的装置和方法。
背景技术:
使用热能来破坏身体组织可应用于各种治疗过程,包括肿瘤的破坏。可使用各种形式的能来将热能施用于组织,例如射频电能、微波或光波电磁能或超声振动能。射频(RF)消融例如可通过如下来实现:将一个或更多电极抵靠待处理的组织放置或放置入待处理的组织中并且将高频率电流传输入组织。电流可在紧密间隔的发射电极之间流动或在发射电极和更大的共用电极之间流动,共用电极远离待加热的组织定位。
这些技术的一个缺点在于最大加热通常出现在治疗工具和组织之间的界面处或附近。例如,在RF消融中最大加热可出现在紧邻发射电极的组织中。这可降低组织的传导性并且在一些情况中可导致组织内的水沸腾并且变成水蒸气。随此过程继续,组织的阻抗可增加并阻止电流进入周围组织。因此常规的RF仪器受到可处理的组织的体积的限制。
流体增强消融治疗,例如SERF消融技术(盐增强射频TM消融)比常规RF消融可处理更大体积的组织。通过引用并入本文的美国专利号6,328,735中描述了SERF消融技术。使用SERF消融技术,盐通过针管传输并且被加热,且加热的流体输送至紧密围绕针管的组织。盐帮助分配针管附近发展的热量并且从而允许用治疗剂量的消融能使更大体积的组织被处理。一旦目标体积的组织达到所期望的治疗温度或另外接受治疗剂量的能,通常就完成了治疗。
流体增强消融治疗通常在消融装置周围的组织中产生球状的处理区。然而,在一些情况中,可能期望产生具有非球状的处理区。例如,一些组织损伤或肿瘤适合于用非球状的流体增强消融来处理。此外,可能期望保护特定结构,例如处于非常接近组织损伤或其它目标体积的组织处的敏感神经细胞。
还在其它情况中,可能期望将定向性引入使用消融治疗产生的处理区中。例如,用于心律不整(例如心房颤动)的常规处理涉及基于导管的过程,其选择性地消融心房壁中的组织以便产生用于驱动心跳的电信号通过的限定途径。然而,目前的消融治疗的方法不能在心室中产生类似于这些定向的途径的处理区,因为它们不能穿过心室壁加热,所以此技术不能应用于室性心动过速的处理。流体增强消融能够穿过心室壁加热,但产生的消融区过大以致不可能产生用于电信号的途径,因为过多的心脏被消融。
因此,还存在对于用于塑形在流体增强消融治疗期间产生的处理区的改良的装置和方法的需求。
技术实现要素:
本发明总体提供通过控制处理区的塑形来用于改良消融治疗的装置和方法。在本发明的一方面中,提供了一种用于形成组织中具有期望形状的消融处理体积的方法,包括输送治疗能至组织以形成组织中的消融处理体积,并且同时输送第一流体和第二流体至组织,第一和第二流体沿期望的方向对流传递治疗能,使得消融处理体积具有期望的形状。
在一些实施例中,该方法可还包括输送另外的流体至组织以与第一流体和第二流体结合。例如,在一些实施例中,可引入第三、第四、第五等等流体。这些流体中的每个均可被引入组织中,使得它们相互作用以形成期望形状的消融处理体积。可利用任何数量的流体。
在一些实施例中,可以不同的温度输送第一和第二流体。多个不同温度可被选择以用于第一和第二流体。在一些实施例中,第一流体可处于大约50℃。在其它实施例中,第二流体可处于大约37℃。然而,任何温度均可被选择以用于第一或第二流体。并且,该方法可在患者身体内的各种位置使用。在某些实施例中,例如,组织可在心脏中。在其它实施例中,例如,组织可在肝脏中。又在其它实施例中,组织可为任意的前列腺、子宫、肾脏、肺、乳房中或可为患者身体内的任何其它器官或组织。
在某些实施例中,第一和第二流体可通过插入组织中的一个或多个长形主体输送。此外,该方法可包括用于促进消融处理体积的塑形的各种其它步骤。例如,该方法可还包括调节第一流体和第二流体中的任一者的流体流率和流体温度中的任一者以进一步塑形消融处理体积。类似地,该方法可还包括调节输送至组织的治疗能水平以进一步塑形消融处理体积。在一些实施例中,输送治疗能至组织可包括激活构造成将电能传输入组织中的消融元件。此外,在其它实施例中,该方法可还包括在多个位置重复输送治疗能和同时输送第一流体和第二流体的步骤以形成具有长形平面形状的处理体积。
在一些实施例中,第一流体可从长形主体的内腔的第一和第二相对的纵向部分输送,并且第二流体可从内腔的第三和第四相对的纵向部分输送。此外,第三和第四部分可与第一和第二部分径向偏置。
又在其它实施例中,输送第一流体可包括从形成在长形构件的侧壁的近侧部分中的至少一个出口端口射出第一流体,并且输送第二流体可包括从形成在邻近该近侧部分的长形构件的侧壁的远侧部分中的至少一个出口端口射出第二流体。
又在其它实施例中,该方法可包括从组织去除第一和第二流体以便进一步塑形消融处理体积。第一和第二流体可使用构造成从长形主体周围的组织吸出流体的诸如长形主体来选择性地被去除。
在本发明的另一个方面中,提供了一种用于塑形输送至组织的治疗能的方法,其包括在第一位置处将第一长形主体定位在患者身体内,其中,第一长形主体具有延伸穿过其中的内腔、在其中形成的至少一个出口端口、沿其长度布置的至少一个消融元件和布置在内腔内的至少一个加热器元件。该方法还包括在第二位置处将第二长形主体定位在患者身体内,其中第二长形主体具有延伸穿过其中的内腔和在其中形成的至少一个出口端口。该方法还包括同时输送来自第一长形主体的第一流体和来自第二长形主体的第二流体,使得第一和第二流体相互作用以塑形消融处理体积。
该方法可具有多种修改,所有的修改都被认为在本发明的范围内。在一些实施例中,例如,第一流体和第二流体可处于不同温度。在其它实施例中,该方法可还包括输送来自沿第一长形主体布置的消融元件的治疗能。在这样的实施例中,流体的相互作用可引导来自消融元件的能以塑形接受治疗能的组织的体积。
在其它实施例中,将第一长形主体定位在第一位置处和将第二长形主体定位在第二位置处可包括在患者身体中定位长形构件,长形构件具有置于其上的第一和第二长形主体。长形构件可例如为如下文描述的导管或其它长形轴或构件。并且,在一些实施例中,第二长形主体可定位在邻近待被保护以免受治疗能影响的结构的位置处,例如神经细胞群。
在本发明的另一个方面中,提供一种消融装置,其包括具有近侧端和远侧端的长形主体、延伸穿过长形主体的内腔和形成在长形主体中构造成输送流体至长形主体周围的组织的至少两个出口端口。长形主体还包括沿长形主体的远侧部分布置的至少一个消融元件,消融元件构造成当长形主体插入组织中时加热消融元件周围的组织。并且,该至少两个出口端口构造成输送处于不同温度的流体。
消融装置可具有各种构造和另外的特征。在一些实施例中,消融装置可还包括与两个出口端口的一个或多个关联的至少一个加热器元件,该至少一个加热器元件布置在内腔内并且构造成加热流至一个或多个关联的出口端口的流体。
在其它实施例中,消融装置可还包括至少一个分割构件,至少一个分割构件布置在内腔内并且构造成将内腔分割成彼此不呈流体连通的两个或多个部分。并且,每个部分可与至少两个出口端口的一个或多个连通。在某些实施例中,该至少一个分割构件可将内腔分割成沿内腔纵向延伸的四个部分,以便将内腔分割成具有相对的对的扇形体。加热器元件可布置在扇形体的第一相对的对的每个部分内,其构造成将流过其中的流体加热至第一个温度。并且,加热器元件可布置在扇形体的第二相对的对的每个部分内,其构造成将流过其中的流体加热至低于第一温度的第二温度。又在其它实施例中,该至少一个分割构件可将内腔分割成近侧部分和远侧部分,其中每个部分均与不同消融元件关联。该至少一个分割构件可还包括至少两个分割构件,至少两个分割构件进一步分割内腔以产生接近或远离该远侧部分的第三部分。在某些实施例中,该装置可还包括两个或多个温度传感器,并且每个温度传感器均可布置在内腔的不同部分中。
在本发明的另一个方面中,提供一种具有长形构件的消融装置,长形构件具有构造成用于引入患者身体中的远侧端。该装置还包括布置在长形构件远侧端上的至少两个长形主体。每个长形主体均包括近侧端和远侧端、延伸穿过其中的内腔和形成在长形主体中并且构造成输送流体至长形主体周围的组织的至少一个出口端口。长形主体中至少一个包括沿长形主体的远侧部分布置的至少一个消融元件并且消融元件构造成加热消融元件周围的组织。并且,长形主体中至少一个包括布置在长形主体的内腔内的加热器元件并且加热器元件构造成加热流过内腔的流体。
在一些实施例中,至少两个长形主体可包括第一、第二和第三长形主体,第一、第二和第三长形主体安排在围绕长形构件的远侧端距长形构件的纵轴线一定距离处。例如,第一、第二和第三长形主体可安排成使得它们彼此呈角度地偏置并且定位在距长形构件的纵轴线特定半径处。在其它实施例中,第一、第二和第三长形主体可呈直线地定位在长形构件的远侧端上。在这个实施例中,一个或多个长形主体可包括在其上的消融元件。
附图说明
根据结合附图进行的以下详细描述,将可以更完全地理解上文描述的本发明的方面和实施例,图中:
图1是流体增强消融系统的一个实施例的示意图;
图2是具有在流体增强消融中使用的长形主体的医疗装置的一个实施例的透视图;
图3是各种形式的消融的模拟加热曲线的图示;
图4是长形主体的远侧部分的侧视图,示出处理区随时间的扩展;
图5是通过本发明的流体增强消融系统的一个实施例可产生的处理区的横截面图;
图6是具有从导管纵向延伸的三个长形主体的消融装置的一个实施例的透视图;
图7A是包括长形主体的消融元件的一个实施例的透视图,长形主体具有内腔,内腔被分割成沿内腔纵向延伸的多个部分;
图7B是图7A的装置的横截面图,用箭头描绘了流体流,并示出了所得的处理区;
图8A是具有沿长形主体布置的多个消融元件的长形主体的一个实施例的侧视图;
图8B是图8A的长形主体的半透明透视图,示出长形主体被分割成近侧部分和远侧部分,它们可各自独立地接受处于给定温度的流体;
图9是外科手术处的一个实施例的横截面图,示出组织结构,输送处于第一温度的流体的第一长形主体以及输送处于第二温度的流体的第二长形主体,以形成非球形处理区;以及
图10是外科手术处的一个实施例的横截面图,示出输送流体和治疗能至处理区中的第一长形主体和从处理区吸出流体的第二长形主体。
具体实施方式
现在将描述某些示例性实施例以提供对于本文所公开的装置和方法的原理的总体理解。附图中展示了这些实施例的一个或多个范例。本领域技术人员将理解,本文具体描述以及附图中所展示的装置和方法是非限制性的示例性实施例,并且本发明的范围仅由权利要求限定。结合一个示例性实施例展示或描述的特征可与其它实施例的特征结合。这种修改和变化旨在包括在本发明的范围内。
术语“一(a)”和“一个(an)”可互相交换地使用,并且当在本申请中使用时等同于短语“一个或多个”。术语“包括”、“具有”、“含有”和“包含”除另外说明外,应解释成开放性术语(即表示“包括但不限于”)。用于任何数值或范围的术语“大约”和“近似”指出允许组成(composition)、零件或元件的集合发挥功能以用于如本文描述的其预期目的适当的尺寸公差。这些术语通常指围绕中心值±10%的变化。本文描述为被联接(coupled)部件可为直接联接或它们可经由一个或多个中间部件来间接联接。本文中任何数值范围的叙述除另外指出外仅旨在充当一一地列出落入该范围内的每个单独数值的便捷方法,并且每个单独数值都被并入说明书,就像它被一一地叙述一样。此外,就用于所公开的装置、系统和方法的描述中的直线和圆形尺寸来说,这些尺寸并非旨在限制可与这些装置、系统和方法协同使用的形状种类。本领域技术人员将认识到这种直线和圆形尺寸的等同物可容易地被确定成任意几何形状。
除非本文另外指出或另外明显与上下文抵触外,本文所描述的所有方法均可以以任何适合的顺序执行。本文提供的任何以及所有范例或示例性语言(例如“例如”)的使用仅旨在更好地阐明发明并且除另外声明外不对本发明的范围强加限制。说明书中没有任何语言应当解释为指出任何非声明元件对于本发明的实践为必要的。此外,就与任何实施例协同使用的本文中的术语“盐”来说,除明确指出外,这些实施例不限于使用“盐”而排斥其它流体。其它流体通常可以类似方式使用。
流体增强消融系统
本发明总体针对用于塑形使用流体增强消融产生的治疗或处理的区(zone)或带(region)的装置和方法。如上文提到的,流体增强消融被定义成将流体传输入组织中同时从消融元件输送治疗能。治疗能进入组织的输送可导致组织中的超高温,最终导致坏死。这种温度诱发的组织的选择性破坏可用于处理各种情况,包括肿瘤、纤维瘤、心律不整(例如,室性心动过速等)等。
美国专利第6,328,735号中所描述并在上文通过引用并入的流体增强消融,例如SERFTM消融技术(盐增强射频TM消融)将加热至治疗温度的流体与消融能一起输送到组织中。输送加热流体增强了消融处理,因为流过处理组织的细胞外的间隙的流体可使通过组织的热传输增加20倍以上。流动的加热流体从而使用来自于消融能的源的热能进一步对流传递至目标组织。此外,流体被加热至治疗温度的事实增加可施用到组织中的能的量。最后流体还可有助于持续水化组织并且防止任何烧焦和关联的阻抗上升。
图1展示一个示例性流体消融系统100的示意图。系统包括构造成以用于插入目标体积的组织中的长形主体102。根据目标组织的几何形状,长形主体可具有各种形状和大小。此外,长形主体的具体大小可取决于各种因素,包括待处理的组织的类型和位置、待处理的组织体积的大小等。仅作为范例,在一个实施例中,长形主体可为薄壁不锈钢针管,其在大约16-和大约18-规格之间(即,外径大约1.27mm至大约1.65mm),并且具有大约25cm的长度L(例如,如图2中所示)。长形主体102可包括尖的远侧顶端104,其构造成刺穿组织以便于装置引入至目标体积的组织中,然而,在其它实施例中,该顶端可为钝的并且可具有各种其它构造。长形主体102可由传导材料形成使得长形主体可沿其长度将电能传导至沿长形主体远侧部分定位的一个或多个消融元件。发射电极105是能够输送来自于长形主体的RF能的消融元件的一个范例。
在一些实施例中,发射电极105可为长形主体102的一部分。例如,长形主体102沿其整个长度而除了代表发射电极105的部分以外可涂覆有绝缘材料。更具体地,在一个实施例中,长形主体102可涂覆有1.5mil的含氟聚合物XylanTM 8840(木聚糖TM8840)。电极105可具有各种长度和形状构造。在一个实施例中,电极105可为暴露于周围组织的管状长形主体的4mm节段。此外,电极105可位于沿长形主体105长度的任何位置处(并且还可存在沿长形主体长度布置的多于一个的电极)。在一个实施例中,电极可位于远侧顶端104附近。在其它实施例中,长形主体可由绝缘材料形成,并且电极可围绕长形主体布置或布置在长形主体的部分之间。
在其它实施例中,电极可由适合于导电的各种其它材料形成。可使用任何金属或金属盐。除不锈钢以外,示例性金属还包括铂、金或银,而示例性金属盐包括银/氯化银。在一个实施例中,电极可由银/氯化银形成。已知的是:金属电极呈现出的电压电位与周围组织和/或液体的电压电位不同。使电流传输通过此电压差可导致在电极/组织界面处的能量损耗,这可加剧电极附近的组织的过度加热。使用诸如银/氯化银的金属盐的一个优点是其具有高交换电流密度。因此,大量的电流可通过这种电极传输到组织中而仅存在小电压降,从而使此界面处的能量损耗最小化。因此,由诸如银/氯化银的金属盐形成的电极可降低组织界面处的过多的能的产生,并且从而产生更合期望的治疗温度曲线,即使当电极周围不存在液体流时。
电极105或其它消融元件可包括一个或更多出口端口108,其构造成将来自于延伸穿过长形主体102的内腔106的流体输送入周围组织中(如箭头109所示)。备选地,电极105可定位在形成在长形主体102中的一个或多个出口端口108附近。在许多实施例中,可能期望在治疗时将电极定位在一个或多个出口端口附近以使流动流体的作用最大化。出口端口108可以各种大小、数量和图案的构造形成。此外,出口端口108可构造成相对于长形主体102以各种方向引导流体。这些方向可包括由图1中的箭头109所示的正交定向(即,垂直于长形主体表面)、以及沿长形主体102的纵轴线指向近侧和指向远侧的定向,其包括围绕长形主体发展出圆形或螺旋形流体流的各种定向。再进一步,在一些实施例中,长形主体102可形成有充当出口端口的打开远侧端。作为进一步的范例,在一个实施例中,使用电子放电加工(EDM),具有大约0.4mm直径的24个均等地间隔开的出口端口108可围绕电极105的圆周产生。本领域的技术人员将理解另外的制造方法是可用来产生出口端口108的。此外,在一些实施例中,出口端口可沿电极附近的长形主体的部分布置,而不是布置在电极自身中。
与出口端口108连通的内腔106还可容纳加热组件110,其构造成当流体传输通过内腔106刚要被引入组织前加热流体。适合用于本发明的装置和方法的加热组件110的各种实施例的详细论述可见于第13/445,036号、名称为 "Methods and Devices for Heating Fluid in Fluid Enhanced Ablation Therapy(在流体增强消融治疗中用于加热流体的方法和装置)"的、与本申请同时提出并在上文通过引用以其全部内容并入的相关美国申请。
位于电极105或其它消融元件远侧的长形主体的部分可为实心的或被填充的使得内腔106终止于电极105的远侧端。在一个实施例中,电极远侧的长形主体的部分的内体积可用塑料塞填充,塑料塞可环氧胶固就位或通过干涉配合固定。在其它实施例中,电极远侧的长形主体的部分可由固体金属形成并通过焊接、锻压或本领域已知的任何其它技术附接至长形主体的近侧部分。
流体可从流体储蓄器112供应至内腔106和加热组件110。流体储蓄器112可经由流体导管114连接至内腔106。流体导管114可为例如一定长度的柔韧塑料管。流体导管114还可为刚性管或刚性和柔韧管的结合。
流体可通过泵116从流体储蓄器112推进入内腔106。泵116可为注射型泵,其随活塞(未示出)的前进而产生固定体积的流。这种泵的一个范例为伊利诺伊州芝加哥的Cole-Palmer公司销售的74900型。也可使用其它类型的泵,例如隔膜泵。
泵116可由电源和控制器118控制。电源和控制器118可将电控制信号输送至泵116以导致泵产生所期望的流体流率。电源和控制器118可经由电气连接120连接至泵116。电源和控制器118还可经由连接122电气连接至长形主体102,并经由连接126电气连接至集电极124。此外,通过类似的电气连接,电源和控制器118可连接至加热组件110。
集电极124可具有各种形式。例如,集电极124可为位于患者身体外的大型电极。在其它实施例中,集电极124可为沿长形主体102的其它位置定位的返回电极,或其可位于引入患者身体内、处理处附近的第二长形主体上。
在手术中,电源和控制器118可驱使如下:流体以期望的流率输送到目标组织中、流体加热至期望的治疗温度以及经由诸如电极105的一个或多个消融元件输送治疗消融能。为了做到这些,电源和控制器118自身可包括多个部件以用于产生、调节和输送需要的电控制信号和治疗能信号。例如,电源和控制器118可包括一个或更多频率发生器以产生给定幅度和频率的一个或多个RF信号。这些信号可通过一个或多个RF功率放大器放大成相对高电压、高电流的信号,例如,1安下50伏。这些RF信号可经由一个或多个电气连接122和长形主体102输送至消融元件,使得RF能在发射电极105和可能远离地位于患者身体上的集电极124之间传输。在长形主体由非传导材料形成的实施例中,一个或多个电气连接122可延伸穿过长形主体的内腔或沿其外表面延伸以将电流输送至发射电极105。由于组织的固有电阻率,消融元件和集电极124之间的RF能的穿过可加热长形主体102周围的组织。电源和控制器118还可包括定向耦合器以将一个或多个RF信号的一部分供给至例如功率监视器以允许RF信号功率调节至期望的处理水平。
图1中所示的长形主体102可构造成用于以各种方式插入患者身体中。图2展示医疗装置200的一个实施例,其具有置于其远侧端上的长形主体202,长形主体202构造成用于腹腔镜或引导件进入组织目标区域的插入。除了长形主体202,装置200可包括柄204以允许操作者操纵装置。柄204可包括一个或多个电气连接206,其将长形主体的各种部件(例如,即加热组件和消融元件205)连接至例如上文所描述的电源和控制器118。柄204还可包括用于连接流体源至装置200的至少一个流体导管208。
虽然装置200是可能适于在流体增强消融中使用的医疗装置的一个示例性实施例,但也可使用多种其它装置。例如,在处理心率不整例如室性心动过速中可能需要非常小的长形主体。在这种情况中,适当定大小的长形主体可例如置于构造成用于经由循环系统插入心脏的导管的远侧端。在一个实施例中,在大约20和大约25规格之间(即,外直径大约0.5mm至大约0.9mm)的不锈钢针管主体可置于导管的远侧端。导管可具有各种大小,但在一些实施例中,其可具有大约120cm的长度和大约8弗伦奇的直径(“弗伦奇"是用于导管产业中以描述导管大小的度量单位且等于以毫米表示的导管直径的三倍)。
使用流体增强消融的治疗处理
消融总体涉及高温或低温的应用以导致组织的选择性坏死和/或去除。通过消融实现的组织热破坏中存在已知的时间-温度关系。用于导致对组织的不可逆热破坏的临界温度一般认同为大约41°摄氏度(C)。实现具体水平的细胞坏死所需要的时间随处理温度升高进一步超过41℃而降低,这也是已知的。可理解,准确的时间/温度关系随细胞类型而变化,但存在可用于确定期望的热剂量水平的跨许多细胞种类的大致关系。此关系可一般被称为43℃下的等效的时间,表达为:
(1)
其中T是组织温度而R是无单位的治疗效率的指示因子,其在0和5之间的范围中(温度大于或等于43℃的情况下通常为2,温度小于41℃的情况下为0,且温度在41℃和43℃之间的情况下为4),如同在Sapareto S.A. 和W.C. Dewey的《Int. J. Rad. Onc. Biol. Phys. 10(6): 787-800》(1984)中所描述的。此等式和参数设置仅表现用于计算热剂量的许多已知方法的一个范例,并且任何方法论都可与本发明的方法和装置一起使用。使用上文的等式(1),当治疗时,teq43℃=20分钟到1小时的范围中的热剂量是被广泛认同的,尽管一些想法认为杀死组织所需要的剂量取决于组织的种类。因此,治疗温度可指的是超过41℃的任何温度,但输送剂量和最终地治疗作用由温度的时间历史(即,组织之前所忍受的加热量)、被加热的组织类型和等式(1)确定。例如,Nath S.和Haines D. E.的《Prog. Card. Dis. 37(4):185-205》(1995)(Nath等人)建议温度50℃持续1分钟作为治疗法,其等于其中R=2的43℃下128分钟的时间。此外,为了最大效率,治疗温度应当均匀地遍及被处理的组织,以便均匀地输送热剂量。
图3通过示出距诸如电极105的消融元件的给定距离处取得的模拟温度来展示若干消融技术的性能曲线。第一曲线302展示未使用流体增强的RF消融的性能。如图中所示,组织的温度随距电极的距离而非常急剧地下降。这意味着在消融元件10mm内,组织温度仍为大约为体温(37℃),大大低于上文所论述的治疗温度50℃。此外,非常接近消融元件处,温度非常高,意味着组织将更快地脱水或干涸并且烧焦。一旦这种情况发生,组织的阻抗显著升高,使得很难将能传输至距消融元件更远的组织。
第二组织温度曲线304与第二现有技术系统关联,其类似于美国专利第5,431,649号中描述的。在此第二系统中,电极被插入组织并且施用400kHz、大约525mA的RF电流以加热组织。处于体温(37℃)的盐溶液同时以10ml/min的速率注射入组织。所得的组织温度曲线304比曲线302更均匀,但是任何地方所获得的最大温度为大约50℃。因此,温度曲线304仅在小部分组织中超过用于一分钟治疗所指定的广泛认同的组织破坏的温度临界。如上文所描述,这样的少量温度增量需要显著的处理时间以获得任何治疗上有意义的结果。
第三组织温度曲线306使用本发明的教导来获得。在展示的实施例中,由银/氯化银形成的电极被插入组织中并施用480kHz、525mA的RF电流以加热组织。加热至50℃的盐溶液同时以10ml/min的速率注射入组织。所得的温度曲线306不但均匀并且最外达到距电极15mm处都显著地高于50℃的治疗临界。此外,由于温度在此体积内是均匀的,所以输送的热剂量也均匀地穿过此体积。
图3中所见的均匀温度曲线可通过在消融能应用期间的加热流体至目标组织的引入而获得。流体使热更深地对流传递入组织,从而降低组织中的烧焦以及阻抗变化,其发生在消融元件附近,如曲线302中所示。并且,由于流体被加热至治疗水平,所以其不充当如曲线304中所见的使周围组织的温度下降的吸热源。因此,同时应用RF能和灌注热的盐溶液至组织中排除邻近电极的组织的脱水和/或蒸发,保持有效组织阻抗,并且提高用RF能加热的组织内的热传输。可被加热至治疗温度例如大于41℃的组织的总体积从而增加。例如,实验测试证实使用本文所描述的流体增强消融技术,可在5分钟内处理具有大约8cm的直径的组织体积(即,大约156cm3的球体体积)。相比之下,在同样5分钟的时间跨度中,传统RF仅可处理具有大约3cm直径的体积(即,大约14cm3的球体体积)。
此外,根据本发明的流体增强消融装置具有可根据被处理的组织而变化以调节处理曲线的形状的许多个参数。例如,当使用SERF消融技术时,操作者或控制系统可修改参数诸如盐温度(例如从大约40℃至大约80℃)、盐流率(例如从0ml/min至大约20ml/min)、RF信号功率(例如从大约0W至大约100W)和处理的持续时间(例如从大约0分钟至大约10分钟)以调节温度曲线306。此外,不同的电极构造也可用于改变处理。例如,虽然图1展示的发射电极105构造成适于单极电流的连续的圆柱形嵌条(band),但电极还可以其它几何形状形成,例如,形成连续的表面区域的球形或螺旋形,或电极可具有多个分立部分。电极还可构造成用于两极操作,其中一个电极(或电极的一部分)充当阴极而另一个电极(或其部分)充当阳极。
用于在SERF消融技术中使用的优选流体为无菌的普通盐溶液(定义为包含盐的溶液)。然而,可使用其它液体,包括林格溶液或浓缩盐溶液。流体可被选择成当作用于目标组织时提供所期望的治疗性能和物理性能,并且推荐无菌的流体以避免组织感染。
治疗区的流体塑形
如上文所提及,消融能从诸如发射电极105的消融元件大致呈球形图案扩展。这又接着产生了具有大体上球形的消融治疗处理区、体积或带(即,如上文所论述,通过达到治疗温度一段时间而接受治疗剂量的消融能的带)。球体处理区的直径可随处理时间的延长而增加。
图4中展示了此行为的一个实施例。图示出消融装置400的一个实施例,其包括具有远侧顶端404和发射电极405的长形主体402。多个出口端口408可沿发射电极405的外表面定位并且可构造成将流体输送进入长形主体402周围的组织。由于加热的流体从出口端口408输送并且消融能经由发射电极405输送入组织,所以处理区在由标注T1的虚线限定的第一时间处发展。虽然绘成两维圆,但本领域技术人员将理解呈现的处理区是三维的并且大体成球形。随处理时间增加,处理区的直径也增加,直到其在大于第一时间的第二时间处达到标注T2的虚线。类似地,在大于第二时间的第三时间处,处理区可达到标注T3的虚线。
然而,在某些情况中,可能期望向不是球形的组织的体积提供治疗剂量的消融能。例如,在一些实施例中,消融可用于处理非对称或球形的纤维瘤、肿瘤或其它组织损伤。在其它实施例中,待处理的组织的体积可处于非常接近另一不用处理的组织结构的位置,诸如神经细胞群或其它健康组织。再进一步,在一些实施例中,可能期望产生具有限定的定向性(例如,具有长度和厚度的消融组织的平面)的处理带。定向处理区的示例性用途是用消融处理心率不整(例如室性心动过速)。在这种过程中,消融可用于产生定向途径以引导控制心跳的电信号的传播,从而防止可产生心动过速的游走信号。这些途径通常产生为在心脏的壁中的竖直平面。
本发明提供在流体增强消融治疗期间用于产生这些类型的定向处理带以及别的非球形处理带的装置和方法。总而言之,本发明的装置和方法通过使用不同温度的流体以塑形处理带来操作。在一个实施例中,加热至治疗温度的流体可在一个或多个位置处从长形主体引入组织,并且处于低温的流体可在一个或多个不同位置从相同或不同的长形主体引入。在一个或多个长形主体周围的某些带中,较高温度的流体可与较低温度的流体混合,导致骤冷(即加热流体冷却至治疗温度以下)。此骤冷可防止在特定位置处的治疗剂量的消融能的输送。流体源的相关定位以及诸如流率和温度等操作参数的选择可提供在流体增强消融治疗期间产生的处理带的更好的控制和定制。本领域的技术人员将理解,本文公开的各种方法和装置可用于产生具有任何期望形状的处理带。
多主体系统
图5展示了本发明的系统的一个实施例。图描绘了具有输送处于不同温度的流体的多个长形主体的流体增强消融系统的一个实施例的顶视横截面图(即,下文跨页论述的长形主体)。特别地,第一长形主体502可基本定位在待处理的体积的中心。第一长形主体502可类似于上文所论述的长形主体102。第二长形主体504a和第三长形主体504b可邻近于如图所示的第一长形主体502定位。在一些实施例中,第二和第三长形主体504a、504b可类似于上文所论述的长形主体102。然而,在其它实施例中,第二和第三长形主体可缺少长形主体102的一个或多个消融元件和加热组件,因为这些主体不用于输送治疗加热流体或消融能。在某些实施例中,加热组件仍可包括在第二和第三长形主体504a、504b中以允许它们加热从其中流过的流体至升高的温度,例如,低于治疗临界但高于体温的温度(尽管任何升高的温度都是可能的)。
如上文所论述,在使用中,来自第一流体源的流体可通过如下输送入第一长形主体502周围的组织:传输流体通过内腔、加热该流体并使流体穿过形成在长形主体502的侧壁中的至少一个出口端口射出。加热流体可处于治疗温度,例如,大约45℃到大约80℃之间。在一个实施例中,流体可被加热至大约50℃。此外,第二、较低温度的流体可从相同或不同的流体源输送入第二和第三长形主体504a、504b周围的组织。较低温度的流体可为小于穿过长形主体502输送的流体的温度的任何温度。在一个实施例中,尽管可使用只要其使任何热剂量骤冷的任何温度的流体,但较低温度的流体可在大约25℃到大约41℃之间。来自第一、第二和第三长形主体502、504a、504b的每个的流体流均由图5中的箭头表示。如上文提及,从第一长形主体502流出的较高温度的流体可与从第二和第三长形主体504a、504b流出的较低温度的流体混合以防止特定区域的组织达到治疗温度,从而防止组织破坏。此流体相互作用和所得的组织中的热的选择性骤冷可产生具有椭圆形的处理体积,如图5中标注A1的虚线所指示的。本领域技术人员将理解:尽管图5中的处理带A1被示出为椭圆形,但处理体积三维地延伸且类似于椭圆形盘或球,其被从第二和第三长形主体504a、504b流出的流体从相对侧压缩。
图5中所示的构造是用于本文所公开的流体增强消融系统的各种可能的构造之一。例如,在某些实施例中,多于一个的长形主体可构造成用以输送治疗加热流体或加热流体以及消融能。类似地,可利用多于或少于两个的长形主体504a、504b以输送处于较低温度的流体至邻近于用于消融组织的一个或多个长形主体的区域。因此,使用供应流体至组织的任意数量的长形主体,可获得多种不同的三维治疗区形状。再进一步,一个或更多长形主体可相对于彼此定位在各种位置处。变化可包括角度调节(例如将第三长形主体504b置于图中的第一长形主体502的左边而不是下面)、距离调节(例如移动第三长形主体504b远离图中的第一长形主体502)以及竖直调节(例如沿正交于图中的平面的方向移动第二长形主体504a)。此外,对于被输送穿过任何长形主体的流体,可选择各种温度。在一个实施例中,流过第一长形主体502的流体可加热至治疗温度。流过第二和第三长形主体504a、504b的流体可加热至小于治疗温度的任何温度。例如,可输送没有被有效加热的处于体温的流体,或可输送处于体温以下温度的流体。此外,可调节从第一、第二和第三长形主体注射的流体的流率和温度以产生图5中所示的形状的不同变化。此外,可变化从布置于长形主体上的任何消融元件输送的消融能,并且任意数量的长形主体可定位在处理区中或周围以产生期望的治疗。
图5 中描绘的长形主体502、504a、504b同样可以各种方式引入并定位在目标体积的组织内。例如,可利用类似于上文论述的医疗装置200的三个单独的装置。然而,在一些实施例中,可提供具有多个长形主体附加至其上的消融装置,如果需要,其中每个长形主体均可联接至相同或不同流体源,以及加热组件和消融元件。图6展示这类装置600的一个实施例,其可包括长形轴610、第一长形主体602、第二长形主体604a和第三长形主体604b。第一长形主体602可构造成输送加热至治疗温度的流体连同来自例如发射电极605的消融能至周围组织。第二和第三长形主体604a、604b可构造成输送处于低于第一长形主体602的温度的流体至周围组织。此外,每个长形主体602、604a、604b均可具有一个或多个出口端口606a、606b、606c,其构造成将来自于长形主体602、604a、604b的各自内腔的流体输送至周围组织中。
长形轴610可具有各种大小和构造。例如,在一些实施例中,长形轴可为构造成用于经由循环系统来进入患者身体的导管。在一个示例性实施例中,导管可为大约12弗兰奇。每个第一、第二和第三长形主体602、604a、604b均可根据用作长形轴610的导管的总直径而定大小。在一个示例性实施例中,每个长形主体均可为27规格的不锈钢针管主体(即具有大约0.4mm的外径)。在另一个示例性实施例中,长形轴610可构造为类似于上文论述的医疗装置200的腹腔镜装置。
长形主体602、604a、604b可相对于长形轴610以各种构造定位。在图6展示的实施例中,长形主体602、604a、604b可沿限定长形轴610的直径的轴线D均布。更特别地,第一长形主体502可定位在长形轴610的中部,且第一长形主体604a和第二长形主体604b可沿轴线D定位在长形轴的直径的外部。长形主体602、604a、604b可沿基本平行于长形轴610的纵轴线L的方向延伸。在其它实施例中,长形主体602、604a、604b或至少第二和第三长形主体604a、604b可构造成沿轴线D滑动以调节长形主体602、604a、604b之间的间隙。在又一个实施例中,长形主体602、604a、604b可在距纵轴线L特定半径处彼此呈角度地偏置。例如,长形主体602、604a、604b可在距纵轴线L一定距离处每隔120°定位。在这种实施例中,消融元件可提供在每个长形主体602、604a、604b上并且可利用变化的功率水平、流体流率和流体温度以产生期望的治疗区。
如上文提及,第一长形主体602可包括诸如发射电极605的消融元件,其构造成输送RF能至长形主体602周围的加热组织。在某些实施例中,第二和第三长形主体604a、604b同样可包括消融元件(例如,消融元件可以非常低的功率运行或在治疗期间保持不被激活),或者在一些实施例中,第二和第三长形主体604a、604b可完全不包括消融元件。此外,每个长形主体602、604a、604b均可包括加热组件,其布置于内腔内且构造成用以加热流过其中的流体。利用的加热组件可类似于上文论述且在与本发明同时提交且在上文通过引用其全部内容并入的第13/445,036号、名称为 "Methods and Devices for Heating Fluid in Fluid Enhanced Ablation Therapy(在流体增强消融治疗中用于加热流体的方法和装置)"的相关美国申请中的那些加热组件。如上文所提及,在一些实施例中,第二和第三长形主体604a、604b可不包括加热组件或如果不需要或不期望加热,包括在第二和第三长形主体的每个中的加热组件可保持不被激活。此外,本领域技术人员将理解长形轴可具有置于其上的任何数量的长形主体,并且长形主体可相对于导管以各种角度方向来定向。
单主体装置
在流体增强消融治疗期间产生的处理区的有效塑形还可使用仅具有单个长形主体的装置实现。例如,在一个实施例中,消融装置可包括具有内腔的长形主体,内腔被分割成彼此不流体连通的两个或多个部分,其中每个部分均可与共用或单独的流体源以及沿长形主体定位的一个或多个不同的出口端口连通。因此,处于各种温度的流体可输送至长形主体周围的不同区域。在离开一个或更多出口端口后,流体可混合,造成在长形主体周围的某些组织区域中积聚的热的选择性的骤冷。此选择性的骤冷可防止组织破坏,从而塑形接受治疗剂量能的组织体积。
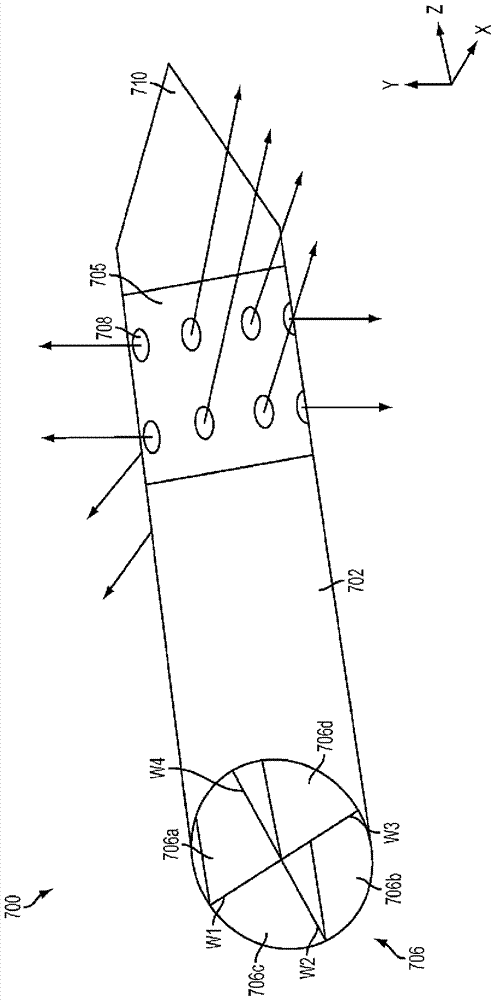
图7A展示了单主体消融装置700的一个实施例,其包括具有内腔706的长形主体702,内腔706被多个内壁w1、w2、w3、w4分割成呈扇形体形式706a、706b、706c、706d的多个部分。各个扇形体706a、706b、706c、706d因此限定延伸穿过长形主体702的分离内腔。本领域技术人员将理解内腔可以在其它构造在长形主体中形成,并且长形主体可具有任何数量的内腔。装置700还可包括尖(或别的塑形)的远侧端710、消融元件(例如发射电极)705和多个出口端口708。
内壁w1、w2、w3、w4可沿长形主体702的整个长度延伸,使得由壁限定的扇形体706a、706b、706c、706d彼此不流体连通。内壁w1、w2、w3、w4之间的界面和长形主体702的内壁可包括诸如密封剂或粘合剂等特征,其防止流体在扇形体706a、706b、706c、706d之间泄漏。此外,内壁w1、w2、w3、w4可由隔热且可能绝缘的材料形成或涂覆有隔热且可能绝缘的材料以防止在一个扇形体中的加热流体给邻近的扇形体中的流体加温。例如,内壁w1、w2、w3、w4可相对于长形主体102由上文论述的相同的含氟聚合物形成或涂覆有该含氟聚合物。在一些实施例中,隔热可能不是必要的。例如,高流体流率(例如10ml/min或更高)可减少流体流过内腔706所花的时间量,从而减少可发生在邻近扇形体之间的传热的量。
每个扇形体706a、706b、706c、706d均可与一个或多个出口端口708流体连通。例如,在图7A中展示的实施例中,内腔706的扇形体706a可与沿正y方向引导流体的一个或多个出口端口708流体连通。相反地,扇形体706b可与沿负y方向引导流体的一个或多个出口端口708流体连通。类似地,扇形体706c和706d可与分别沿负x方向和正x方向引导流体的一个或多个出口端口708流体连通。本领域技术人员将理解每个扇形体706a、706b、706c、706d均可与不同于图7a中所示的那些的出口端口流体连通,并且任何数量的出口端口可定位在沿长形主体702的不同位置处。
图7B以横截面展示了图7A的装置。如所示,从内腔706的扇形体706c和706d射出的流体可由布置于各个扇形体内的单独的加热组件(未示出)加热至治疗温度。另一方面,从扇形体706a和706b射出的流体可处于第二温度,第二温度小于从扇形体706c和706d输送的流体的治疗温度。如上文描述,第二温度可小于体温、等于体温或大于体温,但小于选择的治疗温度。此外,此第二温度可通过输送处于第二温度的流体获得,或通过利用在扇形体706c、706d中的单独加热组件(未示出)来加热流过其中的流体至第二温度来获得。当来自各个扇形体的流体进入长形主体702周围的组织时,其可混合并且形成由虚线所示的热界线。这些界线可限定处理区A2和A3,在处理区A2和A3中,达到治疗温度,并持续足够输送治疗剂量的消融能的一段时间。区A2和A3外的组织可通过从扇形体706a和706b射出的较冷的流体来防止接受治疗剂量的消融能。本领域技术人员将理解,每个扇形体706a、706b、706c、706d均可射出处于不同温度和流率的流体以形成各种不同塑形的治疗区。
图8A和8B展示了单主体消融装置800的另一个实施例,其构成将处于各种温度的流体输送入处理体积中。相比于图7A和7B中所描绘的在装置700中纵向延伸穿过内腔706的部分,装置800可被分割成远侧部分和近侧部分802a、802b。如图8A中所示,消融装置800可包括长形主体802,其由阻挡元件803分割成远侧部分802a和近侧部分802b。阻挡元件803可为内壁,其将长形主体的远侧部分802a的内腔与长形主体的近侧部分802b的内腔分开。
每个部分802a、802b均可包括诸如发射电极805a、805b的消融元件,以及沿长形主体802和/或发射电极805a、805b形成的一个或多个出口端口808a、808b,其与每个部分的内腔流体连通。部分802a、802b可还包括一个或多个温度传感器804a、804b,其沿长形主体布置并且构造成探测长形主体802周围的组织的温度。温度传感器可以各种方式实施并且,在一些实施例中,传感器可为嵌入形成在长形主体802的侧壁中的孔中的细导线镍铬-康铜热电偶。温度传感器804a、804b可定位在沿长形主体802的任何位置处,但是,在一些实施例中,温度传感器804a、804b可相对于消融元件805a、805b对称地定位。这样的布置可允许处理区的扩展的均匀性的更准确的测量。关于温度传感器的更多信息可见于与本发明同时提交并且在上文通过引用并入的第13/445,034号、名称为"Devices and Methods for Remote Temperature Monitoring in Fluid Enhanced Ablation Therapy(用于流体增强消融治疗中的远程温度监控的装置和方法)"的相关美国专利申请。
长形主体802分割成的部分802a、802b可允许在由温度传感器804a、804b探测到的非均匀加热的情况下的处理区的调节。例如,展示的装置在以下情况中可特别地有用:来自部分802a、802b两者的处于相等的温度的流体连同来自电极805a、805b两者的消融能一起输送,但由温度传感器804a记录的温度却大于由传感器804b记录的温度。为了调节治疗区并且提供更均匀的加热,可减少或停止来自电极805a的消融能的输送。此外,可降低从远侧部分802a的一个或多个出口端口808a射出的流体的温度。此外,如果有必要,可降低流体流率。这些举措的每个都可减少发生在远侧部分802a周围的组织中的加热,并且帮助向温度传感器804b和在该区域中长形主体802周围的组织驱使从近侧部分802b中的出口端口射出的加热流体。本领域技术人员将理解,相反的步骤(例如增加消融能、增加盐温度等)可应用于部分802a以增加在该区域中输送的热剂量。此外,如果观察到的情况相反的话,上文叙述的任何步骤可相反地应用以在温度传感器804a附近提供更多加热。再进一步,上文列出的步骤可取决于期望或需要的治疗塑形的量而以任何顺序执行并且可个别地执行或一齐执行。
图8B展示了图8A的装置的半透明视图并且示出长形主体的一个实施例的内部结构,该长形主体具有由一个或多个阻挡构件803分开的近侧部分和远侧部分。如所示,远侧部分802a的内腔可通过阻挡构件803与近侧部分802b分开。阻挡构件803可构造成类似于上文论述的壁w1,w2、w3、w4。例如,阻挡构件可为长形主体802的一体部分,或可为通过粘合剂或其它保持部件或材料紧固在长形主体802的内腔806中的单独部件。阻挡803可例如由塑料或其它适合的材料形成。
阻挡元件803可还包括在其中形成的一个或多个腔,其各自构造成接受诸如插管810a的插管。插管810a可由金属、塑料或具有金属衬套的塑料形成,并且可包括内腔,其提供到装置800的近侧端的流体途径,该流体途径穿过任何介于其间的阻挡(例如阻挡803)和部分(例如近侧部分802b)。插管810a的内腔与任何其它部分(例如近侧部分802b)的内腔都不呈流体连通。这允许了例如流体从与用于将流体输送至近侧部分802b的源分开的源输送入远侧部分802a。备选地,流体可从公用的源输送至部分802a、802b两者内。内腔806可还包括另外的插管,其构造成输送流体至装置800的其它部分。例如,内腔806可包括插管810b,其构造成从装置800的近侧端将流体输送至装置800的远侧端的近侧部分802b中。
本领域技术人员将理解,内腔806可包括与装置中存在的部分一样多的插管。此外,取决于处理区期望的形状,装置800可具有任何数量的部分。例如,如图8中所展示,装置800可包括两个部分,或可具有三个或多个部分。在具有三个部分的实施例中,例如,中心定位的消融元件可在各侧上都邻接一个或多个出口,出口构造成将较低温度的流体输送入长形主体802周围的组织中。在这个实施例中,邻接的出口可沿长形主体802的纵轴线的方向压缩处理区。
此外,插管可各自都通过隔离元件(例如类似于阻挡803但还包括一个或多个腔以允许阻挡周围的流体穿过的元件)刚性地保持就位或可允许在内腔806中漂浮。在其它实施例中,插管可包括形成在其外表面上的特征以防止与其它插管或内腔806的内壁接触。示例性特征包括形成在插管外表面上的翅片或梁。
每个插管810a、810b均可在近侧端连接至独立或公用的流体源。每个插管810a、810b均可还包括独立的加热组件,其布置于在其远侧端附近的插管的内腔内。示例性加热组件可包括贯穿插管810a、810b的内腔的例如单导线814a、814b,其构造成通过插管的内腔内的流体将RF能传输至插管的内壁中。导线814a、814b可包括置于其上的一个或多个隔离件以防止导线直接接触插管810a、810b的传导部分。这种加热组件的更详细的描述可见于与本申请同时提交且在上文通过引用并入的第13/445,036号、名称为"Methods and Devices for Heating Fluid in Fluid Enhanced Ablation Therapy(在流体增强消融治疗中用于加热流体的方法和装置)"的美国申请。
上文描述的示例性加热组件需要每个插管810a、810b均至少部分地由导电材料形成(以接受来自导线814a、814b的RF能)。在这样的实施例中,插管810a、810b可涂覆有绝缘材料以便防止由于与彼此接触或与装置800的内腔806的内壁的接触而产生的任何电短路。此外,隔热材料还可用于涂覆插管810a、810b以防止在任何一个部分中的流体的温度影响在其它部分中的流体的温度。然而,在一些实施例中,流体流率可足够高,使得在任何一个部分中流体所花的时间不足以影响该部分中的流体温度或被该部分中的流体温度影响。在这些实施例中,插管810a、810b的隔热不是必要的。
插管810a、810b可还包括温度传感器,其构造成提供关于输送至装置800的一部分的流体的温度的反馈。例如,插管810a可包括双导线热电偶812a,其构造成延伸超过插管810a的远侧端以使得热电偶可测量远侧部分802a内的流体在其离开插管并在内腔806内混合后通过出口端口808a离开进入周围组织前的温度。两个热电偶导线820、822可延伸穿过插管810a的内腔返回至装置810a的近侧端。如本领域中所知,导线可连接至信号处理电路,以确定远侧部分802a中的流体的温度。如图中所示,第二插管810b可还包括温度传感器812b,例如,由两个导线816、818形成的双导线热电偶。传感器812b可类似地构造成延伸超过插管810b的远侧端进入近侧部分802b,使得由传感器812b测量的温度表现出将要经由出口端口808b输送入周围组织的混合流体的温度。本领域技术人员将理解在本发明的装置中可采用各种温度传感器,例如包括镍铬-康铜细导线热电偶。
使用方法
可利用本发明的教导以产生具有任何期望的形状的处理区。总而言之,这可通过将流体连同治疗能(例如来自消融元件或单独来自加热流体)从两个或更多位置引入来实现。例如,在一些实施例中,一种方法可包括在一个或多个位置处输送消融能并且加热流体,而同时在一个或多个不同的位置处输送较低温度的流体,以产生期望的处理区的形状。作为进一步的范例,在特定情况中,可能期望提供大致球形的处理体积但使特定的体积子集不接受治疗剂量的消融能。例如,当在前列腺的区域中利用流体增强消融时,可能期望保护附近的控制失禁和勃起功能的神经束。使用本发明的教导,这可通过如下实现:在治疗期间将长形主体引入待保护的结构附近的组织,并且输送所选择的治疗温度以下的流体,而同时向待处理的组织输送能。
图9展示了非球形处理区的一个实施例的顶部横截面图(类似于上文的图5)。如图中所示,第一长形主体902基本定位于处理体积的中心。然而,处理体积位于无需接受消融治疗的结构901附近(例如神经束、健康组织等)。为了实现这点,第二长形主体904可定位于结构901附近以及第一长形主体902和结构901之间。在流体增强消融治疗期间,其中第一长形主体将加热至治疗温度的流体连同RF能输送至周围组织中,第二长形主体904可将处于治疗温度以下的温度的流体输送入周围组织中。如上文所论述,流体可在周围组织中混合并且使结构901周围的组织中的温度降低至治疗水平以下。所得的治疗处理区由标注A4的虚线示出。本领域技术人员将理解,该技术以及包括多个消融和非消融长形主体的变型可用于保护遍布身体的各种组织结构。
在其它实施例中,处理区的塑形可使用构造成同时输送处于多个温度的流体的单长形主体实现。上文描述了这种装置并且图7A和7B中展示了一个示例性处理区。图8A和8B中展示了这种装置的另一个实施例。在使用中,这些装置任一个均可通过腹腔镜或内窥镜引入患者体内,并且定位在待处理的组织附近。流体可随后通过装置的一个或多个内腔来输送入待处理的组织中。流过每个内腔的流体均可独立地加热至治疗温度或低于治疗温度的任何温度。处于不同温度的流体从装置的不同部分(沿装置的长度或围绕其圆周)输送以产生不同形状的处理区。
又在其它实施例中,可能期望通过引入构造成从周围组织去除流体而不是将流体输送入组织中的长形主体来塑形治疗处理区。利用构造成从周围组织吸出流体的长形主体可辅助在处理中的组织体积内发展期望的流体流图案。在一些实施例中,当处理体积不能吸收并散除在消融治疗期间引入的流体的量时,吸出流体还可能是必要的。
图10展示了使用一个长形主体来输送加热流体和一个长形主体来从处理体积去除流体的输送流体增强消融的方法的一个实施例。如图中所示,第一长形主体1002可插入处理体积1004中。然而,不同于上文描述的实施例,长形主体1002可被定位以使得消融元件1006位于处理体积1004的一侧,而不是基本位于处理体积的中心。第二长形主体1008可随后在基本与第一长形主体1002相对的位置处插入处理体积。第二长形主体1008不需要具有消融元件或如果其具有,消融元件可为未激活的。此外,第二长形主体1008可构造成从周围组织吸出流体,例如,这可通过将第二长形主体1008的内腔(其经由一个或多个出口端口1010与周围组织流体连通)连接至真空源而实现。
在第一和第二长形主体1002、1008两者都定位在处理体积1004内后,第一长形主体可开始输送来自消融元件1006的治疗能以及从形成在长形主体1002或消融元件1006的侧壁中的一个或多个出口端口1012输送加热至治疗水平的流体。也可激活第二长形主体1008以开始从处理体积1004中的组织吸出流体。如图中通过箭头所示,流体从处理体积的同时引入和去除可导致在第一长形主体1002和第二长形主体1008之间的定向流图案的发展。
本领域技术人员将理解,从处理区吸出流体的技术可与本文所描述的任何其它技术结合以产生具有多种形状的各种复杂的治疗处理区。此外,可同时利用构造成输送消融能或吸出引入处理区中的流体的多个长形主体。再进一步,第一和第二长形主体的定位不必要是彼此相对的,这取决于期望的治疗带的形状以及接近其中的部分的能力。事实上,在一些实施例中,流体的引入和去除可使用单个长形主体来实现,例如,图8中所示的装置800。在这类实施例中,装置中的一个部分可构造成将流体引入处理体积中,而装置的其它部分可构造成从体积中去除流体。
例如,当处理诸如子宫纤维瘤等呈囊的组织损伤时,图10中展示的方法可特别有用。呈囊的组织损伤具有不允许流体(例如在流体增强消融期间引入的流体)通过的外层。因此,如果流体在治疗期间未被吸出,组织损伤可不期望地由引入的大量不可压缩的流体压迫。此外,通过如图中所示地定位第一和第二长形主体1002、1008,强的方向性(如通过箭头所示)可强加到由第一长形主体1002输送的热的传播上。因此,治疗结束可通过测量第二长形主体1008周围的组织的温度来确定,例如,这可使用上文所论述的相同类型的温度传感器来实现。
本文所公开的装置和系统的各种实施例可在各种外科手术过程中利用以处理多种医疗情况。例如,如本文所公开的医疗装置可构造用于在开口的外科手术过程期间直接插入目标组织的体积中。备选地,在腹腔镜或其它微创过程期间,医疗装置可构造成穿过一个或多个组织层传输。此外,装置可构造成以用于经由穿过一个或多个组织层形成的接近端口或其它开口或经由自然孔口(即通过内窥镜)而引入患者。输送至处理处后,可将外科手术装置的一部分例如长形主体102的远侧部分插入目标处理体积中,使得消融元件布置于处理体积内。在一些实施例中,消融元件可定位在处理体积的中心附近。
一旦装置定位在处理体积内,消融能和加热至治疗温度的流体可通过一个或多个装置输送入处理体积中。此外,一个或多个其它装置可输送处于较低温度的流体或从处理体积吸出流体。在一段时间后,或取决于一个或多个反馈指示(例如来自布置于处理体积内的温度传感器中的读数),可停止消融能和流体的输送。装置可随后被去除和/或如果需要另外治疗可重新定位装置。
此外,具有第一形状的大的处理区可通过连接若干个具有第二形状的较小的处理区而产生。例如大的直线处理区可通过如下产生:应用产生类片状(例如如图5中所示)的治疗并且重新定位装置使得随后的处理区的端部重叠。使用连接较小的给定形状和大小的处理区的类似方法也可产生各种其它形状。
杀菌和重复使用
本文所公开的装置可设计成在单次使用后弃置,或其可设计成用于多次使用。然而,在任一种情况中,装置在至少一次使用后可被翻新以用于再使用。翻新可包括装置拆卸的步骤的任何组合,接着清洗或替换特定部分,并且随后重新组装。特别地,可拆卸装置,并且装置的任何数量的特定部分或零件可选择性地、以任何组合替换或去除。当清洗和/或替换特定零件时,装置可在翻新机构处或由外科手术组在外科手术过程前立即重新组装以用于随后的使用。本领域技术人员将理解装置的翻新可利用多种用于拆卸、清洗/替换和重新组装的技术。这些技术的使用以及所得的翻新装置都在本发明的范围内。
例如,本文所公开的外科手术装置可局部或完全地拆卸。特别地,图2中所示的医疗装置200的长形主体202可从柄204去除,或整个柄和长形主体组件可与电和流体连接206、208断开联接。又在另一个实施例中,柄、长形主体和连接可去除地联接至壳体,壳体包含例如图1中所示的流体储蓄器、泵以及电源和控制器。
优选地,将在外科手术前处理本文描述的装置。首先,可取得新的或用过的仪器,并且如果需要的话可被清洗。仪器可随后被杀菌。在一个杀菌技术中,仪器放置在封闭和密封的容器中,例如塑料或TYVEK(蒂维克)袋。容器和其包含物可随后放置在可穿透容器的射线的区域中,例如伽马射线、X射线或高能电子。射线可杀死在仪器上和在容器中的细菌。经杀菌的仪器可随后储存在无菌容器中。密封容器可保持仪器无菌直到其在医疗机构中被打开。
在许多实施例中,优选地,装置被杀菌。这可通过本领域技术人员已知的任何数量的方法来完成,包括贝塔射线或伽马射线、氧化乙烯、蒸汽和液体浴(例如冷浸)。在某些实施例中,选择用于形成诸如长形主体的部件的材料可能不能承受某些形式的杀菌,例如,伽马射线。在这些情况中,可使用合适的备选杀菌形式,例如氧化乙烯。
本领域技术人员将基于以上描述的实施例理解本发明的其它特征和优点。因此,本发明不受除所附权利要求指出之外的具体示出和描述的实施例的限制。本文引用的所有公开物和参考文献都明确地其全部内容通过引用而并入本文。
- 还没有人留言评论。精彩留言会获得点赞!