含有由撕裂蜡孔菌生成的胞外多糖作为有效成分的用于预防或者治疗癌症的药学组合物的制作方法
本发明涉及一种用于预防或者治疗癌症的药学组合物,所述用于预防或者治疗癌症的药学组合物含有如下有效成分:由撕裂蜡孔菌(ceriporialacerata)生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物。
背景技术:
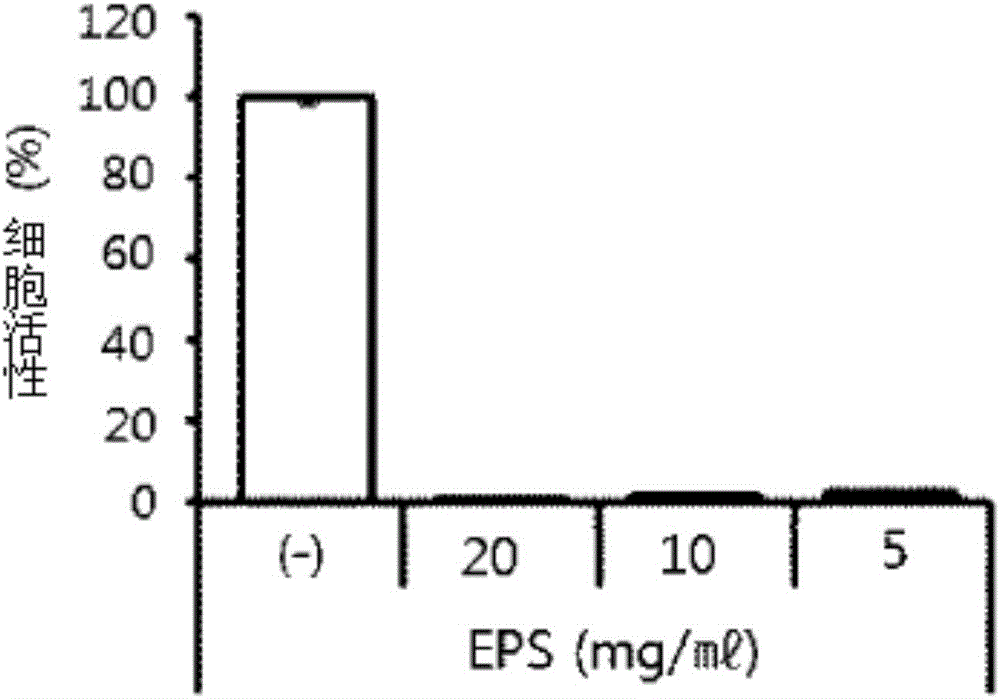
:癌症是一种疾病群组的总称,所述疾病群组通过肿块或肿瘤对周围的正常组织或器官进行破坏,从而可能夺走个体的生命,所述肿块或肿瘤由因各种原因所致的无限增殖的未分化细胞组成。针对癌症的化学疗法依存于表现出强烈细胞毒性的抗癌物质用药,其问题在于引发很多副作用。因此,需要开发能够降低副作用的同时提高治疗效率的新的抗癌剂。因此,最近正在进行根据现有天然物、尤其根据自生植物、植物生药的抗癌剂的开发研究。所述来自于天然物的抗癌剂中,虽然从紫衫分离的紫杉醇(taxol;paclitaxel)广为人知,但是因为其不仅对消灭癌细胞有作用,而且对身体内的其他正常细胞也有作用,所以问题在于,可能引发其他疾病。众所周知,撕裂蜡孔菌作为白腐菌的一种,为了在生态界利用纤维素(cellulose)、半纤维素(hemicellulose)、其他多糖类及甘油(glycerol)等碳源,执行被称为木质素(lignin)分解的共代谢(cometabolism)。与利用撕裂蜡孔菌的医学治疗用途相关地,目前为止广为人知的只有由本发明的发明人申请的韩国登记专利第10-1031605号公开的撕裂蜡孔菌培养液提取物的治疗糖尿病的用途,而利用撕裂蜡孔菌来预防或治疗癌症的效果尚未得到报告。因此,本发明的发明人确认由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物表现出预防或治疗癌症的效果,从而完成本发明。技术实现要素:本发明的目的在于提供一种含有由撕裂蜡孔菌生成的活性成分的用于预防或者治疗癌症的药学组合物。本发发明的另一个目的在于提供一种用于预防或改善癌症的健康功能食品。为了实现所述目的,本发明提供一种用于预防或者治疗癌症的药学组合物,所述用于预防或者治疗癌症的药学组合物含有如下有效成分:由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物。为了实现所述另一个目的,本发明提供一种用于预防或改善癌症的健康功能食品,所述用于预防或改善癌症的健康功能食品含有如下有效成分:由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物。为了实现所述目的,本发明提供一种治疗癌症的方法,所述方法包括将如下成分用药于需要抗癌活性的对象:由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物。为了实现所述目的,本发明提供一种用于制造抗癌药剂的由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物的用途。根据本发明的含有由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物作为有效成分的药学组合物能够有效用于各种癌症的预防或治疗。附图说明图1是表示由撕裂蜡孔菌生成的胞外多糖的针对肝癌细胞株的细胞生长抑制效果的图表。图2是表示由撕裂蜡孔菌生成的胞外多糖的针对大肠癌细胞株的细胞生长抑制效果的图表。图3是表示由撕裂蜡孔菌生成的胞外多糖的针对胃癌细胞株的细胞生长抑制效果的图表。图4是表示由撕裂蜡孔菌生成的胞外多糖的针对肺癌细胞株的细胞生长抑制效果的图表。图5是表示由撕裂蜡孔菌生成的胞外多糖的针对宫颈癌细胞株的细胞生长抑制效果的图表。图6是表示由撕裂蜡孔菌生成的胞外多糖的针对皮肤癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图7是表示由撕裂蜡孔菌生成的胞外多糖的针对口腔癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图8是表示由撕裂蜡孔菌生成的胞外多糖的针对前列腺癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图9是表示由撕裂蜡孔菌生成的胞外多糖的针对胰腺癌细胞株的细胞生长抑制效果的图表(*p<0.05,**p<0.01)。图10是表示由撕裂蜡孔菌生成的胞外多糖的针对甲状腺癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图11是表示撕裂蜡孔菌的菌丝体培养液的针对皮肤癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图12是表示撕裂蜡孔菌的菌丝体培养液的针对口腔癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图13是表示撕裂蜡孔菌的菌丝体培养液的针对前列腺癌细胞株的细胞生长抑制效果的图表(**p<0.01)。图14是表示撕裂蜡孔菌的菌丝体培养液的针对胰腺癌细胞株的细胞生长抑制效果的图表(*p<0.05,**p<0.01)。具体实施方式以下,对本发明进行详细说明。本发明提供一种用于预防或者治疗癌症的药学组合物,所述用于预防或者治疗癌症的药学组合物含有如下有效成分:由撕裂蜡孔菌(ceriporialacerata)生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物。在本发明中所使用的术语“胞外多糖(extracellularpolysaccharide,eps)”是指,作为菌类等微生物的细胞壁的一部分,使得多糖类分泌至细胞外,从而在其周围生成荚膜,或者作为粘质物分泌至细胞周围或培养基的物质。所述胞外多糖是微生物为了躲避抗体、毒性物质、原生动物及噬菌体(bacterio-phage)等外部环境保护自己而分泌的。所述胞外多糖可包括40至60重量%的糖和30至40重量%的蛋白质、40至50重量%的糖和32至38重量%的蛋白质、43至47重量%的糖和33至36重量%的蛋白质、或约45重量%的糖和约34重量%的蛋白质。所述糖可含有甘露糖(mannose)、半乳糖(galactose)及葡萄糖(glucose)。所述胞外多糖可具有100至150kda、110至140kda或115至125kda的分子量,更为具体地可具有约120kda的分子量。作为本发明的一个实施例,所述胞外多糖可通过包括如下步骤的制造方法得以制造:(a)对撕裂蜡孔菌的菌丝体进行液体培养,从而制造撕裂蜡孔菌的菌丝体培养液;(b)使得所述撕裂蜡孔菌的菌丝体培养液干燥从而进行粉末化;以及(c)用溶剂对撕裂蜡孔菌的菌丝体培养液粉末进行提取后,对其进行过滤并减压浓缩。在所述(a)步骤中的用于对撕裂蜡孔菌菌丝体进行液体培养的培养基可包括糖、葡萄糖、淀粉、高粱粉、大麦粉、大豆粉、硫酸镁(mgso4)、磷酸二氢钾(kh2po4)、磷酸氢二钾(k2hpo4)及水,氢离子浓度(ph)可以为4.5至6.0。具体而言,所述培养基可包括糖0.2至3重量%、葡萄糖0.2至3重量%、淀粉0.2至4重量%、高粱粉0.1至0.5重量%、大麦粉0.1至0.5重量%、大豆粉0.2至3重量%、硫酸镁(mgso4)0.05至0.1重量%、磷酸二氢钾(kh2po4)0.05至0.25重量%、磷酸氢二钾(k2hpo4)0.05至0.25重量%,剩余为水。在所述(a)步骤中的液体培养可以在蓝色led光源下进行,具体而言,所述液体培养在蓝色led光源下,以使得二氧化碳的浓度保持在1,000至2,000ppm的形式得以进行。就所述液体培养而言,例如,在20~28℃下,氢离子浓度为4.5至6.0,光源为蓝色led,光照度保持0.1至0.8lux,并且空气以0.5至2.0kgf/cm2注入,二氧化碳的浓度保持为1,000至2,000ppm的同时可进行8至13天。具体而言,在20至25℃、ph4.5至6.0、0.5至2.0kgf/cm2的空气注入以及1,000至2,000ppm的二氧化碳浓度条件下可进行5至15天。以所述条件进行液体培养时,所生产的胞外多糖的含量较高,因此是优选的。作为所述(a)步骤中的亲株可在经过如下培养过程后进行使用:将以马铃薯葡萄糖琼脂(potatodextroseagar,pda)培养基状态在1至5℃下保管中的优良菌株,在锥形瓶中使用马铃薯葡萄糖肉汤(potatodextrosebroth,pdb)培养基,并在振荡培养器中保持25℃的恒温,并经过7至9天培养。此外,进行如上所述的亲株培养后,可以将培养液或获得的菌丝体用作接种体。此时,作为接种体要投入的菌丝体的量以将要培养的溶液的量为基准,优选为0.5%(w/v)程度。菌丝体量(%/100ml,w/v)多,并非胞外多糖的含量也一起升高,因此优选地,培养基组成适用使得胞外多糖的含量形成得最高的选择性培养条件,而不是适用对菌丝体的生长最好的营养比例及环境条件。所述培养液能够分离精制为菌丝体和水溶液。具体而言,就所述分离精制而言,可通过多片压滤机(multi-sheetfilterpress)和振动离心膜分离机(pallsep)对通过离心分离机去除菌丝体的溶液进行反复精制后,进行1分钟紫外线(uv)照射。此外,所述培养液需要在去除氧后进行密封保管,这是因为,培养液中存在菌丝的情况下,菌丝的生长可能为有效成分的含量带来变化。在所述(b)步骤中,使得在所述(a)步骤所制造的菌丝体培养液干燥,从而能够粉末化。所述干燥为了防止消除有效物质,可以在40℃以下的温度,更为具体地,在30℃以下的温度下进行48至96小时。并且,就在(b)步骤中的干燥而言,相比真空干燥机使用真空冻结干燥机使得有效物质含量变化最小化,因此是优选的,所述真空干燥机将蒸发温度设置为相对较高。在所述(c)步骤中,用溶剂对在(b)步骤中所得到的菌丝体培养液的干燥粉末进行提取后,对根据本发明的组合物的有效成分胞外多糖进行分离。具体而言,向菌丝体培养液的干燥粉末3至10g中添加蒸馏水100ml,从而充分悬浮后,以5,000至10,000rpm进行10至30分钟离心分离,从而获得上清液,并向所述上清液中添加相当于其的量的2至3倍的提取溶剂后,能够放置于1至5℃的冰箱,并静放10至15小时。在所述的静放物中仅对上清液重新以5,000至10,000rpm进行10至30分钟离心分离后,回收沉淀物,从而能够制造粗制(crude)的胞外多糖。优选地,在30℃以下对所述粗制的胞外多糖进行真空冻结干燥,从而能够获得胞外多糖。所述提取溶剂可以是选自由如下物质组成的群中的溶剂或它们的混合溶剂:水、碳原子数量为1至4的低级醇(alcohol)、丙酮(acetone)、乙醚(ether)、氯仿(chloroform)以及乙酸乙酯(ethylacetate),更为具体地,可以是选自由如下物质组成的群中的溶剂或它们的混合溶剂:水、甲醇(methanol)、乙醇(ethanol)、丁醇(butanol)、丙酮(acetone)以及乙酸乙酯(ethylacetate),更为优选地,可以是水或50至90%(v/v)的乙醇水溶液。本发明的含有由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物的用于预防或治疗癌症的组合物可额外包括通常使用的适当的载体、赋形剂及稀释剂。相对于用于预防或治疗癌症的药学组合物总重量,所述胞外多糖可包含0.1至80重量%,或0.1至50重量%,并且撕裂蜡孔菌的菌丝体培养液、菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物能够以相当于所述胞外多糖的含量的量适当地被包含。但是,所述胞外多糖、包含所述胞外多糖的培养液、所述培养液的干燥粉末或所述培养液的提取物的有效含量能够根据药学组合物的使用方法及目的适当地得到调节。可根据通常的方法分别对根据本发明的药学组合物进行剂型化并使用。作为适合的剂型有锭剂、丸剂、散剂、颗粒剂、糖衣片剂、硬质或软质的胶囊剂、溶液剂、悬浮剂或乳化液剂、注射剂、坐剂等,但是并非限定于此。根据本发明的药学组合物能够利用药学上非活性的有机或无机载体来制造适当的剂型。换句话说,剂型为锭剂、涂覆的锭剂、糖衣片剂及硬质胶囊的情况,可以包括乳糖(lactose)、蔗糖(sucrose)、淀粉或其衍生物、滑石(talc)、碳酸钙(calciumcarbonate)、明胶(gelatin)、硬脂酸(stearicacid)或硬脂酸盐。此外,剂型为软质胶囊的情况,可以包括植物性油、蜡(wax)、脂肪、半固体及液体的多元醇(polyol)。并且,剂型为溶液或糖浆(syrup)形态的情况,可以包括水、多元醇、甘油(glycerol)及/或植物性油等。根据本发明的药学组合物除了所述载体以外,还可包括保存剂、稳定剂、湿润剂、乳化剂、溶解剂、甜味剂、着色剂、渗透压调节剂、防氧化剂等。根据本发明的药学组合物的用药方法能够根据剂型而易于选择,并且能够进行口服或非口服用药。用药量虽然根据患者的年龄、性别、体重、病情、用药途径而可以不同,但是通常以有效成分胞外多糖为基准,5至1,000mg/kg体重的量,具体地,能够将10至600mg/kg体重的量分为每天一次至三次进行用药。但是,所述用药量不对本发明的范围构成限定。根据本发明的药学组合物不仅提供优秀的预防或治疗癌症的效果,而且几乎不存在药物毒性及副作用,从而作为抗癌剂即使长期服用时也能够放心使用。由此,本发明的药学组合物能够用于多种癌症的预防及治疗,例如,从由肝癌、大肠癌、胃癌、肺癌、宫颈癌、膀胱癌、乳房癌、卵巢癌、甲状腺癌、中枢神经系统肿瘤、脑癌、皮肤癌、胰腺癌、直肠癌、食道癌、肾癌、上皮癌、血癌、口腔癌、前列腺癌及它们的组合所组成的群中所选择的癌症。并且,本发明提供用于预防或改善癌症的健康功能食品,所述健康功能食品含有如下有效成分:由撕裂蜡孔菌(ceriporialacerata)生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物。根据本发明的健康功能食品可以是粉末、颗粒、锭剂、胶囊或饮料的形态,可以是糖果、巧克力、口香糖、茶、维他命复合剂、健康辅助食品等。此时,所述健康功能食品中所包含的根据本发明的胞外多糖、包含胞外多糖的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物的含量,通常能够以整体食品重量的0.01至50重量%,或以0.1至20重量%的形式被包含。此外,健康饮料组合物的情况,能够以健康饮料组合物100ml为基准,以0.02至10g或0.3至1g的含量被包含。所述食品中,与本发明的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或者所述菌丝体培养液的提取物一起,还可包括食品学能够允许使用的食品辅助添加剂。本发明提供治疗癌症的方法,所述方法包括将如下成分用药于需要抗癌活性的对象:由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末、或所述菌丝体培养液的提取物。所述需要抗癌活性的对象可以是哺乳动物,具体地可以是人类。此外,本发明提供用于制造预防或治疗癌症的药剂的由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物的用途。所述由撕裂蜡孔菌生成的胞外多糖、包含所述胞外多糖的撕裂蜡孔菌的菌丝体培养液、所述菌丝体培养液的干燥粉末或所述菌丝体培养液的提取物与前面所述的相同。此外,所述抗癌活性能够用于需要癌症预防或治疗效果的多种疾病,例如,肝癌、大肠癌、胃癌、肺癌、宫颈癌、膀胱癌、乳房癌、卵巢癌、甲状腺癌、中枢神经系统肿瘤、脑癌、皮肤癌、胰腺癌、直肠癌、食道癌、肾癌、上皮癌、血癌、口腔癌、前列腺癌等。以下,通过以下实施例对本发明进行更加详细的说明。但是,以下实施例只是用于对本发明进行示例,本发明的范围并非限定于此。【实施例】制造例1.撕裂蜡孔菌菌丝体培养液的制造使得从在庆尚北道尚州市(韩国)采集的柞树活组织中分离的撕裂蜡孔菌,通过传代培养而培养的毛霉菌,在-80℃进行冷冻保管,并将保管中的菌株在pda(potatodextroseagar)培养基(87塑料培养皿;培养基(difco),贝克顿迪金森公司(bectondickinsonandcompany))中传代2~3次后,将菌株(以下称为“pda培养菌株”)在4℃冰箱中保管后进行使用。并且在锥形瓶中形成pdb(potatodextrosebroth)培养基(difco,bectondickinsonandcompany)600ml后,在此放入一个pda培养菌株,并在25℃下进行八天的震荡培养,从而获得了pdb培养菌株。另外,为了菌株的培养,将液体培养培养基在800l发酵槽中以1.5kgf/cm2形式注入121℃的空气并杀菌20分钟后,在冷却至23℃的状态下,作为起子(starter)接种pdb培养菌株600ml,并以0.5~1.5kgf/cm2进行通气的同时,光源为蓝色led,照度保持在0.5lux,二氧化碳的浓度为2,000ppm,并且使得撕裂蜡孔菌菌丝体在23℃的恒温下进行10天的液体培养,从而制造撕裂蜡孔菌菌丝体培养液,所述液体培养培养基包括:糖1.5重量%、葡萄糖0.5重量%、土豆淀粉0.5重量%、高粱粉0.25重量%、大麦粉0.25重量%、大豆粉0.75重量%、硫酸镁(mgso4)0.05重量%、磷酸二氢钾(kh2po4)0.05重量%、磷酸氢二钾(k2hpo4)0.05重量%,剩余为水。制造例2.撕裂蜡孔菌培养液干燥粉末的制造利用真空冻结干燥机使得在所述制造例1中所制造的撕裂蜡孔菌菌丝体培养液在25℃下进行72小时的真空冻结干燥,从而使其粉末化,因此制造撕裂蜡孔菌菌丝体培养液的干燥粉末。制造例3.撕裂蜡孔菌培养液提取物的制造向在所述制造例2中所制造的撕裂蜡孔菌菌丝体培养液的干燥粉末5g中添加蒸馏水100ml,进行充分悬浮后,以8,000rpm进行20分钟离心分离后,向其上清液中加入相当于其量的2~3倍的乙醇,并在4℃下静放12小时。之后从静放物中提取上清液,从而制造撕裂蜡孔菌菌丝体培养液的提取物。制造例4.从撕裂蜡孔菌培养液制造胞外多糖(extracellularpolysaccharide;以下称“eps”)对在所述制造例3中所获得的撕裂蜡孔菌菌丝体培养液的提取物重新以8,000rpm进行20分钟离心分离后,回收沉淀物,从而获得粗制(crude)的eps。利用真空冻结干燥机使得所述粗制eps在25℃下真空冻结干燥72小时,从而获得由撕裂蜡孔菌生成的eps。实施例1.eps的特性评价1.1利用凝胶渗透色谱法(gelpermeationchromatography,gpc)进行的eps的分子量测定使得所述制造例4中所制造的eps在0.1mna2so4/0.05mnan3[通过冰醋酸(glacialaceticacid)将ph调整为4]溶液中以成为1%(w/v)的形式溶解后,以4,000rpm进行0.5小时的离心分离,之后通过0.45μm针筒式过滤器(syringefilter)仅过滤上清液,从而通过gpc进行分析。就gpc分析条件而言,通过检测器利用折射指数,就gpc柱(column)而言,利用ohpaksb805hq(shodex,japan),就流动相而言,使用了0.1mna2so4/0.05mnan3[通过冰醋酸将ph调整为4],流动相的流速以1.0ml/分钟的速度流动。标准曲线利用具有各自不同的分子量(130kda、400kda、770kda或1,200kda)的葡聚糖(dextran)(americanpolymercorporation,usa)来制作,并且利用折射指数(refractiveindex,ri)测定器knauerk-2310(germany)来测定eps的分子量。如果对测定条件进行整理,则如下表1。【表1】分子量的测定gpc系统knauerk-501系统柱ohpaksb805hq(shodex,japan)流动相0.1mna2so4/0.05mnan3/ph4流速0.1ml/分测定器ri(knauerk-2310)结果,本发明的eps的分子量表现为约120kda。1.2eps的糖及蛋白质含量测定对在制造例4中所制造的eps进行二次精制,并且用蛋白水解酶进行处理,从而测定糖及蛋白质含量。具体而言,将一次精制的eps(在制造例4中所制造的eps)溶入蒸馏水后,以8,000rpm进行20分钟的离心分离,从而分离上清液后,向所分离的上清液中添加相当于其量的2至3倍的乙醇,并放入4℃的冰箱,从而静放12小时。之后,在静放物中仅对上清液进行采集并再次以8,000rpm进行20分钟的离心分离后,对沉淀物进行回收,从而获得二次精制的eps。将所述二次精制的eps溶解于蒸馏水后,用作为蛋白水解酶的碱性蛋白酶(alcalase)以0.5%(w/v)的浓度在50℃下处理30分钟。糖含量通过酚-硫酸法(phenol--sulfuricacidmethod)进行测定。具体地,向按照不同浓度稀释的标本1ml中添加80%(v/v)酚25μl后,添加硫酸2.5ml,并以室温进行冷却,并在465nm下测定吸光度从而对糖含量进行计算。此外,蛋白质含量通过bca方法(smithpk等,analyticalbiochemistry,150(1):76-85,1985)得到测定,并使用牛血清白蛋白(albumin)作为标准物质。如上所述,测定的糖含量及蛋白质含量显示在下表2中,糖含量表现为45至51重量%,蛋白质含量表现为33至34重量%。【表2】产率(%)总糖含量(%)总蛋白质含量(%)eps1.22±0.0345.32±1.4134.17±0.73二次精制的eps0.78±0.0150.49±0.5233.50±2.79酶处理的eps*0.24±0.0651.39±1.3234.61±1.51*酶处理:碱性蛋白酶(alcalase)0.5%,50℃,30分钟各数值为平均±se(n≥3)此外,eps的糖构成成分分析结果,eps表现为主要含有甘露糖(mannose)、半乳糖(galactose)及葡萄糖(glucose)。实施例2.eps的抗癌效果验证i2.1mtt法(mttassay)为了确认在所述制造例4中所制造的eps的抗癌效果,按照所述eps的不同处理浓度执行mtt法,由此对针对各种癌细胞的细胞生长抑制效果进行了测定。所述mtt(3-(4,5-dimetylthiazol-2-yl)2,5-diphenyltetrazoliumbromide)作为淡黄色的基质,因活细胞的线粒体(mitochondria)内的呼吸链酶而开裂,并生成深蓝色的甲瓒(formazan),因为在死细胞中不发生反应,因此所述甲瓒的生成量被利用于活细胞数测定中(相关文献:vandeloosdrecht,a.a.等,j.lmmunol.methods,141(1):15-22,1991)。首先,将从韩国细胞株银行购入的hep3b(肝癌细胞株)、dld-1(大肠癌细胞株)、ags(胃癌细胞株)、a549(肺癌细胞株)及hela(宫颈癌细胞株)分别在24孔板(wellplate)中以5x104细胞/孔的浓度进行分株后,在37℃、5%co2的培养器中进行一天的培养。各个癌细胞株的培养液的组成如下。-hep3b(肝癌细胞株):dmem(dulbeccomodifiedeaglemedium)、10%(v/v)胎牛血清(fetalbovineserum,fbs)、1%(v/v)p/s(penicillin/streptomycinsolution,青霉素/链霉素溶液)-dld-1(大肠癌细胞株)、ags(胃癌细胞株)及a549(肺癌细胞株):rpml(roswellparkmemorialinstitutemedium)、10%(v/v)fbs、1%(v/v)p/s-hela(宫颈癌细胞株):mem(minimumessentialmedium)、10%(v/v)fbs、1%(v/v)p/s在确认细胞附着后,以新的培养液调换,并在蒸馏水中进行溶解,在各孔中对eps进行处理,以便分别成为5、10或20mg/ml的浓度,在37℃、5%co2培养器中培养三天。对照组添加蒸馏水并以相同的条件进行培养。在此,分别对成为整体培养基的1/10(v/v)的量的mtt溶液进行处理,并在培养器中进行四小时的反应后,确认形成甲瓒,并且为了使得甲瓒不散开而完全去除上清液。之后,分别向各个孔加入100μl二甲基亚砜(dimethylsulfoxide,dmso),使得形成于细胞内的甲瓒溶解。通过酶联免疫吸附测定(elisa,enzymelinkedimmunosorbentassay)读取器,在570nm的波长下测定吸光度,从而对各个癌细胞株的细胞生存率进行测定。2.2肝癌治疗效果分析如下表3及图1所示,所述实施例2.1的mtt法结果,随着本发明的eps的处理浓度由5mg/ml增加至20mg/ml,hep3b(肝癌细胞株)的细胞生存率逐渐下降。尤其,对eps以5mg/ml浓度进行处理时,表现出大约97%的细胞生长抑制效果。所述结果表明根据本发明的eps表现出优秀的肝癌治疗效果。【表3】2.3大肠癌治疗效果分析如下表4及图2所示,所述实施例2.1的mtt法结果,随着本发明的eps的处理浓度由5mg/ml增加至20mg/ml,dld-1(大肠癌细胞株)的细胞生存率逐渐下降。尤其,对eps以5mg/ml浓度进行处理时,表现出大约98%的细胞生长抑制效果。所述结果表明根据本发明的eps表现出优秀的大肠癌治疗效果。【表4】2.4胃癌治疗效果分析如下表5及图3所示,所述实施例2.1的mtt法结果,随着本发明的eps的处理浓度由5mg/ml增加至20mg/ml,ags(胃癌细胞株)的细胞生存率逐渐下降。尤其,对eps以5mg/ml浓度进行处理时,表现出大约85%的细胞生长抑制效果。所述结果表明根据本发明的eps表现出优秀的胃癌治疗效果。【表5】2.5肺癌治疗效果分析如下表6及图4所示,所述实施例2.1的mtt法结果,随着本发明的eps的处理浓度由5mg/ml增加至20mg/ml,a549(肺癌细胞株)的细胞生存率逐渐下降。尤其,对eps以5mg/ml浓度进行处理时,表现出大约43%的细胞生长抑制效果。所述结果表明根据本发明的eps表现出优秀的肺癌治疗效果。【表6】2.6宫颈癌治疗效果分析如下表7及图5所示,所述实施例2.1的mtt法结果,随着本发明的eps的处理浓度由5mg/ml增加至20mg/ml,hela(宫颈癌细胞株)的细胞生存率逐渐下降。尤其,对eps以5mg/ml浓度进行处理时,表现出大约96%的细胞生长抑制效果。所述结果表明根据本发明的eps表现出优秀的宫颈癌治疗效果。【表7】实施例3.eps的抗癌效果验证ii3.1mtt法eps的处理浓度为0.25、0.5或1mg/ml,且除了癌细胞使用melanomab16(皮肤癌细胞株)、crl-1628(口腔癌细胞株)、pc-3(前列腺癌细胞株)、snu-410(胰腺癌细胞株)及snu-790(甲状腺癌细胞株)之外,以与实施例2相同的方法对eps的抗癌效果进行验证。各个癌细胞株培养液的组成如下。-melanomab16:dmem(dulbeccomodifiedeaglemedium)、10%(v/v)胎牛血清(fetalbovineserum,fbs)、1%(v/v)p/s(penicillin/streptomycinsolution)-crl-1628、pc-3、snu-410及snu-790:rpmi(roswellparkmemorialinstitutemedium)、10%(v/v)fbs、1%(v/v)p/s3.2皮肤癌治疗效果分析如图6所示,所述实施例3.1的mtt法结果,随着本发明的eps的处理浓度由0.25mg/ml增加至1mg/ml,皮肤癌细胞株的细胞生存率逐渐下降。尤其,对eps以1mg/ml浓度进行处理时,表现出大约14%的细胞生长抑制效果。3.3口腔癌治疗效果分析如图7所示,所述实施例3.1的mtt法结果,对本发明的eps以1mg/ml浓度进行处理时,表现出大约15%的细胞生长抑制效果(eps的处理浓度0.25及0.5mg/ml的mtt法结果未记载)。3.4前列腺癌治疗效果分析如图8所示,所述实施例3.1的mtt法结果,随着本发明的eps的处理浓度由0.25mg/ml增加至1mg/ml,前列腺癌细胞株的细胞生存率逐渐下降。尤其,对eps以1mg/ml浓度进行处理时,表现出大约49%的细胞生长抑制效果。3.5胰腺癌治疗效果分析如图9所示,所述实施例3.1的mtt法结果,随着本发明的eps的处理浓度由0.5mg/ml增加至1mg/ml,胰腺癌细胞株的细胞生存率逐渐下降。尤其,对eps以1mg/ml浓度进行处理时,表现出大约14%的细胞生长抑制效果(eps的处理浓度0.25mg/ml的mtt法结果未记载)。3.6甲状腺癌治疗效果分析如图10所示,所述实施例3.1的mtt法结果,随着本发明的eps的处理浓度由0.5mg/ml增加至1mg/ml,甲状腺癌细胞株的细胞生存率逐渐下降。尤其,对eps以1mg/ml浓度进行处理时,表现出大约14%的细胞生长抑制效果(eps的处理浓度0.25mg/ml的mtt法结果未记载)。实施例4.撕裂蜡孔菌菌丝体培养液的抗癌效果验证4.1mtt法为了确认在所述制造例1中制造的撕裂蜡孔菌菌丝体培养液(以下,在表及附图中标示为cl01)的抗癌效果,cl01的处理浓度为1、2.5或5mg/ml,如实施例2.1所示,实施mtt法,从而对针对各种癌细胞的细胞生长抑制效果进行了测定。作为癌细胞使用melanomab16(皮肤癌细胞株)、crl-1628(口腔癌细胞株)、pc-3(前列腺癌细胞株)、snu-410(胰腺癌细胞株),各个癌细胞株的培养液的组成如实施例3所记载的一样。4.2皮肤癌治疗效果分析如图11所示,所述实施例4.1的mtt法结果,随着本发明的cl01的处理浓度由1mg/ml增加至5mg/ml,皮肤癌细胞株的细胞生存率稍有下降。尤其,对cl01以5mg/ml浓度进行处理时,表现出大约14%的细胞生长抑制效果。4.3口腔癌治疗效果分析如图12所示,所述实施例4.1的mtt法结果,随着本发明的cl01的处理浓度由1mg/ml增加至5mg/ml,口腔癌细胞株的细胞生存率逐渐下降。尤其,对cl01以5mg/ml浓度进行处理时,表现出大约48%的细胞生长抑制效果。4.4前列腺癌治疗效果分析如图13所示,所述实施例4.1的mtt法结果,随着本发明的cl01的处理浓度由1mg/ml增加至5mg/ml,前列腺癌细胞株的细胞生存率逐渐下降。尤其,对cl01以5mg/ml浓度进行处理时,表现出大约48%的细胞生长抑制效果。4.5胰腺癌治疗效果分析如图14所示,所述实施例4.1的mtt法结果,随着本发明的cl01的处理浓度由1mg/ml增加至5mg/ml,胰腺癌细胞株的细胞生存率逐渐下降。尤其,对cl01以5mg/ml浓度进行处理时,表现出大约54%的细胞生长抑制效果。由此,了解到不仅是根据本发明的eps,而且包括所述eps的撕裂蜡孔菌菌丝体培养液、所述菌丝体培养液的干燥粉末、所述菌丝体培养液的提取物也作为抗癌剂具有效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1