包含抗EGFR抗体的药物制剂的制作方法
本申请涉及一种包含抗表皮生长因子受体(egfr)抗体的药物制剂。
背景技术:
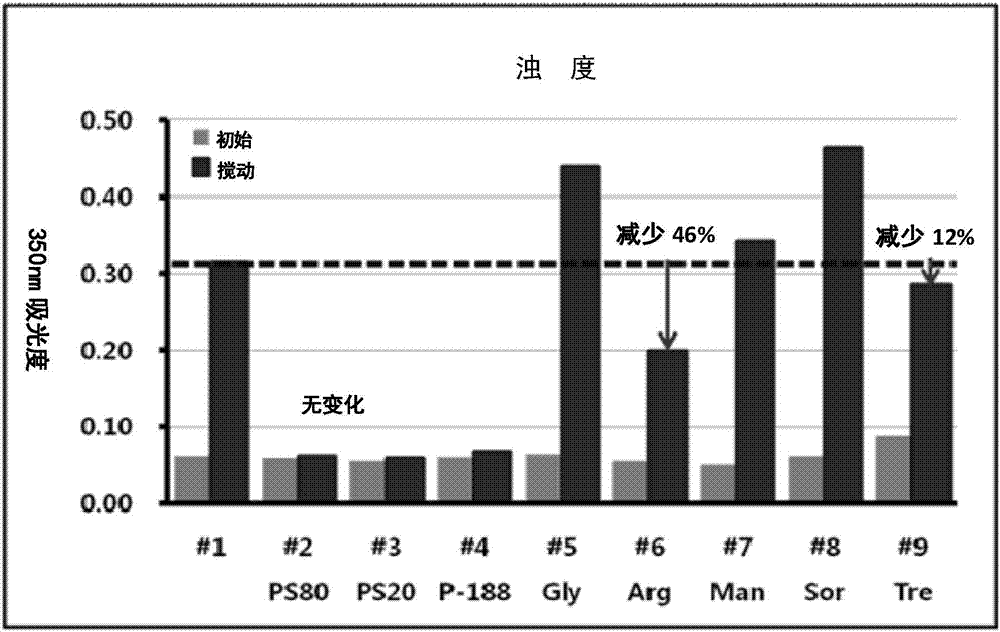
:结合表皮生长因子受体的抗体称为抗egfr抗体。这种抗体的实例包括西妥昔单抗(cetuximab),它是一种含有小鼠来源的可变区和人源恒定区的嵌合型抗体(naramuraetal.,cancerlmmunol.immunotherapy,1993,37:343-349和专利wo96/40210);以及mab425,它是一种egfr的鼠源抗体(kettleboroughetal.,proteinengineering,1991,4:773-783)。根据抗egfr抗体的各种体外和体内研究结果,抗egfr抗体可抑制癌细胞增殖、减少介导肿瘤的血管生成、诱导癌细胞凋亡、增强放射治疗和传统化疗的毒性作用。因此,抗egfr抗体可以抑制各种水平的肿瘤。然而,用于治疗目的的包含抗egfr抗体的液体制剂可能会存在由于抗体的聚集性质导致蛋白质多聚体形成的问题,并且也可能会由于蛋白水解反应而发生脱氨基反应。这种变性反应可以由例如在运输过程中在高温下储藏或由切应力引起。如果包含抗egfr抗体的液体制剂由于变性反应而出现聚集,则可能出现沉淀并形成颗粒,从而引起栓塞。在这方面,可以在将液体制剂施用于患者之前对液体制剂进行过滤(例如通过注射器注射)以防止聚集。然而,这种附加步骤可能使得给药方法复杂并且不适合于临床试验。此外,在过滤之后,颗粒可以继续形成,导致稳定性降低。因此,仍然需要开发一种稳定的包含抗egfr抗体的药物制剂,该药物制剂具有低浊度且在应力条件下也无聚集或无颗粒形成。同时,常规的包含抗egfr抗体的药物制剂通常包含氯化钠(nacl)作为等渗剂,以减少当施用药物制剂时由渗透压引起的身体疼痛反应。然而,包含蛋白质治疗剂的药物制剂应包含适合其的适当成分。在这方面,nacl的相容性还需要验证。技术实现要素:技术问题本申请的目的是提供一种包含抗egfr抗体的药物制剂,该药物制剂可表现出优异的稳定性。解决方案本申请提供包含抗egfr抗体、无水醋酸钠和聚山梨酯80的药物制剂,该药物制剂不含任何氯化钠(nacl)。有益效果与大多数含有氯化钠的包含抗egfr抗体的常规药物制剂不同,由于本申请的包含抗egfr抗体的药物制剂不含氯化钠,因此具有低浊度,且无聚集或无颗粒形成,甚至在加速条件下也可表现出良好的稳定性。因此,本申请的药物制剂可以有效地用于治疗癌症等疾病。附图说明图1a、1b和1c分别示出了用于选择表面活性剂和调渗剂类型的样品的目视检查、浊度和动态光散射(dls)分析结果。图2a和2b分别示出了用于选择与聚集和颗粒形成相关的因素的样品的浊度和dls分析结果;以及,图3a和3b分别示出了这些样品的se-hplc和ie-hplc分析结果。图4a、4b和4c分别示出了用于筛选调渗剂类型的样品的目视检查、浊度和dls分析结果。图5a、5b和5c分别示出了用于测定聚山梨酯80浓度的样品的目视检查、浊度和dls分析结果。图6a和6b分别示出了制备例和比较制备例中的药物制剂经高温储存后的浊度和dls分析结果。图7a、7b和7c分别示出了制备例1-3(制剂3-5)在不同温度下的浊度变化结果。图8a和8b分别示出了在37℃下储存的制备例和比较例的药物制剂在非还原和还原条件下的sds-page结果。图9-14分别示出了在37℃下储存两周后,对每个通过响应曲面设计法(rsm)制备的样品的目视检查、蛋白质浓度、se-hplc、ie-hplc、ief(等电聚焦)和sds-page分析结果。图15-18分别示出了在60℃下储存1天后,对每个通过rsm设计制备的样品的目视检查、浊度、dls和效力1(结合测定)分析结果。图19示出了通过rsm设计制备的样品优化图的结果。具体实施方式本申请提供包含抗egfr抗体、无水醋酸钠和聚山梨酯80的药物制剂,该药物制剂不含任何氯化钠(nacl)。考虑到对用户的便利性,本申请的药物制剂可以优选为液体制剂的形式。本申请的药物制剂的特征在于其不含nacl。通常,包含抗egfr抗体的药物制剂含有nacl作为调渗剂,以减少施用药物制剂时由渗透压引起的身体疼痛反应。然而,与常规药物制剂不同,为了制备更稳定的、包含抗egfr抗体的药物制剂,nacl不包含在本申请的药物制剂中。该药物制剂具有低浊度,即使在加速条件下也不会出现聚集或形成颗粒。考虑到与nacl的相容性,在本申请的抗egfr抗体制剂中优选不包含nacl,从而减少聚集现象和颗粒的形成,使产品分布更稳定。在本申请的一个实施方案中,对影响抗体制剂的浊度、聚集和颗粒形成的主要因素进行检验。结果发现影响浊度的主要因素是nacl、缓冲剂浓度和ph(图2a)。根据dls分析,影响单体强度降低的主要因素是ph和nacl(图2b)。此外,根据se-hplc分析,影响主峰降低的主要因素是ph和nacl(图3a)。根据ie-hplc分析,影响主峰降低的主要因素是ph和缓冲剂浓度(图3b)。基于这些结果,抗体制剂应优选不含有nacl,以降低浊度并抑制聚集和颗粒形成。本申请的药物制剂包含抗egfr抗体。抗egfr抗体的浓度可以为1-16mg/ml,优选为2-10mg/ml(例如10mg/ml)。本申请使用的抗egfr抗体可以是已知的或可商购的常规抗egfr抗体。例如,可以使用美国专利6,217,866或韩国专利1108642中公开的抗egfr抗体。本申请的药物制剂含有无水醋酸钠作为缓冲剂。根据本申请的一个实施方案,影响浊度、聚集和颗粒形成的主要因素包括缓冲剂的浓度和ph。因此,缓冲剂的种类及其浓度和ph值是重要因素。使用无水醋酸钠来维持本申请的药物制剂的ph,可减少由外部影响带来的ph变化。无水醋酸钠可以使用选自磷酸钠、谷氨酸、组氨酸及其组合的缓冲剂代替。然而,为了降低浊度并抑制药物制剂中的聚集和颗粒形成,应选择适当的ph范围。根据本申请,在ph5-6的范围内或附近,优选使用无水醋酸钠作为缓冲剂。无水醋酸钠的浓度可以为10-200mm,优选10-100mm(例如50mm)。本申请药物制剂的ph值可以为5-7,优选为ph5.3-6.1。本申请的药物制剂含有聚山梨酯80作为表面活性剂。通常,含有抗体的溶液在空气-水界面中具有较高的表面张力。为了降低这种表面张力,抗体易于在空气-水界面中聚集。表面活性剂通过减少空气-水界面中的抗体聚集,有助于保持溶液中抗体的生物活性。根据本申请的一个实施方案,对含有聚山梨酯80、聚山梨酯20或泊洛沙姆188作为表面活性剂的抗体制剂进行机械应力试验。结果发现,优选含有聚山梨酯80,可以达到降低浊度并抑制药物制剂的聚集和颗粒形成的效果(参见实施例1)。此外,根据本申请的另一个实施方案,对于含有不同浓度的聚山梨酯80的抗体制剂,结果发现含有浓度为0.05-2.0mg/ml的聚山梨酯80的抗体制剂具有降低浊度并抑制聚集和颗粒形成的作用。特别地,当聚山梨酯80的浓度为0.2mg/ml时,聚集度和颗粒形成的程度最小(参见实施例4)。因此,聚山梨酯80的浓度可以为0.05-2.0mg/ml,优选为0.1-1.0mg/ml(例如0.2mg/ml)。本申请的药物制剂还可以含有调渗剂。本申请中的调渗剂起抑制药物制剂的聚集和降解的作用。为了减少浊度并抑制聚集和颗粒的形成,特别优选使用甘露醇、甘氨酸或其组合作为调渗剂。根据本申请的一个实施方案,含有甘露醇或甘氨酸作为调渗剂的抗体制剂可以显著抑制浊度的增加(参见实施例3)。调渗剂可以是甘露醇,其浓度可以为1%-20%(重量/体积),优选2%-10%(重量/体积),例如5%(重量/体积)。调渗剂可以是甘氨酸,其浓度可以为1%-10%(重量/体积),优选2%-5%(重量/体积),例如3%(重量/体积)。调渗剂可以是甘露醇和甘氨酸的组合,其中甘露醇和甘氨酸以5:1-1:5的重量比混合,浓度可以为1%-10%(重量/体积),优选2%-5%(重量/体积)。本申请的一个实施方案提供了一种药物制剂,其由10mg/ml抗egfr抗体、50mm无水醋酸钠和0.2mg/ml聚山梨酯80组成,不含nacl。本申请的另一个实施方案提供了一种药物制剂,其由10mg/ml抗egfr抗体、50mm无水醋酸钠、0.2mg/ml聚山梨酯80和5%(重量/体积)甘露醇组成,不含nacl。本申请的又一个实施方案提供了一种药物制剂,其由10mg/ml抗egfr抗体、50mm无水醋酸钠、0.2mg/ml聚山梨酯80和3%(重量/体积)甘氨酸组成,不含nacl。根据应力条件下的稳定性分析结果,本申请药物制剂可保持无色透明状态,浊度增加率低;并且与含有nacl的药物制剂相比,本申请药物制剂经长期储存后仍保持良好的纯度,也没有出现聚集。基于这些结果,包含抗egfr抗体的药物制剂在不含有nacl时具有优异的稳定性(参见试验实施例)。本申请的药物制剂可以根据需要进一步含有药学上可接受的添加剂,如稀释剂、载体、稳定剂、抗氧化剂和防腐剂等。稀释剂可以是盐水、葡萄糖、林格氏溶液(ringer)或缓冲溶液。载体可以是缓冲盐溶液、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)等。稳定剂可以是氨基酸、环糊精、聚乙二醇、白蛋白(例如人血清白蛋白(hsa)和牛血清白蛋白(bsa))、盐(例如氯化钠、氯化镁和氯化钙)、螯合剂(例如edta)等。抗氧化剂可以是抗坏血酸、谷胱甘肽等。防腐剂可以是苯酚,间甲酚,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、氯丁醇、苯扎氯铵等。本申请的药物制剂可以以本领域已知的各种方式施用,例如口服或肠胃外给药。肠胃外给药的实例可以包括但不限于静脉内、肌内、动脉内、膜内、囊内、眶内、心内、皮内、腹膜内、经支气管镜、皮下、皮内层、关节内、囊下、蛛网膜下、鞘内、硬膜外和胸骨内注射和输注。本申请的药物制剂的日剂量可以为0.01-10mg/kg(体重),优选为0.01-1.0mg/kg体重,并且可以每天一次或分次给药。然而,药物制剂的实际剂量应考虑各种相关因素,如给药途径、年龄、性别、体重、疾病严重程度等,因此上述剂量不以任何方式限制本发明。实施例以下通过实施例对本发明进行详细说明。以下实施例旨在进一步说明本发明而不限制其范围。以下实施例中使用的试剂的供应商如下。试剂和试验溶液无水醋酸钠(scharlau,目录号so0032)磷酸二氢钠(scharlau,目录号so0333)磷酸氢二钠(jtbaker,目录号3817-05)聚山梨酯20(吐温20,merck,目录号8.17072.1000)聚山梨酯80(吐温80,fluka,目录号59924)泊洛沙姆188(pluronicf68,sigma,目录号p-1300)nacl(scharlau,目录号so0225)甘露醇(jtbaker,目录号238506)山梨醇(sigma,目录号s7547)甘氨酸(sigma,目录号15527)海藻糖二水合物(sigma,目录号t5251)精氨酸盐酸盐(arg-hcl,scharlau,目录号ar0125)通过以下步骤制备实施例中的样品:首先根据每种设计条件对原料进行混合,并通过0.22μm过滤器过滤,再在干净的工作台中分装入3ml玻璃小瓶中,并用橡胶塞塞住,以备使用。本申请中使用的试验方法如下。(1)机械应力:将小瓶固定在涡流混合器(vortex-genie2,scientificindustries)中,并在室温下以3000rpm的转速涡旋4小时。(2)热应力:将小瓶放入37℃的恒温恒湿器(lhd-2250c,labtech)或60℃恒温器(dx7,hanyoung)中。(3)目视检查:用肉眼观察聚集形成。(4)浊度:不稀释制备1ml各样品溶液,使用紫外分光光度计(libras32,biochem)在350nm测量吸光度,以分析浊度。(5)动态光散射(dls):不稀释制备至少1ml各样品溶液,使用dls仪器(zetasizernanozs90,malverninstrument)分析样品溶液的尺寸分布图。(6)sds-page:使用电泳装置并通过常规sds-page分析方法进行分析。(7)等电聚焦(ief):使用电泳装置并通过常规ief分析方法进行分析。(8)uv蛋白定量:使用分光光度计在280nm处测定吸光度,并进行蛋白质定量分析。(9)se-hplc:使用se-hplc分析柱(tskgelg3000swxl,目录号08541,tosohcorporation)进行分析。(10)ie-hplc:使用ie-hplc分析柱(propacwcx-10analytical,目录号054993,dionex)进行分析。(11)效力1(结合测定):使用elisa读数器(spectramax190,moleculardevices)用于效力1分析。(12)效力2(基于细胞的测定):将通过细胞计数计算的相同数量的细胞分装到96孔板的每个孔中,培养24小时后,除去培养基。然后,将100μl稀释的样品溶液放入每个孔中,并将100μl稀释的标准物质和稀释样品放入每个孔中并培养5天。每孔加入40μl的mts试剂,用箔包裹,在37℃下反应3小时。使用elisa读数器(spectramax190,moleculardevices)在490nm测量吸光度。<为制备最优抗体制剂而进行的筛选>实施例1:选择表面活性剂和调渗剂的类型为了选择可以抑制聚集和颗粒形成的表面活性剂和调渗剂的类型,通过混合如表1所示的原料制备各样品。表1用上述制备的样品进行机械应力试验。其中,目视检查、浊度和dls分析结果分别示于图1a、1b和1c中。如图1所示,通过目视检查确定的浊度顺序为#1、#5、#8>#7、#9>#6>#2、#3、#4。并且,样品浊度的测量结果如下:具有表面活性剂的样品浊度不增加;具有调渗剂的样品显示浊度降低。更具体地,与样品#1相比,添加arg-hcl的样品(#6)降低46%,并且添加海藻糖的样品(#9)浊度降低12%。dls分析结果显示,表面活性剂抑制聚集形成,而调渗剂增加聚集强度。因此,对于表面活性剂(考虑到浊度、聚集形成和其它竞争药物制剂),聚山梨酯80(ps80)优于聚山梨酯20(ps20)或泊洛沙姆188(p-188)。对于调渗剂,在浊度方面优选arg-hcl。实施例2:选择影响聚集和颗粒形成的因素为了确定影响包含抗egfr抗体的药物制剂(gc1118a,mogambiotechnologyinstitute)的聚集和颗粒形成的主要因素,通过混合如表2所示的原料制备各样品。表2序号蛋白质浓度(mg/ml)缓冲液ph表面活性剂调渗剂1210mmna-醋酸盐4――2210mmna-磷酸盐82mg/mlps80―32100mmna-醋酸盐42mg/mlps803%arg-hcl42100mmna-磷酸盐8―3%arg-hcl51010mmna-醋酸盐42mg/mlps803%arg-hcl61010mmna-磷酸盐8―3%arg-hcl710100mmna-醋酸盐4――810100mmna-磷酸盐82mg/mlps80―9210mmna-醋酸盐42mg/mlps80300mmnacl/3%arg-hcl10210mmna-磷酸盐8―300mmnacl/3%arg-hcl112100mmna-醋酸盐42mg/mlps80300mmnacl122100mmna-磷酸盐8―300mmnacl131010mmna-醋酸盐42mg/mlps80300mmnacl141010mmna-磷酸盐8―300mmnacl1510100mmna-醋酸盐4―300mmnacl/3%arg-hcl1610100mmna-磷酸盐82mg/mlps80300mmnacl/3%arg-hcl用上述制备的样品进行热应力试验。热应力试验(37℃下储存2周)后,通过目视检查、dls、se-hplc和ie-hplc分析进行浊度分析,选择影响聚集和颗粒形成的三个主要因素。使用minitab软件分析帕累托图结果(α=0.15),以选出主要因素。结果分别示于图2a、2b、3a和3b中。如图2所示,影响浊度的主要因素是nacl、缓冲液浓度和ph(图2a)。此外,dls分析结果表明,影响单体强度降低的主要因素是ph和nacl(图2b)。另外,如图3所示,se-hplc分析结果表明,影响主峰降低的主要因素是ph和nacl(图3a)。此外,ie-hplc分析结果表明,影响主峰降低的主要因素是ph和缓冲液浓度(图3b)。基于该结果,选择ph、nacl和缓冲液浓度作为影响聚集和颗粒形成的主要因素。在以下实验中,使用minitab程序进行响应曲面设计(rsm)。实施例3:通过rsm设计选择药物制剂的条件对于液体制剂在热应力下稳定的优化条件,为了检验实施例2中选择的聚集和颗粒形成的主要因素,通过minitab程序(cci,5级)进行rsm设计,并且根据不同的ph(4-8)、以及nacl(0-300mm)和缓冲液(10-100mm)的浓度制备各样品。制备的样品的具体原料如表3中所述。表3首先,通过将如表3所示的原料混合,制备各样品。将制备的样品在以下储存条件下进行热试验:(i)37℃,两周;或(ii)60℃,一天。在37℃、两周的储存条件下,各样品的目视检查、蛋白质浓度、se-hplc、ie-hplc、ief和sds-page分析结果示于图9-14中。目视检查分析结果表明,只有#9是不透明的,而其他所有的都是无色透明的。ief结果显示,#9表现出由颗粒形成引起的带状拖曳现象。在60℃、一天的储存条件下,各样品的目视检查、浊度和dls分析结果以及结合测定1的结果示于图15-18中。目视检查分析结果表明,浊度顺序为#9>#5>#7>#1和#3(其他所有样品均无色透明)。结合测定1的结果表明,与对照组相比,#15样品的ec50%为114%-121%。另外,基于上述结果的优化图示于图19和表4中。表4基于表4结果进行统计分析得到的建议的优选药物制剂的条件示于表5中。表5更具体地说,能满足期望效能且同时在热应力条件下可减少聚集、颗粒形成和潜在变化的条件是:蛋白质(抗egfr抗体)浓度为10mg/ml,10-100mm醋酸钠,ph为5.3-6.1和0mmnacl(基于等高线图)。此外,上述条件中最佳安全条件是:ph为5.94,50mm醋酸钠,无nacl(即0mmnacl)(基于优化图)。实施例4:调渗剂类型的筛选为了选择本申请药物制剂中使用的调渗剂的类型,将如表6所示的原料混合,制备各样品,将制备的样品在60℃下储存一天。目视检查、浊度和dls分析结果分别示于图4a、4b和4c中。表6如图4所示,目视检查分析结果表明,所有样品均无色透明(图4a)。浊度和dls分析结果表明,含有3%甘氨酸或5%甘露醇的制剂显著抑制了浊度的增加(图4b和4c)。实施例5:聚山梨酯80的浓度的测定为了确定本申请药物制剂中使用的聚山梨酯80的浓度,将如表7所示的原料混合,制备各样品,然后将制备的样品进行机械试验。目视检查、浊度和dls分析结果分别示于图5a、5b和5c中。表7如图5所示,只有样品#1是不透明的,其它所有样品都是无色透明的(图5a)。另外,除了样品#1,均没有显著的浊度变化,并且在0.05-2.0mg/ml的浓度范围内可观察到浊度抑制效果(图5b)。同时,dls分析结果也显示,在0.05-2.0mg/ml的浓度范围内可观察到聚集抑制作用(图5c)。其中,0.2mg/ml的聚山梨酯80显示最低程度的聚集,因此,为最佳浓度。制备例1-3和比较制备例1-2:药物制剂的制备使用表8所示的原料以常规方式制备液体药物制剂。表8试验实施例:药物制剂的稳定性分析在下述应力条件下储存根据制备例1-3和比较制备例1-2制备的药物制剂后,进行目视检查、浊度、dls、蛋白质含量、se-hplc、ie-hplc、sds-page、ief和效力1和效力2分析。应力条件(1)在60℃下储存2周(1天、3天、1周和2周)(2)在5℃、25℃或37℃下储存2周至12个月(初始、2周、4周、6周、8周和3至12个月)结果在60℃储存两周的情况下,目视检查分析结果表明,比较制备例1和比较制备例2的药物制剂变得不透明,而制备例3的药物制剂在储存2周后保持无色透明。浊度和dls分析表明,制备例3中含有甘露醇和聚山梨酯80的药物制剂浊度的增加最少(图6a和6b)。在5℃、25℃或37℃下储存2周至12个月的情况下,目视检查分析结果表明,所有药物制剂在任何储存条件下均无色透明。对制剂在不同温度下储存的浊度变化分析表明,不管制剂的种类如何,在5℃或25℃下储存的样品都无浊度变化。然而,在37℃下储存的样品中,与初始点相比,制备例2的制剂#4在储存8周后浊度增加2.3倍(图7)。另一方面,uv蛋白质定量分析显示,与初始点相比,在任何温度条件下的所有制剂均在95%-105%的范围内,没有显著变化。sds-page分析结果表明,在制备例和比较制备例的不同储存温度下的带型没有差异。然而,从图8a和8b中可以看出,初始点和在非还原条件下在37℃下储存8周后的结果表明,在初始点的样品和经高温储存后的样品之间存在带型差异。在非还原条件下,与初始点相比,制备例和比较制备例中的所有制剂#1至#5在经37℃储存后显示250kd和37-50kd条带强度增加。此外,在还原条件下,与初始点相比,制备例和比较制备例中的所有制剂#1至#5在经37℃储存后显示75kd条带强度增加,并在25-50kd形成新的条带。同时,ief结果表明,在任何储存条件下,不同温度下的制剂之间ief带型无差异,条带位于pi7.8至8.3之间。se-hplc分析结果表明,制备例和比较制备例中的所有制剂#1至#5在经5℃或25℃储存后均未显示出显著的纯度变化。然而,在经37℃储存8周后,制剂#1、#2、#3、#4和#5分别显示95.66%、95.15%、96.46%、96.42%和96.56%的值,这意味着与初始点相比,纯度下降了3.14%-4.55%。因此,与比较制备例相比,本申请的制备例的制剂显示出更高的稳定性。特别地,比较制备例的制剂纯度大幅度降低,这是由主峰之前的峰前部分(假设为聚集体)的增加引起的。效力2分析(基于细胞的测定)结果显示,与对照组相比,所有制剂无论储存温度如何,ec50均为70%-130%,说明没有显著变化。上述结果表明,在包含抗egfr抗体的药物制剂中,用于抑制热应力条件下的聚集和颗粒形成的调渗剂可以是nacl、甘氨酸、甘露醇等,优选甘露醇或不含nacl;并且用于抑制机械应力条件下的聚集和颗粒形成的聚山梨酯80的优选浓度为0.2mg/ml。此外,药物制剂在60℃高温下储存后的稳定性分析结果表明,含有10mg/ml抗egfr抗体的制剂在含有50mm醋酸钠、ph为5.7±0.4、含有0.2mg/ml聚山梨酯80和5%甘露醇的条件下,其在机械/热应力下可达到稳定。此外,药物制剂在5℃、25℃和37℃下储存8周后的稳定性分析结果表明,在物理/化学稳定性方面,含有10mg/ml抗egfr抗体的制剂优选进一步含有50mm醋酸钠、ph为5.7±0.4、含有0.2mg/ml聚山梨酯80且不含nacl。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1