醋酸阿比特龙复合物、其制备方法及包含它们的药物组合物与流程
本发明涉及一种具有受控粒度、增加的表观溶解度和增加的溶解速率的稳定复合物,该复合物包含作为活性化合物的醋酸阿比特龙,其可用于治疗已经扩散到身体其他部位的某种类型的前列腺癌。醋酸阿比特龙可用于早期前列腺癌和晚期乳腺癌。具体而言,本发明的复合物具有增加的表观溶解度,并且表现出允许显著的剂量降低以及放弃空腹服药的要求的非积极的食物作用。本发明还涉及配制和制备本发明复合物的方法、包含其的药物组合物、其用途,以及使用该复合物及其组合物的治疗方法。
背景技术:
阿比特龙为一种有效且具有选择性的cyp17(17α-羟化酶/c17,20-裂合酶)抑制剂。由于阿比特龙的生物利用度差且还易受酯酶水解,因此已开发前药。已发现醋酸阿比特龙(a)对于酯酶具有抗性,并在体内被迅速脱乙酰化为阿比特龙(b),从而产生了有效的cyp17抑制。醋酸阿比特龙的化学命名为(3β)-17-(3-吡啶基)雄甾-5,16-二烯-3-基乙酸酯,其结构为:
醋酸阿比特龙为一种白色至灰白色、不吸湿的结晶性粉末。其分子式为c26h33no2且其分子量为391.55。醋酸阿比特龙为一种亲脂性化合物,其辛醇-水分配系数为5.12(logp),并且几乎不溶于水。芳族氮的pka为5.19。
醋酸阿比特龙(zytiga)在体内转化为阿比特龙——一种雄激素生物合成抑制剂——其抑制17α-羟化酶/c17,20-裂合酶(cyp17)。该酶在睾丸、肾上腺和前列腺肿瘤组织中表达,并且是雄激素生物合成所需要的。
cyp17催化两个连续反应:1)通过17α-羟化酶活性将孕烯醇酮和孕酮转化为其17α-羟基衍生物,2)随后通过c17,20裂合酶活性分别形成脱氢表雄酮(dhea)和雄甾烯二酮。dhea和雄甾烯二酮为雄激素类,并且是睾酮的前体。通过阿比特龙对cyp17的抑制也可导致由肾上腺素产生的盐皮质激素增加。
雄激素敏感的前列腺癌对于降低雄激素水平的治疗有响应。雄激素剥夺疗法(例如用gnrh激动剂或睾丸切除术的治疗)降低睾丸中的雄激素生成,但不影响肾上腺或肿瘤中的雄激素生成。
在安慰剂-对照的3期临床试验中,醋酸阿比特龙使患者中的血清睾酮和其他雄激素减少。不必监测阿比特龙对血清睾酮水平的影响。
可观察到血清前列腺特异性抗原(psa)水平的变化,但这并不表明与个体患者的临床益处相关。
在给予醋酸阿比特龙之后,对于健康受试者和患有转移性阉割抗性前列腺癌(crpc)的患者中的阿比特龙和醋酸阿比特龙的药代动力学进行研究。在体内,醋酸阿比特龙转化成阿比特龙。在临床研究中,>99%的分析样本中的醋酸阿比特龙血浆浓度低于可检测的水平(<0.2ng/ml)。
在对患有转移性crpc的患者口服给予醋酸阿比特龙后,达到阿比特龙最大血浆浓度的中位时间(mediantime)为2小时。与单次1,000mg剂量的醋酸阿比特龙相比,观察到阿比特龙累积处于稳态,暴露量(exposure)增加2倍(稳态auc)。
在患有转移性crpc的患者中,在每日1,000mg的剂量下,cmax的稳态值(平均值±sd)为226±178ng/ml,auc为993±639ng*hr/ml。在250mg至1,000mg的剂量范围内,未观察到剂量比例的较大偏差。然而,在将剂量从1,000倍翻倍至2,000mg时,暴露量没有显著增加(平均auc增加了8%)。
在醋酸阿比特龙与食物一起给予时,阿比特龙的全身性暴露量增加。在醋酸阿比特龙与低脂肪膳食(7%脂肪、300卡路里)一起给予时,阿比特龙cmax和auc0-∞分别增加约7倍和5倍,在醋酸阿比特龙与高脂肪(57%脂肪、825卡路里)膳食一起给予时,其分别增加约17倍和10倍。考虑到膳食的含量和组成的正常变化,与膳食一起服用
阿比特龙与人血浆蛋白、白蛋白和α-1酸性糖蛋白高度结合(>99%)。表观稳态分布容积(平均值±sd)为19,669±13,358l。体内研究表明,在临床相关浓度下,醋酸阿比特龙和阿比特龙不是p-糖蛋白(p-gp)的底物,并且表明醋酸阿比特龙为p-gp抑制剂。尚未进行其他转运蛋白的研究。
在口服给予醋酸14c-阿比特龙胶囊后,醋酸阿比特龙水解为阿比特龙(活性代谢物)。转化可能通过酯酶活性(酯酶未被鉴定)而非cyp介导。在人血浆中,阿比特龙的两种主要循环代谢物为硫酸阿比特龙(无活性)和硫酸阿比特龙n-氧化物(无活性),二者占每次暴露量的约43%。cyp3a4和sult2a1为参与形成硫酸阿比特龙n-氧化物的酶,sult2a1参与形成硫酸阿比特龙。
在患有转移性crpc的患者中,阿比特龙在血浆中的平均最终半衰期(平均值±sd)为12±5小时。口服给予醋酸14c-阿比特龙后,在粪便中回收大约88%的放射性剂量,在尿液中回收大约5%。存在于粪便中的主要化合物为未变化的醋酸阿比特龙和阿比特龙(分别约为给药剂量的5%和22%)。
通常的剂量是每天一次一起服用4片(1,000mg)。片剂必须在空腹时用一杯水吞服。片剂必须在进食前至少1小时或进食后至少2小时服用。阿比特龙必须与被称为泼尼松龙的类固醇一起服用,以帮助减少一些副作用。
在口服给予醋酸阿比特龙后的临床研究中,阿比特龙表现出不同的药代动力学和极大的积极食物作用。在给予单剂量的醋酸阿比特龙时,阿比特龙cmax和auc0-∞(暴露量)分别增加17倍和10倍。为了控制阿比特龙血浆浓度,
为了克服与现有常规的醋酸阿比特龙制剂和可用的药物递送系统相关的问题,醋酸阿比特龙的新型复合配方物和复合剂以及药学上可接受的赋形剂的特征在于增强的表观溶解度、即时溶解、降低的食物作用,所述降低的食物作用允许显著的剂量降低并且放弃空腹服药的要求。
已使用多种策略以尝试克服这些问题,参见例如cn101768199a、cn102558275a、wo2014083512a1、wo2014145813a1、cn102321142a、wo2014102833a2、wo2014009436a1、wo2014145813a1、wo2014009434a1、wo2009009132a1、wo2013164473a1、wo1995011914a1、ca2513746a1、wo2010078300a1、wo2014100418a2和wo2014009437a1。
根据cn102336801a专利申请,醋酸阿比特龙的多晶型物的特征在于在5.76°、11.98°、12.50°、14.74°、15.02°、15.86°、17.14°、18.30°、18.82°、19.02°、19.70°、21.58°、21.78°、22.38°、22.98°、23.34°和27.48°2θ处的典型x射线衍射图,以及在2937.73cm-1、2889.59cm-1、2855.6cm-1、l479.66cm-1、1437.34cm-1、1372.01cm-1、1245.41cm-1、l034.63cm-1、962.33cm-1、800.75cm-1和713.79cm-1处的红外吸收光谱。
醋酸阿比特龙表现出多晶型现象,cn101768199专利申请公开了醋酸阿比特龙的醋酸阿比特龙a、b、c、d型。多晶型物a的特征在于x射线粉末衍射峰的2θ值为5.860°、12.060°、15.120°、15.920°、18.400°、18.940°、19.700°、21.700°、22.460°、23.500°、25.380°、27.580°。多晶型物b的特征在于x射线粉末衍射峰的2θ值为5.940°、9.640°、12.140°、14.880°、15.120°、16.000°、17.640°、18.460°、21.840°、22.500°、23.100°。多晶型物c的特征在于x射线粉末衍射峰的2θ值为5.960°、9.580°、12.140°、12.680°、14.920°、15.940°、17.280°、18.360°、19.000°、19.860°、21.820°、22.040°、22.400°、23.160°、23.460°、23.760°、25.420°、26.900°、27.520°和29.460°和30.000°,对应于特征衍射峰。多晶型物d的特征在于x射线粉末衍射峰的2θ值为5.860°、12.040°、14.800°、15.100°、15.920°、17.580°、18.400°、19.100°、19.740°、21.680°、22.380°、23.500°、29.500°、36.780°。
根据cn102558275a专利申请,醋酸阿比特龙的α多晶型物晶体的特征在于红外光谱,其包含在3047cm-1、2937cm-1、2891cm-1、2855cm-1、1735cm-1、1560cm-1、1374cm-1、1245cm-1和1035cm-1处的特征吸收峰。
发明概要
1.一种具有改善的物理化学特性和增强的生物学性能的稳定复合物,包含
a)活性化合物醋酸阿比特龙;或包括醋酸阿比特龙的活性化合物的组合;
b)至少一种选自下述的复合剂:由单-、二-和三甘油酯及聚乙二醇的单酯和二酯组成的聚乙二醇甘油酯,羟丙纤维素、泊洛沙姆(poloxamers)、乙烯基吡咯烷酮/乙酸乙烯酯共聚物、聚乙二醇、聚(2-乙基-2-噁唑啉)、聚乙烯基吡咯烷酮,基于环氧乙烷和环氧丙烷的嵌段共聚物、聚(马来酸/甲基乙烯基醚)、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物、聚乙二醇15羟基硬脂酸酯、环氧乙烷/环氧丙烷嵌段共聚物、聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯;
c)如果需要,药学上可接受的赋形剂;
其中所述复合物的粒度小于600nm,并具有下述特征中的一种或多种:
—其立即再分散于生理相关介质中;
—其具有增加的溶解速率;
—其以固体形式且在胶体溶液和/或分散体中是稳定的;
—其在水中的表观溶解度为至少0.6mg/ml;
—其显示出固体形式的x射线无定形特征;
—其在分散于蒸馏水中时的pampa渗透率为至少0.5*10-6cm/s,该渗透率在至少3个月内不会降低;
—表现出非积极的食物作用(进食/禁食比低于1.25),这允许显著的剂量降低以及放弃空腹服药的要求;
—与zytiga相比,暴露量的可变性显著降低。
2.根据要点1的复合物,其中所述复合物的粒度在50nm至60nm范围内。
3.根据要点1和2的复合物,其中所述复合物的粒度在100nm至500nm范围内。
4.根据要点1-3的复合物,其中,
a)复合剂选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物;以及
b)赋形剂为脱氧胆酸钠。
5.根据要点1-4的复合物,其中所述复合物由下述组成:
a)5-40重量%的醋酸阿比特龙;
b)5-80重量%的聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝聚合物;
c)0.1-50重量%的脱氧胆酸钠。
6.根据要点1-4的复合物,其中所述复合物包含活性剂醋酸阿比特龙和一种或多种选自下述的额外的活性剂:利福平(rifampicin)、泼尼松(prednisone)/泼尼松龙(prednisolone)、地塞米松(dexamethasone)、酮康唑(ketoconazole)、庚酸睾酮(testosteroneenanthate)、恩杂鲁胺(enzalutamide)、氢溴酸右美沙芬(dextromethorphanhydrobromide)、地塞米松(dexamethasone)、依西美坦(exemestane)、戈舍瑞林(goserelin)、地加瑞克(degarelix)、维利帕尼(veliparib)、度韦替尼(dovitinib)、亮丙瑞林(leuprolide)、alisertib、卡博替尼(cabozantinib)、卡巴他赛(cabazitaxel)、达沙替尼(dasatinib)、糖皮质激素(glucocorticoid)、多西他赛(docetaxel)、度他雄胺(dutasteride)、羟氯喹(hydroxychloroquine)、伊匹木单抗(ipilimumab)、二甲双胍(metformin)、舒尼替尼(sunitinib)、selinexor、依维莫司(everolimus)、曲妥单抗(trastuzumab)、他莫昔芬(tamoxifen),及其组合。
7.根据要点1-3的稳定复合物,包含
a)醋酸阿比特龙;或包括醋酸阿比特龙的活性化合物的组合;
b)复合剂聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物;
c)赋形剂脱氧胆酸钠;
8.根据要点1-3的稳定复合物,包含:
a)醋酸阿比特龙;
b)复合剂聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物;
c)赋形剂脱氧胆酸钠;
其中所述复合物的特征在于图19所示的红外(atr)光谱和图20所示的拉曼光谱。
在一种实施方案中,所述复合物的特征在于红外(atr)光谱,其具有的主/特征吸收峰为至少在569cm-1、607cm-1、713cm-1、797cm-1、843cm-1、942cm-1、973cm-1、1030cm-1、1103cm-1、1148cm-1、1195cm-1、1241cm-1、1333cm-1、1371cm-1、1421cm-1、1441cm-1、1477cm-1、1336cm-1、1734cm-1、2858cm-1、2928cm-1处的特征吸收峰;其特征在于拉曼光谱,其具有的主/特征吸收峰为至少在239cm-1、581cm-1、701cm-1、797cm-1、846cm-1、1026cm-1、1088cm-1、1196cm-1、1264cm-1、1445cm-1、1584cm-1、1600cm-1、1735cm-1处的特征吸收峰。
在一个实施方案中,所述复合物的特征在于红外(atr)光谱,其具有的主/特征吸收峰为至少在713cm-1、1030cm-1、1103cm-1和1734cm-1处的特征吸收峰;特征在于拉曼光谱,其具有的主/特征吸收峰为至少在581cm-1、1026cm-1和1445cm-1处的特征吸收峰。
9.制备根据要点1-8的稳定复合物的方法,所述方法包括将活性剂和至少一种复合剂和任选的一种或多种药学上可接受的赋形剂于药学上可接受的溶剂中的溶液与含有任选的至少一种药学上可接受的赋形剂的水性溶液混合的步骤。
10.根据要点9的方法,其中所述方法在连续流量仪中进行。
11.根据要点9和10的方法,其中所述连续流量仪为微流体流量仪。
12.根据要点9-11的方法,其中所述药学上可接受的溶剂选自甲醇、乙醇、异丙醇、正丙醇、丙酮、乙腈、二甲亚砜、四氢呋喃或其组合,优选所述药学上可接受的溶剂为四氢呋喃。
13.根据要点9-11的方法,其中所述溶剂彼此混溶,并且水性溶剂占最终溶液的0.1-99.9重量%。
14.一种组合物,其包含根据要点1-7的稳定复合物及药学上可接受的载体。
15.根据要点14的药物组合物,其中,所述组合物适用于口服、肺、直肠、结肠、肠胃外、脑池内、阴道内、腹膜内、眼、耳、局部、颊、鼻或外用给药,优选所述组合物适用于口服给药。
16.根据要点1-7的复合物,其用于制备治疗已经扩散到身体其他部位的某种类型的前列腺癌和早期前列腺癌和晚期乳腺癌的药物。
17.根据要点16的复合物,其用于治疗已经扩散到身体其他部位的类型的前列腺癌和早期前列腺癌和晚期乳腺癌。
技术实现要素:
本发明涉及一种稳定的复合物,其包含活性化合物醋酸阿比特龙或包括醋酸阿比特龙的活性化合物的组合,及至少一种复合剂;所述复合剂选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物、泊洛沙姆、聚乙烯基吡咯烷酮,乙烯基吡咯烷酮和乙酸乙烯酯的共聚物,和聚(马来酸-共-甲基-乙烯基-醚);所述复合物的特征在于其具有下述特性中的至少一种:
a)粒度小于600nm;
b)立即再分散于生理相关介质中;
c)具有增加的溶解速率;
d)以固体形式且在胶体溶液和/或分散体中是稳定的;
e)在水中的表观溶解度为至少0.6mg/ml;
f)显示出固体形式的x-射线无定形特征;
g)在分散于蒸馏水中时的pampa渗透率为至少0.5*10-6cm/s,该渗透率在至少3个月内不会降低;
h)表现出非积极的食物作用,其允许显著的剂量降低以及放弃空腹服药的要求;
i)与zytiga相比,暴露量的可变性显著降低。
本发明是一种具有增加的表观溶解度并且表现出非积极的食物作用的复合配方物,所述非积极的食物作用允许显著的剂量降低并且放弃空腹服药的要求。
我们已经发现,只有本发明中公开的复合剂和药学上可接受的赋形剂的经选择的组合产生具有改善的物理化学特性和增强的生物学性能的稳定复合配方物。
在一个实施方案中,所述复合剂选自:由单-、二-和三甘油酯及聚乙二醇的单酯和二酯组成的聚乙二醇甘油酯,羟丙纤维素、泊洛沙姆(环氧乙烷和环氧丙烷嵌段的共聚物)、乙烯基吡咯烷酮/乙酸乙烯酯共聚物、聚乙二醇、聚(2-乙基-2-噁唑啉)、聚乙烯基吡咯烷酮,基于环氧乙烷和环氧丙烷的嵌段共聚物、聚(马来酸/甲基乙烯基醚)、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物、聚乙二醇15羟基硬脂酸酯、环氧乙烷/环氧丙烷嵌段共聚物、聚乙烯醇-聚乙二醇接枝共聚物和d-α-生育酚聚乙二醇1000琥珀酸酯。
在一个优选实施方案中,所述复合剂为聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物。
在一个实施方案中,所述聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物为soluplus。
在一个实施方案中,所述复合物还包含脱氧胆酸钠。
在一个特别优选的实施方案中,本发明的复合物包含聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物和脱氧胆酸钠,并且
a)其特征在于图19所示的红外(atr)光谱和图20所示的拉曼光谱,或
b)其特征在于红外(atr)光谱,具有的主/特征吸收峰为至少在569cm-1、607cm-1、713cm-1、797cm-1、843cm-1、942cm-1、973cm-1、1030cm-1、1103cm-1、1148cm-1、1195cm-1、1241cm-1、1333cm-1、1371cm-1、1421cm-1、1441cm-1、1477cm-1、1336cm-1、1734cm-1、2858cm-1、2928cm-1处的特征吸收峰;并且其特征在于拉曼光谱,具有的主/特征吸收峰为至少在239cm-1、581cm-1、701cm-1、797cm-1、846cm-1、1026cm-1、1088cm-1、1196cm-1、1264cm-1、1445cm-1、1584cm-1、1600cm-1、1735cm-1处的特征吸收峰,或
c)其特征在于红外(atr)光谱,具有的主/特征吸收峰为至少在713cm-1、1030cm-1、1103cm-1和1734cm-1处的特征吸收峰;并且其特征在于拉曼光谱,具有的主/特征吸收峰为至少在581cm-1、1026cm-1、1445cm-1处的特征吸收峰。
在一个实施方案中,所述复合物的受控粒度在50nm至600nm范围内。在一个实施方案中,所述粒度为100nm至500nm。
在一个实施方案中,所述复合物进一步包括一种或多种额外的活性剂。
在一个实施方案中,所述额外的活性剂选自在治疗某种类型的前列腺癌是有用的并且可能用于早期前列腺癌和晚期乳腺癌的试剂。
在一种实施方案中,所述额外的活性剂选自利福平、泼尼松/泼尼松龙、地塞米松、酮康唑、庚酸睾酮、恩杂鲁胺、氢溴酸右美沙芬、地塞米松、依西美坦、戈舍瑞林、地加瑞克、维利帕尼、度韦替尼、亮丙瑞林、alisertib、卡博替尼、卡巴他赛、达沙替尼、糖皮质激素、多西他赛、度他雄胺、羟化氯喹、伊匹木单抗、二甲双胍、舒尼替尼、selinexor、依维莫司、曲妥单抗、他莫昔芬,及其组合。
在一个实施方案中,所述复合物表现出非积极的食物作用,其允许显著的剂量降低以及放弃空腹服药的要求。
在一个实施方案中,所述复合物具有a)–h)中所述的至少两种特性。
在一个实施方案中,所述复合物具有a)–h)中所述的至少三种特性。
在一个实施方案中,所述复合物具有增加的溶解速率。
本文中还公开了一种稳定复合物,其包含活性化合物醋酸阿比特龙、至少一种复合剂、和至少一种药学上可接受的赋形剂;所述复合剂选自聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物、泊洛沙姆、聚乙烯基吡咯烷酮、乙烯基吡咯烷酮和乙酸乙烯酯的共聚物、和聚(马来酸-共-甲基-乙烯基-醚);所述药学上可接受的赋形剂选自十二烷基硫酸钠、泊洛沙姆和脱氧胆酸钠;其中所述复合物通过混合方法获得。
在一个实施方案中,所述复合剂为聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物。
在一个实施方案中,所述聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物为soluplus。
在一个实施方案中,所述复合物还包含脱氧胆酸钠。
在一个实施方案中,所述复合物通过连续流动混合方法而获得。
在一个实施方案中,复合物包含复合剂和药学上可接受的赋形剂,其总量基于复合物总重量计在约1.0重量%至约95.0重量%范围;所述复合剂为聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物;所述药学上可接受的赋形剂为脱氧胆酸钠。
在一个实施方案中,复合物包含复合剂和药学上可接受的赋形剂,其总量基于复合物总重量计在约5.0重量%至约95.0重量%范围;所述复合剂为聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物;所述药学上可接受的赋形剂为脱氧胆酸钠。
在一个实施方案中,所述复合剂和药学上可接受的赋形剂占复合物总重量的10重量%至约95重量%,所述复合剂为聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物,所述药学上可接受的赋形剂为脱氧胆酸钠。
本文中进一步公开了制备复合物的方法,包括将醋酸阿比特龙、和至少一种复合剂和任选的一种或多种药学上可接受的赋形剂于药学上可接受的溶剂中的溶液与含有任选的至少一种药学上可接受的赋形剂的水性溶液混合的步骤。
在一个实施方案中,所述方法在连续流量仪中进行。
在一个实施方案中,所述连续流量仪为微流体流量仪。
在一个实施方案中,所述药学上可接受的溶剂选自甲醇、乙醇、异丙醇、正丙醇、丙酮、乙腈、二甲亚砜、四氢呋喃,或其组合。
在一个实施方案中,所述药学上可接受的溶剂为四氢呋喃。
在一个实施方案中,所述药学上可接受的溶剂与所述水性溶剂彼此混溶。
在一个实施方案中,所述水性溶剂占最终溶液的0.1-99.9重量%。
在一个实施方案中,所述水性溶剂占最终溶液的50-90重量%。
在一个实施方案中,所述水性溶剂占最终溶液的50-80重量%。
在一个实施方案中,所述水性溶剂占最终溶液的50-70重量%。
在一个实施方案中,所述水性溶剂占最终溶液的50-60重量%。
在一个实施方案中,所述水性溶剂占最终溶液的50重量%。
在一个实施方案中,所述水性溶剂占最终溶液的10-40重量%。
在一个实施方案中,所述水性溶剂占最终溶液的10-30重量%。
在一个实施方案中,所述水性溶剂占最终溶液的10-20重量%。
在一个实施方案中,所述水性溶剂占最终溶液的10重量%。
在一个实施方案中,药物组合物包括复合物和药学上可接受的载体。
在一个实施方案中,所述组合物适用于口服、肺、直肠、结肠、肠胃外、脑池内、阴道内、腹膜内、眼、耳、局部、颊、鼻或外用给药。
在一个实施方案中,所述组合物适用于口服给药。
在一个实施方案中,所述复合物用于制备治疗已经扩散到身体其他部位的某种类型的前列腺癌和早期前列腺癌和晚期乳腺癌的药物。
在一个实施方案中,所述复合物用于治疗已经扩散到身体其他部位的某种类型的前列腺癌和早期前列腺癌和晚期乳腺癌。
在一个实施方案中,与
本文中还公开一种稳定的复合物,其包括
a)5–40重量%的醋酸阿比特龙;
b)5–80重量%的聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共
聚物;
c)0.1–50重量%的脱氧胆酸钠;
其中所述复合物的受控粒度在50nm至600nm范围内,并且其中所述复合物不是通过粉碎法或高压均质法、包封法和固体分散法获得的,而是通过混合法、优选通过连续流动混合法获得。
在一个实施方案中,所述粒度为100nm至500nm。
在一个实施方案中,所述聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物为soluplus。
在一个实施方案中,基于狗体内研究和临床研究,所述复合物表现出非积极的食物作用。
在一个实施方案中,所述复合物表现出非积极的食物作用,其允许显著的剂量降低并且放弃空腹服药的要求。
在一个实施方案中,所述复合物立即再分散于生理相关介质中。
在一个实施方案中,所述复合物以固体形式并且在胶体溶液和/或分散体中是稳定的。
在一个实施方案中,所述复合物在水中的表观溶解度为至少0.6mg/ml。
在一个实施方案中,所述复合物显示出固体形式的x-射线无定形特征。
在一个实施方案中,所述复合物在分散于蒸馏水中时的pampa渗透率为至少0.5*10-6cm/s,该渗透率在至少3个月内不会降低。
本发明的醋酸阿比特龙复合配方物的复合剂和药学上可接受的赋形剂选自药学上可接受的非离子型、阴离子型、阳离子型、离子型聚合物,表面活性剂和其他类型的赋形剂。复合剂本身或与药学上可接受的赋形剂一起具有这样的功能:通过非共价次级相互作用与活性药物成分形成复合物结构。次级相互作用可以通过下述形成:静电相互作用例如离子相互作用、h键、偶极-偶极相互作用、偶极-诱导的偶极相互作用、london色散力、π-π相互作用和疏水相互作用。复合剂、药学上可接受的赋形剂和活性成分选自能够通过非共价次级相互作用形成这种复合物结构的复合剂、药学上可接受的赋形剂和活性成分。
在一些实施方案中,组合物可额外地包含一种或多种药学上可接受的赋形剂、辅助材料、载体、活性剂或其组合。在一些实施方案中,活性剂可包含对于治疗已经扩散到身体其他部位的某种类型的前列腺癌和早期前列腺癌和晚期乳腺癌有用的试剂。
本发明的另一个方面是醋酸阿比特龙与复合剂和药学上可接受的赋形剂的复合配方物,其中复合剂和药学上可接受的赋形剂优选与醋酸阿比特龙相结合(associated)或相互作用,尤其作为混合方法、优选连续流动混合方法的结果。在一些实施方案中,醋酸阿比特龙复合配方物的结构与核-壳型研磨颗粒、沉淀的包封颗粒、胶束和固体分散体不同。
本发明的药物组合物可以配制成:(a)用于选自口服、肺、直肠、结肠、肠胃外、脑池内、阴道内、腹膜内、眼、耳、局部、颊、鼻和外用给药的给药;(b)选自液体分散剂、凝胶剂、气雾剂、软膏剂、乳膏剂、冻干制剂、片剂、胶囊剂的剂型;(c)选自控释制剂、速溶制剂、延迟释放制剂、延长释放制剂、脉冲释放制剂,以及即释和控释的混合制剂的剂型;或(d)(a)、(b)和(c)的任意组合。
组合物可通过加入用于口服给药的固体的、液体的,用于局部给药(粉剂、软膏剂或滴剂)或外用给药等的药学上可接受的不同类型的赋形剂来配制。
尽管可利用药学上可接受的任何剂型,但是本发明的优选剂型为固体剂型。
用于口服的固体剂型包括但不限于胶囊剂、片剂、丸剂、粉剂和颗粒剂。在该固体剂型中,活性剂与至少一种下述赋形剂混合:(a)一种或多种惰性赋形剂(或载体),例如柠檬酸钠或磷酸二钙;(b)填料或填充剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇、微晶纤维素和硅酸;(c)粘合剂,例如纤维素衍生物、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯树胶;(d)保湿剂,例如甘油;(e)崩解剂,例如交联聚维酮、淀粉羟基乙酸钠、泡腾剂组合物、交联羧甲基纤维素钠、硫酸钙、马铃薯或木薯淀粉、褐藻酸、某些复合硅酸盐和碳酸钠;(f)溶液阻滞剂,例如丙烯酸盐、纤维素衍生物、石蜡;(g)吸收促进剂,例如季铵化合物;(h)润湿剂,例如聚山梨酸酯、十六醇和甘油单硬脂酸酯;(i)吸附剂,例如高岭土和膨润土;以及(j)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠、或其混合物。对于胶囊剂、片剂和丸剂,剂型也可包括缓冲剂。
除了这些惰性稀释剂,组合物也可包含佐剂,例如润湿剂、乳化剂和助悬剂、甜味剂、调味剂和芳香剂。
本发明的醋酸阿比特龙复合配方物的优点包括但不限于(1)物理化学稳定性,(2)即时再分散性,(3)在治疗时间窗口期中,在胶体溶液或分散体中的稳定性、(4)与常规醋酸阿比特龙制剂相比,增加的表观溶解度,(5)增加的渗透率,(6)在禁食状态下增加的口服生物利用度,(7)非积极的食物作用,及(8)良好的可加工性。
本发明的有益特征如下:在水、生物学相关介质(例如sgf、sgf、fessif和fassif介质)和胃肠液中,醋酸钠阿比特龙的固体复合配方物具有良好的/即时再分散性,以及在治疗时间窗口期中,在胶体溶液和/或分散体中具有足够的稳定性。
本发明的醋酸比特龙复合配方物的一个优选特征为其增加的表观溶解度和渗透率。在一些实施方案中,醋酸阿比特龙复合配方物的表观溶解度和渗透率分别为至少0.6mg/ml和0.5*10-6cm/s。
本发明的醋酸阿比特龙复合配方物的另一个优选特征涉及醋酸阿比特龙复合配方物的增强的药代动力学性能。其表现出非积极的食物作用,这允许显著的剂量降低以及放弃空腹服药的要求。
附图说明
图1示出用于配方物选择的复合剂筛选,以便选择具有即时再分散性的配方物。
图2示出由不同的药学上可接受的赋形剂组成的醋酸阿比特龙复合制剂的比较的pampa测定。
图3示出含有不同比率的soluplus和sdc的醋酸阿比特龙复合制剂的比较的再分散性、稳定性测试及pampa测定。
图4示出包含不同比率的soluplus和sdc的醋酸阿比特龙复合制剂的比较的pampa测定。
图5示出用于制备本发明的醋酸阿比特龙复合制剂的胶体溶液的溶液组成。
图6示出流速比率对于再分散配方物的外观和稳定性的影响。
图7示出以不同流速比率制备的再分散的醋酸比特龙复合制剂的稳定性。
图8示出所选择的配方物的合成的(as-synthetized)胶体溶液和再分散的固体复合物的粒度分布。
图9示出以加强的工艺流速制备的再分散的醋酸阿比特龙复合制剂的稳定性。
图10示出生产温度对于醋酸阿比特龙复合制剂质量的影响。
图11示出在fassif介质中,湿研磨的醋酸阿比特龙和醋酸阿比特龙复合物的溶出曲线。
图12示出在fessif介质中,湿研磨的醋酸阿比特龙和醋酸阿比特龙复合物的溶出曲线。
图13示出本发明的挤出的醋酸阿比特龙制剂和阿比特龙复合制剂的pampa渗透率。
图14示出在模拟禁食和进食(gi道模拟)中的胶体溶液的稳定性。
图15示出在fassif介质中,结晶醋酸阿比特龙、物理混合物、zytiga和醋酸阿比特龙复合物的溶出曲线。
图16示出在fessif介质中结晶醋酸阿比特龙、物理混合物、zytiga和醋酸阿比特龙复合物的溶出曲线。
图17示出了在不同条件下储存后,再分散于蒸馏水之后,根据所测量的pampa渗透率来检测的固体形式的稳定性。
图18示出关于本发明的醋酸阿比特龙复合物(b:本发明的含有醋酸阿比特龙、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)、脱氧胆酸钠的复合物)和在没有醋酸阿比特龙的存在下而制备的安慰剂样品(a)的扫描电子显微镜(sem)图像。
图19示出结晶醋酸阿比特龙(a)、醋酸阿比特龙复合物(b)、安慰剂样品(c)、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)(d)和脱氧胆酸钠(e)的atr光谱。
图20示出结晶醋酸阿比特龙(a)、醋酸阿比特龙复合物(b)、安慰剂样品(c)、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)(d)和脱氧胆酸钠(e)的拉曼光谱。
图21示出结晶醋酸阿比特龙、安慰剂样本和醋酸阿比特龙复合制剂的粉末x射线衍射图。
图22示出醋酸阿比特龙复合制剂的复原溶液的ph。
图23示出刚好在制备后的pib制剂的水含量。
图24示出复原后的pib制剂的醋酸阿比特龙含量。
图25示出醋酸阿比特龙复合片剂的组成。
图26示出在对比格犬口服给予zytig后,阿比特龙的血浆浓度,n=4,剂量:50mg。
图27示出在对比格犬口服给予醋酸阿比特龙复合制剂后阿比特龙的血浆浓度,n=4,剂量:50mg。
图28示出在对比格犬口服给予zytiga(a)和醋酸阿比特龙复合配方物(b)之后的药代动力学参数,n=4,剂量:50mg。
图29示出在对10名健康男性志愿者在禁食和进食状态下口服给予20mg本发明的醋酸阿比特龙复合制剂后,阿比特龙的血浆浓度。
图30示出在对10名健康男性志愿者在禁食和进食状态下口服给予1000mgzytiga(emeaassessmentreportforzytiga(abiraterone),acharyaetal.,2012和attardetal.,2008.)或口服给予200mg醋酸阿比特龙复合制剂之后的药代动力学参数。
实施例
测试了几种药学上可接受的复合剂和药学上可接受的赋形剂及其组合,以便选择具有即时再分散性的配方物。选择显示出具有可接受水平的再分散性的实施例之一用于进一步分析(图1)。
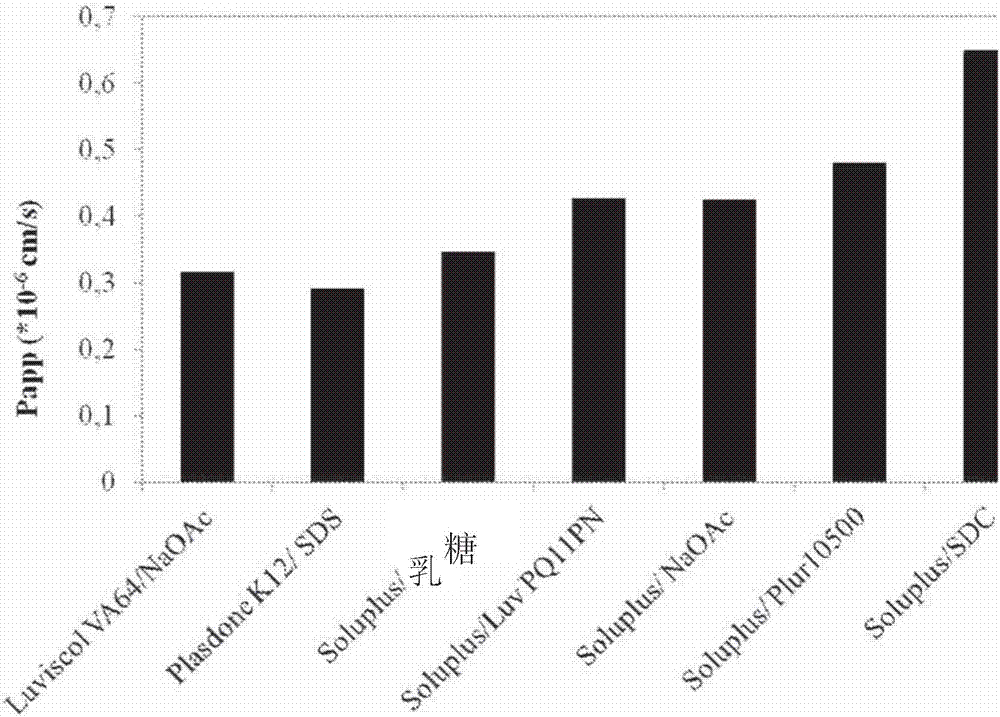
测量所选的制剂的pampa渗透率,以便选择具有最佳体内性能的醋酸阿比特龙复合制剂(图2)。按照由m.kansi等所记载的(journalofmedicinalchemistry,41,(1998),pp1007),并具有基于s.bendels等(pharmaceuticalresearch,23(2006),pp2525)所作的某些改变,来进行pampa渗透率测量。在96孔板测定中,测量穿过由pvdf膜(millipore,usa)支撑的、由具有20%大豆卵磷脂的十二烷组成的人造膜的渗透率。接收室为补充有1%十二烷基硫酸钠的磷酸盐缓冲盐水(ph7.0)。所述测定在室温下进行,温育时间为1-24小时。接收室中的浓度通过uv-vis分光光度计(thermoscientificgenesyss10)测定。
选择聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)作为复合剂,以及脱氧胆酸钠(sdc)作为药学上可接受的赋形剂来形成具有改善的材料特性的醋酸阿比特龙复合制剂。基于体内特性(再分散性曲线、再分散溶液的稳定性和pampa渗透率)(图3和图4),发现在本发明的复合制剂中醋酸阿比特龙、聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)和脱氧胆酸钠(sdc)的最佳重量比为1:4:0.6。
用于制造本发明的醋酸阿比特龙复合制剂粉末的技术方法依赖于含有经选择的复合剂、药学上可接受的赋形剂和活性药物的醋酸阿比特龙复合制剂的胶体溶液的冷冻干燥或喷雾干燥。本发明的醋酸阿比特龙复合制剂的胶体溶液通过两种溶液的连续流动混合而制备。一种溶液含有醋酸阿比特龙和复合剂。第二种溶剂为水并且包含药学上可接受的赋形剂。胶体溶液在制备之后立即固化。所制备的胶体溶液的特性可在加工期间通过对不同变换参数(例如,温度、流速和浓度)的精确控制和优化来改变。
使用如图5所示的含有醋酸阿比特龙和
对再分散的冷冻干燥样品的稳定性进行监测。使用1mg/ml浓度的醋酸阿比特龙,将醋酸阿比特龙复合物的固体制剂再分散于净化水中或再分散于生物相关介质中。再分散的制剂的稳定性通过在不同的时间点用0.45μm孔径的过滤器将其过滤来监测。通过uv-vis分光光度法(vwruv-3100pc)测定滤液的醋酸阿比特龙含量(图7)。已发现1:4的流速比率对于制备本发明的醋酸阿比特龙复合制剂是最佳的。
在流量仪中,本发明的具有复合剂和药学上可接受的赋形剂的最佳比率的醋酸阿比特龙复合配方物的胶体溶液通过连续流动混合来制备。作为起始溶液,使用溶解于100ml四氢呋喃中的1000mg醋酸阿比特龙和4000mg聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)。将所制备的溶液以10ml/min的流速进入仪器。同时,将500ml水中含有750mg脱氧胆酸钠的水性溶剂以40ml/min的流速进入仪器,其中醋酸阿比特龙形成醋酸阿比特龙复合组合物。在大气压下连续制备醋酸阿比特龙复合物的胶体溶液。将所制备的胶体溶液经干冰冷冻,然后使用配备有-110℃冰冷凝器和真空泵的冷冻干燥机进行冻干。对于所述方法,监测醋酸阿比特龙复合配方物的粒度和粒径分布。在图8中示出刚好在制备之后的胶体溶液和复原的固体醋酸阿比特龙复合配方物的粒度和粒径分布。已发现所制备的胶体溶液的d(50)=310nm,再分散颗粒的d(50)=158nm。
进行工艺强化以增加制备的效力。流速比率由1:4增加至10:40。使用如上所述的冷冻干燥方法,将所制备的本发明的醋酸阿比特龙复合制剂的胶体溶液制成固体。使用净化水复原样品。过滤后,再分散溶液的物理稳定性也通过测量过滤后的再分散溶液的醋酸阿比特龙的含量而及时进行监测(图9)。工艺强化不影响再分散溶液的稳定性。
考察制备温度对于产品质量的影响。使用如上所述的强化的和最佳的参数集,在20、30和40℃的温度下,制备本发明的醋酸阿比特龙复合制剂的胶体溶液。然后将所制备的胶体溶液冷冻干燥。如先前所述,将冷冻干燥的样品再分散于净化水中,并且及时监测其稳定性(图10)。发现最佳制备温度为30℃。
比较制剂研究
在聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)和脱氧胆酸钠的存在下,将结晶醋酸阿比特龙进行湿研磨,以制备纳米级醋酸阿比特龙颗粒。研磨工艺使用fritschpulverisette6仪器实施。si2n3研磨容器的体积为250ml。使用直径为10mm的25个研磨球。研磨速度设定为500rpm。采用的研磨时间为5×1h。
在12.5mlmilliq水中,研磨的悬浮液含有0.447g醋酸阿比特龙、1.178gsoluplus和0.267g脱氧胆酸钠。湿研磨工艺得到泡沫状悬浮液,其被冷冻干燥以获得固体粉末。
在37℃下,将湿研磨的阿比特龙的溶出曲线与本发明的结晶醋酸阿比特龙和醋酸阿比特龙复合物的溶出进行比较。将10mg醋酸阿比特龙等同样品分散于20mlfassif(禁食的)和fessif(进食的)介质中,并且通过20nm一次性注射过滤器过滤。通过uv-vis分光光度法测量滤液中的活性物含量。
与来自湿研磨样品的醋酸阿比特龙溶出量相比,来自本发明的醋酸阿比特龙复合制剂的醋酸阿比特龙溶出在fessif中提高3倍,在fassif中提高9倍(图11和图12)。
使用聚乙烯基己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(soluplus)和作为药学上可接受的赋形剂的脱氧胆酸钠,通过挤出工艺来制备醋酸阿比特龙的药物制剂。使用haaketmminilabiimicrocompounder(thermoscientific)仪器实施挤出。
在预混合步骤中,将干燥的粉末(17.9w/w%醋酸阿比特龙、71.4w/w%soluplus、10.7w/w%sdc)在研钵中混合,然后将8g粉末混合物进料至挤出机中。挤出在130℃下以20rpm的螺杆速率进行。在水、fassif和fessif介质中,将挤出的醋酸阿比特龙制剂的pampa渗透率与本发明的醋酸阿比特龙复合制剂的pampa渗透率进行比较。在fessif介质中,醋酸阿比特龙复合物的pampa渗透率比挤出的制剂的渗透率提高2倍(图13)。
比较溶解度测试
通过uv-vis光谱法在室温下测量醋酸阿比特龙复合配方物和未经配制的化合物的表观溶解度。将样品分散于蒸馏水中,并且将所得的分散体通过100nm一次性注射过滤器过滤。通过uv-vis分光光度法测量滤液中的活性物含量并计算溶解度。滤液可包含使用100nm孔径过滤器无法滤出的醋酸阿比特龙复合物颗粒。
醋酸阿比特龙复合配方物和未经配制的化合物的溶解度分别为0.6mg/ml和<0.004mg/ml。
比较体外pampa测定
醋酸阿比特龙复合配方物的pampa渗透率高于0.5*10-6cm/s,而未经配制的化合物的pampa渗透率低于0.1*10-6cm/s。
胶体溶液在gi道中的稳定性
进行通过gi道的模拟通路,以检测胶体溶液在禁食和进食条件下在代表gi道的ph值和胆汁酸浓度下的任何不稳定性。在模拟中没有观察到胶体溶液的光散射的显著变化,这表明在禁食和进食条件下,在吸收过程的时间窗口期中,醋酸阿比特龙复合制剂在这些条件下是稳定的(图14)。
比较溶出测试
通过uv-vis光谱法在37℃下测量结晶醋酸阿比特龙、本发明的组合物的物理混合物和本发明的醋酸阿比特龙复合制剂的溶出。将10mg醋酸阿比特龙等同样品分散于20mlfassif和fessif介质中,然后通过100nm(结晶醋酸阿比特龙、zytiga和物理混合物)或20nm(醋酸阿比特龙复合物)一次性注射过滤器过滤。通过uv-vis分光光度法测量滤液中的活性物含量。
在每种测试条件下,来自本发明的醋酸阿比特龙复合制剂的醋酸阿比特龙的溶出优于来自结晶阿比特龙、物理混合物和zytiga的醋酸阿比特龙的溶出(图15和图16)。在fassif条件下,0.5h内从醋酸阿比特龙复合制剂中溶出大于35%的醋酸阿比特龙,而zytiga在4h内的溶出小于4%。在fessif条件下,0.5h内从本发明的醋酸阿比特龙复合制剂中阿比特龙的溶出大于90%,而在4h内从zytiga中醋酸阿比特龙的溶出小于35%。
固体形式的稳定性
在不同条件下储存后,测量固体(制剂1)的pampa渗透率。在4℃、rt或40℃、75%相对湿度下存储3个月,在任何测试条件下,所测量的pampa渗透率都没有表现出显著的下降(图17)。
结构分析
使用feiquanta3d扫描电子显微镜考察醋酸阿比特龙复合制剂的形态。将本发明的复合物的形态与如上所述制备的在缺少醋酸阿比特龙的条件下制备的安慰剂样品进行比较。本发明的醋酸阿比特龙复合物由球状颗粒组成(图18b)。在缺少活性化合物的情况下,复合剂和药学上可接受的赋形剂不形成球状颗粒(图18a)。
通过使用具有brukerplatinumdiamondatr单元的brukervertex70ft-ir光谱仪和配备有使用785nm(nir)激光二极管的olympusbxfm自由空间显微镜的horibajobinyvonlabramhruv-vis-nir进行结构分析。
在一个实施方案中,所述复合物的特征在于红外(atr)光谱,具有的主/特征吸收峰为至少在569cm-1、607cm-1、713cm-1、797cm-1、843cm-1、942cm-1、973cm-1、1030cm-1、1103cm-1、1148cm-1、1195cm-1、1241cm-1、1333cm-1、1371cm-1、1421cm-1、1441cm-1、1477cm-1、1336cm-1、1734cm-1、2858cm-1、2928cm-1处的特征吸收峰(图19)。
在一个优选的实施方案中,所述复合物的特征在于红外(atr)光谱,具有的主/特征吸收峰为至少在713cm-1、1030cm-1、1103cm-1、1734cm-1处的特征吸收峰(图19)。
在一个实施方案中,所述复合物的特征还在于拉曼光谱,具有的主/特征吸收峰在239cm-1、581cm-1、701cm-1、797cm-1、846cm-1、1026cm-1、1088cm-1、1196cm-1、1264cm-1、1445cm-1、1584cm-1、1600cm-1、1735cm-1处(图20)。
在一个优选的实施方案中,所述复合物的特征还在于拉曼光谱,具有的主/特征吸收峰在581cm-1、1026cm-1和1445cm-1处(图20)。
通过粉末x射线衍射(xrd)分析(philipspw1050/1870rtg粉末衍射仪)考察本发明的醋酸阿比特龙复合物的结构。测量结果表明醋酸阿比特龙复合组合物为xrd无定形的(参见图21中)。醋酸阿比特龙复合物和安慰剂样品的衍射图的特征性反射归因于样品架。
瓶制剂中的粉末
制备本发明的醋酸阿比特龙复合物的50mg剂量浓度粉末的瓶(pib)制剂。将以下制备参数用于制造工艺中:
在制备之后以及在用0.45μm孔径过滤器过滤之后立即对所制备的胶体中的醋酸阿比特龙含量进行考察。胶体溶液的活性物含量为2.007mg/ml,而发现滤液中的醋酸阿比特龙含量为2.026mg/ml。溶液混合物的额定活性物含量为2.000mg/ml。
测定pib制剂的质量均匀性:将所制备的溶液混合物的25ml等份填充入200ml琥珀玻璃药用瓶中。在冷冻干燥工艺后,核对pib制剂的重量。瓶中冷冻干燥的粉末的平均质量为0.2773mg±0.0015mg。
测定pib制剂的含量均匀性:考察冷冻干燥的pib制剂的含量均匀性。将所述冷冻干燥的粉末溶解于甲醇中。通过hplc方法测量醋酸阿比特龙含量。所测试的每个样品均满足avnmt15标准。
测定在固体和复原的溶液中pib制剂的稳定性:在制备以及于40℃下存储2周之后,立即用50ml净化水复原醋酸阿比特龙复合物pib制剂。在用0.45μm孔径过滤器过滤后,及时测定胶体溶液的活性物含量,从而监测复原的胶体溶液的稳定性。刚好在制备及存储2周后,滤液的醋酸阿比特龙含量非常一致。两种复原都形成了均匀的乳白色胶体溶液,其几乎不含可见的颗粒。
在10分钟内,复原的胶体溶液即可用于给药。复原的溶液在室温下至少4小时内是稳定的。
测定复原的pib制剂的ph:考察了本发明的醋酸阿比特龙复合物的复原的pib制剂的ph。每种复原的溶液的ph均在由旨在用于口服给药的产品的ich指南的推荐的ph范围内(图22)。
测定pib制剂的水含量:使用卡尔费歇尔滴定法测定刚好在制备后的本发明的醋酸阿比特龙复合物的pib制剂的水含量(图23)。
在每种情况下,所述制剂的水含量都符合相关ich指南中具体指定的验收标准。
50mg剂量的复原和给药:使用50ml的ph.eur水对本发明的醋酸阿比特龙复合物的pib制剂进行复原在10min内得到乳白色溶液。该溶液必须口服给药。应该将另外的190mlph.eur水加入瓶中,使得口服给药的体积总计为240ml。
100mg剂量的复原和给药:使用50ml的ph.eur水对本发明的醋酸阿比特龙复合物的pib制剂进行复原得到乳白色溶液。该液体必须口服给药。应该将另外的70mlph.eur水加入瓶中并且口服给药。给药应该使用第二瓶50mg浓度的pib制剂重复。口服给药的体积总计为240ml。
200mg剂量的复原和给药:使用50ml的ph.eur水对本发明的醋酸阿比特龙复合物的pib制剂进行复原得到乳白色溶液。该液体必须口服给药。应该将另外的10mlph.eur水加入瓶中并口服给药。给药应该使用另外的三瓶50mg浓度的pib制剂重复四次。口服给药的体积总计为240ml。
测试本发明醋酸阿比特龙复合物的pib制剂的复原。将不同量的ph.eur水加入到pib制剂中,以对冷冻干燥的粉末进行复原。测量复原的胶体溶液的醋酸阿比特龙含量。然后将瓶通过添加10mlph.eur水冲洗一次。还测量冲洗液体的醋酸阿比特龙含量。最后将瓶用甲醇冲洗以完全溶解剩余的醋酸阿比特龙。在这种情况下还测定醋酸阿比特龙含量(图24)。在复原的体积中醋酸阿比特龙含量大于98%。在一步冲洗步骤后,瓶中剩余有小于0.7%的醋酸阿比特龙。
包含醋酸阿比特龙复合物的肠溶性包衣片剂
将本发明的冷冻干燥的醋酸阿比特龙复合制剂通过击压或辊压进行干燥粒化,以获得具有足够流动性的粉末。颗粒状醋酸阿比特龙复合制剂的粒度为160-320μm。然后将颗粒状醋酸阿比特龙复合制剂与下述物质混合:作为填料的一水合乳糖、微晶纤维素、作为崩解剂的交联羧甲基纤维素纳及作为吸收支持剂的脱氧胆酸钠(图25)。
将含有本发明的颗粒状醋酸阿比特龙复合制剂的粉末混合物压制成50mg剂量浓度的片剂。含有醋酸阿比特龙复合制剂的片剂在模拟肠液中的崩解时间小于5分钟。含有醋酸阿比特龙复合制剂的片剂的内核用基于甲基丙烯酸和丙烯酸乙酯的阴离子型共聚物包衣。
体内药代动力学
动物体内pk测试
对在禁食和进食(高脂肪)状态下的比格犬给予50mgzytiga,在这两种情况下都能快速吸收,然而在禁食状态下的血浆浓度、cmax和aucinf值比在进食(高脂肪)状态下低5倍以上(图26和图27)。在将醋酸阿比特龙复合制剂口服给予禁食和进食(高脂肪)的比格犬后,在0.5小时检测到最大血浆阿比特龙浓度,表明了来自配方物的活性成分的立即吸收。当在禁食或在进食(高脂肪)状态下给予所述化合物时,没有观察到血浆浓度的显著差异(图27)。由曲线计算出的aucinf和cmax值表明,在禁食和进食状态下,本发明的醋酸阿比特龙复合制剂的暴露量明显高于zytiga,同时完全消除zytiga所表现出的积极的食物作用(图28)。
健康男性中的药代动力学
在临床药代动力学研究中招募了十名年龄在45岁至65岁的健康男性志愿者,其中在禁食和进食状态下口服给予200mg阿比特龙复合制剂。在0.5小时检测到最大血浆阿比特龙浓度,表明来自本发明的阿比特龙复合制剂的醋酸阿比特龙的立即吸收。与禁食状态相比,没有观察到在进食状态下血浆浓度的显著增加,实际上,在早期时间点进食状态下的血浆浓度更低,而在4小时时间点后,它们实际上是相同的(图29)。由曲线计算出aucinf和cmax值,和暴露量的可变性,以及由这些药代动力学参数计算出食物作用,并且将其与所公开的1000mgzytiga的临床药代动力学数据进行比较(图30)。对于200mg剂量的本发明的醋酸阿比特龙复合制剂,其在禁食状态下的auc为1000mg剂量的zytiga的80%,因此,使用本发明的促使阿比特龙复合制剂可使剂量显著降低。此外,极大的积极食物作用的消除表明消除针对zytiga必须空腹服用的要求。暴露量的可变性也显著降低。消除半衰期与针对zytiga公布的数据(emeaassessmentreportforzytiga(abiraterone))一致。
- 还没有人留言评论。精彩留言会获得点赞!