脱细胞化组织的制作方法
本发明涉及用于再生医疗的脱细胞化组织。
背景技术:
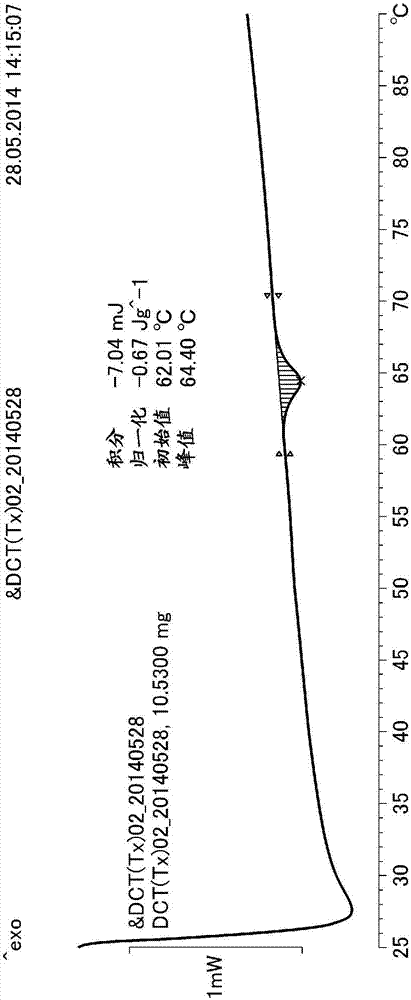
:在移植来自他人、异种动物的生物组织的移植物时,被移植者自身的组织对移植物的排斥反应将成为问题。作为这样的问题的解决方法,对人工组织的开发备受期待。虽已尝试了各种高分子作为原材料,但由于这些原材料与生物组织的相容性低,因此存在移植物与生物组织的接合部位处发生脱落、发生感染症的情况。因此,为了提高与生物组织的相容性,开发了以下技术:从生物组织中去除细胞,使用残留的支持组织即脱细胞化生物组织作为移植物。已知脱细胞化的程度可根据脱细胞化组织中的dna含量进行判断,脱细胞化组织中的dna含量越少则越不易引起排斥反应(例如,参见非专利文献1)。另外,作为将生物组织进行脱细胞化的方法,使用表面活性剂的方法(例如,参见专利文献1、2)、使用酶的方法(例如,参见专利文献3)、使用氧化剂的方法(例如,参见专利文献4)、利用高静水压处理的方法(例如,参见专利文献5~7)、利用冻融处理的方法(例如,参见专利文献8~9)、用高渗电解质溶液进行处理的方法(例如,参见专利文献10)等是已知的。现有技术文献专利文献专利文献1:日本特开昭60-501540号公报专利文献2:日本特表2003-518981号公报专利文献3:日本特表2002-507907号公报专利文献4:日本特表2003-525062号公报专利文献5:日本特开2004-094552号公报专利文献6:国际公开第2008/111530号小册子专利文献7:日本特表2013-502275号公报专利文献8:日本特开2005-185507号公报专利文献9:日本特开2005-211480号公报专利文献10:日本特开2010-221012号公报非专利文献非专利文献1:t.w.gilbert等人,j.ofsurgicalresearch152.1(2009)135-139技术实现要素:发明要解决的课题在再生医疗中使用脱细胞化组织时,除了没有排斥反应的方面,是否能迅速进行组织的再生也成为问题。即使是由来自同一生物体的生物组织获得的、细胞已被去除至相同程度的脱细胞化组织,当脱细胞化的方法、步骤不同时,仍存在宿主细胞对脱细胞化组织的粘附性、对宿主细胞的吸引效果、宿主细胞向脱细胞化组织内的浸润等的速度出现差异的情况,对组织的再生有很大影响。本发明是为了解决上述课题而完成的,其课题在于提供细胞粘附性优异的脱细胞化组织。用于解决课题的手段本申请的发明人为解决上述课题进行了深入研究,结果发现,使用基于差示扫描量热测定而得的吸热量在来自生物体的组织进行脱细胞化之前和之后变化少的脱细胞化组织时,能使得组织快速再生,从而完成了本发明。具体而言,本发明提供下述方案。(1)脱细胞化组织,其是将来自生物体的组织进行脱细胞化而得到的脱细胞化组织,其特征在于,利用差示扫描量热测定而测得的、脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的吸热量之比为0.70以上。(2)如(1)所述的脱细胞化组织,其特征在于,脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的dna量的质量比为0.300以下。发明的效果根据本发明,可提供细胞粘附性优异的脱细胞化组织。可预期该脱细胞化组织的细胞毒性低、具有对细胞的吸引效果、分化诱导效果、组织的再生效果高。附图说明[图1]是表示脱细胞化前的来自生物体的组织的dsc吸热量的图。[图2]是表示实施例1的脱细胞化组织的dsc吸热量的图。[图3]是表示实施例4的脱细胞化组织的dsc吸热量的图。[图4]是表示比较例2的脱细胞化组织的dsc吸热量的图。具体实施方式以下,对本发明的实施方式进行说明,但本发明并不限于以下的实施方式。本发明的脱细胞化组织的特征在于,利用差示扫描量热测定而测得的吸热量与脱细胞化前的组织相比几乎没有变化。以下,本说明书中,将利用差示扫描量热测定而测得的吸热量称为“dsc吸热量”。对于来自生物体的组织、其脱细胞化组织而言,可在55~70℃的区域内观察到吸热。将利用差示扫描量热测定而测得的、脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的吸热量之比称为“脱细胞化吸热量比”。另外,将脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的dna量的质量比称为“脱细胞化dna比”。需要说明的是,由于来自生物体的组织、脱细胞化组织有时因吸收水分或干燥而导致质量发生变化,因此,本发明中,脱细胞化dna比及脱细胞化吸热量比均以来自生物体的组织及其脱细胞化组织的干燥质量作为基准。〔脱细胞化吸热量比〕本发明的脱细胞化组织的脱细胞化吸热量比为0.70以上,当脱细胞化吸热量比低于0.70时,存在向脱细胞化组织中的细胞吸引性、细胞的分化诱导性不充分、导致对利用脱细胞化组织进行的再生治疗造成不良影响的情况。脱细胞化吸热量比优选为0.72以上,更优选为0.74以上,最优选为0.77以上。脱细胞化吸热量比为0.77以上时,尤其容易提高对脱细胞化组织的细胞粘附性,从这方面考虑是优选的。脱细胞化吸热量比的上限值没有特别限定,为1.3以下,优选为1.27以下,更优选为1.25以下,最优选为1.23以下时,向脱细胞化组织中的细胞吸引性、细胞的分化诱导性容易变良好,从这方面考虑是优选的。在计算脱细胞化吸热量比时,可在实施差示扫描量热测定后,对测定用样品的干燥质量进行测定,计算出每单位干燥质量的dsc吸热量,根据脱细胞化组织的每单位干燥质量的dsc吸热量相对于脱细胞化前的组织的每单位干燥质量的dsc吸热量,算出脱细胞化吸热量比。需要说明的是,所谓“将样品干燥”是指使样品干燥至样品中的水分含量成为5质量%以下。作为使样品干燥的手段没有特别限定,可举出实施例中实施的方法等。(每单位干燥质量的dsc吸热量)=(未干燥试样的dsc吸热量)×(干燥后的试样的质量/(干燥前的试样的质量))(脱细胞化吸热量比)=(脱细胞化组织的每单位干燥质量的dsc吸热量)/(脱细胞化前的组织的每单位干燥质量的dsc吸热量)来自生物体的组织的、差示扫描量热测定时的55~70℃区域的吸热可以认为是由组织中的胶原蛋白的热变形导致的。胶原蛋白是细胞外基质的主成分,但来自生物体的组织中的全部胶原蛋白并非均保持于脱细胞化组织中,在脱细胞化过程中,有时部分胶原蛋白会脱离。本发明人原本设想脱细胞化组织对细胞的吸引效果、分化诱导效果会与脱细胞化组织的胶原蛋白的含量相关,却发现并没有必然的相关性,而是存在即使胶原蛋白的含量高,对细胞的吸引效果、分化诱导效果仍然低的脱细胞化组织,在脱细胞化组织的细胞粘附性、对细胞的吸引效果及分化诱导效果与脱细胞化组织的dsc吸热量之间可能存在相关关系。生物组织中的胶原蛋白具有被称为胶原蛋白螺旋的三螺旋结构是已知的。本发明人推测,来自生物体的组织、脱细胞化组织的55~70℃区域的吸热是由呈三螺旋结构的胶原蛋白的氢键的断裂所致,所述氢键为胶原蛋白与胶原蛋白或者胶原蛋白与配位水之间的氢键,脱细胞化组织的dsc吸热量与呈三螺旋结构的胶原蛋白的含量相关,而并非与脱细胞化组织的胶原蛋白的含量相关。进而,本发明人还推测,脱细胞化组织中,与生物组织中的胶原蛋白的结构相同、呈三螺旋结构的胶原蛋白含量越高,则对细胞的吸引效果、分化诱导效果越高。〔脱细胞化dna比〕通常认为脱细胞化组织的dna含量少是优选的,本发明的脱细胞化组织中,脱细胞化dna比优选为0.300以下。脱细胞化dna比大于0.300时,在用于再生医疗时存在发生排斥反应的情况。从对细胞的吸引效果、分化诱导效果的方面考虑,本发明的脱细胞化组织的脱细胞化dna比优选为0.200以下,更优选为0.150以下,最优选为0.080以下,特别优选为0.005以下。脱细胞化dna比为0.080以下时,尤其容易提高对脱细胞化组织的细胞粘附性,从这方面考虑是优选的。脱细胞化dna比的下限越小则越理想,从实现的容易度考虑,优选为0.001以上,更优选为0.002以上。用于求出脱细胞化dna比的dna含量的测定方法没有特别限定,利用已知的方法即可,可利用例如下述方法来测定:用酶等将蛋白质部分分解去除后,使组织与同dna特异性结合的荧光试剂反应,由此测定荧光强度的方法(例如,参见非专利文献1)等。由于脱细胞化dna比是以干燥质量为基准的比值,因此优选在使组织干燥后进行dna含量的测定。(脱细胞化dna比)=(经干燥的脱细胞化组织的dna含量)/(经干燥的脱细胞化前的组织的dna含量)但是,对脱细胞化组织进行干燥后测定dna含量的情况下,有时测定值的误差变大,因此也可另行预先测定干燥前后的组织的质量之比(干燥减重比),以该干燥减重比对以未干燥的状态测得的dna含量进行修正而算出。(干燥减重比)=(干燥后的质量)/(干燥前的质量)(经干燥的组织的dna含量)=(未干燥的组织的dna含量)/(干燥减重比)〔生物组织〕本发明的用于脱细胞化组织的生物组织只要为来自脊椎动物的生物组织即可,没有特别限定,从排斥反应少的方面考虑,优选来自哺乳类或鸟类的生物组织,从容易获得的方面考虑,更优选来自哺乳类家畜、鸟类家禽或人类的生物组织。作为哺乳类的家畜,可举出牛、马、骆驼、美洲驼、驴、牦牛、绵羊、猪、山羊、鹿、羊驼、狗、貉、黄鼠狼、狐狸、猫、兔、仓鼠、豚鼠、大鼠、小鼠、松鼠、浣熊等。另外,作为鸟类的家禽,可举出鹦哥、鹦鹉、鸡、鸭、火鸡、鹅、珍珠鸡、野鸡、鸵鸟、鹌鹑、鸸鹋等。其中,从稳定获得的方面考虑,优选牛、猪、兔、人类的生物组织。作为生物组织的部位,可使用在细胞外具有基质结构的部位,作为这样的部位,可举出例如:肝脏、肾脏、输尿管、膀胱、尿道、舌、扁桃体、食道、胃、小肠、大肠、肛门、胰腺、心脏、血管、脾脏、肺、脑、骨、脊髓、软骨、精巢、子宫、输卵管、卵巢、胎盘、角膜、骨骼肌、肌腱、神经、皮肤等。作为生物组织的部位,从组织再生的效果高的方面考虑,优选软骨、骨、肝脏、肾脏、心脏、心膜、血管、皮肤、小肠粘膜下组织、肺、脑、及脊髓。〔得到本发明的脱细胞化组织的方法〕得到本发明的脱细胞化组织的方法只要为使脱细胞化吸热量比成为0.7~1.3的脱细胞化方法即可,没有特别限定。作为得到本发明的脱细胞化组织的优选方法,可举出例如利用高静水压处理的方法、利用冻融处理的方法等,从容易降低脱细胞化dna比的方面考虑,优选利用高静水压处理的方法。来自生物体的组织的高静水压处理优选在含有表面活性剂的清洗液中进行。该情况下的表面活性剂的含量根据所清洗的来自生物体的组织、表面活性剂的种类的不同而不同,优选为0.01质量%以上且2.00质量%以下,更优选为0.03质量%以上且1.00质量%以下,最优选为0.05质量%以上且0.50质量%以下。需要说明的是,在施加了高静水压的来自生物体的组织的清洗中,若使用核酸分解酶及表面活性剂,则可提高清洗效果。若在使用含有表面活性剂的清洗液后使用核酸分解酶,则可进一步提高清洗效果。在通过利用高静水压处理的方法得到本发明的脱细胞化组织时,在介质中对来自生物体的组织施加50~1500mpa的静水压。施加的静水压低于50mpa时,存在脱细胞化不充分的情况,在高静水压处理后利用含有表面活性剂的清洗液进行清洗的步骤中对组织的损伤变大,高于1500mpa时,需要能耐受施压的压力容器,需要大量的能量,并且,在施压中使用的介质为水性介质时,存在生成冰、并且生成的冰对组织造成损伤的情况。施加的静水压优选为80~1300mpa,更优选为90~1200mpa,最优选为95~1100mpa。作为用于施加静水压的介质,可举出:水、生理盐水、丙二醇或其水溶液、甘油或其水溶液、糖类水溶液等。作为缓冲液,可举出乙酸缓冲液、磷酸缓冲液、柠檬酸缓冲液、硼酸缓冲液、酒石酸缓冲液、tris缓冲液、hepes缓冲液、mes缓冲液等。作为糖类水溶液的糖类,可举出赤藻糖、木糖、阿拉伯糖、阿洛糖、塔罗糖(talose)、葡萄糖、甘露糖、半乳糖、赤藻糖醇、木糖醇、甘露糖醇、山梨糖醇、半乳糖醇、蔗糖、乳糖、麦芽糖、海藻糖、葡聚糖、海藻酸、玻尿酸等。高静水压处理的温度只要为不形成冰、且不会对组织造成热损伤的温度即可,没有特别限定,从顺利地进行脱细胞处理且对组织的影响也小的方面考虑,优选为0~45℃,更优选为4~37℃,最优选为15~35℃。高静水压处理的时间过短时,细胞的破坏进行不充分,时间长时会造成能量浪费,因此,在高静水压处理中,维持目标施加压力的时间优选为5~60分钟,更优选为7~30分钟。对于施加了高静水压的生物组织而言,组织中的细胞被破坏,可利用清洗液将所述细胞去除。清洗液可与高静水压处理的介质相同或不同。清洗液优选含有核酸分解酶、有机溶剂或螯合剂。核酸分解酶和有机溶剂可分别提高从施加了静水压的生物组织中去除核酸成分和脂质的效率,螯合剂可通过使脱细胞化组织中的钙离子、镁离子失活而防止将本发明的粒子化脱细胞化组织应用于疾病部位的情况下的钙化。从脂质的去除效果高的方面考虑,作为有机溶剂,优选水溶性的有机溶剂,优选乙醇、异丙醇、丙酮、二甲基亚砜。作为螯合剂,可举出乙二胺四乙酸(edta)、次氮基三乙酸(nta)、二亚乙基三胺五乙酸(dtpa)、羟乙基乙二胺三乙酸(hedta)、三亚乙基四胺六乙酸(ttha)、1,3-丙二胺四乙酸(pdta)、1,3-二氨基-2-羟基丙烷四乙酸(dpta-oh)、羟乙基亚氨基二乙酸(hida)、二羟乙基甘氨酸(dheg)、乙二醇醚二胺四乙酸(gedta)、二羧甲基谷氨酸(cmga)、3-羟基-2,2’-亚氨基二琥珀酸(hida)、二羧甲基天冬氨酸(asda)等亚氨基羧酸系螯合剂或其盐;柠檬酸、酒石酸、苹果酸、乳酸等羟基羧酸系螯合剂或其盐,作为这些螯合剂的盐,可举出钠盐或钾盐。从提高清洗效率的方面考虑,清洗液可含有表面活性剂。作为表面活性剂,可举出:脂肪酸皂、烷氧基羧酸盐、聚氧乙烯烷氧基羧酸盐、烷基磺酸盐、烷基苯磺酸盐、烷基硫酸酯盐、聚氧乙烯烷基硫酸酯盐、烷基磷酸酯盐、α-磺基脂肪酸酯盐、n-酰基谷氨酸盐、酰基-n-甲基牛磺酸盐、n-烷基肌氨酸盐、胆酸盐、去氧胆酸盐等阴离子性表面活性剂;烷基二甲基胺、烷基二乙醇胺、烷基三甲基铵盐、二烷基二甲基铵盐、烷基吡啶鎓盐、烷基苄基二甲基铵盐等阳离子性表面活性剂;烷基二甲基氧化胺、烷基羧基甜菜碱、烷基酰胺丙基甜菜碱、烷基酰胺丙基磺基甜菜碱、烷基咪唑鎓甜菜碱、3-[(3-胆酰胺丙基)二甲基铵基]-2-羟基-1-丙磺酸内盐(chapso)、3-[(3-胆酰胺丙基)二甲基铵基]-1-丙磺酸内盐(chaps)等两性表面活性剂;甘油脂肪酸酯、山梨糖醇酐脂肪酸酯、蔗糖脂肪酸酯、海藻糖脂肪酸酯、聚乙二醇脂肪酸酯、聚氧乙烯甘油脂肪酸酯、聚氧乙烯山梨糖醇酐脂肪酸酯、聚氧乙烯烷基醚、聚氧乙烯烷基苯基醚、聚氧乙烯聚氧丙烯醚、烷基(聚)甘油醚、脂肪酸烷醇酰胺、聚氧乙烯脂肪酸烷醇酰胺、烷基(聚)糖苷、烷基麦芽糖苷、烷基硫葡糖苷、烷基麦芽吡喃糖苷、烷酰基-n-甲基-d-葡糖胺、n,n-双(3-d-葡糖酰胺丙基)胆酰胺(bigchap)、n,n-双(3-d-葡糖酰胺丙基)去氧胆酰胺(deoxy-bigchap)等非离子性表面活性剂。从细胞的去除的方面考虑,作为表面活性剂,优选烷基磺酸盐、烷基硫酸酯盐、聚氧乙烯烷基硫酸酯盐、α-磺基脂肪酸酯盐、聚氧乙烯烷基醚、聚氧乙烯烷基苯基醚、烷基(聚)糖苷,更优选烷基磺酸盐、聚氧乙烯烷基醚、聚氧乙烯烷基苯基醚、烷基(聚)糖苷。对施加了高静水压的生物组织进行清洗时的温度为对组织不造成热损伤的温度即可,没有特别限定,从清洗性良好且对组织的影响也小的方面考虑,优选为0~45℃,更优选为1~40℃,最优选为2~35℃。进行清洗时,根据需要,可振荡或搅拌清洗液。通过利用冻融处理的方法得到本发明的脱细胞化组织的情况下,重复实施以下步骤1次或2次以上、优选为2~5次:将来自生物体的组织于-80~-20℃(优选-80~-40℃)的温度保持1~48小时(优选10~30小时)而将其冷冻后,于20~37℃的温度进行融解。对于经过冻融处理的生物组织而言,组织中的细胞被破坏,可利用清洗液去除所述细胞。清洗的方法可以与高静水压处理时的清洗方法相同。对脱细胞化dna比及脱细胞化吸热量比的测定作为筛选在宿主细胞的吸引、粘附、浸润等方面优异的脱细胞化组织的方法而言是优异的,因此,在制备脱细胞化组织时,通过组入以下步骤,能够制造良好的脱细胞化组织,所述步骤为:确认脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的dna量的质量比为0.3以下的步骤(即,确认脱细胞化dna比为0.3以下的步骤);和确认利用差示扫描量热测定而测得的、脱细胞化组织相对于脱细胞化前的来自生物体的组织的每单位干燥质量的吸热量之比为0.7~1.3的步骤(即,确认脱细胞化吸热量比为0.7~1.3的步骤)。确认脱细胞化dna比为0.3以下的步骤及确认脱细胞化吸热量比为0.7~1.3的步骤优选在清洗脱细胞化组织的步骤之后,存在对脱细胞化组织进行杀菌或灭菌的步骤时,优选在清洗脱细胞化组织的步骤之后且在进行杀菌或灭菌的步骤之前。本发明的脱细胞化组织可单独使用,也可以与具有疾病部位的再生·治愈效果的其他成分同时使用。作为这样的其他成分,可举出生长因子、蛋白多糖或糖胺多糖、细胞、β-1,3-葡聚糖、甲羟戊酸等。作为生长因子,可举出胰岛素样生长因子(igf)、碱性成纤维细胞生长因子(bfgf)、酸性成纤维细胞生长因子(afgf)、转化生长因子-α(tgf-α)、转化生长因子-β(tgf-β)、骨形态发生蛋白(bmp)、血小板衍生生长因子(pdgf)、角质细胞生长因子(kgf)、表皮细胞生长因子(egf)、血管内皮细胞生长因子(vegf)、促红细胞生成因子(epo)、粒细胞巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)、神经细胞生长因子(ngf)、肝素结合生长因子(egf)等。作为蛋白多糖或糖胺多糖,可举出硫酸软骨素、硫酸乙酰肝素、硫酸角质素、硫酸皮肤素、玻尿酸、肝素等。本发明的脱细胞化组织可直接用于移植,也可在接种细胞进行培养后使用。另外,本发明的脱细胞化组织可进行切割、切片(slice)、粉碎加工成片状、粒状、微粉状、凝胶状等而使用,脱细胞化组织为片状时,可将脱细胞化组织彼此或与其他的片状物组合形成多层而使用,也可加工为管状。根据本发明,可提供细胞吸引效果优异的脱细胞化组织。对于脱细胞化组织的细胞吸引效果而言,可利用实施例中记载的方法而对脱细胞化组织实施细胞粘附性试验,由此进行评价。实施例以下,通过实施例进一步说明本发明,但本发明不限于这些实施例。需要说明的是,只要没有特别限定,则实施例中的“份”、“%”均以质量为基准。〔实施例1〕向聚乙烯制附带夹链的袋中装入切开猪大动脉采集的片状的内膜(以下,将该片状的内膜称为“内膜片”)、和作为高静水压处理的介质的生理盐水,使用研发用高压处理装置(神户制钢制,商品名:dr.chef),施加100mpa的静水压15分钟。将经高静水压处理的内膜片在含有20ppmdnase作为核酸分解酶的生理盐水中于4℃振荡96小时,由此进行清洗,进而,在80%乙醇中于4℃振荡72小时,然后在生理盐水中于4℃振荡2小时,得到实施例1的脱细胞化组织。〔实施例2〕将实施例1中在含有20ppmdnase的生理盐水中的振荡时间由96小时变更为8小时,除此以外,进行与实施例1同样的操作,得到实施例2的脱细胞化组织。〔实施例3〕用干冰将内膜片冷冻,在加入了干冰的保冷箱中(约-78℃)保存20小时,然后于25℃使其融解。将重复进行三次该冻融后的内膜片在含有20ppmdnase作为核酸分解酶的生理盐水中于4℃振荡96小时,由此进行酶处理,进而,在80%乙醇中于4℃振荡72小时,然后在生理盐水中于4℃振荡2小时,得到实施例3的脱细胞化组织。〔实施例4〕将内膜片在含有0.1质量%十二烷基磺酸钠(以下为sds)的生理盐水中于25℃振荡96小时,由此进行脱细胞。将经sds处理的内膜片在含有20ppmdnase作为核酸分解酶的生理盐水中于4℃振荡96小时,由此进行酶处理,进而,在80%乙醇中于4℃振荡72小时,然后在生理盐水中于4℃振荡2小时,得到实施例4的脱细胞化组织。〔实施例5〕利用与实施例1同样的方法,对内膜片施加1000mpa的静水压15分钟。将经高静水压处理的内膜片在含有0.1质量%十二烷基磺酸钠(以下为sds)的生理盐水中于25℃振荡8小时,接着,在含有20ppmdnase作为核酸分解酶的生理盐水中于25℃振荡24小时,由此进行清洗。进而,在80%乙醇中于4℃振荡72小时,然后在生理盐水中于4℃振荡2小时,得到实施例5的脱细胞化组织。〔实施例6〕将实施例5中高静水压处理的静水压由1000mpa变更为400mpa,除此以外,进行与实施例5同样的操作,得到实施例6的脱细胞化组织。〔实施例7〕将实施例5中高静水压处理的静水压由1000mpa变更为600mpa,除此以外,进行与实施例5同样的操作,得到实施例7的脱细胞化组织。〔实施例8〕将实施例1中高静水压处理的静水压由100mpa变更为600mpa,除此以外,进行与实施例1同样的操作,得到实施例8的脱细胞化组织。〔比较例1〕将实施例4中sds的浓度由0.1质量%变更为1质量%,除此以外,进行与实施例4同样的操作,得到比较例1的脱细胞化组织。〔比较例2〕将实施例4中含有0.1质量%的sds的生理盐水变更为含有1质量%的tritonx-100(聚氧乙烯辛基苯基醚:以下为tx)的生理盐水,除此以外,与实施例4进行同样的操作,得到比较例2的脱细胞化组织。〔比较例3〕将比较例2中tx的浓度由1质量%变更为0.1质量%,除此以外,进行与比较例3同样的操作,得到比较例3的脱细胞化组织。〔比较例4〕在生理盐水中对内膜片进行超声波处理(强度:10w/cm2,频率:10khz,作用时间:2分钟)。针对经超声波处理的内膜片,进行与比较例2同样的操作,得到比较例4的脱细胞化组织。〔比较例5〕将比较例4中tx的浓度由1质量%变更为0.1质量%,除此以外,进行与比较例5同样的操作,得到比较例5的脱细胞化组织。〔比较例6〕向磷酸缓冲液中添加chaps、氯化钠及edta,使它们分别成为8mmol/l、1mol/l、25mmol/l,将由此得到的溶液作为脱细胞液。将内膜片在该脱细胞液中于25℃振荡96小时,由此进行脱细胞,在含有20ppmdnase作为核酸分解酶的生理盐水中于25℃振荡24小时,由此进行酶处理,进而,在80%乙醇中于4℃振荡72小时,然后在生理盐水中于4℃振荡2小时,得到比较例6的脱细胞化组织。〔脱细胞化dna比的计算〕测定各脱细胞化组织的质量,将其制成试验片,浸渍于蛋白质分解酶溶液中并使其溶解,然后用苯酚/氯仿进行处理而去除蛋白质,利用乙醇沉淀法回收dna。利用picogreen(lifetechnologies公司)对回收的dna进行荧光染色,并测定荧光强度,由此对dna进行定量,根据试验片的质量与dna的量计算出试验片的dna含量。需要说明的是,在dna的定量中,使用利用picogreen中附带的标准dna制成的标准曲线。使用另一试验片,根据试验片的质量与经干燥的试验片(在60℃的恒温槽中保持12小时后试验片)的质量,求出干燥减重比,根据试验片的dna含量与干燥减重比,算出试验片的每单位干燥质量的dna含量。(试验片的dna含量)=(dna的量)/(试验片的质量)(干燥减重比)=(经干燥的试验片的质量)/(试验片的质量)(干燥试验片的dna含量)=(试验片的dna含量)/(干燥减重比)根据内膜片的干燥试验片的dna含量与脱细胞化组织的干燥试验片的dna含量之比,计算出脱细胞化dna比。结果示于表1。(脱细胞化dna比)=(脱细胞化组织的干燥试验片的dna含量)/(内膜片的干燥试验片的dna含量)〔脱细胞化吸热量比的计算方法〕将切割成3mm×3mm的试验片放入已测定质量的铝制试样盘中,使用差示扫描量热测定仪(mettlertoredo公司制,型式dsc1),在测定起始温度为25℃、升温速度为3℃/分钟、测定结束温度为90℃的条件下测定差示扫描热量。由于可在55~68℃的区域内观察到被认为是源于胶原蛋白的吸热,因此将该吸热量作为试验片的吸热量。脱细胞化前的来自生物体的组织、实施例1及4的脱细胞化组织、比较例2的脱细胞化组织的吸热量分别示于图1~4。将测定吸热量后的试样盘打孔,于60℃的恒温槽中保存12小时使其干燥,然后测定装有经干燥的试验片的试样盘的质量,利用下式计算出试验片的每单位干燥质量的吸热量。(试验片的每单位干燥质量的吸热量)=(吸热量)/{(装有经干燥的试验片的试样盘的质量)-(试样盘的质量)}根据内膜片的每单位干燥质量的吸热量和脱细胞化组织的每单位干燥质量的吸热量,利用下式算出脱细胞化吸热量比。结果示于表1。(脱细胞化吸热量比)=(脱细胞化组织的每单位干燥质量的吸热量)/(内膜片的每单位干燥质量的吸热量)〔细胞粘附性试验〕使用直径6mm的活检环钻,对实施例1~7或比较例1~6的脱细胞化组织以圆盘状进行钻取,将得到的组织作为试验片。以圆盘状试验片的内膜侧朝上的方式设置于96孔培养板(96wellplatedish)中,在含有10%的胎牛血清(fbs)的mem培养基中于37℃预培养12小时。去除mem培养基后,接种人皮肤成纤维细胞(nhdf)(2.7×103个细胞/孔),于37℃培养3小时。使用磷酸缓冲生理盐水,从试验片将未附着的细胞清洗除去,然后用wst-8(同人化学研究所制)将试验片染色,测定450nm处的吸光度。另外,预先制作吸光度与nhdf的数量在利用wst-8染色的情况下的标准曲线,根据试验片的吸光度和标准曲线而算出附着于试验片的nhdf数量。结果示于表1中。[表1]脱细胞化dna比脱细胞化吸热量比粘附细胞数实施例10.00430.982300实施例20.0871.022100实施例30.0710.771700实施例40.460.761100实施例50.00411.212400实施例60.00441.012300实施例70.00431.172300实施例80.00000.972500比较例10.120.0500比较例20.300.68750比较例30.380.61910比较例40.0140.65790比较例50.0210.66820比较例60.00610.63890由表1的结果可得到如下启示:实施例的脱细胞化组织均较之比较例的脱细胞化组织而言细胞粘附数量更多、对细胞的吸引效果更优异、组织的再生效果更高。〔实施例9~12、比较例7~10〕关于除实施例1~8、比较例1~6中使用的猪大动脉内膜片以外的生物组织,将本发明的脱细胞化组织的制造例示于实施例9~12。另外,将比较制造例示于比较例7~10。实施例的脱细胞化组织均较之比较例的脱细胞化组织而言细胞粘附数量更多、对细胞的吸引效果更优异。〔实施例9〕使用猪大动脉本身代替实施例8中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与实施例8同样的操作,得到实施例9的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔实施例10〕使用猪皮肤(包含真皮)来代替实施例8中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与实施例8同样的操作,得到实施例10的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔实施例11〕使用猪的心膜来代替实施例8中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与实施例8同样的操作,得到实施例11的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔实施例12〕使用切开牛大动脉采集的片状的内膜来代替实施例8中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与实施例8同样的操作,得到实施例12的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔比较例7〕使用猪大动脉本身来代替比较例1中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与比较例1同样的操作,得到比较例7的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔比较例8〕使用猪皮肤(包含真皮)来代替比较例1中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与比较例1同样的操作,得到比较例8的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔比较例9〕使用猪的心膜来代替比较例1中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与比较例1同样的操作,得到比较例9的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。〔比较例10〕使用切开牛大动脉采集的片状的内膜来代替比较例1中切开猪大动脉采集的片状的内膜(内膜片),除此以外,进行与比较例1同样的操作,得到比较例10的脱细胞化组织。按照上述方法算出得到的脱细胞化组织的脱细胞化dna比和脱细胞化吸热量比。结果示于表2。[表2]脱细胞化dna比脱细胞化吸热量比实施例90.00000.87实施例100.000671.35实施例110.00210.98实施例120.00000.75比较例71.590.02比较例81.140.003比较例91.030.03比较例100.710.62当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1