新型治疗方法与流程
本发明涉及一种治疗形成抗药物抗体的哺乳动物受试者的方法,特别是治疗形成针对因子viii(fviii)的抗体的哺乳动物受试者。具体地,本发明涉及用ido诱导剂(例如zebularine)离体处理的自体抗原递呈细胞(特别是树突细胞)在药物抗原(如fviii)的存在下用于该目的的用途。
背景技术:
抗药物抗体
血友病a(ha)是由编码fviii的f8基因中的多种突变引起的x染色体连锁的出血性疾患,所述编码fviii的f8基因中的多种突变干扰表达或翻译的蛋白质的促凝血功能。fviii主要在肝脏和内皮血管床中表达。血友病a患者缺乏足够的促凝血活性,易发生出血事件及其后遗症,包括增加的发病率和死亡率。fviii数据库目前基于5,472个个案报告鉴别了2,015种独特的fviii变体。该大量的点突变(66.5%)、缺失(23.2%)以及其它(复制、多态性、插入、插入缺失和复合体)导致了各种临床结果。可以用血浆来源的或重组的fviii急性(按需)或预防性治疗患者。
大量患者形成称为“抑制剂”的中和抗体,其阻断施用的fviii的活性,因为这些患者的免疫系统尚未完全耐受正常fviii的某些序列。抑制剂形成是目前在血友病患者中看到的最显著的治疗并发症。
目前,一旦形成抑制剂,唯一经证实的根除方法是通过常规fviii输注的免疫耐受诱导(iti),但该治疗策略在10-20%的患者中失败。
抗药物抗体的问题不仅限于fviii缺陷的血友病患者。抗药物抗体可以在用其它药物治疗的受试者中形成。
人们相信针对fviii的免疫应答的第一步是由抗原递呈细胞(apc)识别fviii。在通过apc的fviii内吞后,fviii被加工成小肽,然后加载到细胞表面的mhcii类分子上以呈递至fviii特异性cd4+t细胞。这些t细胞的激活需要由apc提供的另外的信号。这些信号是在如apc细胞膜上的cd40、cd80、cd83和cd86与t细胞上的cd28、cd154和ctla-4分子之间的膜相关的相互作用。与这些相互作用组合,apc通过细胞因子如il-12或il-10向t细胞信号传递。信号的组合决定激活的t细胞的分化方向。t辅助细胞1(th1)细胞通常诱导细胞毒性免疫应答,th2,b细胞介导的抗体应答以及调节性t细胞能够通过抑制b细胞和t细胞应答来诱导免疫抑制/耐受。最终,这些fviii特异性t细胞能够激活fviii特异性b细胞,并诱导亲和力成熟和b细胞中免疫球蛋白基因的分类转换。结果,产生分泌抗fviii抗体的浆细胞和循环的fviii特异性记忆b细胞,其能够在再次暴露于fviii时产生抗体。
抗原递呈细胞
抗原递呈细胞(apc)是在其表面上显示与主要组织相容性复合物(mhc)复合的外源抗原的细胞;它们加工抗原并将其递呈给t细胞。apc分为两类:专门和非专门,专门apc是表达mhcii类分子的apc。专门apc有四种主要类型:树突细胞、巨噬细胞、某些b细胞和某些激活的上皮细胞。apc与t细胞的相互作用发生在淋巴结中,apc通过趋化作用被引导到淋巴结。树突细胞可以从许多来源分离和成熟,如骨髓(特别是造血骨髓祖细胞)和血液(特别是外周血单核细胞,其中一些不成熟并且表达cd34)。根据情况(例如,共刺激物如cd80/86、cd40或ido1、pd-l1或具有抑制活性的pd-l2的表达水平),树突细胞和t细胞在淋巴结中的相互作用可导致免疫或耐受应答。因此,关键的相互作用涉及表达ido1并产生免疫抑制性细胞因子(例如il-10和tgf-β)的dc,其诱导t细胞采用调节性表型。而调节性t细胞不仅在其微环境中抑制效应t细胞或原始
ido
ido1,吲哚胺2,3-双加氧酶1是含有血红素的酶,其催化色氨酸降解中的初始、速率限制的步骤,已知该步骤在诱导实验动物和人的免疫耐受中具有重要作用。ido1的关键作用已被明确鉴别,例如在哺乳动物怀孕期间,ido1水平升高,并且以这种方式,其对诱导针对胎儿的免疫耐受是至关重要的,已经表明小鼠中ido1的实验性抑制导致与其母亲表达不同mhc分子的胎儿的排斥。
当由dc或其它抗原递呈细胞细胞内表达时,ido1作为天然免疫调节剂通过抑制t细胞应答发挥作用,导致免疫耐受。
zebularine
zebularine是含有2-(1h)-嘧啶酮环的胞苷类似物,其是dna甲基化的有效抑制剂。zebularine非常稳定,在37℃、ph1.0的pbs中的半衰期约为44小时,在ph7.0的pbs中的半衰期约为508小时,可以口服给药。事实上,已经显示口服给药的zebularine引起裸鼠中生长的人膀胱肿瘤细胞中沉默和高甲基化的p16基因的去甲基化和再激活。zebularine在体外和体内在使用浓度下也似乎是最低限度的细胞毒性,尽管在高浓度下是有毒的。已知zebularine诱导ido,已经指出zebularine上调ido的机制是通过ido1基因的表观遗传上调。
wo2008/147283公开了zebularine用于制备用于治疗自体免疫性疾患或疾病或移植物或基因治疗性修饰细胞的免疫排斥的药物中的用途,其中治疗诱导ido。
wo2012/087234公开了包含至少两种化合物的组合物,每种化合物诱导吲哚胺2,3-双加氧酶(ido),用于治疗自体免疫性疾患或疾病或治疗遭受器官、组织、正常细胞或基因治疗性修饰细胞的免疫排斥,其中所述ido诱导剂具有不同的作用机制并且对ido水平产生协同作用。还公开了一种在细胞培养物中诱导ido的方法,包括以下步骤:(a)在合适的培养基中提供分离的细胞,(b)加入这样的组合物,(c)与组合物一起孵育所述分离的细胞,和(d)获得其中ido被诱导的细胞培养物。还公开了一种治疗患有自体免疫性疾患或疾病或遭受器官、组织、正常细胞或基因治疗性修饰细胞的免疫排斥的哺乳动物的方法,其中治疗诱导ido,所述方法包括首先,在与所治疗的病症相关的一种或多种抗原的存在下,用治疗有效量的该组合物离体处理源自治疗的哺乳动物或源自另一种哺乳动物的细胞,然后将经处理的细胞转移至所治疗的哺乳动物。
dhodapkar(2001)是未成熟dc注射后人中效应t细胞功能的抗原特异性抑制的报告。
giannoukakis(2011)是1型糖尿病患者中自体致耐受性dc的i期(安全性)研究报告。
nittby(2013)是在streptoxotocin治疗的糖尿病大鼠中zebularine诱导胰岛同种异体移植物长期存活的报告。
上述现有技术文献都不涉及治疗形成抗药物抗体的受试者。
本发明解决了治疗对上述传统iti方法不反应的受试者的方法的需要。
技术实现要素:
本发明提供了一种治疗哺乳动物的方法,所述哺乳动物遭受对药物治疗的免疫应答或易于对药物治疗发生免疫应答,包括抗药物抗体的增加,所述方法包括(a)在所述药物或其含有表位的片段存在下,用在所述apc中诱导ido的试剂离体处理从哺乳动物获得的抗原递呈细胞(apc),和(b)在所述apc中诱导ido后,将所述细胞转移回哺乳动物,由此建立对药物的免疫耐受。
本发明还提供了一种通过以下方法在细胞培养物中诱导ido的方法,包括:在药物或其含有表位的片段存在下,用在所述apc中诱导ido的试剂离体处理从哺乳动物获得的apc,以及通过所述方法获得的其中ido已被诱导的apc。
本发明还提供如上所述的apc,用于治疗哺乳动物的方法中,所述哺乳动物遭受对药物治疗的免疫应答或易于对药物治疗发生免疫应答,包括抗药物抗体的增加,由此根据所述方法,所述细胞被转移回所述哺乳动物,从而建立对药物的免疫耐受。
不受理论的限制,根据本发明的方法,用已经用zebularine(或其它ido诱导剂)处理的自体apc治疗已经形成抗药物抗体的受试者,其将apc的表型偏向为耐受性。这些致耐受性的apc被相应的药物抗原离体引发并转移回受试者。该apc迁移到淋巴结和脾脏,在那里它们对其它免疫细胞发挥致耐受作用(包括产生调节性t细胞和b细胞),通过调节性t细胞启动致耐受性环路,使原始dc偏向致耐受性分化,导致建立对药物的耐受。
附图说明
图1显示了在各种条件下培养的bmdc在体外对抗原卵白蛋白的淋巴细胞增殖反应的抑制作用(参见实施例1)
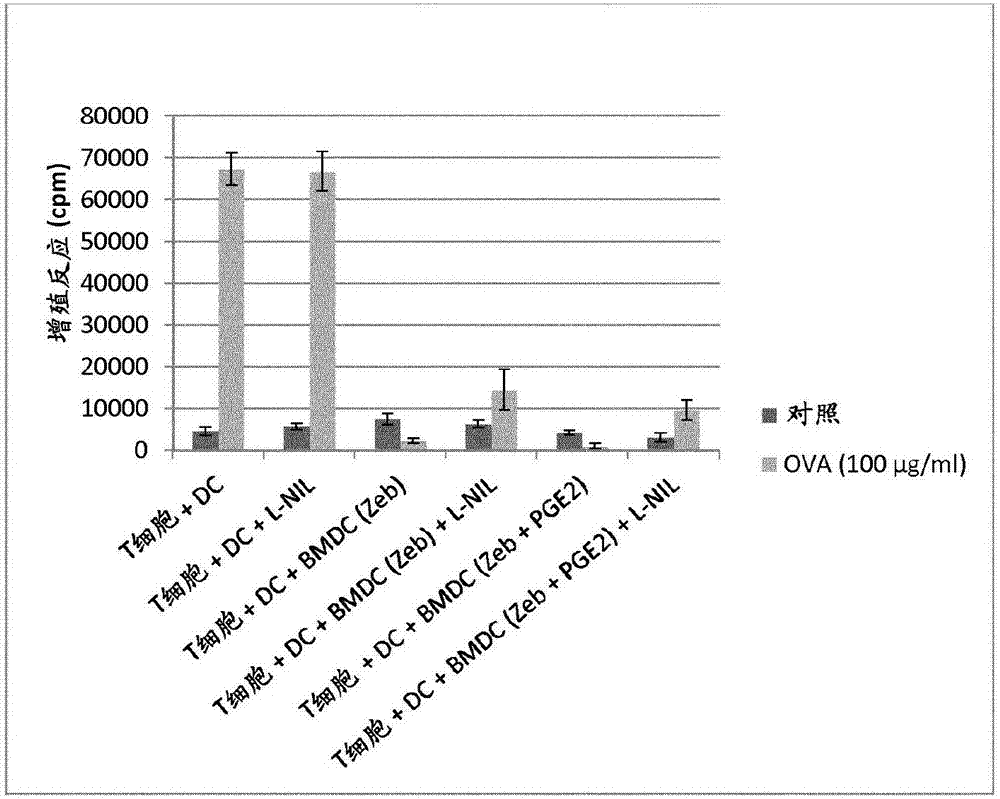
图2显示了在各种条件下培养的bmdc在体外对抗原卵白蛋白的t细胞增殖反应的抑制作用(参见实施例2)
图3显示了在s.c接种后与zebularine和pge2培养的bmdc的迁移。(参见实施例3)。
图4显示了用在各种条件下培养的bmdc处理的免疫大鼠的淋巴结细胞在体外再刺激的增殖反应(参见实施例4)。
图5显示了用zebularine处理bmdc增加其对体外fviii再刺激而由fviii引发的cd4+t细胞的增殖反应的抑制作用(参见实施例5)。
图6显示了氮胞苷对thp-1细胞中ido1基因表达(mrna水平)的作用(参见实施例8)。
图7显示了脱氧氮胞苷对thp-1细胞中ido1基因表达(mrna水平)的作用(参见实施例9)。
本发明的详细说明
定义
本文所用的术语“吲哚胺双加氧酶”或“ido”是指ido1(吲哚胺2,3-双加氧酶,ec1.13.11.52)或ido2(吲哚胺-吡咯-2,3-双加氧酶样1,ec1.13.11.-),其是可以分解代谢色氨酸的两种不同的蛋白质,可以由apc表达。
“zebularine”是指2'-o-叔丁基二甲基硅烷基-3'-o-[(二异丙基氨基)(2-氰基乙氧基)膦基]-5'-o-(4,4'-二甲氧基三苯甲基)-2(1h)-嘧啶酮-1-β-d-核糖苷,也称为1-(β-d-呋喃核糖基)-1,2-二氢嘧啶-2-酮或2-嘧啶酮-1-β-d-核糖苷。
类似物是化学结构与母体化合物不同的分子,例如同源物(不同之处在于化学结构中的增量,如烷基链的长度差)、分子片段、一个或多个官能团不同的结构、离子化的改变。通常使用定量结构活性关系(qsar)、使用如remington(thescienceandpracticeofpharmacology,第19版(1995),第28章)中公开的那些技术发现结构类似物。
在使用ido诱导剂的组合后增加ido水平的上下文中术语“协同作用”旨在表示ido水平的增加高于(优选显着高于)单独使用时每个ido诱导剂所达到的ido水平的总和,所述总和通常被称为“相加作用”。
哺乳动物
可以通过根据本发明的方法治疗的哺乳动物包括人、家养动物(domesticanimal)和畜牧动物(livestockanimal),特别是人。家养动物的例子包括猫和狗。畜牧动物的例子包括马、牛、羊、山羊。
apc
适用于本发明方法的apc是表达ido、特别是ido1的apc。适当地,apc能够诱导致耐受的环路,例如通过产生抗原特异性调节性t细胞或b细胞。
最适当地,apc是树突细胞(dc),例如骨髓来源的树突细胞(bmdc)、由cd34+造血祖细胞(特别是外周血中存在的)产生的dc或源自外周血单核细胞(pbmc)的dc。能够增殖的dc是优选的。似乎可能通过适当的处理来诱导源自外周血单核细胞(pbmc)的dc增殖(参见例如langstein,1999)。
在本发明的另一方面,apc是与dc共培养的间充质干细胞。
ido诱导剂
在根据本发明的方法中诱导ido的试剂包括zebularine或其类似物或盐。可用作根据本发明的ido诱导剂的zebularine类似物的实例包括2'-deoxyzebularine、5-氟-zebularine、5-氟-2'-dexyzebularine、5-氯-zebularine、5-氯-2'-dexyzebularine、5-溴-zebularine、5-溴-2'-dexyzebularine、5-碘-zebularine、5-碘-2'-dexyzebularine、5-甲基嘧啶-2-酮、5-me-2'-deoxyzebineine或其单、二或三磷酸酯。盐的实例包括可以由zebularine与强的有机或无机酸形成的盐如hbr和hcl盐。
诱导ido的其它试剂包括其它胞苷类似物(例如5-甲基胞苷、氮胞苷或脱氧氮胞苷)、组蛋白脱乙酰酶抑制剂(例如丙戊酸或其盐如丙戊酸钠、曲古抑菌素a或伏立诺他(vorinostate(saha)))、维生素d3类似物(例如骨化三醇)、干扰素γ类似物、其它干扰素(例如干扰素α、干扰素b1或干扰素-tau)、toll样受体配体(例如含有cpg的dna寡核苷酸或脂多糖)、促性腺激素受体信号传导激素(例如重组人促性腺激素(rhcg)或催乳素)、前列腺素e2类似物、ido稳定剂(例如tgf-b或il-10)、可溶性ctla4缀合物(例如ctla4-ig,如阿巴西普(abatacept))和糖皮质激素(例如地塞米松)。因此,诱导ido的试剂可以例如选自氮胞苷和脱氧氮胞苷。
在本发明的另一方面,可以使用两种(或多种)均诱导ido的试剂。在一个具体实施方案中,两种ido诱导剂之一是zebularine或其类似物或盐。适宜地,所述两种(或多种诱导剂)产生协同作用,例如,这两种(或更多种)ido诱导剂具有不同的作用机制。所述ido诱导剂选自zebularine或其类似物或盐、其它胞苷类似物(例如5-甲基胞苷、氮胞苷或脱氧氮胞苷)、组蛋白脱乙酰酶抑制剂(例如丙戊酸或其盐如丙戊酸钠、曲古抑菌素a或伏立诺他(saha))、维生素d3类似物(例如骨化三醇)、干扰素γ类似物、其它干扰素(例如干扰素α、干扰素b1或干扰素-tau)、toll样受体配体(例如含cpg的dna寡核苷酸或脂多糖)、促性腺激素受体信号传导激素(例如重组人促性腺激素(rhcg)或催乳素))、前列腺素e2类似物、ido稳定剂(例如tgf-b或il-10)、可溶性ctla4缀合物(如ctla4-ig,如阿巴西普)和糖皮质激素(例如地塞米松)。可以提及的特定组合包括(i)zebularine和ifn-γ,(ii)ifn-γ和丙戊酸,(iii)zebularine、ifn-γ和丙戊酸,(iv)人绒毛膜促性腺激素(hcg)和zebularine,(v)hcg和ifn-γ,(vi)zebularine和ifn-a,(vii)zebularine、ifn-γ和ifn-a,(viii)zebularine、ifn-γ和tgf-β,和(ix)zebularine、ifn–γ、ifn-a和tgf-β。诱导ido的两种或更多种试剂可以以适合于最佳效果的同时、依次或分开地(以适当的时间分开)施用于细胞。
从哺乳动物获得apc
根据本发明,首先从哺乳动物获得如dc的apc。一种合适的方法是通过血浆分离置换法收集未成熟的pbmc(任选地在用标准剂量的重组g-csf动员未成熟细胞后)。另一种合适的方法是在裂解红细胞后使用nycodenz离心分离低密度单核细胞。为了获得增殖的dc群,可以使用连接抗cd34mab的磁珠(dynalbiotech,oslo,norway)从pbmc中纯化未成熟的cd34+细胞。cd34+细胞纯度可以通过流式细胞术确认。通常通过用gm-csf和il-4处理使纯化的cd34+细胞分化成dc。因此,通常它们在组织培养瓶(nunc,roskilde,denmark)中以1×105个细胞/ml培养于cellgro无血清培养基或含有10%自体血浆、2mml-谷氨酰胺(jhr)、20-100ng/mlgm-csf200-1000u/m、il-4(r&dsystems,minneapolis,mn,usa)的rpmi培养基中,任选与5-20ng/mlil10和50ng/mlflt-3l(r&dsystems)一起。也可以用胎牛血清或人血清ab培养细胞。培养物可以在37℃在加湿的5%co2气氛中保持14天。随着细胞扩增,补充细胞培养基和细胞因子(例如大约每4天)。
在某些情况下,有可能从受试者的骨中分离bmdc。可以如以上对cd34+细胞进行的,诱导dc细胞分化以及细胞扩增。
离体暴露于ido诱导剂和抗原
在第12-14天,未成熟的dc可以暴露于ido诱导剂或其组合(如zebularine)和对应于药物的抗原制剂。可以选择ido诱导剂(或组合)的浓度和暴露长度用于最佳化ido诱导。示例性的浓度为1μm-1mm,例如,50-100μm。
ido诱导剂或其组合(如zebularine)和抗原制剂可以一起或分开加入到dc中。
为了在将细胞施用于患者后实现dc到淋巴结的恰当迁移,通常用前列腺素e2(浓度为1-10μm)处理细胞约24小时以诱导所需的趋化受体。
在第15-17天,可以收获dc、悬浮在培养基中并冷冻保存在液氮中直至释放使用。
通常,在使用前进行质量控制步骤。质量控制应包括测试生存能力、不育和内毒素以及ido1的表达。此外,考虑pd-l1、pd-l2、趋化受体ccr7的表达,共刺激因子cd80/cd86、cd40和mhc-ii的表达水平。这些物质的表达水平是dc是致耐受性的指标。
将细胞施用到受试者
可以通过各种途径将细胞施用到哺乳动物,例如静脉内、皮下或皮内。合适地含有细胞的培养基含有人白蛋白作为细胞保护蛋白。通常,以每周至每两周的间隔施用1-10个剂量的3-10×106个细胞/剂量的量。可以延长治疗直到获得所需的耐受。
抗原
对应于药物的抗原制剂可以含有全部或部分药物,所述部分包含其含有表位的片段。通常,使用纯化的抗原。适当地,对应于药物的抗原制剂尽可能接近地类似于施用到受试者的药物。在fviii的情况下,可以使用适合于此目的的各种重组药物,包括商业产品refactoaf、novoseven、helixatenexgen、kogenatebayer、advate、novoeight、nuwiq、beriate、beriatep、feiba、haemoctin、hemofil、monoclate–p、octanate[lv]、optivate和recombinate。
本发明的免疫应答和方法的使用
通常,本发明的方法适用于治疗形成免疫应答的哺乳动物受试者,所述免疫应答包括针对能够产生所述应答的任何药物的抗药物抗体的生成,例如任何生物药物例如,蛋白药物。
示例的蛋白药物包括血液因子(包括fviii或因子ix)、激素(包括胰岛素和epo)、生长因子(包括egf、igf、kgf、hgf和fgf)、细胞因子(例如白介素)、酶等。其它实例包括gcsf和类似物例如非格司亭(filgrastim)和其聚乙二醇化形式(如聚二乙醇非格司亭)和干扰素(例如干扰素β-1a)。在本发明的一个优选方面,药物是fviii。在本发明的另一方面,药物是因子ix。
生物药物可含有多糖成分
进一步示例的生物药物包括工程化的蛋白(如融合和嵌合蛋白)和重组蛋白。在一些实施方案中,药物可以是抗体。例如药物可以是单克隆抗体,如人源化或完全的人单克隆抗体。药物也可以是包含免疫球蛋白片段的蛋白构建体。术语抗体包括抗体-药物缀合物和抗体-纳米颗粒缀合物以及聚乙二醇化的类似物。在一些实施方案中,抗体可以是结构域抗体,包括单个轻链抗体或vhh。药物可以由完整的轻链免疫球蛋白或其片段组成,其包含至少一个可变结构域和至少部分轻链恒定区或scfv。药物可以不含重链免疫球蛋白。抗体包括抗tnf-α单克隆抗体,例如remicadetm(英夫利昔单抗)、enbreltm(依那西普)、humiratm(阿达木单抗)、
本发明的方法适用于治疗形成对药物免疫应答的哺乳动物受试者,所述免疫应答包括在许多药物治疗情况下抗药物抗体的产生,如出血性疾病(分别缺乏fviii和因子ix的血友病a和b)、生长因子缺乏(缺乏egf、igf、kgf、hgf、fgf等)、激素缺乏(缺乏胰岛素、epo)、酶替代疗法和炎性和自体免疫性疾病(抗tnf-α单克隆抗体抗体)。
2013年pharma报告“biologics”-http://www.phrma.org/sites/default/files/pdf/biologics2013.pdf中公开了临床开发中的和批准的生物蛋白疗法的广泛列表产品,其中详细介绍了907种针对超过100种疾病的生物制剂。该文件通过引用整体并入。认为本发明可以用于针对在治疗的受试者中形成免疫应答的这些以及其它生物疗法。
优点
在至少一些实施方案中,预期本发明提供一个或多个以下优点:
·成功建立对药物的免疫耐受,或降低对药物的免疫不耐受,例如如所测量的降低的血液中抗药物抗体水平;
·适合于个体受试者的针对药物的定制反应。例如,每个血友病a患者将基于他们自己的fviii缺陷和其它遗传学如hla而对天然fviii具有独特的反应。因此,本发明的自体方法能够确保受试者的apc变成致耐受的;
·在所需浓度下具有低毒性的良性作用;
·在开始治疗方案后,相当快的时间实现有用的耐受。
实施例
材料和方法
用于免疫中的dc制剂
将lewis大鼠安乐死,取出股骨和胫骨。然后通过将骨浸入70%乙醇中1分钟来消毒。用无菌剪刀切割骨的两端,使用带有20号针的5ml注射器冲洗骨髓并悬浮于bmdc培养基(补充有2%v/v正常lewis大鼠血清、10mmhepes、100u/ml青霉素、100μg/ml链霉素和50μm2-巯基乙醇的rpmi1640)中。在bmdc培养基中一次洗涤后,将红细胞裂解,然后在bmdc培养基中洗涤骨髓细胞两次,并通过70μm的细胞过滤器。
将骨髓细胞(3.5×106)在37℃和5%co2下、在t25细胞培养烧瓶中、在补充有重组大鼠(rr)gm-csf(5ng/ml)和rril-4(5ng/ml)的5mlbmdc培养基中培养。在第3天,向每个烧瓶中加入5ml补充有rrgm-csf(5ng/ml)和rril-4(5ng/ml)的bmdc培养基。在第5天,抽出培养基和非粘附细胞,并用5ml含有rrgm-csf(5ng/ml)、rril-4(5ng/ml)和zebularine(50μm)的新鲜bmdc培养基替换。此外,可以在这里添加rril-10(5ng/ml)。在第7天,通过轻轻敲打或冲洗烧瓶来收获以簇生长的非粘附细胞和半粘附细胞,离心并分散在仅含有rrgm-csf(2.5ng/ml)和zebularine(50μm)的新鲜bmdc培养基中,在新鲜的t25培养烧瓶(2-3.5×106/5ml)中亚培养。在第7天从半粘附bmdc分离非粘附bmdc的情况中(实施例5),在开始亚培养3-4小时后收集非粘附的bmdc,并转移到新鲜的t75培养烧瓶中。在第8天,可以将前列腺素e2(pge2)(1-3μm)加入到烧瓶中(用于上调趋化因子受体7(ccr7),从而使bmdc迁移到淋巴结)。此外,通过将抗原加入到烧瓶中,可以用抗原脉冲bmdc。在第9天,通过轻轻敲打或冲洗烧瓶来收获细胞。然后在pbs中彻底洗涤(2-3次)要接种到大鼠中的细胞。洗涤后,将细胞(1-5×106)再悬浮于0.2mlpbs中,皮下接种在大鼠的大腿内。在加入培养物之前用20gy照射将在体外增殖反应测定法中测试的bmdc。
在实施例1-4中,使用卵白蛋白(ova)作为模型抗原。
在实施例5中,使用因子viii(fviii)作为抗原。
体外增殖反应测定法中评估抑制作用
用100μg完全弗氏佐剂中乳化的ova在尾基(tailbase)上免疫lewis大鼠一次(实施例1-4),或者用150iu/kg重组人fviii以2周间隔在尾基上免疫lewis大鼠两次(实施例5)。在免疫7天后从免疫的大鼠中分离腹股沟淋巴结。在96孔板中、150μl/孔的总体积(补充有10%v/v加热灭活的胎牛血清、10mmhepes、100u/ml青霉素、100μg/ml链霉素和50μm2-巯基乙醇的rpmi1640)中进行标准增殖反应测定法,其中使用总淋巴结细胞群(实施例1和4)(100000/孔)或使用分离的cd4+t细胞(50000/孔)与照射的(20gy)同基因dc(10000/孔(实施例2)或5000/孔(实施例5))作为刺激剂。为了产生cd4+t细胞(≥98%纯度),用抗体混合物染色淋巴结细胞,并通过使用磁珠的阴性选择分离cd4+t细胞。为了产生同基因lewisdc,分离原始脾细胞,并在红细胞裂解后离心超过14.5%nycodenz。从梯度界面分离低密度脾细胞,从那些脾细胞中通过使用磁珠的阳性选择分离ox62+dc。通过向培养物中加入ova(100μg/ml)(实施例1-4)或fviii(1μg/ml)(实施例5)来刺激引发的淋巴细胞。用仅有培养基(无ova或fviii)设置阴性对照。
在37℃、5%co2中3天后,用0.5μci的[3h]胸苷脉冲培养物最后8小时。然后将细胞收获到玻璃纤维过滤器上,并使用标准闪烁步骤测量[3h]胸苷掺入,作为t细胞增殖的量度。实验以三或六次重复进行,结果表示为每分钟计数(cpm)±标准偏差(sd)。
为了评估bmdc对增殖反应的抑制作用,照射的(20gy)bmdc(10000/孔(实施例1和2)或5000/孔(实施例5))加入增殖反应测定法中。
bmdc表达对t细胞增殖具有强抑制作用的酶诱导型一氧化氮合酶(inos)。inos在bmdc中的表达由被激活的增殖的t细胞释放的干扰素γ诱导。在我们的实验中我们主要感兴趣的不是inos的抑制作用。事实上,由于抑制作用非常强,我们必须通过加入l-nil(n6-(1-亚氨乙基)-l-赖氨酸二盐酸盐)来阻断酶的inos活性,l-nil是inos的选择性抑制剂,以确保抑制不仅仅归因于inos活性。
在thp-1细胞中诱导ido1
从适当数量的t75烧瓶中收获thp-1细胞。将细胞在bürker室中计数,用0.4%台盼蓝染色。对于每个实验将适当数量的细胞转移到新管中,并在室温(rt)下以1200rpm离心5分钟。弃去上清液,加入新鲜的含有5%fbs的rpmi以获得2×105个细胞/ml的细胞浓度。将化合物加入到6孔板中的五个分开的孔中,使得在加入细胞后获得5个不同的最终浓度。将对照添加到添加细胞的6孔板中的一个孔中。每孔接种1×106个细胞以达到每孔5ml的总体积。将细胞在37℃、5%co2下孵育96小时。96小时后,停止测定法,裂解细胞以分离rna。
rna提取和通过rt-qpcr定量基因表达
根据制造商的说明书,使用rnarneasymini提取试剂盒(qiagen)从thp-1细胞中提取总rna。使用
实施例1-用zebularine培养的bmdc(含或不含pge2)在体外抑制淋巴结细胞的增殖反应
用100μg完全弗氏佐剂中乳化的ova在尾基免疫大鼠。免疫后7天分离腹股沟淋巴结。将淋巴结细胞(ln细胞,总淋巴结群)在96孔板(每孔100000)中培养,并用ova(100μg/ml)再刺激或无刺激(对照,无ova)持续3天,加入或不加入用zebularine(50μm)培养的具有或不具有pge2的照射的(20gy)bmdc(每孔10000个)。为了确保抑制作用不仅仅归因于inos活性,将inos抑制剂l-nil(0.01mg/ml)加入到一些孔中。在37℃、5%co2中3天后,用0.5μci的[3h]胸苷脉冲培养物最后8小时。
结果表示为六次重复孔的平均值±sd(图1)。
结果表明,以1:10的比例体外加入时,免疫淋巴结细胞对限定的抗原卵白蛋白的增殖反应完全抑制。在pge2存在下,dc的培养物不降低这种作用。根据在inos抑制剂l-nil存在时淋巴结细胞反应的有限增加,看起来添加的dc的仅仅一小部分作用是归因于酶inos的表达,在其它情况下已知酶inos的表达能够在体外强地瞬时地抑制t淋巴细胞反应。该结果证实产生的dc确实具有抑制淋巴结细胞对体外蛋白抗原反应的能力。
实施例2-用zebularine培养的bmdc(含或不含pge2)在体外抑制t细胞的增殖反应
用100μg完全弗氏佐剂中乳化的ova在尾基免疫大鼠。免疫后7天从腹股沟淋巴结分离cd4+t细胞。同样地,将cd4+t细胞(每孔50000个)在96孔板中与ox62+dc(分离自未处理的对照lewis大鼠脾脏)(每孔10000个)共培养,并用ova(100μg/ml)再刺激或无刺激(对照,无ova)持续3天,加入或不加入用zebularine(50μm)培养的具有或不具有pge2的bmdc(每孔10000个)。为了确保抑制作用不仅仅归因于inos活性,将inos抑制剂l-nil(0.01mg/ml)加入到一些孔中。在37℃、5%co2中3天后,用0.5μci的[3h]胸苷脉冲培养物最后8小时。
结果表示为六次重复孔的平均值±sd(图2)。
这些结果表明,混合的dc确实能够抑制纯cd4+t淋巴细胞(≥98%,具有最小的b淋巴细胞或非淋巴细胞污染)的反应。抑制这些t细胞是特别重要的,因为它们在进行细胞溶解效应细胞的免疫应答中起核心作用,并帮助产生抗体的b细胞进行抗体的产生。注意到在该体外实验中,必须加入一种激活脾ox62+dc的类型以向纯t淋巴细胞递呈抗原。在这种情况下,我们的抑制性dc抑制这些激活dc的活性。
实施例3-用zebularine和pge2培养的bmdc在皮下接种后迁移到引流淋巴结
用完全弗氏佐剂中乳化的100μgova在尾基免疫大鼠。五天后,大鼠在大腿皮下接种2×106cfse染色的bmdc,所述bmdc用zebularine(50μm)和pge2培养。在bmdc接种后72小时分离腹股沟淋巴结,并通过密度离心分离低密度淋巴结细胞。在facscalibur上分析来自分离的低密度细胞的样品,以检测cfse阳性bmdc。
结果如图3所示。
致耐受性dc的体内作用的一个重要特征是它们表现出受体需求以能够从接种区域迁移到引流淋巴结。pge2处理dc的作用是增强这种类型主要受体(ccr7)的表达。这些结果表明抑制性dc确实迁移到引流淋巴结。
实施例4-用zebularine培养的bmdc(含有或不含pge2)处理的免疫大鼠的淋巴结细胞在体外表现出降低的对再刺激的增殖反应。
用完全弗氏佐剂中乳化的100μgova在尾基免疫大鼠。同时,一些大鼠通过在大腿中皮下接种2×106用zebularine(50μm)培养的bmdc,含有或不含pge2。免疫后7天分离腹股沟淋巴结。将淋巴结细胞(ln细胞,总淋巴结群)在96孔板(每孔100000个)中培养,并用ova(100μg/ml)再刺激3天。为了确保抑制作用不仅归因于inos活性,将inos抑制剂l-nil(0.01mg/ml)加入到一些孔中。在37℃,5%co2中3天后,用0.5μci的[3h]胸苷脉冲培养最后8小时。
结果表示为六次重复孔的平均值±sd(图4)。
这些体内结果表明,当它们同时、但在不同的位点(尽管引流到相同的淋巴结)进行免疫与接种时,dc抑制淋巴结淋巴细胞的反应。该抑制作用不是归因于inos活性。
实施例5-用zebularine处理bmdc增加其对fviii引发的cd4+t细胞对体外fviii再刺激的增殖反应的抑制作用
以2周间隔用混合1μglps的150iu/kg人fviii(advate)在尾基皮下免疫大鼠两次。免疫后7天,从腹股沟引流淋巴结分离cd4+t细胞。将cd4+t细胞(每孔50000个)与ox62+dc(从未处理对照lewis大鼠的脾脏分离)(每孔5000个)在96孔板中共培养,并用fviii(advate,1μg/ml)再刺激或无刺激持续3天,加入或不加入比例为1:100(bmdc:t细胞,每孔500个bmdc)或1:10(bmdc:t细胞;每孔5000个bmdc)的半粘附(“semiadh”)或非粘附(“nonadh”)的bmdc,所述bmdc用或不用zebularine(“zeb”)(50μm)培养。为了确保记录的抑制作用不仅是归因于inos活性,将inos抑制剂l-nil(0.01mg/ml)加入到一些孔中。在37℃、5%co2中3天后,用0.5μci的[3h]胸苷脉冲培养物最后8小时。
结果表示为百分比刺激指数。对每个样品计算刺激指数(fviii刺激的增殖反应除以非刺激的增殖反应)。没有添加bmdc的孔的刺激指数被认为是100%。结果表示为一式三份孔的平均值±sd(图5)。
这些结果表明,混合的dc确实能够抑制fviii引发的cd4+t淋巴细胞(具有最小的b淋巴细胞或非淋巴细胞污染)对体外fviii再刺激的增殖反应。此外,这些结果表明用zebularine处理dc增加了这些抑制作用。
实施例6:通过静脉内转移体外诱导的表达ido1的树突细胞抑制在人fviii免疫的大鼠中诱导的免疫应答
从成年大鼠收获骨髓细胞后,通过在gm-csf和il-4中培养细胞诱导分化成未成熟树突细胞。在体外通过用zebularine单独或用ifn-γ和zebularine或其它ido诱导剂(ifn-α、丙戊酸、tgf-β)的组合处理未成熟的树突细胞,产生表达ido1的致耐受的大鼠树突细胞。
以2周间隔用混合1μglps的150iu/kg人fviii静脉内免疫成年大鼠两次,已知其诱导可检测的t细胞和b细胞对人fviii的免疫应答。在一组大鼠中,体外产生耐受性的同基因dc的三个剂量加载人fviii静脉内施用,在最后一次免疫后一周开始。对照组的大鼠同样免疫,但不接受任何静脉内转移的树突细胞。通过elisa监测动物对人fviii的抗体,通过t细胞增殖测定法(掺入胸苷的测定法)监测抗人fviiit细胞反应性和通过elisa监测细胞因子产生(il-2、il-4、il-5、il-17、ifn-γ、tnf-α和il-6)。
预期三种剂量的表达ido1的树突细胞抑制对人fviii的t细胞应答,如体外所测定的,并且还抑制对人fviii的抗体应答。由于对ifn-γ和相应诱导剂的组合诱导的ido1的协同作用,预期ifn-γ和zebularine或其它ido1-诱导物的组合的抑制作用更强。此外,ifn-γ在树突细胞中诱导的色氨酸的高亲和力转运蛋白(bhutia,2015)应该对不能表达该高亲和力转运蛋白的免疫t细胞产生更强的抑制作用。
实施例7-体外证明表达ido1的自体树突细胞对已经形成fviii抗体(抑制剂)的血友病a成人患者的t细胞反应性的抑制作用
从已经对fviii形成抗体(抑制剂)的成人血友病a患者中分离cd34+pbmc。通过在体外用scf、flt3l培养扩增细胞,并通过gm-csf和il-4分化成未成熟的dc。未成熟的dc与fviii加载并分别暴露于zebularine(50μm)单独、或ifn-γ和zebularine或ifn-α或丙戊酸或tgf-β的组合,持续3天,来诱导ido1的表达和致耐受性功能。
在测试产生的致耐受性dc的当天,分别从外周血分离自体cd4+t细胞和单核细胞,并通过磁珠分离纯化(≥95%)。通过将50,000个cd4+t细胞在5,000个单核细胞的存在下(以递呈fviii)暴露于浓度为0、0.01、0.1、0.3和1μg/ml的fviii,体外测定患者对fviii的t细胞反应性。在3-6天的孵育期的最后8小时期间,通过3h-胸苷掺入来测量t细胞增殖反应。通过elisa测定培养基中细胞因子(il2、il4、il5、il6、il17、ifn-γ、tnf-α)的释放。通过确定fox-p3+cd4+细胞的频率和数量,在facs中测定表达ido1的dc影响的t细胞转化成treg的诱导。
预期产生的致耐受的dc抑制cd4+t细胞增殖反应及其细胞因子的产生/释放。证明的对th2型细胞因子的强抑制表明通过抑制th2的b细胞抗体应答的抑制作用的可能机制,并且将预测dc应对体内抗fviii抗体产生具有抑制作用。
实施例8-用氮胞苷在thp-1细胞中诱导ido1
遵循“在thp-1细胞中诱导ido1”的步骤,得到表1中列出的最终浓度。
表1:5ml孔中结晶5-氮胞苷的最终浓度
rna提取后,通过如上所述的rt-qprc定量基因表达,研究了使用样品1至6诱导的ido1基因表达。
表2:5-氮胞苷样品对ido1表达的结果
结果也显示在图6中。结果表明,5-氮胞苷单独将ido1基因表达增加高达23倍。在1微摩尔浓度的5-氮胞苷中观察到最高水平的ido诱导。
实施例9-用脱氧氮胞苷在thp-1细胞中诱导ido1
遵循“在thp-1细胞中诱导ido1”的步骤,得到表3中列出的最终浓度。
表3:5ml孔中5-氮杂-2'-脱氧胞苷(地西他滨)的最终浓度
rna提取后,通过如上所述的rt-qprc定量基因表达,研究了使用样品7至12诱导的ido1基因表达。
表4:地西他滨样品对ido1表达的结果
结果也显示在图7中。结果表明,5-氮杂-2'-脱氧胞苷单独将ido1基因表达增加高达101倍。在10微摩尔浓度的地西他滨中观察到最高水平的ido诱导。
参考文献
dhodapkar,m.等人,j.exp.med.,2001,193(2),233-238
giannoukakis,n.等人,diabetescare,2011,34,2026-2032
nittby,h.等人,plosone,2013,8(8),1-8
langstein,j.blood,1999,94,3161-3168
bhutia,y.等人,biochimbiophysacta,2015,1848,453-462
缩略语
ha血友病a
iti免疫耐受诱导
dc树突细胞
apc抗原递呈细胞
ido吲哚胺双加氧酶
l-niln6-(1-亚氨乙基)-l-赖氨酸二盐酸盐
mhc主要组织相容性复合体
ifn干扰素
dna脱氧核糖核酸
pbs磷酸缓冲盐水
bmdc骨髓来源的树突细胞
pbmc外周血单核细胞
ova卵白蛋白
cfse羧基荧光素琥珀酰亚胺酯
fviii因子viii
inos诱导型一氧化氮合酶
s.c.皮下
hcg人绒毛膜促性腺激素
egf表皮生长因子
hgf肝细胞生长因子
kgf角化细胞生长因子
tgf组织生长因子
tgf-btgf-β
tnf肿瘤坏死因子
g-csf粒细胞集落刺激因子
gm-csf粒细胞巨噬细胞集落刺激因子
epo促红细胞生成素
ig免疫球蛋白
ifn-a干扰素α
mab单克隆抗体
rr大鼠重组
facs荧光激活的细胞分选
tnf-α肿瘤坏死因子-α
flt3lfms样酪氨酸激酶3配体
scf干细胞因子
μ微
elisa酶联免疫吸附测定法
tregs调节性t细胞
il白细胞介素
i.v.静脉内
fbs胎牛血清
rna核糖核酸
hac乙酸
ln淋巴结
sd标准偏差
在整个说明书和所附权利要求中,除非上下文另有要求,单词“包括”和如“包括”和“包含”之类的变形将被理解为暗示包含提到的整数、步骤、整数组、或步骤组,但不排除任何其它整数、步骤、整数组或步骤组。
本文所提及的所有专利和专利申请的全部内容通过引用并入本文。
- 还没有人留言评论。精彩留言会获得点赞!