免疫诱导剂的制作方法
本发明涉及作为癌的治疗剂和/或预防剂等有用的新的免疫诱导剂。
本发明还涉及用于癌免疫疗法的抗原呈递细胞或细胞毒性t细胞、或该细胞的制作方法。
背景技术:
癌症是占全部死亡原因的第一位的疾病,当前所实施的治疗是以手术疗法为主,结合放疗法和化疗法。尽管近年来开发了新的手术法和发现了新的抗癌剂,但是现状是,除了一部分癌之外,癌的治疗成绩没有大的改善。近年来,随着分子生物学、癌免疫学的进步,已经鉴定了对癌起反应的细胞毒性t细胞所识别的癌抗原、编码癌抗原的基因,从而对抗原特异性免疫疗法的期望提高。
在免疫疗法中,为了减轻副作用,需要作为其抗原被识别的肽或蛋白质基本上不存在于正常细胞、但特异性地存在于癌细胞。1991年,比利时ludwig研究所的boon等通过使用自身癌细胞株和癌反应性t细胞的cdna表达克隆法,分离了cd8阳性t细胞识别的人黑素瘤抗原mage1(非专利文献1)。此后,报导了采用基因表达克隆法鉴定由抗体识别的肿瘤抗原的serex(通过重组表达克隆进行的抗原的血清学鉴定)法,其中所述的抗体是癌患者身体内对自身癌反应而产生的抗体(专利文献1、非专利文献2),通过该方法分离了若干癌抗原。此外,已经开始了以一部分所述癌抗原为靶的癌免疫疗法的临床试验。
另一方面,与人同样地,已知犬、猫也会患乳腺肿瘤、扁平上皮癌等多种肿瘤,并且在犬、猫的疾病统计中也是排名靠前的疾病。但是,当前没有针对犬、猫的癌有效治疗药、预防药和诊断药。基本上大部分犬、猫的肿瘤是在发展而肿瘤变大之后饲养主才注意到,即使到医院通过外科手术切除、或施与人用药物(抗癌剂等)等也已为时过晚,多数在处置后不久死亡。在这样的现状下,如果能获得对犬、猫有效的癌治疗药和预防药,则可以期待开发针对癌症的用途。
硫酸软骨素蛋白聚糖5(chondroitinsulfateproteoglycan5,cspg5)是i型跨膜蛋白质,是神经调节蛋白家族蛋白质的一种。另外,报告了cspg5与erbb3结合而作为增殖因子发挥作用,在brca1有突变的卵巢癌中表达上升(非专利文献3、4)。另外,cspg5在视网膜神经节细胞、浦肯野细胞、海马等神经系统的组织中高表达,作为神经细胞的增殖/分化因子发挥作用,从而参与神经轴突的伸长(非专利文献5、6、7)。但是,没有cspg5蛋白对癌细胞具有免疫诱导活性,由此该蛋白质对于癌的治疗、预防有用这样的报告。
现有技术文献
专利文献
专利文献1:美国专利第5698396号
非专利文献
非专利文献1:bruggenp.etal.,science,254:1643-1647(1991)
非专利文献2:sahin,uetal.,proc.natl.acad.sci.usa,92:11810-11813(1995)
非专利文献3:kinugasa,y.etal.,biochem.biophys.res.commun321:1045(2004)
非专利文献4:press,jz.etal.,neoplasia.dec;12(12):993-1002.(2010)
非专利文献5:yasuda,y.etal.,neurosci.res.32:313(1998)
非专利文献6:aono,s.etal.,j.neurosci.res.83:110(2006)
非专利文献7:nakanishi,k.etal.,j.biol.chem.281:24970(2006)
技术实现要素:
发明要解决的课题
本发明的目的是,发现作为癌的治疗剂和/或预防剂等有用的新的多肽,提供该多肽用于免疫诱导剂的用途。
用于解决课题的方法
本发明者们进行了深入研究,结果通过使用了犬精巢来源的cdna文库和荷癌犬血清的serex法,获得了编码与来自荷癌生物体的血清中存在的抗体结合的蛋白质的cdna,并且以该cdna为基础,制作了具有序列号2所示氨基酸序列的犬硫酸软骨素蛋白聚糖5(chondroitinsulfateproteoglycan5,以下记载为“cspg5”)的多肽。另外,以所获得的基因的人、猫和小鼠同源性基因为基础,制作了具有序列号4、6、8、10、12、14和16所示氨基酸序列的人、猫和小鼠cspg5多肽。然后,发现这些cspg5多肽在乳癌、肺癌、脑肿瘤、卵巢癌、白血病、恶性淋巴瘤、腺癌、肥大细胞瘤、扁平上皮癌、黑素瘤或成神经细胞瘤的组织或细胞中特异性地表达。进一步发现通过对生物体施与这些cspg5,能够在生物体内诱导针对cspg5的免疫细胞,以及使表达cspg5的生物体内肿瘤的退缩。此外,发现能够表达编码cspg5的多肽或其片段的多核苷酸的重组载体对表达cspg5的癌在生物体内诱导抗肿瘤效果。
此外,发现cspg5的多肽具有被抗原呈递细胞呈递、使对该多肽特异的细胞毒性t细胞活化和增殖的能力(免疫诱导活性),由此该多肽对于癌的治疗和/或预防是有用的,并且接触了该多肽的抗原呈递细胞、以及接触了该抗原呈递细胞的t细胞对于癌的治疗和/或预防是有用的,从而完成了本发明。
因此,本发明具有以下特征。
(1)免疫诱导剂,包含(i)选自以下(a)、(b)和(c)的多肽类且具有免疫诱导活性的至少1种多肽、或(ii)包含编码该多肽的多核苷酸且能够在生物体内表达该多肽的重组载体作为有效成分,
(a)由序列号8、4、6、10、12、2或14所示的氨基酸序列组成的多肽、和由该氨基酸序列中的连续7个以上氨基酸组成的多肽,
(b)与序列号8、4、6、10、12、2或14所示的氨基酸序列有85%以上的序列同一性的多肽、和由该多肽的氨基酸序列中的连续7个以上氨基酸组成的多肽,
(c)包含所述(a)或(b)的多肽作为部分序列的多肽。
(2)根据上述(1)所述的免疫诱导剂,所述具有免疫诱导活性的多肽是由序列号8、4、6、10、12、2或14所示的氨基酸序列组成的多肽。
(3)根据上述(1)或(2)所述的免疫诱导剂,是抗原呈递细胞处理用免疫诱导剂。
(4)根据上述(1)或(2)所述的免疫诱导剂,是癌的治疗和/或预防用免疫诱导剂。
(5)根据上述(4)所述的免疫诱导剂,所述癌是表达cspg5的癌。
(6)根据上述(4)或(5)所述的免疫诱导剂,所述癌是脑肿瘤、白血病、恶性淋巴瘤或成神经细胞瘤。
(7)根据上述(1)~(6)的任一项所述的免疫诱导剂,还包含免疫增强剂剂。
(8)根据上述(7)所述的免疫诱导剂,所述免疫增强剂是选自弗氏不完全佐剂、montanide、聚肌胞及其衍生物、cpg寡核苷酸、白细胞介素12、白细胞介素18、干扰素α、干扰素β、干扰素ω、干扰素γ和flt3配体中的至少一种。
(9)包含上述(1)中定义的多肽与mhc分子的复合物的抗原呈递细胞的制作方法,包括使该多肽与来源于受检体的抗原呈递细胞离体(exvivo)或体外(invitro)接触的步骤。
(10)根据上述(9)所述的方法,所述抗原呈递细胞是保有mhcⅰ类分子的树突状细胞或b细胞。
(11)对上述(1)中定义的多肽特异的细胞毒性t细胞的制作方法,包括使通过上述(9)或(10)所述的方法得到的抗原呈递细胞与来源于受检体的t细胞离体(exvivo)或体外(invitro)接触,从而激活该t细胞的步骤。
(12)抗原呈递细胞,其特征在于,是通过上述(9)或(10)所述的方法得到的,并且包含上述(1)中定义的多肽与mhc分子的复合物。
(13)细胞毒性t细胞,其特征在于,是通过上述(11)所述的方法得到的,并且对上述(1)中定义的多肽特异。
本说明书包含成为本申请的优先权基础的日本专利申请号2015-093354号的公开内容。
本发明提供了对癌的治疗和/或预防等有用的新的免疫诱导剂。如后述实施例中具体显示的那样,向受检体施与本发明中所用的多肽或编码该多肽的载体,能够在受检体内诱导免疫细胞,进而能使已存在的癌缩小或退缩。因此,该多肽或该载体对癌的治疗和预防是有用的。
附图说明
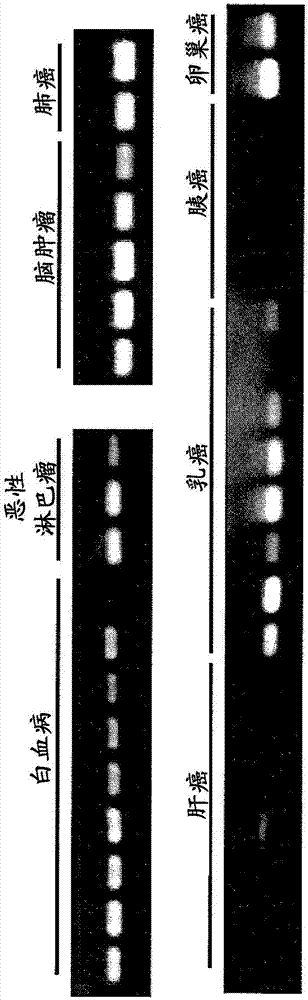
图1是显示鉴定的cspg5基因在图示的犬肿瘤组织或癌细胞株中的表达图谱的图。参考号1:犬cspg5基因在犬的各组织和细胞株中的表达图谱;参考号2:犬gapdh基因在犬的各组织和细胞株中的表达图谱。
图2是显示鉴定的cspg5基因在图示的人肿瘤组织或癌细胞株中的表达图谱的图。人gapdh基因在人的各组织和细胞株中全部确认了表达。
图3是显示鉴定的cspg5基因在图示的小鼠肿瘤组织或癌细胞株中的表达图谱的图。参考号3:小鼠cspg5基因在小鼠的各组织和细胞株中的表达图谱;参考号4:小鼠gapdh基因在小鼠的各组织和细胞株中的表达图谱。
具体实施方式
更详细地说明本发明。
1.多肽
作为本发明的免疫诱导剂中作为有效成分包含的具有免疫诱导活性的多肽,可列举以下(a)~(c)的多肽。
(a)由序列号8、4、6、10、12、2或14所示的氨基酸序列组成的多肽、和由该氨基酸序列中的连续7个以上氨基酸组成的多肽,
(b)与序列号8、4、6、10、12、2或14所示的氨基酸序列有85%以上的序列同一性的多肽、和由该多肽的氨基酸序列中的连续7个以上氨基酸组成的多肽,
(c)包含所述(a)或(b)的多肽作为部分序列的多肽。
本说明书,“多肽”是多个氨基酸通过肽键形成的分子,不仅包含构成的氨基酸数多的多肽分子,也包含构成的氨基酸数少的低分子量分子(寡肽)和全长蛋白质;在本发明中,也包含具有序列号8、4、6、10、12、2或14所示的氨基酸序列的cspg5的全长蛋白质。
本说明书中,“具有氨基酸序列”只要不特别说明,就是指氨基酸残基以氨基酸序列所示的顺序排列。因此,例如,“具有序列号8所示的氨基酸序列的多肽”是指具有序列号8所示的metglyargalagly…(中略)…asnasnleuthr的氨基酸序列的、大小为566个氨基酸残基的多肽。另外,例如,有时将“具有序列号8所示的氨基酸序列的多肽”简写为“序列号8的多肽”。对于“具有碱基序列”这样的表述也同样。此时,“具有氨基酸序列”或“具有碱基序列”中的“具有”这样的术语,只要不特别说明,可以用“包含”这样的表述置换。
本说明书中,“免疫诱导活性”是指在受检体的生物体内诱导分泌干扰素等细胞因子的免疫细胞的能力。
本说明书中,“受检体”是指为了癌(或肿瘤)的治疗或预防而需要用本发明的免疫诱导剂进行免疫诱导的动物、优选哺乳动物,包含例如,人、犬、猫等宠物、在动物园等饲养的熊猫等动物、牛等家畜动物、马等竞技用动物等。
上述多肽是否具有免疫诱导活性可以通过例如公知的酶联免疫斑点测定(elispotassay;enzyme-linkedimmunospotassay)等确认。具体而言,例如如后述的实施例中所记载的那样,从施与了要评价免疫诱导活性的多肽的动物获得外周血单核细胞等细胞,将该细胞与该多肽共培养,通过使用特异抗体测定由该细胞产生的细胞因子量,能够测定该细胞中的免疫细胞数,由此能够评价免疫诱导活性。
另外,如后述的实施例中所记载的那样,将上述(a)~(c)的多肽(优选重组多肽)施与荷癌生物体,则通过其免疫诱导活性能够使肿瘤退缩。由此,上述免疫诱导活性也能够以抑制癌细胞增殖或使癌组织(肿瘤)缩小或消减的能力(下文中称为“抗肿瘤活性”)来评价。多肽的抗肿瘤活性例如如后述的实施例中具体记载的那样,能够通过研究实际施与了该多肽的荷癌动物中肿瘤是否缩小等来确认。另外,通过调查将该多肽施与荷癌动物而诱导的细胞毒性t细胞是否对肿瘤显示细胞毒活性也可以评价多肽的抗肿瘤活性。生物体内的t细胞的细胞毒活性的测定,例如可以通过将t细胞从生物体内除去的抗体施与荷癌动物,调查肿瘤是否缩小等来确认,但不限于此。
或者,也能够通过研究用该多肽刺激的t细胞(即,与呈递该多肽的抗原呈递细胞接触的t细胞)在体外是否显示对肿瘤细胞的细胞毒活性,来评价多肽的抗肿瘤活性。t细胞与抗原呈递细胞的接触可以如后述那样,将两者在液体培养基中共培养而实施。细胞毒活性的测定可以通过例如d.d.kharkevitchetal.,int.j.cancer,58:317-323,1994中所记载的称为51cr释放测定法的公知方法来实施。在将上述多肽用于癌的治疗和/或预防用途中的情形时,不特别地限制评价方法,但优选以抗肿瘤活性作为指标来评价免疫诱导活性。
本发明公开的序列表的序列号8、4、6、10、12、2或14所示的氨基酸序列是通过使用源自犬精巢的cdna文库和荷癌犬的血清的serex法,作为与源自荷癌犬的血清中存在的特异性抗体结合的多肽及其人、猫、和小鼠同源因子分离的cspg5的氨基酸序列(参照实施例1)。在作为犬cspg5的人同源因子的人cspg5中,序列同一性为碱基序列87%、氨基酸序列87%,在作为猫同源因子的猫cspg5中,序列同一性为碱基序列92%、氨基酸序列91%,在作为小鼠同源因子的小鼠cspg5中,序列同一性为碱基序列84%、氨基酸序列85%。
上述(a)的多肽是由具有序列号8、4、6、10、12、2或14所示的氨基酸序列的多肽中的连续7个以上、优选连续8、9或10个以上的氨基酸组成、且具有免疫诱导活性的多肽。更优选该多肽是由与序列号8所示的氨基酸序列的序列同一性为85%以上的氨基酸序列组成的多肽,特别优选该多肽具有序列号8、4、6、10、12、2或14所示的氨基酸序列。此外,如本领域公知的那样,只要是约7个氨基酸残基以上的多肽,就能够发挥抗原性和免疫原性。因此,只要是序列号8、4、6、10、12、2或14的氨基酸序列中的连续7氨基酸残基以上的多肽,就具有免疫诱导活性,所以能够用于制备本发明的免疫诱导剂。
另外,作为通过施与癌抗原多肽来进行免疫诱导的原理,已知多肽被抗原呈递细胞摄入,然后在该细胞内被肽酶分解成为较小的片段,呈递在该细胞表面上,细胞毒性t细胞等免疫细胞对其进行识别,选择性杀死呈递该抗原的细胞。抗原呈递细胞的表面上呈递的多肽大小是比较小的,氨基酸数为7~30个左右。因此,从呈递在抗原呈递细胞上这点出发,作为上述(a)的多肽,优选的实施方式之一是序列号8、4、6、10、12、2或14所示的氨基酸序列中的连续7~30个氨基酸左右,更优选只要是由8~30个或9~30个左右的氨基酸组成的多肽就足够了。也有时这些比较小尺寸相对小的多肽不被摄入抗原呈递细胞内,而是直接呈递在抗原呈递细胞上的细胞表面。
另外,被抗原呈递细胞摄入的多肽通过该细胞内的肽酶而在随机位置被切断,产生多种多肽片段。由于这些多肽片段被呈递在抗原呈递细胞表面上,所以如果施与序列号8、4、6、10、12、2或14的全长区域这样大尺寸的多肽,则通过抗原呈递细胞内的分解而必然产生对介由抗原呈递细胞的免疫诱导有效的多肽片段。因此,即使对于介由抗原呈递细胞的免疫诱导,也能够优选使用尺寸大的多肽,也可以是氨基酸数为30个以上、更优选100个以上、更优选200个以上、更优选250个以上、更优选为序列号8、4、6、10、12、2或14的全长区域多肽。
上述(b)的多肽是在上述(a)所记载的具有序列表的序列号8、4、6、10、12、2或14所示的氨基酸序列的多肽中替换、缺失和/或添加或插入了少数(优选1个或几个)氨基酸残基、且具有免疫诱导活性的多肽,或者与未改变的原序列具有85%以上、90%以上、优选地95%以上、更优选地98%以上、进一步优选地99%以上或99.5%以上的序列同一性、且具有免疫诱导活性的多肽。一般地,本领域技术人员广泛已知:在蛋白质抗原中,即使在该蛋白质的氨基酸序列中替换、缺失或添加或插入了少数的氨基酸残基的情况下,有时也具有与原蛋白质几乎相同的抗原性。因此,上述(b)的多肽也能够发挥免疫诱导活性,所以能够用于制备本发明的免疫诱导剂。另外,上述(b)的多肽还优选为在序列号8、4、6、10、12、2或14所示的氨基酸序列中替换、缺失、和/或添加或插入了1个或几个氨基酸残基的多肽。本说明书中的“几个”表示2~10的整数、优选2~6的整数、进一步优选2~4的整数。
本说明书中,氨基酸序列(或碱基序列)的“序列同一性”的“序列同一性”是指在使需要比较的2个氨基酸序列(或碱基序列)的氨基酸残基(或碱基)尽可能多地一致地将两个氨基酸序列(或碱基序列)排列,用百分率来表示一致的氨基酸残基数(或一致的碱基数)除以总氨基酸残基数(或总碱基数)。进行上述排列时,根据需要在所比较的2个序列的一方或双方中适宜地插入间隙。这样的序列排列化可以使用例如blast、fasta、clustalw等周知的算法进行。插入间隙时,上述总氨基酸残基数变为将1个间隙作为1个氨基酸残基来计数的残基数。由此,计数的总氨基酸残基数在所比较的2个序列间不同的情形下,序列同一性(%)是以一致的氨基酸残基数除以较长一方序列的总氨基酸残基数而算出的。
此外,构成天然蛋白质的20种氨基酸能够按具有类似性质的氨基酸来分组为具有低极性侧链的中性氨基酸(gly,ile,val,leu,ala,met,pro)、具有亲水性侧链的中性氨基酸(asn,gln,thr,ser,tyr,cys)、酸性氨基酸(asp,glu)、碱性氨基酸(arg,lys,his)、芳香族氨基酸(phe,tyr,trp),已知如果是组内的氨基酸之间的置换,多数情况下多肽的性质不变化。因此,对上述(a)的多肽中的氨基酸残基进行置换时,通过在这些各组内的氨基酸之间置换,能够维持免疫诱导活性的可能性高,因此优选。
上述(c)的多肽是包含上述(a)或(b)的多肽作为部分序列、且具有免疫诱导活性的多肽。即,是在(a)或(b)的多肽的一端或两端添加了其他至少1个氨基酸残基或其他(单数或多数的)多肽、且具有免疫诱导活性的多肽。这样的多肽也可以用于制备本发明的免疫诱导剂。
上述多肽可以按照例如fmoc法(芴甲氧羰基法)、tboc法(叔丁氧羰基法)等公知的肽合成法等化学合成法合成。另外,也能够利用各种市售的肽合成仪按照常规方法来合成。此外,通过使用公知的基因工程技术,制备编码上述多肽的多核苷酸,将该多核苷酸插入表达载体,导入宿主细胞中,在该宿主细胞中生产多肽,从而能够得到目的多肽。
编码上述多肽的多核苷酸能够使用公知的基因工程技术或市售的核酸合成仪根据常规方法容易地制备。例如,具有序列号1的碱基序列的dna,能够通过使用犬染色体dna或cdna文库作为模板,用设计成能够扩增序列号1中所记载的碱基序列的一对引物进行pcr来制备。对于具有序列号3的碱基序列的dna,能够使用人染色体dna或cdna文库作为上述模板同样地制备。可以适当地设定pcr反应条件,可例举例如,以由94℃30秒(变性)、55℃30秒~1分钟(退火)、72℃2分钟(延伸)组成的反应工序作为1个循环,进行例如30个循环后,72℃反应7分钟的条件等,但不限于此。另外,基于本说明书中的序列表的序列号1和3分别所示的碱基序列和氨基酸序列信息,制备适当的探针或引物,通过使用它们来筛选犬、人等的cdna文库,能够分离所需要的dna。cdna文库优选地从表达序列号2、4的蛋白质的细胞、器官或组织制作。上述探针或引物的制备、cdna文库的构建、cdna文库的筛选、以及目的基因的克隆等操作是本领域技术人员已知的操作,例如可以依据モレキュラー·クローニング:ア·ラボラトリー·マニュアル第2版(コールド·スプリング·ハーバー·ラボラトリー·プレス)、カレント·プロトコールズ·イン·モレキュラバイオロジー(ジョン·ウイリィ·アンド·サンズ)等中所记载的方法实施。从这样获得的dna能够得到编码上述(a)的多肽的dna。另外,由于编码各氨基酸的密码子是公知的,因而能够容易地确定编码特定氨基酸序列的多核苷酸的碱基序列。因此,由于也能够容易地确定编码上述(b)或(c)的多肽的多核苷酸的碱基序列,所以这样的多核苷酸也能够容易地使用市售的核酸合成仪通过常规方法合成。
作为上述宿主细胞,只要是能够表达上述多肽的细胞,任一细胞均可,作为原核细胞的例子可以例举大肠杆菌等,作为真核细胞的例子可以例举猴肾脏细胞cos1、中国仓鼠卵巢细胞cho等哺乳动物培养细胞、芽殖酵母、裂殖酵母、蚕细胞、非洲爪蟾卵细胞等,但不限于这些。
使用原核细胞作为宿主细胞时,作为表达载体,使用具有能够在原核细胞中复制的起点、启动子、sd序列(或核糖体结合位点)、dna克隆位点、终止子等的表达载体。作为大肠杆菌用表达载体,可以例示puc系统、pbluescriptii、pet表达系统、pgex表达系统等。可以将编码上述多肽的dna插入这样的表达载体,用该载体转化原核宿主细胞后,培养得到的转化体,使上述dna所编码的多肽在原核宿主细胞中表达。此时,也可以使该多肽作为与其它的蛋白质的融合蛋白质表达。
使用真核细胞作为宿主细胞时,作为表达载体,使用具有启动子、剪接区域、多聚a添加位点等的真核细胞用表达载体。作为这样的表达载体,能够例示pka1、pcdm8、psvk3、pmsg、psvl、pbk-cmv、pbk-rsv、ebv载体、prs、pcdna3、pmsg、pyes2等。与上述同样地,可以将编码上述多肽的dna插入这样的表达载体,用该载体转化真核宿主细胞后,培养得到的转化体,使由上述dna编码的多肽在真核宿主细胞中表达。在使用pind/v5-his、pflag-cmv-2、pegfp-n1、pegfp-c1等作为表达载体时,可以使上述多肽作为添加了his标签、flag标签、myc标签、ha标签、gfp等各种标签的融合蛋白质表达。
可以使用电穿孔法、磷酸钙法、脂质体法、deae葡聚糖法等周知的方法将表达载体导入宿主细胞。
为了从宿主细胞分离纯化目的多肽,可以组合进行公知的分离操作。可以例举例如用尿素等变性剂或表面活性剂处理、超声波处理、酶消化、盐析或溶剂分级沉淀法、透析、离心分离、超滤、凝胶过滤、sds-page、等电点电泳、离子交换层析、疏水层析、亲和层析、反相层析等,但不限于此。
在通过以上方法获得的多肽中,如上所述,也包含与其它的任意蛋白质融合的融合蛋白质形式的多肽。可以例示例如与谷胱甘肽-s-转移酶(gst)或his标签融合的融合蛋白质等。这样的融合蛋白质形式的多肽也作为上述(c)的多肽包含在本发明的范围中。进一步地,转化细胞表达的多肽有时在翻译后在细胞内受到各种修饰。这样的被翻译后修饰的多肽只要具有免疫诱导活性也包含在本发明的范围中。作为这样的翻译修饰,可以例示n末端甲硫氨酸去除、n末端乙酰化、添加糖链、由胞内蛋白酶引起的限制性分解、十四烷酰化、异戊二烯化、磷酸化等。
2.免疫诱导剂
如后述实施例中具体记载的那样,向荷癌动物施与具有免疫诱导活性的上述多肽能使已经形成的肿瘤退缩。因此,本发明的免疫诱导剂能够用作癌的治疗剂和/或预防用。另外,具有免疫诱导活性的上述多肽能够用于通过免疫诱导来进行的癌的治疗和/或预防方法中。
本说明书中,“肿瘤”和“癌”这样的术语是指恶性新生物,能够互换使用。
此时,作为成为对象的癌,优选为表达cspg5的癌,更优选乳癌、肺癌、脑肿瘤、卵巢癌、白血病、恶性淋巴瘤、腺癌、肥大细胞瘤、扁平上皮癌、黑素瘤或成神经细胞瘤,特别优选乳癌、肺癌、脑肿瘤、白血病、恶性淋巴瘤、肥大细胞瘤、黑素瘤或成神经细胞瘤。
另外,成为对象的动物(受检体)如上所述,优选为哺乳动物,更优选包含灵长类、宠物、动物园等饲养的动物、家畜类、竞技用动物等的哺乳动物,特别优选人、犬或猫。
本发明的免疫诱导剂向生物体施与的途径可以是经口施与,也可以是非经口施与,但优选肌内施与、皮下施与、静脉内施与、动脉内施与等非经口施与。在以治疗癌为目的使用该免疫诱导剂时,为了提高抗癌作用,如后述实施例中所记载的那样,也能够施与至成为治疗对象的肿瘤附近的所属淋巴结。施与量是对免疫诱导有效的量即可,例如用于癌的治疗和/或预防中时,只要是对癌的治疗和/或预防有效的量即可。对癌的治疗和/或预防有效的量要根据肿瘤的大小、症状等适宜选择,但是通常对于对象动物,每天的有效量是0.0001~1000μg、优选0.001~1000μg,可以1次或分成数次施与。优选分数次、每隔数日至数月施与。如后述实施例中具体例示的那样,本发明的免疫诱导剂能够使已经形成的肿瘤退缩。因此,由于对发生初期的少数癌细胞也能够发挥抗癌作用,所以在癌的发病前、癌的治疗后使用,能够防止癌的发病、复发。即,本发明的免疫诱导剂对癌的治疗和预防两者都有用。
本发明的免疫诱导剂可仅由多肽构成,也可与适应于各施与形式的制药上可容许的担载体、稀释剂、赋形剂等添加剂适当混合来制剂。这里“制剂”也可以与“免疫诱导用组合物”和“免疫诱导用药品”互换使用。制剂方法和可以使用的添加剂是医药制剂领域周知的,能够使用任一方法和添加剂。作为添加剂的具体例子,可以例举生理缓冲液这样的稀释剂;砂糖、乳糖、玉米淀粉、磷酸钙、山梨醇、甘氨酸等这样的赋形剂;糖浆、明胶、阿拉伯胶、山梨糖醇、聚氯乙烯、黄蓍胶等这样的结合剂;硬脂酸镁、聚乙二醇、滑石、二氧化硅等润滑剂,但不限于此。作为制剂形式,可以例举片剂、胶囊剂、颗粒剂、散剂、糖浆剂等经口剂;吸入剂、注射剂、栓剂、液体剂等非经口剂等。这些制剂可以通过常规已知的制法制作。
本发明的免疫诱导剂可以与能在生物体内强化免疫应答的免疫增强剂组合使用。免疫增强剂可以包含于本发明的免疫诱导剂中,也可以作为另一种组合物与本发明的免疫诱导剂联合使用而施与给患者。
作为上述免疫增强剂,可以例举例如佐剂。佐剂通过提供抗原的储备库(细胞外或巨噬细胞内)、活化巨噬细胞、并且刺激特定组的淋巴细胞,能够强化免疫应答,因此能够提高抗癌作用。因此,特别地,当将本发明的免疫诱导剂用于癌的治疗和/或预防时,免疫诱导剂优选地除了作为有效成分的上述多肽之外还包含佐剂。多种的佐剂是本领域周知的,可以使用任一佐剂。作为佐剂的具体例子,可以例举mpl(smithklinebeecham);将沙门氏菌属的明尼苏达沙门氏菌(salmonellaminnesota)re595的脂多糖类纯化和酸水解后得到的同类物;qs21(smithklinebeecham);从皂树(quilljasaponaria)提取物纯化的纯qa-21皂苷;pct申请wo96/33739(smithklinebeecham)中记载的dqs21;qs-7,qs-17,qs-18和qs-l1(so等,“分子与细胞(moleculesandcells)”,1997年,第7卷,p.178-186);弗氏不完全佐剂;弗氏完全佐剂;维生素e;montanide;明矾或氢氧化铝(alum);cpg寡核苷酸(参见例如,kreig等,nature,第374卷、p.546-549);聚肌胞及其衍生物(聚iclc等)以及从角鲨烯和/或生育酚这样的生物可分解性油制备的多种油包水乳液;α半乳糖苷基神经酰胺等。其中优选弗氏不完全佐剂、montanide、聚肌胞及其衍生物、以及cpg寡核苷酸。上述佐剂与多肽的混合比一般是约1:10~10:1,优选约1:5~5:1,更优选约1:1。但是,佐剂不限于上述例示,可以在施与本发明的免疫诱导剂时也使用本领域已知的上述以外的佐剂(参见例如,goding著,《单克隆抗体:原理与实践(monoclonalantibodies:principlesandpractice)》,第2版,1986年)。制备多肽和佐剂的混合物或乳液的方法是预防接种领域的技术人员周知的。
另外,作为上述免疫增强剂,除了上述佐剂之外,还可以使用刺激对象的免疫应答的因子。例如,可以与本发明的免疫诱导剂组合使用具有刺激淋巴细胞、抗原呈递细胞的特性的各种细胞因子作为免疫增强剂。这样的可增强免疫应答的多种细胞因子是本领域技术人员公知的,作为例子可以例举显示增强疫苗的防御作用的白细胞介素-12(il-12)、gm-csf、il-18、干扰素α、干扰素β、干扰素ω、干扰素γ和flt3配体,但不限于这些。这样的因子也可以作为上述免疫增强剂使用,可以包含于本发明的免疫诱导剂中,或者作为另一种组合物与本发明的免疫诱导剂联合使用而施与患者。
另外,通过将上述多肽与(来源于受检体的)抗原呈递细胞离体(exvivo)或体外(invitro)接触,能够将该多肽呈递给抗原呈递细胞。即,上述(a)、(b)或(c)的多肽能够作为抗原呈递细胞的处理用使用。这里,作为抗原呈递细胞,能够优选使用保有mhci类分子的树状细胞或b细胞。多种mhci类分子已经被鉴定并周知。人中的mhc分子称作hla。作为hlai类分子,可以例举hla-a、hla-b、hla-c,更具体地,可以例举hla-a1、hla-a0201、hla-a0204、hla-a0205、hla-a0206、hla-a0207、hla-a11、hla-a24、hla-a31、hla-a6801、hla-b7、hla-b8、hla-b2705、hla-b37、hla-cw0401、hla-cw0602等。
作为将上述多肽作为抗原呈递细胞的处理用使用的例子,如下述3.中说明的那样,可列举将多肽用于制作包含该多肽与mhc分子的复合物的抗原呈递细胞,以及制作对该多肽特异的细胞毒性t细胞等的使用。
保有mhci类分子的树状细胞或b细胞能够通过周知的方法自外周血制备。例如,通过使用粒细胞-巨噬细胞集落刺激因子(gm-csf)和il-3(或il-4)从骨髓、脐带血或患者的外周血诱导出树状细胞,向该培养系统中添加肿瘤相关肽,能够诱导出肿瘤特异性的树状细胞。
通过施与有效量的该树状细胞,能够诱导出癌的治疗中所希望的应答。使用的细胞可以使用健康人提供的骨髓、脐带血、患者本人的骨髓、外周血等,但是使用患者本来的自身细胞时安全性高,也能够期待避免严重的副作用。外周血或骨髓可以是新鲜样品、低温保存样品和冷冻保存样品的任一种。外周血可以培养全血,也可以仅分离白细胞成分并培养,但从效率的观点看,优选后者。进一步地,也可以从白细胞成分中分离单核细胞。另外,在以骨髓或脐带血为起源的情形时,可以培养构成骨髓的全部细胞,也可以从中分离单核细胞并培养。外周血、其白细胞成分、骨髓细胞中包含作为树状细胞起源的单核细胞、造血干细胞或未成熟树状细胞、cd4阳性细胞等。使用的细胞因子只要是安全性和生理活性经确认的特性的细胞因子即可,不管是天然型或基因重组型等,也不管其生产方法,但优选以最小需要量使用确保了用于医疗用的品质的标准品。添加的细胞因子的浓度只要是诱导树状细胞的浓度就不特别限定,通常优选细胞因子的总浓度为10~1000ng/ml左右、更优选20~500ng/ml左右的。培养可以使用通常用于白细胞培养的周知的培养基进行。培养温度只要白细胞能够增殖,就不特别限定,最优选作为人的体温的37℃左右。另外,培养中的气体环境只要白细胞能够增殖,就不特别限定,优选通气5%co2。此外,培养期间只要是能诱导必需数目的细胞的期间,就不特别限定,通常以3天~2周之间进行。供于细胞的分离、培养的仪器可以适宜使用适当的,但优选确认了医疗用安全性、并且操作稳定且简便的。特别是细胞培养装置,不限于培养皿、烧瓶和培养瓶等常见的容器,也可以使用分层型容器、多段式容器、滚瓶(rollerbottle)、转瓶(spinnerbottle)、袋式培养器、中空丝柱等。
此外,根据本发明,通过使编码上述(a)、(b)或(c)的多肽的多核苷酸在对象动物的体内表达,也能够在该生物体内诱导抗体生产、细胞毒性t细胞,获得与施与该多肽同等的针对癌的上述治疗和预防等效果。即,本发明的免疫诱导剂也可以包含重组载体作为有效成分,所述重组载体包含编码上述(a)、(b)或(c)的多肽的多核苷酸、并能够在生物体内表达该多肽。如后述实施例所示,这样的能够表达抗原多肽的重组载体也被称为基因疫苗。
用于制造基因疫苗的载体只要是能在对象动物细胞内(优选哺乳动物细胞内)表达的载体,就不特别限定,可以是质粒载体,也可以是病毒载体,可以使用基因疫苗领域中公知的任意载体。另外,编码上述多肽的dna、rna等的多核苷酸能够如上所述通过常规方法容易地制备。另外,该多核苷酸可以通过使用本领域技术人员周知的方法插入载体。
基因疫苗的施与途径优选是肌内施与、皮下施与、静脉内施与、动脉内施与等的非经口施与途径,施与量可以根据抗原种类等适当地选择,通常是每1kg体重0.1μg~100mg左右、优选1μg~10mg左右。
作为利用病毒载体的方法,可以例举将编码上述多肽的多核苷酸插入例如逆转录病毒、仙台病毒、腺病毒、腺相关病毒、疱疹病毒、痘苗病毒、痘病毒、脊髓灰质炎病毒、辛德比斯病毒等rna病毒或dna病毒中,并用其感染对象动物的方法。其中特别优选使用逆转录病毒、腺病毒、腺相关病毒、痘苗病毒等的方法。
作为其他方法,可以例举将表达质粒直接施与至肌内的方法(dna疫苗法)、脂质体法、脂质转染(lipofectin)法、显微注射法、磷酸钙法、电穿孔法等,特别优选dna疫苗法、脂质体法。
为了使本发明中所用的编码上述多肽的基因实际上作为医药品发挥作用,有将基因直接导入体内的体内(invivo)方法和自对象动物采样某种细胞、体外将基因导入该细胞、并将所述细胞返回体内的离体(exvivo)方法(日経サイエンス(日本),1994年4月,第20-45页;月刊药事,1994年,第36卷,第1号,p.23-48;实验医学增刊(日本),1994年,第12卷,第15号;以及它们的引用文献等),更优选体内方法。
在通过体内方法施与的情形,可以根据治疗目的的疾病、症状等通过适当的施与途径施与。例如,可以施与静脉、动脉、皮下、肌内等。在通过体内方法施与的情形,例如可以采用液体剂等制剂形式,通常可以制成含有编码本发明的上述肽的dna作为有效成分的注射剂等,根据需要可以添加制药上可容许的担载体(例如,生理盐水、缓冲液等)。另外,含有该dna的脂质体或膜融合脂质体(仙台病毒(hvj)-脂质体等)可以采取混悬剂、冷冻剂、离心分离浓缩冷冻剂等脂质体制剂的形式。
另外,在本发明中,在谈及“序列号1所示的碱基序列”的情形,除了指序列号1实际上显示的碱基序列之外,还包含与之互补的序列。因此,在谈及“具有序列号1所示碱基序列的多核苷酸”的情形,包含具有序列号1实际上显示的碱基序列的单链多核苷酸、具有与之互补的碱基序列的单链多核苷酸、和由它们组成的双链多核苷酸。在制备编码本发明中所用多肽的多核苷酸时,适宜选择任一碱基序列序列,只要是本领域技术人员就能够容易地进行这种选择。
3.抗原呈递细胞或细胞毒性t细胞
本发明还提供包含上述多肽与mhc分子的复合物的抗原呈递细胞的制作方法,包括使该多肽与来源于受检体的抗原呈递细胞离体(exvivo)或体外(invitro)接触的步骤。
本发明还提供抗原呈递细胞,其特征在于,是通过该方法得到的,并且包含上述多肽与mhc分子的复合物。
使上述多肽与抗原呈递细胞离体(exvivo)或体外(invitro)接触的方法自身可以通过周知的方法来进行。例如,可以通过将抗原呈递细胞在包含上述多肽的培养液中培养来进行。培养基可以使用市售的抗原呈递细胞培养培养基。对培养基中的肽浓度不特别限定,通常是1~100μg/ml左右,优选是5~20μg/ml左右。对培养时的细胞密度不特别限定,通常是103~107个细胞/ml左右,优选是5×104~5×106个细胞/ml左右。优选按照常规方法在37℃、5%co2环境中进行培养。另外,抗原呈递细胞能够在表面上呈递的肽长度通常是最大30个氨基酸残基左右。因此,虽然不特别限定,但在抗原呈递细胞与多肽离体(exvivo)或体外(invitro)接触的情形,可以将该多肽制成约30个氨基酸残基以下的长度。
通过在上述多肽共存下培养抗原呈递细胞,从而将该多肽插入抗原呈递细胞的mhc分子并呈递在抗原呈递细胞表面。因此,使用上述多肽能够制备包含该多肽与mhc分子的复合体的分离的抗原呈递细胞。这样的抗原呈递细胞能够在体内或离体(exvivo)或体外(invitro)对t细胞呈递该多肽,诱导对该多肽特异的细胞毒性t细胞并使其增殖。
本发明还提供对上述多肽特异的细胞毒性t细胞的制作方法,包括使通过权利要求9或10所述的方法得到的抗原呈递细胞与来源于受检体的t细胞离体(exvivo)或体外(invitro)接触,从而激活该t细胞的步骤。
本发明还提供细胞毒性t细胞,其特征在于,是通过该方法得到的,并且对上述多肽特异。
通过使如上述制备的含有上述多肽与mhc分子的复合体的抗原呈递细胞与t细胞离体(exvivo)或体外(invitro)接触,能够诱导对该多肽特异的细胞毒性t细胞并使其增殖。这可以通过在液体培养基中将上述抗原呈递细胞与t细胞共培养来进行。例如,可以通过将抗原呈递细胞悬浮于液体培养基中、将所得悬浮液置于微量平板的孔等容器中、向其添加t细胞并培养来进行。对共培养时抗原呈递细胞与t细胞的混合比率不特别限定,通常细胞数的比率为约1:1~约1:100、优选为约1:5~约1:20左右。另外,对悬浮于液体培养基中的抗原呈递细胞的密度不特别限定,通常为约100个~1000万个细胞/ml、优选为约10000个~100万个细胞/ml左右。共培养优选按照常规方法在37℃、5%co2环境中进行。培养基可以使用市售的抗原呈递细胞/t细胞培养培养基。对培养时间不特别限定,通常为约2天~3周、优选为约4天~2周左右。另外,共培养优选在1种或多种il-2、il-6、il-7和il-12这样的白细胞介素存在下进行。在这种情况下,il-2和il-7的浓度通常是约5~20u/ml,il-6的浓度通常是约500~2000u/ml,il-12的浓度通常是约5~20ng/ml,但不限于这些。上述的共培养也可以补加新鲜的抗原呈递细胞重复一次至几次。例如,可以将共培养后弃去培养上清、添加新鲜的抗原呈递细胞悬液进一步进行共培养这样的操作重复一次至几次。各共培养的条件可以与上述同样。
通过上述共培养,对该多肽特异的细胞毒性t细胞被诱导、增殖。因此,使用上述多肽制备,能够制备与该多肽和mhc分子的复合体选择性结合的分离的t细胞。
如后述实施例中所记载的那样,cspg5基因在乳癌细胞、乳癌组织、肺癌细胞、肺癌组织、肝癌细胞、肝癌组织、脑肿瘤细胞、脑肿瘤组织、卵巢癌细胞、卵巢癌组织、白血病、恶性淋巴瘤、腺癌细胞、腺癌组织、肥大细胞瘤、扁平上皮癌细胞、黑素瘤细胞或成神经细胞瘤细胞中特异性地表达。因此,认为在这些癌肿瘤中,cspg5比正常细胞有意义地多地存在。因此,存在于癌细胞内的cspg5的多肽的一部分被呈递至癌细胞表面上的mhc分子,当将如上述制备的细胞毒性t细胞施与至生物体内时,细胞毒性t细胞能够以其作为标志物而毒害癌细胞。另外,由于呈递cspg5的多肽的一部分的抗原呈递细胞在生物体内也能够诱导对该多肽特异的细胞毒性t细胞并使其增殖,所以通过将该抗原呈递细胞施与至生物体内也能够毒害癌细胞。即,使用上述多肽制备的上述细胞毒性t细胞、上述抗原呈递细胞作为癌的治疗剂和/或预防剂也如本发明的免疫诱导剂同样地有用。
在将上述分离的抗原呈递细胞、分离的t细胞施与至生物体的情形,为了避免在生物体内将这些细胞作为异物攻击的生物体内的免疫应答,优选这些分离的细胞是将自接受治疗的患者采样的抗原呈递细胞或t细胞如上所述用上述(a)、(b)或(c)的多肽制备的。
包含抗原呈递细胞或分离的t细胞作为有效成分的癌的治疗剂和/或预防剂的施与途径优选静脉内施与或动脉内施与这样的非经口施与。另外,施与量根据症状或施与目的等适当地选择,通常是1个~10兆个、优选地100万个~10亿个细胞,并且优选地每几日或几个月施与一次。制剂可以悬浮在例如生理缓冲盐水中而制成的悬浮液等,也可以与其他抗癌剂、细胞因子等联合使用。另外,还可以添加制剂领域周知的1种或2种以上添加剂。
实施例
以下,基于实施例更具体地说明本发明,但本发明的范围不受该实施例限制。
[实施例1]
<通过serex法获得新的癌抗原蛋白>
(1)cdna文库的制作
通过酸胍-酚-氯仿法(acidguanidium-phenol-chloroform法)从犬的精巢提取总rna,使用oligotex-dt30mrnafurificationkit(宝酒造株式会社、日本京都),根据试剂盒所附的方法纯化聚腺苷酸rna。
使用该获得的mrna(5μg)合成cdna噬菌体文库。使用cdnasynthesiskit、zap-cdnasynthesiskit、zap-cdnagigapackiiigoldcloningkit(stratagene社),按照试剂盒所附的方案制作cdna噬菌体文库。制作的cdna噬菌体文库的大小是1×106pfu/ml。
(2)通过血清筛选cdna文库
使用上述制作的cdna噬菌体文库进行免疫筛选。具体地,感染宿主大肠杆菌(xl1-bluemrf’),在φ90×15mm的nzy琼脂糖平板产生2340个克隆,在42℃培养3~4小时以形成溶菌斑(噬菌斑),将该平板以iptg(异丙基-β-d-硫代半乳糖苷)浸透的硝化纤维素膜(hybondcextra:gehealthecarebio-science社)在37℃覆盖4小时以诱导并表达蛋白质,将蛋白质转印到该膜上。此后,将该膜回收,浸泡在含有0.5%脱脂粉乳的tbs(10mmtris-hcl,150mmnacl,ph7.5)中于4℃振摇过夜以抑制非特异性反应。使该滤膜与500倍稀释的患病犬血清在室温反应2~3小时。
作为上述患病犬血清,使用从乳癌的患病犬采样的血清。将这些血清保存在-80℃,在就要使用之气进行前处理。血清的前处理方法根据以下方法进行。即,用未插入外来基因的λzap表达噬菌体感染宿主大肠杆菌(xl1-bluemrf’)后,在nzy平板培养基上于37℃过夜培养。随后,添加含有0.5mnacl的0.2mnahco3ph8.3的缓冲液至该平板,4℃静置15小时后,回收上清作为大肠杆菌/噬菌体提取液。随后,将回收的大肠杆菌/噬菌体提取液流经nhs-柱(gehealthecarebio-science社),并将大肠杆菌/噬菌体来源的蛋白质固定在该柱上。使患病犬血清流经固定有蛋白质的该柱并反应,从血清中除去吸附至大肠杆菌和噬菌体的抗体。将已经流过柱的血清级分用含有0.5%脱脂粉乳的tbs稀释500倍,将其用作免疫筛选材料。
将已经印迹了所述处理血清和上述融合蛋白质的膜用tbs-t(0.05%tween20/tbs)洗涤4次,使得已经用含有0.5%脱脂粉乳的tbs稀释5000倍的作为二次抗体的山羊抗犬igg(山羊抗犬igg-h+ihrp缀合的:bethyllaboratories社)与该膜在室温反应1小时,通过使用nbt/bcip反应液(roche社)的酶显色反应进行检测,从φ90×15mm的nzy琼脂糖平板上取出与显色反应阳性部位相对应的菌落,溶解于500μlsm缓冲液(100mmnacl,10mmmgclso4,50mmtris-hcl,0.01%明胶ph7.5)。以与上文所述相同的方法重复二次、三次筛选直至显色反应阳性菌落单一化,筛选了与血清中igg反应的9110个噬菌体克隆,分离到1个阳性克隆。
(3)分离的抗原基因的序列同一性检索
为了将通过以上方法分离的1个阳性克隆供碱基序列分析,进行自噬菌体载体转换成质粒载体的操作。具体地,将调节至吸光度od600为1.0的宿主大肠杆菌(xl1-bluemrf’)溶液200μl与100μl纯化的噬菌体溶液和1μlexassist辅助噬菌体(stratagene社)混合,37℃反应15分钟后,添加3mllb培养基,37℃进行2.5~3小时的培养,此后立即在70℃水浴中保温20分钟,然后4℃、1000×g离心15分钟,将上清作为噬菌粒溶液回收。随后,将调节至吸光度od600为1.0的噬菌粒宿主大肠杆菌(solr)溶液200μl与10μl纯化的噬菌体溶液混合后,37℃反应15分钟,将50μl所得物接种在含有氨苄青霉素(终浓度:50μg/ml)的lb琼脂培养基,37℃过夜培养。挑取转化的solr的单菌落并且在含有氨苄青霉素(终浓度:50μg/ml)的lb琼脂培养基中于37℃培养后,使用qiagenplasmidminiprepkit(qiagen社)纯化具有目的插入物的质粒dna。
纯化而得的质粒使用序列号17所记载的t3引物和序列号18所记载的t7引物通过引物步移法进行插入物全长序列的分析。通过所述序列分析获得序列号1所记载的基因序列。使用该基因的碱基序列和氨基酸序列进行序列同一性检索程序blast搜索(http://www.ncbi.nlm.nih.gov/blast/)从而进行与已知基因的序列同一性搜索,结果表明获得的基因是cspg5基因。作为犬cspg5的人同源因子的人cspg5,序列同一性为碱基序列87%、氨基酸序列87%,猫cspg5,序列同一性为碱基序列92%、氨基酸序列91%,作为小鼠同源因子的小鼠cspg5,序列同一性为碱基序列84%、氨基酸序列85%。人cspg5的碱基序列示于序列号3、5、7、9或11,氨基酸序列示于序列号4、6、8、10或12,猫cspg5的碱基序列示于序列号13,氨基酸序列示于序列号14,小鼠cspg5的碱基序列示于序列号15,氨基酸序列示于序列号16。
(4)各组织中的表达分析
通过rt-pcr(逆转录pcr)法研究由上述方法获得的基因在犬、人和小鼠的各种人正常组织和各种癌组织和癌细胞株中的表达。逆转录反应如下进行。即,使用trizol试剂(invitrogen社),按照其所附的方案从各组织50~100mg和各细胞株5~10×106个细胞中提取总rna。利用该总rna,通过superscriptfirst-strandsynthesissystemforrt-pcr(invitrogen社)按照所附的方案合成cdna。对于人正常组织(脑、海马、精巢、结肠、胎盘)的cdna,使用genepoolcdna(invitrogen社)、quick-clonecdna(clonetech社)和large-insertcdnalibrary(clonetech社)。使用对所获得基因特异的引物(犬引物在序列号19和20中记载,人引物在序列号21和22中记载,小鼠引物在序列号23和24中记载)如下进行pcr反应。即,按照通过逆转录反应制备的样品0.25μl、上述引物各2μm、0.2mm各dntp、0.65uextaq聚合酶(宝酒造社制)的方式添加各试剂和所附的缓冲液,使总量为25μl,使用thermalcycler(biorad社),将94℃30秒、55℃30秒、72℃1分钟的循环重复30次。出于比较对照的目的,同时使用gapdh特异性引物(犬和人gapdh引物在序列号25和26中记载,小鼠gapdh引物在序列号27和28中记载)。结果如图1所示,犬cspg5基因在健康犬组织中的大部分组织没有观察到表达;另一方面,在犬肿瘤组织中观察到强表达。人和小鼠cspg5基因的表达也与犬cspg5基因同样,在人和小鼠正常组织中几乎不能确认到表达;在癌细胞的乳癌、肺癌、脑肿瘤、卵巢癌、白血病、恶性淋巴瘤的细胞株中检测到表达(图2、图3)。
[实施例2]
<cspg5在生物体内的癌抗原性的分析>
(1)在生物体内表达cspg5的重组载体的制作
基于序列号15的碱基序列,通过以下方法制作在生物体内表达cspg5的重组载体。pcr从实施例1中观察到表达的小鼠成神经细胞瘤细胞株1(n2a:购自atcc)制备。以cdna1μl、包含hindiii和xbai限制性酶切序列的2种引物(序列号19和20中记载)各0.4μm、0.2mmdntp、1.25uprimestarhs聚合酶(宝酒造株式会社制)的方式添加各试剂和所附缓冲液使总量为50μl,使用thermalcycler(biorad社),将98℃10秒、55℃15秒、72℃4分钟的循环重复进行30次。另外,上述2种引物是扩增编码序列号15的氨基酸序列全长的区域的引物。pcr后,将扩增的dna用1%琼脂糖凝胶进行电泳,使用qiaquickgelextractionkit(qiagen社)纯化了约1000bp的dna片段。
将纯化的dna片段连接到克隆载体pcr-blunt(invitrogen社)中。将所得物转化到大肠杆菌后,回收质粒,通过测序确认扩增的基因片段与目的序列一致。用hindiii和xbai限制性酶处理与目的序列一致的质粒,用qiaquickgelextractionkit纯化后,将目的基因序列插入用hindiii、xbai限制性酶处理的哺乳类表达载体pcdna3.1(invitrogen社)中。通过使用这种载体在哺乳类的细胞内产生cspg5蛋白。
向100μg上述制备的质粒dna添加50μg金粒子(biorad社)、亚精胺100μl(sigma社)、1mcacl2100μl(sigma社),涡旋搅拌,室温静置10分钟(下文称作“金-dna粒子”)。3000转/分钟离心1分钟后,弃去上清,用100%乙醇(wako社)洗涤3次。添加6ml100%乙醇至金-dna粒子,通过涡旋彻底搅拌后,使金-dna粒子流入tefzeltubing(biorad社),使其沉淀在壁面。将附着有金-dna粒子的tefzeltubing的乙醇风干,切成适用于基因枪的长度。
(2)利用dna疫苗法的cspg5的抗肿瘤效果
对10只的a/j小鼠(7周龄,雄性,购自日本slc社),将上述制备的管固定在基因枪上,使用纯氦气以400psi压力将dna疫苗每7日总共3次经皮施与至剃毛小鼠的腹腔(使得质粒dna接种量是2μg/只)后,移植小鼠成神经细胞瘤细胞株n2a细胞评价抗肿瘤效果(预防模型)。另外,作为对照,对于各模型的各10只小鼠施与没有插入cspg5基因的质粒dna。
抗肿瘤效果根据肿瘤的大小(长径×短径2/2)和生存小鼠的比例进行评价。本研究的结果是,在预防模型中,21天后,对照组和scd1质粒施与组分别变为1866mm3、459mm3,在cspg5质粒施与组中观察到肿瘤显著退缩。另外,观察生存经过的结果是,在预防模型中,对照组施与后54天全例死亡,与此相对,cspg5质粒施与组60%的小鼠生存。由以上结果确认,cspg5质粒施与组与对照组相比确认了有意义的抗肿瘤效果。
产业可利用性
由于本发明提供了包含对各种癌发挥抗肿瘤活性的多肽的免疫诱导剂,因此对癌的治疗和/或预防是有用的。
序列表自由文本
序列号17:t3引物
序列号18:t7引物
序列号19:犬rt引物正向
序列号20:犬rt引物反向
序列号21:人rt引物正向
序列号22:人rt引物反向
序列号23:小鼠rt引物正向
序列号24:小鼠rt引物反向
序列号25和26:gapdh引物
序列号27和28:gapdh引物
序列号29:mus-fullcspg5引物正向
序列号30:mus-fullcspg5引物反向
将本说明书中引用的所有出版物、专利和专利申请直接作为参考引入本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!