相关申请的交叉引用
本专利申请要求于2015年3月27日提交的美国临时专利申请号62/139,235,和2015年5月1日提交的62/115,920的优先权,其通过引用并入。
背景技术:
辅酶nad+、nadh和nadp+、nadph的细胞氧化还原反应是众所周知的(pollak,n等人,biochem.j.,402:205–218(2007))。已知nad+在凋亡(gendron,m.c等人,biochem.j.,353:357(2001))、钙动员(guse,a.h等人,j.biol.chem.,280:15952(2005))、细胞增殖(bruzzone,s等人,biochem.j.,375:395(2003))、老化(blasco,m.a.,nat.rev.genet.,6:611(2005))、基因表达(girolamo,m.d等人,j.biol.chem.,282:16441(2007);sauve,a.a.;schramm,v.l.,biochemistry,42:9249(2003);michan,s等人,biochem.j.,404:1(2007);nakano,t等人,proc.natl.acad.sci.u.s.a.,103:13652(2006);culver,g.m等人,j.biol.chem.,272:13203(1997);berger,f等人,proc.natl.acad.sci.u.s.a.,104:3765(2007))、免疫系统调节(song,e.k等人,biochem.biophys.res.commun.,367:156(2008);seman,m等人,immunity,19:571(2003))、能量代谢和代谢调节中发挥重要作用。单和多(adp-核糖)聚合酶使用nad+作为蛋白质共价修饰的底物(ziegler,m.,eur.j.biochem.,267:1550(2000);guarente,l等人,cell,120:473(2005);marmorstein,r.,biochem.soc.trans.,32:904(2004);magni,g等人,cell.mol.lifesci.,61:19(2004);araki,t等人,science,305:1010(2004))。nad+可以酶促合成(suhadolnik,r.j等人,biol.chem.,252:4125(1977))和化学合成(jeck,r等人编,academic:newyork,66:62(1979))自维生素b3(烟酸(na)、烟酰胺(nam)、烟酰胺核苷(nr)、烟酰胺单核苷酸(nmn))的各种前体和色氨酸。nad+利用反应释放烟酰胺,循环利用烟酰胺,以使用烟酰胺磷酸核糖转移酶由烟酰胺和5-磷酸核糖焦磷酸形成nmn。合成的nmn与atp反应,并通过烟酰胺单核苷酸腺苷酰转移酶(nmnat)转化为nad+。
对于可以施用以增加生理nad+的前体的兴趣日益增加,这推动了对前体(如nr和nmn)有效、实用的合成的开发。已经开发了nr的高效化学合成(yang,t等人,j.med.chem.,50:6458(2007))。文献表明,除酶促反应外,几乎没有其他的用于合成烟酰胺单核苷酸和衍生物的化学方法(burgos,e.s等人,biochemistry,47:11086(2008);rozenberg,a等人,j.org.chem.,73:9314(2008))。现有的合成策略涉及复杂的中间体,且nmn的分离难以获得良好的产率。此外,酶促反应通常限于小规模化学合成并且价格昂贵,因此不太能够立即地放大到克级或千克级的规模。
因此,对于改进的制备烟酰胺单核苷酸的方法存在未满足的需求。
发明概述
本发明提供了用于制备具有式(i)的烟酰胺单核苷酸:
或其盐的方法,其中所述方法包括以下步骤:
(i)在酸催化剂的存在下,在溶剂中使具有式(ii)的烟酰胺核糖:
与缩酮化试剂r1r2c(or3)(or4)或r1r2c=o反应,
其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,并且其中r3和r4独立地为c1-c6烷基,以形成如式(iii)所示的化合物:
(ii)分离如式(iii)所示的所述化合物,
(iii)使如式(iii)所示的所述化合物与pocl3和po(or5)3的混合物反应,其中r5是c1-c6烷基,然后用水处理以形成如式(iv)所示的化合物:
(iv)分离如式(iv)所示的所述化合物,
(v)使如式(iv)所示的所述化合物与酸催化剂在溶剂或溶剂混合物中反应以提供烟酰胺单核苷酸,以及
(vi)分离烟酰胺单核苷酸。
本发明还提供了用于制备如式(iii)所示的化合物的方法:
其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,其中所述方法包括在酸催化剂的存在下,在溶剂中使如式(ii)所示的烟酰胺核糖:
与缩酮化试剂r1r2c(or3)(or4)或r1r2c=o反应,
其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,并且其中r3和r4独立地为c1-c6烷基,以形成如式(iii)所示的所述化合物的步骤。
本发明另外提供了用于制备如式(iv)所示的化合物:
或其盐的方法,其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,
其中所述方法包括使如式(iii)所示的化合物:
与pocl3和po(or5)3的混合物反应,其中r5是c1-c6烷基,然后用水处理以形成如式(iv)所示的化合物的步骤。
本发明另外提供了用于制备具有式(i)的烟酰胺单核苷酸:
或其盐的方法,其中所述方法包括使如式(iv)所示的化合物:
其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,与酸催化剂在溶剂或溶剂的混合物中反应以提供烟酰胺单核苷酸的步骤。
附图简述
图1显示了烟酰胺单核苷酸氯化物的滴定曲线。
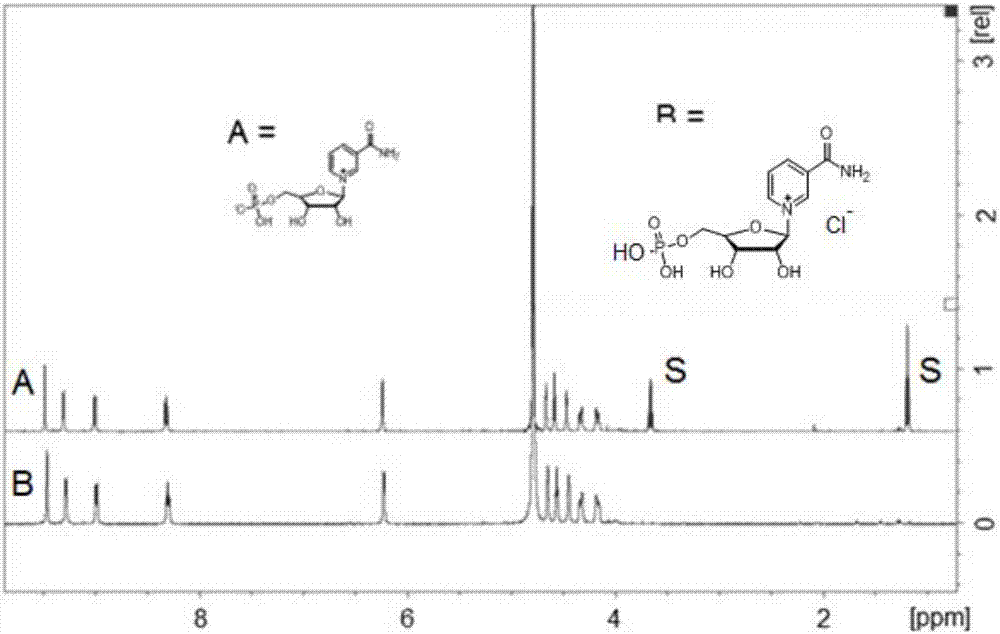
图2显示了两性离子4和氯盐7在d2o中的重叠500mhz1hnmr(500mhz,d2o)光谱。两性离子标记为“s”的峰归因于乙醇杂质。
图3显示了两性离子4的31pnmr(500mhz,d2o)光谱。
图4显示了氯盐7的31pnmr(500mhz,d2o)光谱。
图5显示了两性离子4和氯盐7的重叠31pnmr光谱。
发明详述
本发明提供了用于制备具有式(i)的烟酰胺单核苷酸:
或其盐的方法,其中所述方法包括以下步骤:
(i)在酸催化剂的存在下,在溶剂中使具有式(ii)的烟酰胺核糖:
与缩酮化试剂r1r2c(or3)(or4)或r1r2c=o反应,
其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,并且其中r3和r4独立地为c1-c6烷基,以形成如式(iii)所示的化合物:
(ii)分离如式(iii)所示的所述化合物,
(iii)使如式(iii)所示的所述化合物与pocl3和po(or5)3的混合物反应,其中r5是c1-c6烷基,然后用水处理以形成如式(iv)所示的化合物:
(iv)分离如式(iv)所示的所述化合物,
(v)使如式(iv)所示的所述化合物与酸催化剂在溶剂或溶剂混合物中反应以提供烟酰胺单核苷酸,以及
(vi)分离烟酰胺单核苷酸。
在一个实施方式中,如方案1中所示合成烟酰胺单核苷酸
方案1
在酸催化剂的存在下,在溶剂中使烟酰胺核糖1(其中x-是阴离子)与缩酮化试剂r1r2c(or3)(or4)或r1r2c=o反应,其中r1和r2独立地为c1-c6烷基,或与它们所连接的碳原子一起形成5-7元碳环或杂环,并且其中r3和r4独立地为c1-c6烷基,以形成化合物5。在一个优选实施方式中,缩酮化试剂是r1r2c(or3)(or4),更优选地是2,2-二甲氧基丙烷。
应当理解,当将化合物显示为不具有阴离子的阳离子时,阳离子上的正电荷可以通过任何合适的阴离子或具有负电荷的阴离子组分抵消。阴离子可以是任何合适的有机、无机或聚合阴离子,但不限于此。在一个实施方式中,阴离子是三氟甲磺酸盐。
酸催化剂可以是任何合适的酸催化剂,例如酸催化剂可以是无机酸催化剂,如硫酸、盐酸、磷酸等。酸催化剂可以是有机酸催化剂,例如对甲苯磺酸、甲磺酸、三氟甲磺酸等。在一个优选的实施方式中,酸催化剂是硫酸,更优选地是浓硫酸。
溶剂可以是任何合适的溶剂,并且可以是例如乙腈、二氯甲烷、丙酮、二甲基甲酰胺、二甲基亚砜等。优选地,溶剂为乙腈。
缩酮化可以在任何温度下进行。例如,缩酮化可以在约0℃至约50℃下进行。优选地,缩酮化的进行在约0℃下开始,然后升温至室温。
可以可选地通过用碱(如碳酸钠)淬灭反应混合物,然后过滤并接着蒸发溶剂而分离化合物5。在其它实施方式中,可以在水和有机溶剂(如二氯甲烷、乙酸乙酯等)之间分离反应混合物。酸催化剂可以在分离前中和,或者可以在碱的水溶液中淬灭,然后用溶剂萃取。化合物5可以通过硅胶色谱或通过结晶分离。
可以使用任何合适的条件将化合物5磷酸化,例如,可以在磷酰氯和po(or5)3的混合物中将化合物5磷酸化,其中r5是c1-c6烷基。优选地,在磷酰氯和磷酸三乙酯的混合物中将化合物5磷酸化以提供化合物6。磷酸化可以在任何合适的温度下进行。例如,磷酸化可以在约0℃至约50℃下进行,优选在0℃下进行。
可以任选地通过用碱(如碳酸钠)淬灭反应混合物,然后用溶剂如乙酸乙酯萃取过量的未反应的三乙基磷酸酯,然后通过蒸发从水层中回收化合物6而分离化合物6。化合物6可以通过硅胶色谱或通过结晶分离。
烟酰胺单核苷酸4是通过经由酸催化的脱缩酮使化合物6脱保护而获得的。脱保护可以在水性溶剂混合物中进行,例如在二氯甲烷和水的混合物中进行。脱保护可以在非水性溶剂中进行。例如,脱保护可以在羟基溶剂(如甲醇或乙醇)中进行,优选在甲醇中进行。酸催化剂可以是与化合物5的制备有关的如本文所述的任何合适的酸催化剂,优选三氟甲磺酸或浓盐酸。
可以使用任何合适的分离程序来分离烟酰胺单核苷酸。例如,可以将反应混合物至少部分蒸发以除去挥发性有机溶剂,并且可以用水处理残余物,然后用碱(如碳酸钠)中和至ph5-6。可以以任何合适的方式纯化粗产物以提供纯化的烟酰胺单核苷酸。例如,可以使用c18反相色谱柱纯化粗产物,用水作为洗脱液,以提供纯化的烟酰胺单核苷酸。
如式(i)所示的烟酰胺单核苷酸和如式(iv)所示的化合物可以是两性离子或其任何合适的盐的形式。例如,如式(i)所示的烟酰胺单核苷酸和如式(iv)所示的化合物可以是质子化盐或其一元盐的形式。本文所用的术语质子化盐是指如式(i)和(iv)所示的化合物,其中磷酸酯(-o-p(=o)(oh)2基团未被离子化,本文所用的术语一元盐是指如式(i)和(iv)所示的化合物,其中磷酸酯(-o-p(=o)(o-)2基团完全离子化。烟酰胺单核苷酸和如式(iv)所示的化合物的两性离子的说明性实施方式为:
如式(i)所示的烟酰胺单核苷酸和如式(iv)所示的化合物的质子化盐的实例包括:
其中x-可以是任何合适的一价阴离子。
如式(i)所示的烟酰胺单核苷酸和如式(iv)所示的化合物的一元盐的实例包括:
其中m+可以是任何合适的一价阳离子。在其它实施方式中,一元盐可以与任何合适的二价阳离子m2+缔合,对于烟酰胺单核苷酸如下所示:
可以通过使这些化合物的两性离子形式与理论配比的适当的碱或酸在水或有机溶剂中,或两者的混合物中反应来制备盐。通常,优选如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈的非水性介质。适用盐的列表见于remington’spharmaceuticalsciences,第18版,mack出版社,easton,pa,1990,1445页和journalofpharmaceuticalscience,66,2-19(1977)。
合适的碱包括无机碱(如碱金属和碱土金属碱),例如含有金属阳离子(如钠、钾、镁、钙等)的碱。合适的碱的非限制性实例包括氢氧化钠、氢氧化钾、碳酸钠和碳酸钾。合适的酸包括无机酸(如盐酸、氢溴酸、氢碘酸、硫酸、磷酸等)以及有机酸(如对甲苯磺酸、甲磺酸、苯磺酸、草酸、对溴苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸、乙酸、马来酸、酒石酸、脂肪酸、长链脂肪酸等)。在实施方式中,质子化盐和一元盐包括药学上可接受的盐。优选的一元盐包括钠盐和钾盐。优选的质子化盐包括盐酸盐和氢溴酸盐。
在实施方式中,质子化盐在化合物6转化为化合物4的过程中产生。质子化盐7和两性离子4可以如方案2中所示产生:
方案2
试剂和条件:(a)hcl/meoh,ph=1-2;(b)na2co3水溶液,ph=6-7
以下实施例进一步说明本发明,但当然不应将其视为以任何方式限制本发明的范围。
实施例1
本实施例说明了根据本发明的实施方式合成烟酰胺单核苷酸核苷的方法。
步骤1:制备3-氨基甲酰基-1-((3ar,4r,6r,6ar)-6-(羟甲基)-2,2-二甲基四氢呋喃并[3,4-d][1,3]二氧杂环戊-4-基)吡啶-1-鎓)(2)。
在直火干燥的烧瓶中,在0℃和氩气氛下将浓硫酸(22μl,0.40mmol)缓慢加入到无水乙腈(2.0ml)中。5分钟后,在相同温度下将2,2-二甲氧基丙烷(0.6ml,过量)加入到经搅拌的乙腈溶液中。在0℃下将烟酰胺核糖固体(1)(250mg,0.61mmol)加入到反应混合物中,并立即将反应经10分钟升温至25℃。通过薄层色谱(tlc)和高效液相色谱(hplc)监测反应进程。hplc显示95%的起始原料在10分钟后消耗。在冰浴中将反应混合物再次冷却至0℃,并通过加入粉末状的固体na2co3(50mg,0.47mmol)将其淬灭并搅拌5分钟。缓慢加入0.1ml水以改善酸的中和。过滤残余固体,并在高真空下蒸发滤液(乙腈)以获得粗产物。将粗产物溶于最小体积的dcm中,并通过使用dcm/meoh(9:1)的硅胶柱(60a°)将其纯化以获得白色固体状的2。产率96%。
1hnmr(cd3od,500mhz):δ9.56(s,1h,h-2),9.31(d,1h,j=6.3hz,h-6),9.02(d,1h,j=7.8hz,h-4),8.25(t,1h,j=7.6hz,h-5),6.41(s,1h,h-4’),5.22-5.19(m,1h,h-1’),4.99(d,1h,j=5.7hz,h-2’),3.99-3.94(dd,1h,j=1.8和12.3,h-3’),3.82-3.77(dd,1h,j=2.3和11.6hz,h-5’a),3.70-3.68(m,1h,h-5’b),1.66(s,3h,-ch3),1.45(s,3h,-ch3)。13cnmr(cd3od,125mhz):142.7,142.4,140.5,133.8,127.4,114.0,103.9,90.4,87.7,82.3,61.3,34.0,25.9,23.9。
步骤2:制备3-氨基甲酰基-1-((3ar,4r,6r,6ar)-2,2-二甲基-6-((膦酰氧基)甲基)四氢呋喃并[3,4-d][1,3]二氧杂环戊-4-基)吡啶-1-鎓)(3)。
在直火干燥的烧瓶中,在0℃和氩气氛下将化合物2(880mg,2mmol)加入到8ml干燥的磷酸三乙酯中。10分钟后,向经搅拌和冷却的磷酸三乙酯溶液中分批(176μl+176μl+118μl)缓慢加入470μl磷酰氯(2.5当量,5mmol)。在0℃下搅拌混合物48小时。通过hplc监测反应进程,其显示75%的起始原料在48小时后消耗,同时伴随产物3的增加,其以较短的保留时间洗脱。将反应混合物冷却至0℃,并用3份连续的1ml冷的饱和na2co3溶液将其淬灭,直到酸被中和并且停止鼓泡。通过用乙酸乙酯(3×10ml)萃取除去磷酸三乙酯。然后用水(3×5ml)萃取合并的乙酸乙酯层以除去粗产物。在高真空下干燥合并的水层和含产物3的初始水层以获得粗产物。根据需要将粗产物溶于最小体积的9:1dcm:甲醇中以使其溶解,并通过使用dcm/meoh(6:4)的硅胶柱色谱纯化粗产物以提供白色固体状的(3)。产率80%。
1hnmr(d2o,500mhz):δ9.31(s,1h,h-2),9.11(d,1h,j=6.4hz,h-6),8.86(d,1h,j=8.2hz,h-4),8.22-8.18(m,1h,h-5),6.37(d,1h,j=2.5hz,h-4’),5.30(dd,1h,j=2.6和5.8hz,h-1’),5.07(d,1h,j=5.7hz,h-2’),4.99-4.97(m,1h,h-3’),4.18(t,1h,j=2.1hz,h-5’a),4.16(t,1h,j=2.1hz,h-5’b),1.60(s,3h,-ch3),1.41(s,3h,-ch3)。13cnmr(d2o,125mhz):150.8,145.7,139.5,128.2,103.2,88.2,86.8,82.4,65.2,30.0,25.9,24.2。
步骤3;制备3-氨基甲酰基-1-((2r,5r)-3,4-二羟基-5-((膦酰氧基)甲基)四氢呋喃-2-基)吡啶-1-鎓)(4)。
(a)在二氯甲烷/水中脱保护:
在0℃将tfa(0.6ml,7.8mmol)缓慢加入到化合物3(1000mg,2.67mmol)溶于30ml二氯甲烷和水(1:1)的溶液中。剧烈搅拌反应混合物使其升温至室温。16小时后(通过hplc监测反应进程,其显示95%的起始原料在16小时后消耗),蒸发反应混合物。用极少量na2co3将残余的水中和至ph6,并蒸发水层以获得粗产物。将粗产物溶于最少的水中,并通过使用水的c18柱纯化以提供白色固体状的nmn(4)。产率90%。
1hnmr(d2o,500mhz):δ9.39(s,1h,h-2),9.21(d,1h,j=6.2hz,h-6),8.90(d,1h,j=8.1hz,h-4),8.22(t,1h,j=6.9hz,h-5),6.14(d,1h,j=5.6hz,h-4’),4.56(t,1h,j=2.4hz,h-1’),4.48(t,1h,j=5.3hz,h-2’),4.38-4.35(m,1h,h-3’),4.25-4.20(m,1h,h-5’a);4.01-4.05(m,1h,h-5’b)。13cnmr(d2o,125mhz):165.9,146.0,142.5,139.9,134.0,128.5,100.0,87.5,77.8,75.1,64.2。
(b)在甲醇hcl中脱保护:
在直火干燥的烧瓶中,将浓盐酸(672μl,8.06mmol)在氩气氛下缓慢加入到化合物3(1000mg,2.67mmol)溶于30ml甲醇的溶液中。使反应混合物升温至室温。40小时后,hplc显示没有起始原料残留。然后将反应混合物蒸发至干,并加入5ml水以溶解固体。加入固体na2co3以将ph调节至5。在c18柱上使用水作为洗脱剂纯化nmn以提供白色固体状的nmn(4)。产率67%。
1hnmr(d2o,500mhz):δ9.39(s,1h,h-2),9.21(d,1h,j=6.2hz,h-6),8.90(d,1h,j=8.1hz,h-4),8.22(t,1h,j=6.9hz,h-5),6.14(d,1h,j=5.6hz,h-4’),4.56(t,1h,j=2.4hz,h-1’),4.48(t,1h,j=5.3hz,h-2’),4.38-4.35(m,1h,h-3’),4.25-4.20(m,1h,h-5’a);4.01-4.05(m,1h,h-5’b)。13cnmr(d2o,125mhz):165.9,146.0,142.5,139.9,134.0,128.5,100.0,87.5,77.8,75.1,64.2。
实施例2
本实施例说明了用氢氧化钠滴定烟酰胺单核苷酸氯盐。
将烟酰胺单核苷酸氯盐(110mg,0.29mmol)溶于2ml水(约150mm浓度)中。向所得溶液中加入200μl150mmnaoh溶液(0.1当量)并通过ph计测量ph。继续加入200μl150mmnaoh溶液并测量和标绘ph。通过该滴定测定2个pka值,即将[nmnh]cl转化为中性两性离子形式的第一pka1=2.1,然后是形成单阴离子[nmn]-的pka2=6.7(方案3)。两个质子的滴定均表明了nmn的阳离子[nmnh]cl形式的成功稳定化和表征。
方案3
滴定曲线如图1中所示。
实施例3
本实施例显示了两性离子4和氯盐7的1hnmr和31pnmr光谱。
图2显示了两性离子4和氯盐7在d2o中的重叠500mhz1hnmr(500mhz,d2o)光谱。
图3显示了两性离子4的31pnmr(500mhz,d2o)光谱。
图4显示了氯盐7的31pnmr(500mhz,d2o)光谱。
图5显示了两性离子4和氯盐7的重叠31pnmr光谱。
本文引用的所有参考文献(包括出版物、专利申请和专利)通过引用并入本文,其程度如同单独、具体地指出各篇参考文献通过引用并入本文,并完整列于在本文。
在描述本发明的上下文中(特别是在随后权利要求的上下文中),使用术语“一(a)”和“一个(an)”和“所述(the)”和“至少一个”以及类似指示物应被解释为涵盖单数和复数,除非本文另有说明或明显与上下文相矛盾。使用术语“至少一个”,后跟一列一个或多个项目(例如“a和b中的至少一个”)应被解释为表示从列出的项目(a或b)中选择的一个项目,或者两个或多个所列项目(a和b)的任意组合,除非本文另有说明或明显与上下文相矛盾。术语“包含”、“具有”、“包括”和“含有”将被解释为开放式术语(即表示“包括但不限于”),除非另有说明。除非本文另有说明,否则本文中记载的数值范围仅旨在用作单独指代落在该范围内的每个单独值的速记方法,并且每个单独值并入本说明书中,如同其单独记载于本文。本文描述的所有方法都可以以任何合适的顺序进行,除非本文另有说明或另外明显与上下文相矛盾。本文提供的任何和所有实例或示例性语言(例如,“例如”)的使用仅旨在更好地说明本发明,并且不对本发明的范围构成限制,除非另有要求。说明书中的任何语言不应被解释为指示任何未被要求保护的要素对于本发明的实践是必需的。
本文描述了本发明的优选实施方式,包括发明人已知的用于实施本发明的最佳模式。在阅读之前描述之后,优选实施方式的变体对于本领域普通技术人员来说将变得显而易见。发明人预期技术人员适当地使用此类变化,并且发明人希望本发明可以以不同于本文具体描述的方式实施。因此,本发明包括如所附权利要求中记载的主体的适用法律所允许的所有修改和等同物。此外,除非本文另有说明或另外明显与上下文相矛盾,否则本发明涵盖上述要素的任何组合所有可能的变化。