片状小片、包含该小片的生发促进用片、以及包含该小片的美白和皱纹改善剂的制作方法
本发明涉及片状小片、包含该小片的生发促进用片、以及美白和皱纹改善剂。更详细而言,涉及用于使特定的生理活性物质局部吸收、发挥上述生理活性物质的作用的片状小片、和包含该小片的生发促进用片、以及美白和皱纹改善剂。
背景技术:
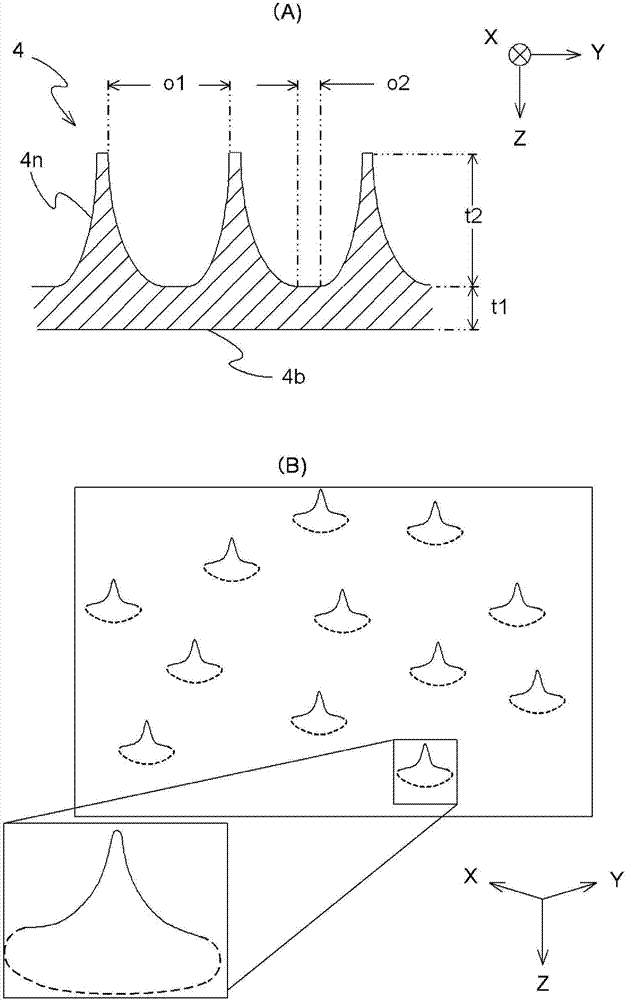
:由于年龄增长、疾病等原因,出现白发增多、头发变细、头发脱落、整体根数减少的情况。此外,由于以斑秃为代表的各种疾病,有时也会部分失去毛发。另外,不仅是头发,斑和皱纹等肌肤老化加重是众所周知的。这种肌肤老化不仅是因年龄增长产生的,也会因日晒等其它原因而产生。特别是在毛发脱落后未长出粗的毛发的情况下,毛发丧失或变细,可看到该部分的头皮。特别是在毛发颜色深的情况下,头发变细或脱落容易引人注目。这种情况下,促进生出与毛发脱落前相同粗细的毛发是非常困难的,开始使用假发。假发可大致分为:以覆盖整个头部的方式戴到头上的类型的可反复使用的假发;以及具备植有植发材料的基片和用于将该基片粘贴于头皮上的粘合层的即抛型假发(下文中有时称为“部分假发”)(参见专利文献1)。对于上述即抛型假发来说,使用时外观上不产生不自然的感觉很重要,为此,要求与头皮具有良好的适合性。目前,提出了由极薄片构成的基片、植于上述基片上的植发材料和设置于上述基片的背面的粘合层所构成的假发(参见专利文献2。下文中称为“现有技术1”)。另外,提出了一种重制性即抛型假发,其通过使粘合层的粘合力比较低,并且将可再利用的部分从即抛的部分分离,能够耐受比较长时间的使用(专利文献3、下文中称为“现有技术2”)。此外,市场上还销售有淡化斑的美白化妆品、改善皱纹的除皱化妆品等包含各种成分的化妆品(参见非专利文献1。下文中称为“现有技术3”)。现有技术文献专利文献专利文献1:日本专利第3484565号公报专利文献2:日本专利第4009910号公报专利文献3:日本特开2012-92464号公报非专利文献非专利文献1:http://www.sk-ii.jp/ja/whats-new/skin-solutions/four-steps-to-reducing-spots.aspx?utm_source=yahoo&utm_medium=cpc&utm_content=pc_cpc&utm_campaign=skincare技术实现要素:发明所要解决的课题现有技术1和2从通过使用假发能够使现在变稀的头发状态看起来如变稀前的状态这一点来看为优异的技术。但是,即便使用现有技术1和2中提出的即抛型假发,头发也不会恢复到变稀前的状态,因此存在必须配合头发状态的变化而一直持续使用的问题。需要说明的是,现有技术2中虽然消除了现有技术1希望改善的若干事项,但使用者难以自行将假发佩戴至头部这一点依然没有改变。即,由于假发的基片为30μm左右的极薄的片,因此在佩戴时基片会不规则地变形,使用者实质上无法自行将假发佩戴至头部。因此,使用者必须到购买假发的商店请专家来为其佩戴。但是,由于在佩戴假发时会在众人前曝光,令人感到害羞,因此使用者具有不愿来商店的倾向。在秃头者、特别是年轻秃头者的情况下,使用者尽管有希望佩戴假发的愿望,但耻于来店佩戴,结果大多会放弃佩戴假发。其结果,众所周知的是应当成为使用者的人的行动变得消极、或者性格变得不开朗。另外,在原本头发颜色深的情况下,头发变稀容易引人注目,会因头发状态而被判断年龄较高,因此为了给人年轻的感觉,对于增加头发具有强烈的社会需求。此外,若能增加头发则也无需使用假发,能够节约佩戴假发所需的时间和成本,因此从这方面出发的需求也很大。此外,近年来,显示出美白效果的化妆品受到关注,在市场上销售有许多种类的化妆品(现有技术3),但是会产生白斑等副作用,成为很大的问题。考虑到若抑制皮肤细胞内的黑色素合成则显现出美白效果,在化妆品中混配了酪氨酸酶的活性抑制剂等。但是,美白、除皱用的化妆品存在涂布后产生刺痛等不适感、仅能短时间维持效果的问题。因此,对于美白、除皱用的化妆品的社会需求正在增大。用于解决课题的手段本申请发明是基于上述情况而完成的,其目的在于提供一种通过使用能够使变稀的头发状态恢复到变稀前的状态的生发促进用片。即,本申请发明的第1方式为一种片状小片,其特征在于,具备:由弹性材料构成的基片;设置于上述基片的一侧的表面上的储层,该储层含有生理活性物质,且形成有向与上述基片侧相反的方向延伸的2个以上的微针;以网状形成于上述储层的与上述基片侧相反一侧的表面上的粘接层;和以能够剥离的方式形成于与形成有上述储层的面相反一侧的上述基片的面上的粘接辅助层,上述微针的尖端部从上述粘接层突出。此处,上述弹性材料优选由具有透湿性的厚度小于0.1mm的半透明合成树脂构成。另外,上述储层优选包含水溶性高分子与单糖类或二糖类的混合物、以及上述生理活性物质的混合物。另外,上述水溶性高分子优选为选自由胶原蛋白、明胶、透明质酸、糊精、右旋糖酐、蛋白聚糖、硫酸软骨素钠、羧甲基纤维素、羟乙基纤维素透明质酸和它们的生理学上允许的盐组成的组中的至少任一种。上述单糖类或二糖类优选为选自由葡萄糖、果糖、蔗糖、乳糖、海藻糖和它们中的2种以上的混合物组成的组中的任一种。另外,上述生理活性物质优选包含于牙髓干细胞的培养上清中,上述牙髓干细胞的培养上清优选为冷冻干燥粉末。并且,上述牙髓干细胞优选为导入有(i)选自由bmi-1、hpv-e6和hpv-e7组成的组中的至少1种以上的基因与(ii)htert或ptert中的任一种基因的组合的永生化细胞。此外,上述牙髓干细胞优选来源于人或猪。上述粘接层优选由医疗用硅系粘接剂形成。此外,粘接辅助层优选由海绵状部件构成,上述海绵状部件优选由选自由氨基甲酸酯、硅、木浆纸、苯乙烯、乙烯基树脂和布组成的组中的原材料构成。另外,优选进一步具备以能够剥离的方式配置于与形成有上述储层的面相反一侧的上述粘接层的面上的、具有框形形状的保持部件,上述保持部件具有比从上述粘接层突出的微针的尖端部的高度更长的厚度。此处,优选使上述保持部件为塑料制或金属制片状部件。作为该金属制片状部件,可以采用铝制部件。本发明的另一方式为一种生发促进用片,其特征在于,在上述生发促进用片中具备本发明的片状小片。此处,可以进一步具备以规定的密度植入于上述片状小片所具备的基片上的人造毛发。此处,上述人造毛发优选由紫外线固化性的树脂固定于上述基片上。另外,上述基片的底面积优选为与指尖的表面积同等的面积。此外,上述人造毛发优选贯通上述粘接辅助层而植入于上述基片上。此处,上述人造毛发优选贯通上述基片而在上述基片的上述储层侧固定于上述基片上。另外,本发明的生发促进用片中优选进一步具备框形形状的保持部件,其对上述片状小片进行保持,具有比从上述片状小片中的粘接层突出的微针的尖端部的高度更长的厚度。作为这样的保持部件,优选为塑料制或金属制片状部件。此处,上述金属制片状部件优选为铝制。本发明的又一方式为一种包含储层含有冷冻干燥培养上清的上述片状小片的美白和皱纹改善剂。优选进一步具备用于保持片状小片的保持部件,上述保持部件优选为塑料制或金属制片状部件。此处,上述金属制片状部件优选为铝制。发明的效果根据本发明,能够提供一种片状小片,其能够加工成各种尺寸,因此能够以适当的尺寸粘贴于头部、面部等各种部位,能够高效地导入生理活性物质。另外,根据本发明,能够提供一种生发促进用片,其通过粘贴于头发基本消失或变稀的部分,能够促进该部分的生发。此外,根据本发明,能够提供一种美白和皱纹改善剂,其通过粘贴于具有斑的部分或皱纹深的部分,发挥出淡化斑或皱纹的美白效果和皱纹的改善效果。附图说明图1是示出本发明的片状小片的结构的示意图。图2是示出微针的形状的示意图。(a)为截面图,(b)为立体图。图3是说明图1的片状小片的制作工序的图(之1)。图4是说明图1的片状小片的制作工序的图(之2)。图5是示出产生本申请发明的生发促进用片的制作中使用的培养上清的永生化干细胞的个体倍增次数的经时变化的曲线图。图6是对上述永生化干细胞中的stro-1的表达是否随着个体倍增次数(pd)的增加而减少进行确认时的图。图7是示出对上述永生化干细胞的骨形成能力是否随着个体倍增次数(pd)的增加而减少进行确认时的苏木素-伊红染色的结果的图。图8是示出上述永生化干细胞的个体倍增数与上述培养上清的新生骨的骨量产生能力的变化的图。图9是示出还具有即抛型假发的功能的本发明的生发促进用片的结构的示意图。图10是图9的生发促进用片的截面图。图11是说明图9的片状小片的制作工序的图(之1)。图12是说明图9的片状小片的制作工序的图(之2)。图13是示出将人造毛发植于基片上的情况的图(a)、以及(a)中的b部的放大图(b)。是用于说明人造毛发的植入的图。图14是说明图9的片状小片的制作工序的图(之3)。图15是将本发明的生发促进用片粘贴至头部时的照片。图16是分别示出粘贴本发明的生发促进用片前的头皮的状态(a)、佩戴3天后的头皮的状态(b)、佩戴7天后的头皮的生发状态(c)的放大照片。图17是示出将本发明的生发促进用片粘贴至头部前后的变化的照片。(a)表示粘贴至头顶部时的变化,(b)表示粘贴至耳后的斑秃部分时的变化。图18是示出本发明的美白和皱纹改善剂的形状的变化的示意图。图中,(a)为表示除斑用的美白和皱纹改善剂的示意图,(b)为表示眼周皱纹改善用的美白和皱纹改善剂的示意图,(c)为表示法令纹改善用的美白和皱纹改善剂的示意图,(d)为表示额头皱纹改善用的美白和皱纹改善剂的示意图。具体实施方式下面进一步详细说明本申请发明。需要说明的是,在以下的说明或附图中,对于相同或同等的要素附以相同的符号,并省略重复的说明。如图1所示,本申请发明的片状小片1具备:(a)由弹性材料构成的基片2;(b)储层4,上述储层4含有生理活性物质,且形成有向与基片2侧相反的方向(-z方向)延伸的2个以上的微针4n,上述储层4设置于基片的一侧(-z方向侧)的表面上;(c)粘接层5,上述粘接层5以网状形成于储层4的与基片侧相反一侧(-z方向侧)的表面上;和(d)粘接辅助层12,上述粘接辅助层12以能够剥离的方式形成于与形成有储层的面相反一侧(+z方向侧)的基片2的面上。此处,微针4n的尖端部从粘接层5突出。另外,片状小片1进一步具备(e)保持部件h,上述保持部件h以能够剥离的方式配置于与形成有储层4的面相反一侧(-z方向侧)的粘接层5的面上,具有框形形状。此处,保持部件h具有比从粘接层5突出的微针4n的尖端部的高度更长的厚度。需要说明的是,2个以上的片状小片1载置于金属制的板状部件、或者塑料制的板状部件上。此处,片状小片1的保持部件h的-z方向侧面由粘接剂牢固地粘接于该板状部件上。这样载置于板状部件上的片状小片1以将保持部件残留于板状部件上的状态从板状部件上被剥离。为了保护形成于上述片状小片1上的微针4n,从产品的重量和成本的方面考虑,优选保持部件h为具备与片状小片一致的形状的环状部件的塑料制或金属制片状部件。在上述保持部件为金属制片状部件的情况下,从加工容易性等方面考虑,优选为铝制。构成上述基片2的弹性材料优选具备下述3个特征:具有透湿性;厚度小于0.1mm;半透明的合成树脂。这是基于以下3个理由。第1,若不具有透湿性,则在粘接于皮肤的情况下,之后汗中含有的水分不蒸发而导致闷热,不仅令人不适,而且有时还会对皮肤产生不良影响。第2,厚度为0.1mm以上时,无法自然地沿着皮肤进行粘接,例如,在将生发促进用片粘接于头皮上的情况下、或者将美白和皱纹改善剂粘贴于皮肤上的情况下,外观上会残留可看出使用了上述生发促进用片的不自然感。第3,若采用半透明的原材料,则无论在粘贴于皮肤的哪个位置的情况下,上述生发促进用片的使用均不显眼。作为这样的弹性原材料,例如可以举出聚氨酯树脂、硅树脂、尼龙树脂等,可以适当地使用硅材料。这是因为,具有透湿性的半透明合成树脂的厚度为约20μm~约60μm时,对皮肤的适合性好,而且粘贴不显眼。需要说明的是,在将这样的原材料用于本发明的美白和皱纹改善剂的情况下,例如也可以在粘贴于脸部后由其上进行化妆。如图2所示,上述的储层4形成有向-z方向延伸的2个以上的微针4n。用于形成微针4n的凹部优选形成上部直径o1为约0.1mm~0.3mm、底部直径o2为约0.03mm~0.05mm、深度t2为约0.6mm~1.0mm的圆锥形状,并以格子状排列。该凹部优选为约50个/cm2~100个/cm2。储层4优选包含水溶性高分子与单糖类或二糖类的混合物、以及上述生理活性物质的混合物。上述水溶性高分子优选为选自由胶原蛋白、明胶、透明质酸、糊精、右旋糖酐、蛋白聚糖、硫酸软骨素钠、羧甲基纤维素、羟乙基纤维素透明质酸和它们的生理学上允许的盐组成的组中的至少一种。这是因为,利用这些成分能够形成适度大小的微针4n,利用所形成的微针4n可将后述的生理活性物质高效地导入皮肤。这些之中,优选使用透明质酸。另外,上述单糖类或二糖类优选为选自由葡萄糖、果糖、蔗糖、乳糖、海藻糖和它们中的2种以上的混合物组成的组中的任一种。从成本和刺激性的方面考虑,优选使用葡萄糖。从微针4n在皮肤内的溶解时间和机械强度的方面考虑,上述的水溶性高分子与单糖类或二糖类的组合物中的上述单糖类或二糖类的含量优选为0.2重量%~4重量%。单糖类或二糖类的含量超过5%时,微针在皮肤内的溶解时间变得过短,为30分钟以内,因此优选使它们的含量为0.2重量%~4重量%。另外,上述的粘接层5优选由医疗用硅系粘接剂形成。这是因为,不会发生粘贴后皮肤发炎、剥下后皮肤变红的问题。此外,为了能够将上述生理活性物质有效地导入皮肤,优选适当尺寸的微针4n从上述粘接层5的网上突出。另外,上述的粘接辅助层12优选由海绵状部件构成,从易于操作、安全、成本低的方面考虑,优选为选自由氨基甲酸酯、硅、木浆纸张、苯乙烯、乙烯基树脂和布组成的组中的原材料。上述的片状小片1可以如下制作。首先,如图3(a)所示,准备基片2、储层4、粘接辅助层12、保持部件h和各种粘接剂。接着,使用一种粘接剂将粘接辅助层12以能够剥离的方式粘接于基片2的+z方向侧表面上,形成图3(b)所示的层积体1a。从在形成之后的储层4等时能够高效地进行作业的方面考虑,优选如此设置粘接辅助层12。接下来,使用另一种粘接剂将储层4牢固地粘接于基片2的-z方向侧表面上,形成图3(c)所示的层积体1b。接着,在储层的-z方向侧面中的未形成有微针4n的部分,以网状涂布粘接剂而形成粘接层5,如图4(a)所示那样形成层积体1c。接下来,将层积体1c切割成所期望的尺寸后,将保持部件h粘接至粘接层5的-z方向侧表面。其结果,如图4(b)所示制作出片状小片1。将如此制作的片状小片1载置于设置在具有所期望厚度的所期望尺寸的金属制的板状部件或塑料制的板状部件上的环状的片支架上,制成产品。需要说明的是,储层4中包含的生理活性物质可以如下获得。首先,准备用于产生包含上述生理活性物质的培养上清的牙髓干细胞。这样的干细胞导入有(i)选自由bmi-1、hpv-e6和hpv-e7组成的组中的至少1种以上的基因与(ii)htert或ptert中的任一种基因的组合。这是因为,若导入这些基因的组合,则能够将牙髓干细胞传代100代以上。在上述牙髓干细胞的制作时,首先,如下分离哺乳类的牙髓细胞。此处,“牙髓干细胞”是指具有再生能力的牙齿的神经中含有的干细胞的一种。由于其被牙齿这样的硬质材料所保护,因而具有紫外线或放射线不会穿过、基因也不容易损伤的特性。上述基因之中,htert为编码人端粒酶的基因,另外,ptert为编码猪的端粒酶的基因。bmi-1是产生bmi-1(构成多梳复合物的蛋白质之一)的基因。bmi-1对于造血干细胞的维持是必要的,通过活性增强,能够增加造血干细胞。另外,hpv-e6和e7为hpv-16或hpv-18的初期基因,是存在于编码这些人乳头瘤病毒为了自我复制而使用的初期基因的开放阅读框中的基因。下面举出使用来自人的脱落乳牙的牙髓细胞制作永生化干细胞的情况为例来进行说明。首先,利用例如氯己定对上述脱落乳牙进行消毒,分割出牙冠部,利用齿科用铰刀回收牙髓组织。接下来,将所采集的牙髓组织悬浮于基本培养基、例如含有5%~15%的牛血清(calfserum、下文中有时称为“cs”)和50单位/ml~150单位/ml抗生物质的杜氏改良伊格尔培养基(dulbecco’smodifiedeagle’smedium,下文中称为“dmem”)中。接着,使用1mg/ml~5mg/ml的胶原酶和1mg/ml~5mg/ml的分散酶(dispase),在37℃处理0.5小时~2小时。在酶处理后,进行3分钟~10分钟的离心操作(3,000~7,000转/分钟),回收牙髓细胞。根据需要使用细胞过滤网进行细胞的分选。分选出的细胞利用例如3ml~6ml的上述基本培养基进行重悬浮,接种到直径4cm~8cm的贴壁细胞培养用培养皿中。接着,添加培养液、例如含有10%fcs的dmem后,利用5%co2温箱在37℃培养2周左右。除去上述培养液后,利用pbs等将细胞清洗1次~数次。也可以不进行培养液的去除和细胞的清洗而回收形成了集落的贴壁性的牙髓干细胞。贴壁性的牙髓干细胞例如利用0.025%~0.1%的胰蛋白酶和0.3mm~1mm的edta在37℃处理数分钟,使其从培养皿剥离,继而回收细胞。在酶处理后,进行3~10分钟的离心操作(3,000~7,000转/分钟),回收牙髓细胞。根据需要使用细胞过滤网进行细胞的分选。分选出的细胞利用例如3ml~6ml的上述基本培养基进行重悬浮,接种到直径4cm~8cm的贴壁细胞培养用培养皿中。接下来,添加培养液、例如含有10%fcs的dmem后,利用5%co2温箱在37℃培养2周左右。除去上述培养液后,利用pbs等将细胞清洗1次~数次。也可以不进行培养液的去除和细胞的清洗而回收形成了集落的贴壁性的牙髓干细胞。贴壁性的牙髓干细胞例如利用0.025%~0.1%的胰蛋白酶和0.3mm~1mm的edta在37℃处理数分钟,使其从培养皿剥离,继而回收细胞。接着,对如上所述分选出的贴壁性细胞进行培养。例如,将如上所述得到的牙髓干细胞接种于贴壁细胞培养用培养皿中,在5%co2、37℃的条件下利用温箱进行培养。如上可以得到人脱落乳牙干细胞的原代培养细胞(shed-p)。关于传代培养,例如在用肉眼观察达到近汇合或汇合时,如上所述使用胰蛋白酶和edta使细胞从培养容器剥离并进行回收,再次接种到加入有培养液的培养容器中。此处,近汇合是指培养容器中的约70%的细胞附着面上有细胞附着的状态。例如,进行1~8次传代培养,使分选出的细胞增殖到所需要的细胞数、例如约1×107个/ml。在如上所述进行培养后,回收细胞,保存在液氮中。由各种供体回收的细胞也可以以牙髓干细胞库的形态进行保存。(i)选自由bmi-1、hpv-e6和hpv-e7组成的组中的至少1种以上的基因与(ii)htert或ptert中的任一种基因的组合可以如下导入。首先,制备用于插入上述基因的组合的质粒,将其插入到穿梭载体、例如pshuttle2中,进行克隆。之后,利用pshuttle2转化大肠杆菌,以卡那霉素作为标记来选择卡那霉素抗性转化体(下文中称为“kn+”)。对该kn+的dna进行提纯,分析限制酶位点,鉴定所生成的重组体。接着,使用例如pi-scei和i-cuei将表达盒从上述穿梭载体中切出,将该表达盒与例如腺病毒载体的dna连接,得到adeno-x病毒dna。将所得到的连接产物(adeno-x病毒dna)利用例如swai进行切割,使用切割产物转化大肠杆菌而得到转化体。使用例如氨苄青霉素从所得到的转化体中选择氨苄青霉素抗性转化体(下文中称为“amp+”)并进行提纯,分析限制酶位点,鉴定重组体。接下来,利用例如paci消化重组腺病毒,将所得到的片段转染到hek293细胞中并使其增殖,将其收集,测定上述病毒的滴度。按照常规方法提纯上述病毒,使其感染靶细胞shed-p。按照常规方法利用fitc对病毒感染后的hek293的细胞群进行染色,使用流式细胞仪检测stro-1阳性细胞。此处,stro-1被认为是骨髓中的具有多向分化潜能的间充质干细胞的标志物之一,为细胞永生化的指标。通过上述程序,可以得到牙髓来源的永生化干细胞。接着,使用上述基本培养基、例如加入有10%fbs的dmem,在5%co2、37℃的条件下对所得到的永生化干细胞进行24小时~48小时培养,得到培养上清。培养上清的回收可以使用例如komagome型移液管等。另外,本发明的永生化干细胞向培养上清中分泌选自由胰岛素样生长因子(igf-1)、血管内皮细胞生长因子(vegf)、转化生长因子β(tgf-β)和肝细胞生长因子hgf组成的组中的至少2种以上的生长因子。此处,“生长因子”为促进细胞分裂、带来形态的变化或肥大的多肽的总称。因子根据产生生长因子的细胞的种类而有所不同,大致分为表皮生长因子(egf)、成纤维细胞生长因子(fgf)、神经生长因子(ngf)、肿瘤生长因子(tgf)等。此外,位于各细胞的细胞膜上的受体具有酪氨酸激酶活性,当生长因子结合时,蛋白质的酪氨酸残基发生磷酸化,引起细胞的增殖或分化。已知有若干生长因子在个体发生中成为中胚层诱导物质的示例。并且已知有若干调节免疫系统的淋巴因子在个体发生中成为中胚层诱导物质的示例。这样的生长因子可以利用公知的elisa法、微阵列法等进行定量。上述igf-1是序列与胰岛素高度类似的多肽,在细胞培养中与胰岛素同样地引起促有丝分裂等反应。已知其还会影响神经细胞的成长。另外,上述vegf是与血管形成和血管新生相关的一组糖蛋白,血管形成是在胚胎形成期在无血管的位置形成新的血管,血管新生是从现有的血管伸出分支来形成血管。上述tgf-β还是针对多种细胞的强力增殖抑制因子,与细胞的分化/迁移/粘附也密切相关,在个体发生、组织重建、创伤治愈、炎症/免疫、癌浸润/转移等广泛的领域发挥重要的作用。此外,hgf不仅对肝细胞、而且对各种细胞具有担负细胞增殖促进、细胞运动促进、抗凋亡(细胞死亡)、形态发生诱导、血管新生以及组织/器官的再生和保护的多种生理活性。将上述各种干细胞在例如添加了15%fcs的dmem中在37℃培养规定的期间,由此可以得到含有上述生长因子的培养上清。需要说明的是,在上述干细胞的培养上清中,除了igf-1、vegf、tgf-β和hg以外,还含有约70种蛋白质。将所得到的培养上清中的15ml加入到amiconultracentrifugalfilterunits-10k(millipore公司制造)中,以4,000×g离心约60分钟,浓缩至约200μl。接下来,向该管中投入与培养上清等量的灭菌pbs,再次以4,000×g离心约60分钟,将溶剂置换为pbs。将所得到的200μl的溶液回收到微量试管中,制成浓缩干细胞培养上清。代替上述使用amicon的方法,也可以利用乙醇沉淀法来进行浓缩。例如,在5ml的培养上清中加入45ml的100%乙醇并混合,在-20℃放置60分钟。之后,以15,000×g在4℃离心15分钟,去除上清。接下来,加入例如10ml的90%乙醇并充分搅拌,再次以15,000×g于4℃离心5分钟。去除上清,可以将所得到的团块溶解在例如500μl的灭菌水中。溶解后,将总量回收到微量试管中,制成浓缩干细胞培养上清。可以按照常规方法将如上得到的培养上清冷冻干燥,制成在使用时进行制备的组合物。所得到的组合物能够用于本发明的片状小片1中使用的储层4的形成。具体而言,将上述的水溶性高分子和单糖类或二糖类以规定的比例混合,向其中混合冷冻干燥的上述培养上清粉末,制备出储层形成用材料。例如,向透明质酸、聚乙烯醇等水溶性高分子中混合约0.2重量%~4重量%的葡萄糖或右旋糖酐,向其中混合所期望量的上述培养上清的冷冻干燥粉末,制成储层形成用材料。接着,利用感光性树脂形成片后,使用光刻法制作图2(a)所示形状的微针图案。之后,通过电铸加工转印该图案,制造微针形成用的铸模。从作业效率的方面考虑,优选使该铸模的一边为约8cm~20cm。另外,用于形成微针4n的凹部优选形成上部直径o1为约0.1mm~0.3mm、底部直径o2为约0.03mm~0.05mm、深度t2为约0.6mm~1.0mm的圆锥形状,并以格子状排列。该凹部优选为约50个/cm2~100个/cm2(参见图2(b))。向上述储层形成用材料中加入水,制备包含约5%~20%的固体成分的水溶液,在室温下浇注至上述铸模中,使水分蒸发而干燥,之后从铸模中剥离,则可以得到形成有微针4n的储层4。需要说明的是,如上制作的片状小片1通过调节所使用的上述生理活性物质的量,能够作为生发促进用片或美白和皱纹改善剂的一个方式使用。因此,在以下说明中,将片状小片1适当地也记为“生发促进用片1”或“美白和皱纹改善剂1”。接着,对生发促进用片的其它方式进行说明。图9中示出了作为生发促进用片的其它方式的生发促进用片10的构成。如图9所示,生发促进用片10具备:上述的片状小片1和多根人造毛发6。如图10所示,上述的人造毛发6以规定的密度植入于基片2上。如该图10所示,人造毛发6贯通基片2和粘接辅助层12,在基片2的-z方向侧表面固定于基片2上。上述的生发促进用片10以整体粘接于头皮上来使用为前提,因而优选使用皮肤基底(skinbase)。另外,从粘接性的良好程度与佩戴摘掉时的牢固度的平衡的方面出发,生发促进用片10的厚度优选为20μm~60μm,进一步优选为30μm~40μm。此处,规定的密度依赖于粘贴生发促进用片10的部位的生发状态而适当决定。通常,日本人的整个头的毛发数据称为约10万根,已经公布了头发密度(每1cm2的根数)在发顶部为133根~249根(平均199根)、在头前部为114根~250根(平均183根)、在头后部为137根~235根(平均172根)、在头侧部为106根~217根(平均130根)这样的测定值。参考这些数字适当选择即可。另外,人造毛发6可以使用聚酯纤维、氯乙烯纤维、丙烯酸类纤维、阻燃聚酯纤维等通常用于假发制作的纤维,从成本的方面考虑,优选使用聚酯纤维。另外,人造毛发6优选由紫外线固化性的树脂固定于基片2上。这是因为,通过如此使用紫外线固化性,在防止人造毛发6的脱落的同时,能够高效地固定所植入的人造毛发6。上述的生发促进用片10可以如下制作。首先,如图11(a)所示,准备基片2、储层4、粘接辅助层12、保持部件h、多根人造毛发6和各种粘接剂。接着,使用一种粘接剂,将粘接辅助层12以能够剥离的方式粘接于基片2的+z方向侧表面上,形成图11(b)所示的层积体1a。接着,按照贯通层积体1a的粘接辅助层12和基片2的方式,以规定的密度植入多根人造毛发6,制作图12(a)所示的中间材料10a。人造毛发6向该层积体1a的植入例如通过v型植发法进行。利用该v型植发法进行植发时,如图13所示,将切断成一定长度的人造毛发6在基片2的-z方向侧卡入到能够沿z轴方向移动的一对导针15中。使导针15在以该状态卡入有人造毛发6的情况下向+z方向移动。其结果,导针15将人造毛发6的根部6a残留于基片2的-z方向侧,同时向+z方向移动而拔出。之后,在残留于基片2的-z方向侧的根部6a上涂布紫外线固化粘接剂,照射紫外线使其固化。如此进行人造毛发6向层积体1a的植入。返回到图12,当制作中间材料10a时,使用粘接剂将储层4牢固地粘接于中间材料10a的基片2的-z方向侧表面,制作出图12(b)所示的中间材料10b。此时,从确保粘接性的提高和自然的外观的方面出发,优选在上述基片2的整个背面重叠具备上述微针4n的厚度均匀的层而形成储层4。另外,从维持本发明的生发促进用片的拉伸强度、以及能够使上述人造毛发(有时称为“头发材料”)6稳定的方面出发,上述厚度优选为基片2的厚度的1.5倍~2倍左右(约45μm~80μm)。接下来,在中间材料10b的储层4的-z方向侧面中的未形成有微针4n的部分,以网状涂布粘接剂,形成粘接层5,制作出图14(a)所示的中间材料10c。接下来,将中间材料10c切割成所期望的尺寸,之后将保持部件h粘接于中间材料10c的粘接层5的-z方向侧表面。其结果,如图14(b)所示,制作出生发促进用片10。将如此制作的生发促进用片10载置于设置在具有所期望厚度的所期望尺寸的金属制的板状部件或塑料制的板状部件上的环状的片支架上,制成产品。本发明的生发促进用片10以格子状形成有粘接层5,因而不会以所需以上的程度抑制从皮肤上出现的毛发的生长。其结果,能够实现快速的生发。另外,通过从上述生发促进用片10的制作工序中省去向上述基片2上植入人造毛发6的工序,并调节所使用的上述生理活性物质的量,能够制作本发明的美白和皱纹改善剂。所制作的美白和皱纹改善剂可以如图18(a)~(d)所示根据用途切割成各种尺寸,可以与片状小片1的情况同样地载置于保持部件h上而制成产品。实施例1(永生化shed的制作和培养方法)(1)病毒导入用载体的制作(1-1)质粒提取用试剂使用卡那霉素(kan)、氨苄青霉素(amp)、lb液体培养基和lb琼脂培养基、糖原、琼脂糖、灭菌水、乙酸铵、乙酸钠、十二烷基硫酸钠以及rnasea。制备50mg/ml的卡那霉素(kan)和氨苄青霉素(amp),以储存液的形式保存在-20℃。糖原制备成20mg/ml。制备10mg/ml的rnasea,保存在-20℃。制备10m(饱和)乙酸铵(nh4oac)、3m乙酸钠(naoac;ph5.2)。(1-2)限制酶等大肠杆菌感受态细胞(superchargeez10电转化感受态细胞、产品编码636756)、swai(产品编码1111a、smii为等同品)、xhoi(产品编码1094a)、t4dna连接酶(产品编码2011a)、nucleobondxtramidi(产品编码740410.10/.50/.100)、nucleospin质粒(产品编码74058810/50/250)均由宝生物株式会社购入。paci由newenglandbiolabs购入。(1-3)缓冲液等制备1×te缓冲液(含有1mmedta的10mmtris-hcl[ph8.0])、用100mmtris-hcl(ph8.0)饱和的苯酚:氯仿:异戊醇(25:24:1、下文中称为“pci混液”)。乙醇以100%和70%使用。为了用于小规模地提纯在重组中使用的padeno-x质粒dna,制备下述缓冲液1~4。缓冲液1:含有10mmedta和50mm葡萄糖的25mmtris-hcl(ph8.0)(高压灭菌后在4℃保存)缓冲液2:含有1%sds的0.2mnaoh(在即将使用前进行使用时的制备,密封,室温保存)缓冲液3:5mkoac(高压灭菌后在4℃保存)缓冲液4:含有1mmedta、20μg/mlrnase的10mmtris-hcl(ph8.0)(在即将使用前添加rnase。在-20℃保存)(2)腺病毒提纯和β-gal检测用试剂使用利用人5型腺病毒进行了转化的人hek293细胞(atcc#crl1573)。hek293细胞在完全培养基中进行培养。完全培养基的组成为添加有100单位/ml的青霉素g钠和100μg/ml的链霉素、4mm的谷氨酰胺和10%fbs的dmem(dulbecco’smodifiedeagle’smedium、基本培养基)。以10,000单位/ml制备青霉素g钠溶液、以10,000μg/ml制备硫酸链霉素溶液,以储存液的形式保存。培养中使用60mm微孔板、100mm微孔板、6孔板、t75和t175烧瓶。胰蛋白酶-edta(产品编码cc-5012)由宝生物株式会社购入。制备磷酸缓冲生理盐水(pbs、不含ca2+和mg2+)和杜氏磷酸缓冲生理盐水(dpbs、含有ca2+和mg2+)。另外,使用0.33%的中性红染色液、0.4%台盼蓝染色液。在β-gal检测中,将x-gal(5-溴-4-氯-3-吲哚基-β-d-吡喃半乳糖苷(25mg/ml))二甲基甲酰胺(dmf)溶液在-20℃遮光保存。使用β-gal发光检测试剂盒ii(产品编码631712、宝生物株式会社制造)。(3)预试验(3-1)含有lacz的重组腺病毒(padeno-x-lacz)的构建将解冻后去除了dmso的hek293细胞重悬浮于10ml的上述完全培养基中,将全部量转移至直径100mm的培养板中。在hek293细胞贴壁后,去除培养液,将细胞利用灭菌pbs进行1次清洗,加入1ml的胰蛋白酶-edta溶液,进行约2分钟处理。接着,加入10ml的完全培养基停止胰蛋白酶的反应,轻柔地进行悬浮。进行活细胞计数,将105个细胞转移至加入有10ml培养液的直径100mm的微孔板中,均匀地铺展。使用pshuttle2-lacz(包含在adeno-x表达系统1中的阳性对照载体)和包含在试剂盒中的adeno-x病毒dna(经pi-scei和i-ceui消化),按照试剂盒所附的操作规程,构建包含lacz的重组腺病毒。使其感染靶细胞shed,检测β-半乳糖苷酶的表达,确认了载体的构建。(3-2)重组pshuttle2质粒的构建在重组pshuttle2载体(下文中称为“rpshuttle2载体”)的构建前,利用试剂盒中含有的pshuttle2载体和pshuttle2-lacz载体对dh5α大肠杆菌进行转化。在含有50μg/ml卡那霉素的lb琼脂板(下文中称为“lb/kan”)上进行转化体的选择,将从单一菌落取得的菌体在新的lb/kan上划线,在37℃温育一夜。接下来,将htert、bmi-1、hpv-e6、hpv-e7按以下顺序克隆到pshuttle2中。利用适合于这些基因的限制酶对pshuttle2载体进行切割。接下来,参照上述试剂盒中所附的pshuttle2载体信息包(pt3416-5),确定与插入的dna匹配的多克隆位点。利用碱性磷酸酶对限制酶处理后的上述质粒进行处理,并进行提纯。按照常规方法制备靶dna片段并进行提纯。将上述利用限制酶消化后的载体与上述基因片段连接,利用连接产物对dh5α细胞(感受态细胞)进行转化。取上述感受态细胞的一部分,利用试剂盒中包含的对照载体pshuttle2-lacz载体进行转化,作为阳性对照。将含有转化后的大肠杆菌的混合液接种于lb/kan琼脂板上,选择卡那霉素抗性(kanr)转化体(菌落)。选择5~10个kan抗性克隆,接种于少量的液体培养基中,进行扩增。在确认这些克隆具有rpshuttle2载体后,进行一夜温育。之后,使用市售的二氧化硅吸附柱,按照常规方法对所构建的质粒dna进行提纯。利用限制酶对该质粒dna进行处理,进行1%琼脂糖凝胶电泳,鉴定目的重组质粒。通过测序确认所插入的片段的方向和插入部位,鉴定阳性克隆。将重组pshuttle2质粒dna(下文中称为“rpshuttle2质粒dna”)直接转染至靶细胞中,进行蛋白免疫印迹法,对目的蛋白质的表达进行预检测。(3-3)rpshuttle2质粒dna的pi-scei/i-ceui双消化利用pi-scei和i-ceui从如上制作的rpshuttle2质粒dna中切出所导入的基因的表达盒。按照试剂盒中所附的操作规程中记载的体外(invitro)连接方法,将切出的表达盒插入到adeno-x病毒dna中。制备rpshuttle2质粒dna的pi-scei/i-ceui双消化液30μl,将下述表1中记载的试剂装入到1.5ml的灭菌微量离心管中,进行混合。[表1]接下来,在充分混合后装入微量离心管中轻柔地离心,之后在37℃温育3小时。将1kb梯状条带(dna大小标记物)与上述双消化后的反应液(5μl)一起在1%琼脂糖/etbr凝胶中进行电泳。(3-4)苯酚:氯仿:异戊醇提取在离心管中向上述双消化液的剩余物(25μl)中添加70μl的1×te缓冲液(ph8.0)和100μl的pci混液,利用漩涡混匀器充分搅拌。接下来,使用微量离心机,在4℃以14,000rpm离心5分钟,将水层转移至洁净的1.5ml微量离心管中。向其中添加400μl的95%乙醇、25μl的10m乙酸铵以及1μl的糖原(20mg/ml),利用漩涡混匀器充分搅拌。接下来,在4℃以14,000rpm离心5分钟,抽吸去除上清,得到团块。向该团块中加入300μl的70%乙醇,在室温下以14,000rpm离心2分钟。小心地抽吸去除上清,将团块在室温下风干约15分钟。团块干燥后,将其溶解在10μl的1×te灭菌缓冲液(ph8.0)中,使用前保存在-20℃。(4)重组adeno-x质粒dna的构建(4-1)表达盒向adeno-x病毒基因组中的亚克隆将下述表2所示的试剂依次加入到1.5ml的灭菌微量离心管中,温和地混合,轻柔离心后,在16℃温育一夜。[表2]试剂等液量(μl)pi-scei/i-ceui消化的pshuttle2质粒dna2.0pi-scei/i-ceui消化的pshuttle2-lacz质粒dna-灭菌水3.010×dna连接缓冲液1.0adeno-x病毒dna(250ng/μl)3.0dna连接酶(1单位/μl)1.0合计10.0向各样品中加入90μl的1×te缓冲液(ph8.0)和100μl的pci混液,利用漩涡混匀器温和地搅拌。在4℃以14,000rpm离心5分钟,将水层转移至洁净的1.5ml微量离心管中,向其中添加400μl的95%乙醇、25μl的10m乙酸铵溶液以及1μl的糖原(20mg/ml),利用漩涡混匀器温和地搅拌。在4℃以14,000rpm离心5分钟,通过抽吸去除上清,得到团块。与上述(3-4)同样地进行之后的乙醇沉淀操作。团块干燥后,将其溶解在15μl的灭菌去离子水中。(4-2)重组adeno-x质粒dna的swai消化制备下述表3所示的消化液,加入到装入于离心管中的各样品中,在25℃温育2小时。[表3]试剂等液量(μl)连接产物1510×swai消化缓冲液2.010×bsa2.0swai(10单位/μl)1.0合计20.0向各样品中加入80μl的1×te缓冲液(ph8.0)和100μl的pci混液,利用漩涡混匀器温和地搅拌。利用微量离心管在4℃以14,000rpm离心5分钟。与上述(3-4)同样地进行之后的乙醇沉淀的操作,团块的溶解液在使用前保存于-20℃。(4-3)利用重组adeno-x质粒dna进行的大肠杆菌转化的确认使用superchargeez10电转化感受态细胞(产品编码636756),利用上述(4-2)中得到的swai消化产物对电穿孔用感受态细胞(大肠杆菌)进行转化。将转化混合液接种到在lb培养基中加入有氨苄青霉素(终浓度100μg/ml)的琼脂板(下文中称为“lb/amp琼脂板”)上,在37℃温育一夜。得到作为氨苄青霉素抗性(ampr)转化体的约106个菌落。将所得到的菌落利用产品所附的adeno-x系统pcr筛选引物组进行检测。在5ml新鲜的lb/amp液体培养基中接种来自单一菌落的菌体,培养一夜。次日,按照后述的小规模法提纯adeno-x质粒dna。(4-4)重组adeno-x质粒dna的小规模制备将处于对数生长期的培养液5ml以14,000rpm离心30秒,去除上清。将团块再次以10,000rpm离心1分钟,使用微量移液管去除上清。向其中加入150μl的上述缓冲液1,温和地吹打,进行重悬浮。向该细胞悬浮液中添加150μl的缓冲液2,温和地颠倒混合,在冰上放置5分钟。向冷却的细胞悬浮液中加入150μl的缓冲液3,再次颠倒混合,在冰上放置5分钟。将该细胞悬浮液在4℃以14,000rpm离心5分钟,将透明的上清转移到洁净的1.5ml离心管中。向该上清中添加450μl的pci混液,颠倒混合,进行搅拌。之后在4℃以14,000rpm离心5分钟,将水层转移到洁净的1.5ml微量离心管中。与上述(4-1)同样地进行之后的乙醇沉淀的操作,团块的溶解液在使用前保存于-20℃。目的rdna通过后述的基于限制酶的分析以及pcr进行鉴定。(5)所得到的radeno-x质粒dna的限制酶位点分析使用pi-scei和i-ceui进行分析。将下述表4所示的试剂装入1.5ml的灭菌微量离心管中,加入30μl的pi-scei/i-ceui双消化反应液,充分搅拌,轻柔地旋转,收集内容物。[表4]试剂等液量(μl)灭菌水19.510×双消化液3.0rpadeno-xdna(500ng/μl)(500ng/μl)2.0pshuttle2-lacz质粒(500ng/μl)-pi-scei(1单位/μl)2.0i-ceui(5单位/μl)0.510×bsa3.0合计30.0在37℃温育3小时,进行限制酶处理。将该处理后的反应液在1%琼脂糖/etbr凝胶中进行电泳。(6)重组腺病毒的产生(6-1)hek293细胞转染用radeno-x质粒dna的制备将下述表5所示的试剂等装入到1.5ml的灭菌离心管中并混合,利用微量离心机轻柔地离心。之后在37℃温育2小时,进行radeno-x质粒dna的paci限制酶处理。[表5]试剂等液量(μl)灭菌水20padeno-x质粒dna(500ng/μl)1010×paci消化缓冲液410×bsa4paci(10单位/μl)2合计40添加60μl的1×te缓冲液(ph8.0)和100μl的pci混液,利用漩涡混匀器温和地搅拌,利用微量离心机在4℃以14,000rpm离心5分钟。将水层小心地转移至洁净的1.5ml灭菌离心管中。与上述(3-4)同样地进行之后的乙醇沉淀的操作,团块的溶解液在使用前保存于-20℃。(6-2)paci消化adeno-x质粒dna向hek293细胞中的转染在上述质粒dna转染前24小时,按照每一直径60mm的培养板的细胞数为1~2×106(大约为100细胞/mm2)的方式接种hek293细胞,在37℃、5%co2存在下进行温育。将paci消化后的10μl的adeno-x质粒dna转染至各培养板中,按照标准的转染法(calphos哺乳动物转染试剂盒、产品编码631312、宝生物株式会社制造)将adeno-xdna导入至hek293细胞中。自转染的次日起确认是否产生了cpe(细胞变性效果)。1周后,对附着于培养板的底面和侧面的细胞温和地进行搅拌,使之游离。将所得到的细胞悬浮液转移至15ml的灭菌后的锥形离心管中,在室温下以1,500×g离心5分钟。将所得到的沉淀悬浮在500μl的灭菌pbs中。反复进行3次在干冰/乙醇中冷冻、在37℃的恒温槽中融解的冰冻融解操作,使细胞充分融解,得到裂解液。接下来,轻柔地离心,除去悬浮物,将上清转移至另一灭菌管中,立即使用。未立即使用的部分保存于-20℃。向60mm微孔板的培养细胞中加入250μl的上述裂解液,继续进行培养。另外,使用adeno-x快速滴度检测试剂盒(产品编码631028、宝生物株式会社制造)中包含的抗hexon抗体,按照该试剂盒的操作说明书(pt3651-1)测定腺病毒的滴度。(6-3)用于高滴度病毒制备的病毒的扩增在开始进行该滴度测定前约24小时,将hek293细胞接种于t75烧瓶中,在37℃、5%co2存在下培养一夜,确认达到50%~70%汇合。次日,更换为含有病毒的新培养基,以moi=10进行感染。在37℃、5%co2存在下培养90分钟后,取出烧瓶,加入10ml的培养基。在37℃、5%co2存在下培养3~4天,确认到cpe。在50%的细胞发生剥离时,与上述同样地制成游离细胞悬浮液,转移至15ml的灭菌锥形离心管中。进行与上述同样的冰冻融解操作,使细胞融解。使用adeno-x快速滴度检测试剂盒(产品编码631028),得到了107pfu/ml的滴度。进行蛋白免疫印迹法,对包装后的腺病毒基因组是否以可发挥功能的形态具有靶基因特异性的转录单元的拷贝进行确认。(7)腺病毒向靶细胞的感染(7-1)向靶细胞的感染在感染前24小时,将1×106个shed接种至6孔板中。在接种的次日,去除培养基,将含有病毒的1.0ml培养基添加到各微孔板的中心。使该溶液在shed所形成的整个单层上均匀地扩展。在37℃、5%co2存在下培养4小时,使病毒感染shed。接下来,添加新鲜的培养基,进一步在37℃、5%co2存在下进行培养。在感染24小时后~48小时后对导入基因的表达进行经时性分析。(7-2)感染细胞的β-半乳糖苷酶表达的分析感染了adeno-x-lacz的贴壁性细胞中的β-半乳糖苷酶的表达使用β-gal发光检测试剂盒ii(产品编码631712、clontech公司制造)进行检测。实施例2(1)shed的制作使用由10岁健康男孩得到的脱落乳牙。将该脱落乳牙利用聚维酮碘溶液消毒后,使用齿科用金刚锉,将牙冠沿水平方向切断,使用齿科用铰刀回收牙髓组织。将所得到的牙髓组织在3mg/ml的i型胶原酶和4mg/ml的分散酶的溶液中于37℃消化1小时。接着,将该溶液使用70mm的细胞过滤网(falcon公司制造)进行过滤。将滤出的细胞重悬浮于4ml的上述培养基中,接种于直径6cm的贴壁性细胞培养用培养皿中。向该培养皿中添加含有10%fcs的dmem(dulbecco’smodifiedeagle’smedium),在调整为5%co2、37℃的温箱中培养2周左右。将形成了集落的贴壁性细胞(牙髓干细胞)利用0.05%胰蛋白酶-0.2mmedta在37℃处理5分钟,回收从培养皿上剥离的细胞。接着,将如上所述挑选出的贴壁性细胞接种于贴壁性细胞培养用培养皿(胶原蛋白包被培养皿)中,在调整为5%co2、37℃的温箱中进行初次培养,得到原代培养细胞。在通过肉眼观察达到近汇合(细胞占培养容器的约70%表面的状态)或汇合时,利用0.05%胰蛋白酶-0.2mmedta在37℃处理5分钟,从培养容器上剥离细胞,并进行回收。将如此得到的细胞再次接种于加入有上述培养基的培养皿中,进行数次传代培养,使之增殖到约1×107个/ml。将所得到的细胞保存在液氮中。之后,使用上述培养基,以约1×104细胞/cm2的浓度对初次培养细胞进行传代培养。将1~3次传代后的细胞用于实验。人bmmsc(骨髓间充质干细胞、bonemarrowmesenchymalstemcells)购自lonza公司,按照制造商的操作说明书进行培养。如上得到人脱落乳牙牙髓干细胞(shed)。对于所得到的shed,使用facstarplus(becton-dickinson公司制造),如下对各试样分选出约1×106个stro-1阳性细胞。按照溴脱氧尿苷brdu染色试剂盒的制造商(invitrogen公司制造)的操作说明书,进行12小时brdu的摄入,对shed的增殖速度进行评价(各组中n=3)。反复进行5次实验。在单因素方差分析后进行tukey-kramer检验,评价统计学显著差异。为了利用免疫荧光对stro-1进行检测,将shed利用3%多聚甲醛进行固定,之后利用pbs漂洗2次,利用100mm的甘氨酸处理20分钟。接下来,将这些细胞利用0.2%的triton-x(sigma-aldrich公司制造)进行30分钟通透处理,之后在5%的驴血清和0.5%的牛血清白蛋白的混合物中温育20分钟。接着,将细胞与作为一次抗体的小鼠抗人stro-1抗体(1:100、r&d公司制造)一起温育1小时,与作为二次抗体的山羊抗小鼠免疫球蛋白m-fitc抗体(1:500、southernbiotech公司制造)一起温育30分钟,使用vectashielddapi(vectorlaboratoriesinc公司制造)进行封固。之后,将添加有15%fbs的α-mem加入到6孔板中,接种分选出的细胞以用于克隆制作。将增殖的细胞中的约300个集落汇集用于试验。(2)基因的导入如上所述将bmi-1、e6、e7和htert这4个基因插入到腺病毒载体中,制作表达这些基因产物的病毒载体。作为对照,制作未插入有这些基因的对照载体。将shed以1×106个接种于直径100mm的胶原蛋白包被培养皿中,加入添加有10%fbs的dmem,培养至近汇合。抽吸去除该培养基,加入利用上述培养基稀释的病毒溶液500μl(moi=10),在37℃于5%co2温箱中培养1小时,使上述病毒载体进行感染。感染48小时后,在加入有嘌呤霉素(1pg/ml)的上述培养基中将感染细胞培养10天而进行选择,汇集到500~600个抗性克隆。每3~4天将约0.5×105个shed接种至直径100mm的培养皿中,进行传代。将导入有基因的shed作为shed-t、将未导入有基因的shed作为shed-c。实施例3(1)shed-c和shed-t的生长速度的测定图5中示出了shed-t(进行了基因导入的shed)的个体数的倍增状态。图中,纵轴为个体倍增次数(细胞分裂次数、次),横轴为时间(培养天数)。另外,将培养中的shed在1个月中未发生分裂的状态作为细胞老化的判断基准。shed-c在30次左右时停止增殖,进入老化或增殖停止阶段。与此相对,shed-t则超过250pd,在经过800天后仍在增殖。(2)流式细胞术分析为了得到单个细胞的悬浮液,将贴壁性的单层细胞利用胰蛋白酶/edta进行消化。在2×105个细胞中加入抗stro-1单克隆抗体(1:100)并放置,使用facscalibur流式细胞仪(bectondickinson公司制造)进行分析。在与相应的同种型相同的对照抗体相比99%以上比例的荧光水平高的情况下,将表达作为阳性。对于shed-t和shed-c,均是将初期和后期的传代细胞进行固定,利用fitc结合stro-1抗体进行染色。之后利用流式细胞术进行分析。分别进行两次试验。shed-c的情况下,stro-1阳性细胞的比例在pd20时为27%、在pd30时减少至15%(图8(a)和(b))。shed-t的情况下,stro-1阳性细胞的比例在pd20时为46%、在pd40时为41%(图6(c)和(d))。(3)分化能力的研究利用新生骨量的形成能力和组织染色对pd0、pd10和pd20时的shed-c和shed-t的分化能力进行研究。首先,将2.0×106个shed-c或shed-t与40mg的羟基磷灰石/磷酸三钙(ha/tcp)陶瓷粉末(奥林巴斯工业株式会社制造)混合,移植到10周龄的免疫缺陷状态小鼠(nih-bgnu-xid、雌性、harlanspraguedawley公司制造)的背侧表面的皮下。移植8周后回收移植物,利用4%福尔马林固定、脱钙后,为了进行石蜡包埋,利用含有10%edta的pbs溶液进行缓冲。为了进行塑料包埋,将一部分保存在70%乙醇溶液中。将石蜡切片脱石蜡化,对其进行水合后,利用苏木素和伊红(下文中称为“h&e”)进行染色。图7(a)~(c)示出了shed-t(永生化干细胞)的pd0~pd20的染色图像,图7(d)~(f)示出了shed-c(正常细胞)的pd0~pd20的染色图像。为了对生物体内的新骨形成进行定量,选择特定的区域,对于shed-t移植后形成的移植物或shed-c移植后形成的移植物,分别计算出新生骨面积和视野面积,由这些数值求出新生骨量。新生骨量=新生骨面积/视野面积×100图8中示出了在各个体数倍增次数(倍增时间)时shed-t和shed-c的新生骨量的变化。图中,**表示p<0.05、***表示p<0.01。需要说明的是,新生骨量由下述计算式求出。如图8所示,shed-c的情况下,随着个体数倍增次数增加,新生骨量减少,在pd20时降低至pd0的约1/5。与此相对,shed-t的情况下,直至pd20时为止,新生骨量几乎没有变动;在pd20时,显示shed-t形成了shed-c的5倍以上的骨。(4)癌变活性的评价将1×106个shed-c和shed-t细胞移植到免疫缺陷状态小鼠的皮下组织中。移植后进行30天以上的观察,但移植了上述细胞的任一小鼠在此期间中均未形成肿瘤。并且,shed-t细胞的情况下,40~200pd的培养细胞的所有克隆均无形态变化。由以上显示出shed-t无癌变活性。(5)评价shed-t即使超过260pd也显示出在保持有分化能力的状态下具有增殖的能力;shed-c虽具有分化能力,但在30pd以下发生老化。由以上显示出shed-t为永生化干细胞,适于大量生产高活性的shed培养上清。实施例4(1)片状小片的制作在玻璃容器中向透明质酸中混合约0.2重量%~4重量%的右旋糖酐,向其中混合所期望量的上述培养上清的冷冻干燥粉末,制成储层形成用材料。接着,利用市售的感光性树脂形成片,使用光刻法制作图2(a)所示形状的微针图案。之后,通过电铸加工转印该图案,制造微针形成用的铸模。该铸模为边长约10cm见方的正方形,或者为7cm×15cm的矩形。另外,用于形成微针的凹部形成上部直径为约0.2mm、底部直径为约0.04mm、深度为约0.8mm的圆锥形状,并以格子状排列。该凹部为约75个/cm2。向上述储层形成用材料中加入水,制备包含约10%的固体成分的水溶液,在室温下浇注至上述铸模中,使水分蒸发而干燥,之后从铸模剥离,得到形成有微针的储层。接下来,与图3(c)~图4(b)同样地制成片状小片。即,利用粘接剂使粘接辅助层12粘接到基片2的单面,在未形成有粘接辅助层12的基片2的面上粘接储层4。接下来,在未形成有微针4n的部分以网状形成粘接层5,制作出极薄片。在该极薄片上重叠作为保持部件h的固定用氨基甲酸酯,制成图1所示的片状小片。切割成如图18(a)~(d)所示的所期望的尺寸,制作出本发明的片状小片。之后,将该片状小片载置于设置在具有所期望厚度的所期望尺寸的金属制的板状部件或塑料制的板状部件上的片支架上,封入遮光性的膜,制成产品。这些产品在使用前冷藏保存。该片支架形成以约1mm的宽度覆盖上述片状小片的周边部的结构,用于维持微针的结构。(2)生发促进用片的粘贴按照图3(a)~图4(b)所示的程序制作出如上制作的生发促进用片1。将如上制备的生发促进用片1如图15所示那样粘贴于男性的头部。在粘贴上述生发促进用片1并使其与头皮密合后,将粘接辅助层从基片剥离。本实施例中,为了容易看到本发明的生发促进用片的粘贴状态,使用未植入有头发材料的皮肤基底(base),用数码相机进行拍摄,将结果示于图16(a)~(c)。将粘贴前的头发状态示于图16(a)的1~3,将粘贴3~7天后的头发状态示于图16(b)的1~3和图16(c)的1~3。由粘贴前后的头发状态可知,粘贴本发明的生发促进用片时,在3天后观察到生发,之后生发量经时地增加(请参见图16(b)1~3的白圈内)。特别是在7天后的照片中,观察到从1个部位长出多根头发(请参见图16(c)3)。另外,将本发明的生发促进用片粘贴至变为白发的部分时的状态变化示于图17(a)。(a)的左侧照片为粘贴开始前的照片,右侧照片为进行了5次粘贴的将近约2个月后的照片。脱发的部分在粘贴前仅为白发,但粘贴后确认到生发量的增加和长出黑发。将本发明的生发促进用片粘贴至脱发的部分时的状态变化示于图17(b)。(b)的左侧照片为粘贴前的照片,(b)的右侧照片为进行了5次粘贴的将近约2个月后的照片。脱发的部分在粘贴前残留有极少的白发,但粘贴后确认到生发量明显增加,并且长出黑发。由以上确认,在粘贴了本发明的生发促进用片的部位,头发的正常生长得到促进。工业实用性本发明在美容领域中极其有用。符号说明1片状小片2基片4储层5粘接层6人造毛发(头发材料)6a根部(植入部)6b自由端部8固定部10生发促进用片12粘接辅助层15导针h保持部件当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1