用于可植入医疗装置的包含生物可吸收聚合物和抗微生物剂的聚合物覆盖物及其生产方法与流程
本发明涉及预防与可植入医疗装置相关的感染。更具体地说,本发明涉及用于将抗微生物剂递送到皮下袋(asubcutaneouspocket)以防止感染的装置和方法。
背景技术:
可植入医疗装置可以包括壳体以及用于将治疗递送至患者体内的治疗部位的引线或导管。例如,起搏器可以包括包含电子器件和电池的壳体或脉冲发生器;以及从脉冲发生器延伸到治疗部位-心脏的电引线。在另一个示例中,药物递送系统可以包括含有泵、电池和药物供应的壳体或药物递送泵;以及从药物递送泵延伸到需要药物的治疗部位的导管。在一些情况下,壳体可以安装在患者体内的皮下袋中。
将医疗装置植入患者体内的皮下袋内固有地使患者暴露于医院(例如医院获得的)感染的风险。例如,与植入起搏器和可植入心律转复除颤器相关的平均医院内感染率约为3%。在一些感染的情况下,必须完全移除包括装置壳体和任何相关电引线或导管的可植入医疗装置。移除后,感染必须治愈,患者必须充分愈合以容忍植入替代医疗装置。这种感染的成本不仅在本质上是显著的,而且在患者所承受的身体和精神压力方面也是显著的。
所需要的是防止可能由将医疗装置植入皮下袋中导致的感染而不干扰医疗装置的运作的方式。
技术实现要素:
实施例1是一种聚合物装置,其被配置为植入到皮下袋中以防止感染,所述袋形成为包含可植入医疗装置壳体。聚合物装置包括由生物可吸收聚合物制成的结构;和配置为从所述结构洗脱的抗微生物剂。聚合物装置被配置为当植入到皮下袋中时,覆盖可植入医疗装置壳体表面积的小于约20%。
在实施例2中,实施例1的聚合物装置,其中所述结构具有细长的形状,并被配置为配合在皮下袋周边的大部分的周围。
在实施例3中,实施例1的聚合物装置,其中所述结构具有管状形状并且被配置为配合在电引线和导管中的至少一个的周围,所述引线或导管从可植入医疗装置壳体延伸到治疗部位。
在实施例4中,实施例3的聚合物装置,其中通过在电引线和导管中的至少一个的周围缠绕生物可吸收聚合物带而形成管状。
在实施例5中,实施例1-4中任一项的聚合物装置,其中所述抗微生物剂设置在所述生物可吸收聚合物内。
在实施例6中,实施例1-5中任一项的聚合物装置,其中所述结构包括由所述生物可吸收聚合物形成的多个聚合物纤维。
在实施例7中,实施例7的聚合物装置,其中抗微生物剂设置在由聚合物纤维形成的空间内。
实施例8是制造根据实施例1-7中任一项的聚合物装置的方法。该方法包括将第一生物可吸收聚合物作为聚合物纤维电纺丝到圆柱形表面上以形成管状形状,从圆柱形表面移除聚合物纤维,以及将抗微生物剂沉积在至少一些聚合物纤维之间的空间内。
在实施例9中,实施例8的方法,其还包括在电纺丝第一生物可吸收聚合物的同时将抗微生物剂电纺丝到圆柱形表面上。
在实施例10中,实施例9的方法,其中抗微生物剂与第一生物可吸收聚合物一起同轴电纺丝。
在实施例11中,实施例8的方法,其还包括将抗微生物剂喷涂到圆柱形表面与聚合物纤维上。
在实施例12中,实施例8-11中任一项的方法,其中沉积抗微生物剂包括抗微生物剂的等离子体增强化学气相沉积、低压化学气相沉积和常压气相沉积中的至少一种。
在实施例13中,实施例8-12中任一项的方法,其中沉积抗微生物剂包括将所述聚合物纤维浸入包含所述抗微生物剂的液体中,其中所述液体是溶液、乳液和悬浮液中的至少一种。
在实施例14中,实施例13的方法,其还包括在将抗微生物剂沉积在聚合物纤维之间的空间内之后,用第二生物可吸收聚合物涂覆聚合物纤维。
实施例15是防止由植入医疗装置导致的感染的方法。该方法包括将聚合物装置至少大体上安装在形成为包含医疗装置壳体的皮下袋中,并且将医疗装置壳体安装在皮下袋中。聚合物装置包括生物可吸收聚合物结构和配置为从聚合物结构中洗脱的抗微生物剂。聚合物装置覆盖医疗装置壳体表面积的小于约20%。
在实施例16中,实施例15的方法,其中当聚合物结构被生物吸收时,抗微生物剂从聚合物结构中洗脱。
在实施例17中,实施例15-16中任一项的方法,其中所述聚合物装置具有管状形状并且安装所述聚合物装置包括使至少一个电引线或至少一个导管穿过所述聚合物装置,并且将所述至少一个电引线或所述至少一个导管连接至所述医疗装置的壳体,使得所述引线或导管从所述可植入医疗装置壳体延伸至治疗部位。
在实施例18中,实施例16的方法,其中安装聚合物装置进一步包括调节聚合物装置沿着至少一个电引线或至少一个导管的位置,使得聚合物装置的端部邻近所述引线或导管所通过的血管或位于其内。
在实施例19中,实施例15-16中任一项的方法,其中所述聚合物装置形成为聚合物带,并且安装所述聚合物装置包括用所述聚合物带缠绕至少一个电引线或至少一个导管,以围绕所述至少一个电引线或至少一个导管形成管状形状,以及将所述至少一个电引线或所述至少一个导管连接到所述医疗装置的壳体,使得所述引线或导管从所述可植入医疗装置壳体延伸到治疗部位。
在实施例20中,实施例19的方法,其中安装聚合物装置,使得聚合物装置的端部邻近所述引线或导管所通过的血管或位于其内。
在实施例21中,实施例15的方法,其中安装聚合物装置包括将聚合物装置配合在皮下袋周边的大部分的周围。
实施例22是一种可植入医疗装置,其包括包含用于提供电刺激治疗的操作电路的壳体、连接到所述壳体并从壳体延伸到治疗部位的至少一根细长引线,以及根据实施例1-7中任一项的聚合物装置。
实施例23是一种可植入医疗装置,其包括包含用于提供电刺激治疗的操作电路的壳体、连接到所述壳体并从壳体延伸到治疗部位的至少一根细长引线,以及聚合物装置。聚合物装置具有管状形状并被配置为配合在所述至少一个细长引线的一部分周围。聚合物装置包括生物可吸收聚合物结构和配置为从所述结构中洗脱的抗微生物剂。
在实施例24中,实施例23的可植入医疗装置,其中通过围绕所述至少一个细长引线缠绕生物可吸收聚合物带而形成管状形状。
在实施例25中,实施例23的可植入医疗装置,其中所述结构包括由所述生物可吸收聚合物形成的多个聚合物纤维。
在实施例26中,实施例25的可植入医疗装置,其中抗微生物剂设置在聚合物纤维之间的空间内。
在实施例27中,实施例23-26中任一项的可植入医疗装置,其中所述抗微生物剂设置在所述生物可吸收聚合物内。
在实施例28中,实施例23-27中任一项的可植入医疗装置,其中所述可植入医疗装置还包括连接到所述壳体的多个细长引线,并且所述聚合物装置被配置为配合在所述多个细长引线的一部分的周围。
尽管公开了多个实施方案,基于示出和描述了本发明的示例性实施方案的下面的详细描述,对于本领域技术人员来说,本发明的其它实施方案将变得显而易见。因此,附图和详细描述应被视为本质上是说明性的而不是限制性的。
附图说明
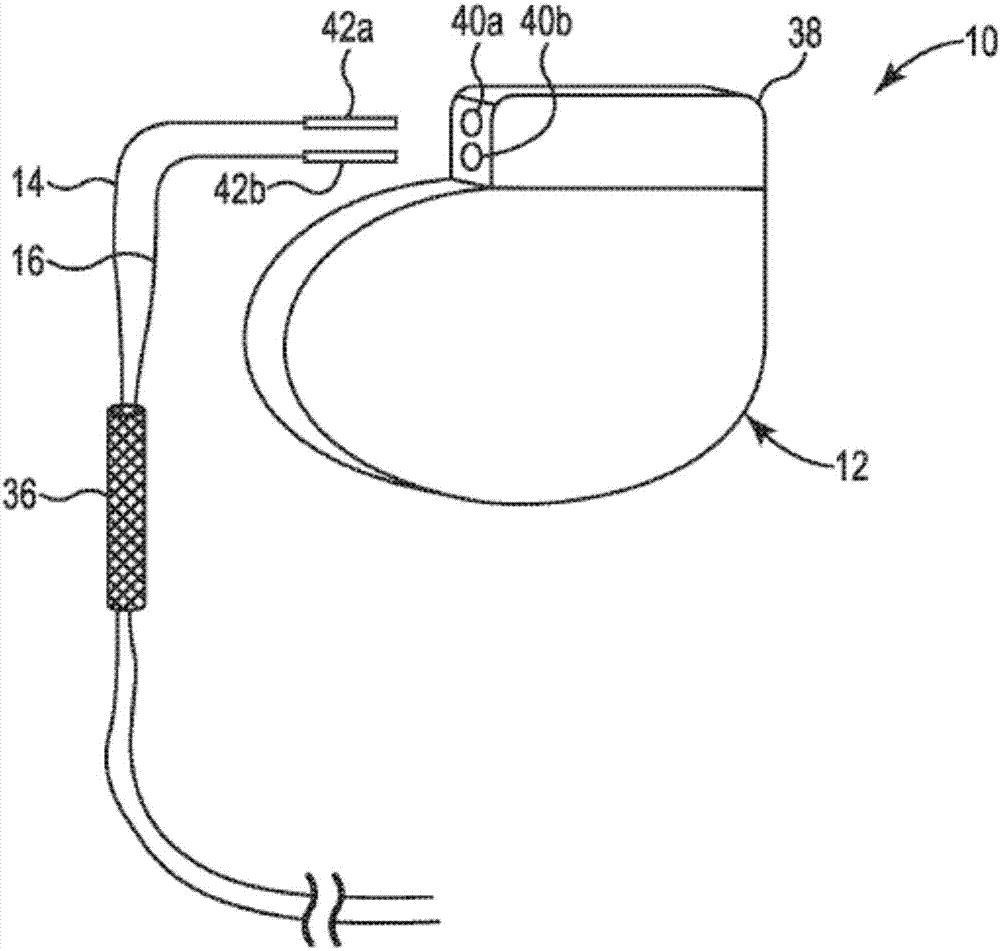
图1是根据本发明实施方案的皮下植入患者体内的可植入医疗装置的示意图。
图2是根据本发明实施方案的包含聚合物装置的图1的可植入医疗装置的示意图。
图3是根据本发明实施方案的包含聚合物装置的另一种可植入医疗装置的示意图。
图4是皮下植入患者体内的图1的包含聚合物装置的可植入医疗装置的一部分的放大示意图。
图5是根据本发明实施方案的皮下植入患者体内的可植入医疗装置和聚合物装置的一部分的放大示意图。
图6是根据本发明实施方案的皮下植入患者体内的可植入医疗装置和聚合物装置的一部分的放大示意图。
图7-9是通过用各种溶剂混合物电纺丝形成的生物可吸收聚合物结构的照片。
虽然本发明可修改为各种修改和替代形式,但具体实施方案已通过附图中的实施例示出并在下面详细描述。然而,并不打算将本发明限制于所描述的特定实施方案。相反,本发明意在覆盖落入由所附权利要求限定的本发明的范围之内的所有修改,等价物和替代。
具体实施方式
图1提供了使用植入皮下袋中的可植入医疗装置和聚合物装置以防止感染的医疗应用的说明性但非限制性实例。应用和位置仅是说明性的,因为包含本发明的实施方案的可植入医疗装置可以用于各种解剖学位置并用于各种其他目的。
图1是根据本发明实施方案的可植入医疗装置的示意图。图1示出了心律管理系统形式的示例性可植入医疗装置(imd)10。如图1所示,imd10可包括壳体12和将壳体12与患者心脏18内的治疗部位连接的多个引线14,16。壳体12可以是例如起搏器或脉冲发生器,并且可以包括电子电路(未示出)和电池(未示出)。引线14,16可以根据需要包括导体和电极(未示出),以在壳体12和心脏18之间传送电脉冲和信号。如图1所示,心脏18包括右心室20和右心房22。向心脏18供血的主要静脉系列包括左辅助静脉24,其流入左锁骨下静脉26,其流入左头臂静脉28。左头臂静脉28流入上腔静脉30,其向右心房22供血。
进一步如图1所示,多个引线14,16可以通过血管进入部位32进入血管系统。在一些实施方案中,血管进入部位32可形成在左辅助静脉24的壁中。在其他实施方案中,血管进入部位32可以形成在左锁骨下静脉26的壁中。多个引线14,16可以从左辅助静脉24延伸穿过左锁骨下静脉26、左头臂静脉28和上腔静脉30到心脏18。在心脏18内,引线14可以植入右心室20中,引线16可以植入右心房22中。因此,右心室20和右心房22是心脏18内的治疗部位,其接受来自imd10的治疗,治疗形式为经由引线14,16从壳体12输送的电脉冲。在一些实施方案中,壳体12可能需要电接地到皮下袋34周围的组织以成功地提供治疗。
例如,如图1所示,壳体12可以植入患者胸部的皮下袋34中。从壳体12延伸到血管进入部位32的引线14,16的一部分也可以位于皮下袋34内。引线14,16的任何多余的长度可绕着皮下袋34内的壳体12盘绕。
如图1所示,imd10还可以包括植入在皮下袋34内的聚合物装置36,以防止植入imd10所引起的感染,如下所述。聚合物装置36可以包括由生物可吸收聚合物制成的结构和抗微生物剂。在一些实施方案中,生物可吸收聚合物可以包括聚乳酸-共-乙醇酸、聚己内酯(pcl)、聚l-丙交酯(plla)或聚(丙交酯-共-乙交酯)-嵌段-聚乙二醇(plga-b-peg)或前述聚合物的任何组合。在一些实施方案中,聚合物装置36可以是完全生物可吸收的。如本文所用,生物可吸收聚合物是可以被生物系统分解到可以从身体完全消除的程度的聚合物。这与如下的生物可吸收聚合物形成对比,即,其是可以被生物系统分解,但不一定达到可以从身体完全消除的程度的聚合物。
抗微生物剂可被配置为从聚合物装置36的所述结构洗脱。在一些实施方案中,抗微生物剂可以设置在生物可吸收聚合物内。也就是说,抗微生物剂可以整合到生物可吸收聚合物本身中,使得当生物可吸收聚合物分解时,抗微生物剂可以被释放。例如,如果抗微生物剂是在形成聚合物装置36之前混入生物可吸收聚合物中的银盐,则当生物可吸收聚合物分解时,银离子可以被释放。在一些实施方案中,抗微生物剂可以包括银盐,如硝酸银或氯化银。在其他实施方案中,抗微生物剂可以包括银纳米颗粒。在其他实施方案中,抗微生物剂可以包括具有抗微生物性质的其它金属如金或铜的盐或纳米颗粒。在这样的实施方案中,当生物可吸收聚合物被生物吸收时,抗微生物剂可从生物可吸收聚合物装置36洗脱。
在其他实施方案中,聚合物装置36的所述结构可以包括由生物可吸收聚合物形成的多个纤维。抗微生物剂可以布置在由多个纤维形成的空间内。在这样的实施方案中,抗微生物剂可以作为空间内的固体、空间内的溶液,空间内的乳液或空间内的悬浮液提供。抗微生物剂可以包括本领域已知的任何抗生素或抗生素组合,例如万古霉素、米诺环素、庆大霉素或利福平,或上述的任何抗微生物剂。在一些实施方案中,在生物可吸收聚合物装置36基本上被生物吸收之前,抗微生物剂可基本上完全从纤维之间的空间洗脱。例如,抗微生物剂可以在几天内基本上完全洗脱,而生物可吸收聚合物装置36可能在几周内基本上不会被生物吸收。在其他实施方案中,抗微生物剂可以与生物可吸收聚合物装置36的生物吸收大致成比例地从生物可吸收聚合物装置36的空间洗脱。例如,抗微生物剂可以在几天内基本上完全洗脱,并且生物可吸收聚合物装置36也可以在几天内基本上被生物吸收。
虽然图1示出了皮下植入的起搏器壳体和引线系统形式的示例性imd10,但是各种实施方案可以在植入皮下袋中的任何可植入医疗装置中实施,用于感测内在生理电活动,将治疗刺激递送给患者组织,或向特定治疗部位提供其他治疗。例如,实施方案可以与皮下植入的可植入心脏复律除颤器(icd)壳体和引线系统一起使用。这样的系统可以包括植入患者胸部中的皮下袋中的壳体以及穿过从皮下袋到前胸前区域的皮下路径的导线。实施方案可以在包含icd壳体的皮下袋中并沿着引线穿过的皮下路径使用。其他此类可植入医疗装置包括但不限于心脏复律除颤器或心脏再同步治疗装置、无引线起搏装置、心内膜起搏导线(endocardiallead)、心外膜起搏导线(epicardiallead)、神经刺激系统如脊髓刺激或深部脑刺激装置壳体及相关导线,以及可植入药物泵,仅举几例。
图2是包括根据本发明实施方案的聚合物装置36的图1的imd10的示意图。如图2所示,imd10还可以包括连接到壳体12的头部38。头部38可以包括电连接到壳体12内的电子电路(未示出)的多个终端引脚接收端口40a,40b。引线14,16可以包括多个终端引脚42a,42b。终端引脚42a,42b可以插入终端引脚接收端口40a,40b中以将引线14,16连接到壳体12。如图2所示,聚合物装置36可以具有管状形状,其在穿过聚合物装置36时配合在引线14,16周围。在一些实施方案中,聚合物结构可以是弹性的并且形成为使得聚合物装置36紧密地配合在引线14,16周围,使得聚合物装置36不可能沿着引线14,16移动,而无需外科医生努力这样做。在一些实施方案中,外科医生可以沿着引线14,16移动聚合物装置36以根据特定患者的需要定位聚合物装置36。外科医生根据特定患者的需要实现聚合物装置36的定位的能力可以导致就感染预防和患者舒适性而言更成功的结果。在一些实施方案中,聚合物装置36可以是柔性的以进一步促进外科医生根据特定患者的需要实现聚合物装置36的定位的能力。
在一些实施方案中,聚合物装置36可以通过将生物可吸收聚合物结构和抗微生物剂一起挤出形成具有在聚合物装置36的长度上轴向延伸的中空开口的细长形状而形成。在一些实施方案中,聚合物装置36可以具有管状形状。在其它实施方案中,聚合物装置36可以通过将生物可吸收聚合物结构和抗微生物剂一起模制以形成具有在聚合物装置36的长度上轴向延伸的中空开口的细长形状而形成。在其他实施方案中,生物可吸收聚合物结构可首先被挤出或模制,然后抗微生物剂可通过浸渍、涂覆或喷洒而以液体形式沉积在表面上。在一些实施方案中,可以通过本领域已知的气相沉积技术(例如原子层沉积、等离子体增强化学气相沉积等)来沉积抗微生物剂。在一些实施方案中,沉积在生物可吸收聚合物结构表面上的抗微生物剂可以进一步用一种或多种额外的生物可吸收聚合物如聚(乙二醇)(peg)包衣以包封抗微生物剂以减慢抗微生物剂的洗脱速率。在一些实施方案中,所述额外的生物可吸收聚合物可以是构成生物可吸收聚合物结构的相同类型的聚合物。在其它实施方案中,所述额外的聚合物可以是与构成生物可吸收聚合物结构不同类型的聚合物。
在一些实施方案中,聚合物装置36可通过将生物可吸收聚合物作为聚合物纤维电纺丝或电喷涂到圆柱形表面(诸如挤出心轴)上以形成管状形状,然后将聚合物装置36从挤出心轴移除。通过将包括抗微生物剂的固体、溶液、乳液或悬浮液沉积在由电纺丝或电喷涂的纤维形成的空间内,可将抗微生物剂设置于所述空间内。例如,可以通过等离子体增强化学气相沉积、低压化学气相沉积或者常压气相沉积来沉积固体。在一些实施方案中,可通过浸渍、浸泡、喷雾或旋涂来沉积包含抗微生物剂的溶液、乳液和悬浮液。在一些实施方案中,抗微生物剂可以在电纺丝或电喷涂过程期间被喷涂以截留抗微生物剂。
在其它实施方案中,聚合物装置36可通过将生物可吸收聚合物作为聚合物纤维和抗微生物剂一起电纺丝或电喷涂到圆柱形表面(诸如挤出心轴)上以形成管状形状,然后将聚合物装置36从挤出心轴移除。在一些实施方案中,抗微生物剂可以与生物可吸收聚合物一起同轴电纺丝或电喷涂。通过将包括抗微生物剂的固体、溶液、乳液或悬浮液沉积在由电纺或电喷涂的纤维形成的空间内,也可以将抗微生物剂设置于所述空间内。设置在空间内的任何抗微生物剂的洗脱速率可通过控制纤维之间的间距来控制,其中更大的间距产生更高的洗脱速率。纤维之间的间距可以通过调整电纺丝或电喷涂沉积工艺的工艺参数(如溶剂组成)来控制。
在上面参考图2描述的实施方案中,单个聚合物装置36被描述为缠绕在两个引线14,16周围。然而,可以理解的是,实施方案可以包括其中聚合物装置36缠绕在引线14,16中仅一个的周围的实施方案。另外,实施方案可以包括多个聚合物装置36,其中每个聚合物装置36缠绕在引线14,16中至少一个的周围。
图3是根据本发明实施方案的包含聚合物装置的另一种可植入医疗装置的示意图。图3示出了imd110。除了imd110包括聚合物装置136而不是聚合物装置36之外,imd110可以与如上所述的imd10相同。聚合物装置136可以与如上所述的聚合物装置36类似,除了聚合物装置136可以最初形成为薄的、长的且相对窄的形状,例如条或带状,并且然后缠绕在引线14,16周围以形成在引线14,16穿过聚合物装置136时配合在引线14,16周围的管状形状。在一些实施方案中,聚合物结构可以是弹性的并且形成为使得聚合物装置136可以缠绕在引线14,16周围,使得聚合物装置136紧密地配合在引线14,16周围。在这种紧密配合的情况下,聚合物装置136不可能沿着引线14,16移动而无需外科医生努力这样做。
在一些实施方案中,聚合物装置136可以通过连续的卷到卷(reel-to-reel)的电纺丝或挤出形成。在一些实施方案中,聚合物装置136可以通过在较大直径的鼓上批量处理然后切割成一定长度形成。在一些实施方案中,聚合物装置136可以以12-18英寸长度的卷供应。
图4是如图1所示的imd10的一部分的放大示意图,其包括皮下植入患者体内的聚合物装置36。图4示出了配合在皮下袋34内的电引线14,16周围的聚合物装置36。电引线14,16通过血管进入部位32进入左侧辅助静脉24。如图4所示,聚合物装置36不覆盖壳体12的任何表面区域。在其它实施方案中,例如,如果聚合物装置36在引线14,16围绕壳体12盘绕时被定位在壳体12附近,聚合物装置36可以覆盖壳体12的一些表面区域。然而,在任何实施方案中,聚合物装置36都不覆盖壳体12的20%或更多的表面积,如下所述。
在手术中,一旦聚合物装置36布置在皮下袋34内,则内部的抗微生物剂可从该结构洗脱以防止皮下袋34内的感染。在一些实施方案中,抗微生物剂可相对独立于聚合物装置36的所述结构的生物吸收而洗脱。也就是说,在聚合物装置的显著部分结构被生物吸收之前,抗微生物剂可以完全从聚合物装置36中洗脱出来。在其他实施方案中,抗微生物剂可以与聚合物装置36的所述结构的生物吸收一起洗脱。在其他实施方案中,抗微生物剂的洗脱可以是独立于所述结构的生物吸收的洗脱和与所述结构的生物吸收一起的洗脱的组合。
在皮下袋34的愈合完成之后,聚合物装置36的所述结构的生物吸收可能导致聚合物装置36什么都没有留下。聚合物装置36可能不会对患者造成任何长期不适或并发症,因为其完全被生物吸收并因此从患者体内消除。
如上所述,在一些实施方案中,imd10可能需要壳体12与皮下袋34周围的组织之间的电接地,以成功地提供治疗。覆盖壳体12的大部分表面区域的任何材料或装置可能干扰imd10的电接地。如果这种干扰在覆盖壳体12的表面区域的材料或装置改变(例如通过生物吸收)时发生量级上的改变或偏移,则该干扰可能特别麻烦。然而,聚合物装置36的生物吸收可能不会在imd10的操作和其提供治疗的能力方面造成麻烦的变化,因为它覆盖了壳体12的不到20%的表面积。
如本文所述,被聚合物装置36覆盖的壳体12的表面区域在植入时同样被植入。由聚合物装置36覆盖的imd10的百分比面积可以通过找到基本上与聚合物装置36物理接触的壳体12的面积来确定。壳体12的总面积是壳体12的总外表面积。壳体12的总面积可以不包括连接到壳体12的物体,例如头部38。由聚合物装置36覆盖的imd10的百分比面积可以是基本上与聚合物装置36物理接触的壳体12的面积除以壳体12的总面积,所得比率以百分比表示。
在一些实施方案中,聚合物装置36可覆盖壳体12的表面积的小于15%、小于10%、小于5%或小于1%。在一些实施方案中,聚合物装置36可以不覆盖壳体12的任何表面区域。通过覆盖壳体12的小于20%的表面积,聚合物装置36的生物吸收不会产生足以干扰由imd10提供的治疗的imd10的电接地的改变。
图5是根据本发明实施方案的imd10的一部分的放大示意图,包括配合在皮下袋34内的电引线14,16周围的聚合物装置36。图5的实施方案与图4的实施方案相同,不同之处在于聚合物装置36的位置沿着电引线14,16调节,使得聚合物装置36的一端邻近于或如图5所示,在左侧辅助静脉24内。在一些实施方案中,聚合物装置36至少基本上在皮下袋34内。在一些实施方案中,“基本上”是指至少约80%的聚合物装置在皮下袋34内。在其它实施方案中,“基本上”是指聚合物装置36的至少约85%、90%、95%或99%在皮下袋34内。在一些实施方案中,所有聚合物装置36完全在皮下袋34内,并且聚合物装置36的末端与邻近血管进入部位32的左侧辅助静脉24物理接触。
在手术中,一旦聚合物装置36的末端邻近左侧辅助静脉24或在左侧辅助静脉24内,内部的抗微生物剂可从结构中洗脱,以防止最初可能在皮下袋34内发现的任何感染源通过血管进入部位32进入血管系统。因为聚合物装置36也基本上布置在皮下袋34内,所以内部的抗微生物剂可以从结构中洗脱以防止皮下袋34内的感染。
图6是根据本发明实施方案的皮下植入患者体内的可植入医疗装置和聚合物装置的一部分的放大示意图。图6示出了如上参考图1针对imd10所描述的植入患者体内的imd210。imd210与imd10相同,不同之处在于它不包括聚合物装置36。图6的实施方案包括聚合物装置236。聚合物装置236可以由与上述聚合物装置36相同的材料制成,包括由生物可吸收聚合物制成的结构和被配置为从所述结构洗脱的抗微生物剂。聚合物装置236具有细长的形状。如图6中的实施方案所示,聚合物装置236可以是一定长度的编织聚合物纤维帘线的形式。聚合物纤维可以通过电纺丝或电喷涂形成。在其他实施方案中,聚合物装置236可以是挤出长度的聚合物的形式。
聚合物装置236被配置为植入在皮下袋34中并且进一步被配置为配合在皮下袋34周边的大部分(asubstantialportion)的周围。如图6所示,聚合物装置236可以配合在皮下袋34的整个周边周围。在一些实施方案中,大部分可以意指皮下袋34周长的至少50%。在其它实施方案中,大部分可以意指皮下袋34周长的至少60%、至少70%、至少80%、至少90%、至少95%或100%。在一些实施方案中,聚合物装置236可以长于皮下袋34的周边,使得聚合物装置236配合在皮下袋34周长的100%周围,并且聚合物装置236的端部彼此重叠。在一些实施方案中,外科医生可根据需要将聚合物装置236切割至特定长度以配合在皮下袋34的周边周围。外科医生对于特定患者创建定制长度的聚合物装置236的能力可以导致就感染预防和患者舒适性而言更成功的结果。
在手术中,一旦聚合物装置236配合在皮下袋34周边的大部分的周围,则内部的抗微生物剂可从该结构洗脱以防止皮下袋34内的感染。如同上述聚合物装置36一样,在皮下袋34的愈合完成之后,聚合物装置236的所述结构的生物吸收可能导致聚合物装置236什么都没有留下。也就是说,聚合物装置236可以是完全生物可吸收的。聚合物装置236可能不会对患者造成任何长期不适或并发症,因为其完全被生物吸收并因此从患者体内消除。
如同聚合物装置36一样,聚合物装置236可覆盖壳体12的小于20%的表面积。如本文所述,被聚合物装置236覆盖的壳体12的表面区域在植入时同样被植入。在一些实施方案中,聚合物装置236可覆盖壳体12的表面积的小于15%、小于10%、小于5%或小于1%。在一些实施方案中,例如图6中所述的实施方案,聚合物装置236可以不覆盖壳体12的任何表面区域。通过覆盖壳体12的小于20%的表面积,聚合物装置236的生物吸收不会产生足以干扰由imd210提供的治疗的imd210的电接地的改变。
聚合物装置236可以包括由生物可吸收聚合物制成的结构和抗微生物剂。在一些实施方案中,生物可吸收聚合物可以包括聚乳酸-共-乙醇酸、聚己内酯(pcl)、聚l-丙交酯(plla)或聚(丙交酯-共-乙交酯)-嵌段-聚乙二醇(plga-b-peg)或前述聚合物的任何组合。在一些实施方案中,聚合物装置236可以是完全生物可吸收的。
抗微生物剂可被配置为从聚合物装置236的所述结构洗脱。在一些实施方案中,抗微生物剂可以设置在生物可吸收聚合物内。也就是说,抗微生物剂可以整合到生物可吸收聚合物本身中,使得当生物可吸收聚合物分解时,抗微生物剂可以被释放。例如,如果抗微生物剂是在形成聚合物装置236之前混入生物可吸收聚合物中的银盐,则当生物可吸收聚合物分解时,银离子可以被释放。在一些实施方案中,抗微生物剂可以包括银盐,如硝酸银或氯化银。在其他实施方案中,抗微生物剂可以包括银纳米颗粒。在其他实施方案中,抗微生物剂可以包括具有抗微生物性质的其它金属如金或铜的盐或纳米颗粒。在这样的实施方案中,当生物可吸收聚合物被生物吸收时,抗微生物剂可从生物可吸收聚合物装置236洗脱。
在其他实施方案中,聚合物装置236的所述结构可以包括由生物可吸收聚合物形成的多个纤维。抗微生物剂可以设置在由多个纤维形成的空间内。在这样的实施方案中,抗微生物剂可以作为空间内的固体、空间内的溶液,空间内的乳液或空间内的悬浮液提供。抗微生物剂可以包括本领域已知的任何抗生素或抗生素组合,例如万古霉素、米诺环素、庆大霉素或利福平,或上述的任何抗微生物剂。在一些实施方案中,在生物可吸收聚合物装置236基本上被生物吸收之前,抗微生物剂可基本上完全从纤维之间的空间洗脱。例如,抗微生物剂可以在几天内基本上完全洗脱,而生物可吸收聚合物装置236可能在几周内基本上不会被生物吸收。在其他实施方案中,抗微生物剂可以与生物可吸收聚合物装置236的生物吸收大致成比例地从生物可吸收聚合物装置236的空间洗脱。例如,抗微生物剂可以在几天内基本上完全洗脱,并且生物可吸收聚合物装置236也可以在几天内基本上被生物吸收。
在一些实施方案中,聚合物装置236可以通过将生物可吸收聚合物结构和抗微生物剂一起挤出形成细长形状而形成。在其它实施方案中,聚合物装置236可以通过将生物可吸收聚合物结构和抗微生物剂一起模制形成细长形状而形成。在其他实施方案中,生物可吸收聚合物结构可首先被挤出或模制,然后抗微生物剂可通过浸渍、涂覆、喷洒而以液体形式沉积在表面上。在一些实施方案中,可以通过本领域已知的气相沉积技术(例如原子层沉积、等离子体增强化学气相沉积等)来沉积抗微生物剂。在一些实施方案中,沉积在生物可吸收聚合物结构表面上的抗微生物剂可以进一步用一种或多种额外的生物可吸收聚合物如聚(乙二醇)(peg)包衣以包封抗微生物剂和增强洗脱性质。在一些实施方案中,所述额外的生物可吸收聚合物可以是构成生物可吸收聚合物结构的相同类型的聚合物。在其它实施方案中,所述额外的聚合物可以是与构成生物可吸收聚合物结构不同类型的聚合物。
在一些实施方案中,聚合物装置236可以通过将生物可吸收聚合物作为聚合物纤维进行电纺丝或电喷涂,然后将聚合物纤维编织成用于聚合物装置236的结构来形成。通过将包括抗微生物剂的固体、溶液、乳液或悬浮液沉积在由电纺丝的或电喷涂的纤维形成的空间内,可将抗微生物剂设置于所述空间内。例如,可以通过等离子体化学气相沉积、低压化学气相沉积或者常压气相沉积来沉积固体。可通过浸渍、浸泡、喷雾或旋涂来沉积溶液、乳液和悬浮液。在一些实施方案中,抗微生物剂可以在电纺丝或电喷涂过程期间被喷涂以截留抗微生物剂。
在其它实施方案中,聚合物装置236可以通过将生物可吸收聚合物作为聚合物纤维和抗微生物剂一起电纺丝或电喷涂,然后将聚合物纤维编织成用于聚合物装置236的结构来形成。在一些实施方案中,抗微生物剂可以与生物可吸收聚合物一起同轴电纺丝或电喷涂。通过将包括抗微生物剂的固体、溶液、乳液或悬浮液沉积在由电纺丝的或电喷涂的纤维形成的空间内,也可以将抗微生物剂设置于所述空间内。设置在所述空间内的任何抗微生物剂的洗脱速率可通过控制纤维之间的间距来控制,其中更大的间距产生更高的洗脱速率。纤维之间的间距可以通过调整电纺丝或电喷涂沉积工艺的工艺参数(如溶剂组成)来控制。
上面的实施方案是以具有脉冲发生器和一对电引线的心律管理系统的形式的示例性可植入医疗装置的上下文来描述的。然而,可以理解的是,实施方案可以包含其他可植入医疗装置,例如具有药物泵和导管的药物递送系统。
可以在不脱离本发明的范围的情况下对所讨论的示例性实施方案进行各种修改和添加。例如,虽然上述实施方案是指特定的特征,本发明的范围也包括具有不同的特征组合的实施方案和不包括所有的所描述特征的实施方案。因此,本发明的范围旨在涵盖落入权利要求书的范围内的所有这些替代、修改以及变型,以及它们的所有等同物。
实施例
以下实施例是说明性的而不是限制性的。
生物可吸收聚合物结构制备
通过将溶解在不同比例的四氢呋喃(thf)和二甲基甲酰胺(dmf)的溶剂混合物中的聚(乳酸-共-乙醇酸)(plga)电纺丝到目标表面上来制备多个生物可吸收聚合物结构。改变thf与dmf的比例产生不同的纤维尺寸和纤维间的不同空间。通过控制纤维间的空间,可以控制随后引入空间中的任何抗微生物剂的洗脱速率。
以50%质量/体积的聚合物与溶剂混合物的比例(例如,5g聚合物溶解于10ml溶剂混合物中为50%质量/体积),电纺丝各样品。将样品在23℃、相对湿度为22-23%的空气中纺丝。溶解的聚合物通过22号电纺喷嘴以约0.3毫升/小时的流速进行电纺丝。电纺喷嘴与目标表面之间的距离约为15厘米。
图7是使用2份thf与1份dmf的溶剂混合物如上所述通过电纺丝形成的生物可吸收聚合物结构的照片。结构放大了大约1000倍。
图8是使用1份thf与1份dmf的溶剂混合物如上所述通过电纺丝形成的生物可吸收聚合物结构的照片。结构放大了大约1000倍。与图7所示的结构相比,图8所示的结构具有较小的平均纤维直径和较小的纤维间平均空间。
图9是使用1份thf与2份dmf的溶剂混合物如上所述通过电纺丝形成的生物可吸收聚合物结构的照片。结构放大了大约1000倍。与图8所示的结构相比,图9所示的结构具有较小的平均纤维直径和较小的纤维间平均空间。
因此,纤维间的平均空间可以通过改变thf与dmf的比率来控制,其中随着thf与dmf之比的降低,纤维间的平均间距减小。以这种方式,也可以控制设置在纤维间的空间内的抗微生物剂的洗脱速率。
- 还没有人留言评论。精彩留言会获得点赞!