包含抗PD‑1抗体和另外的抗体的组合的组合物的制作方法
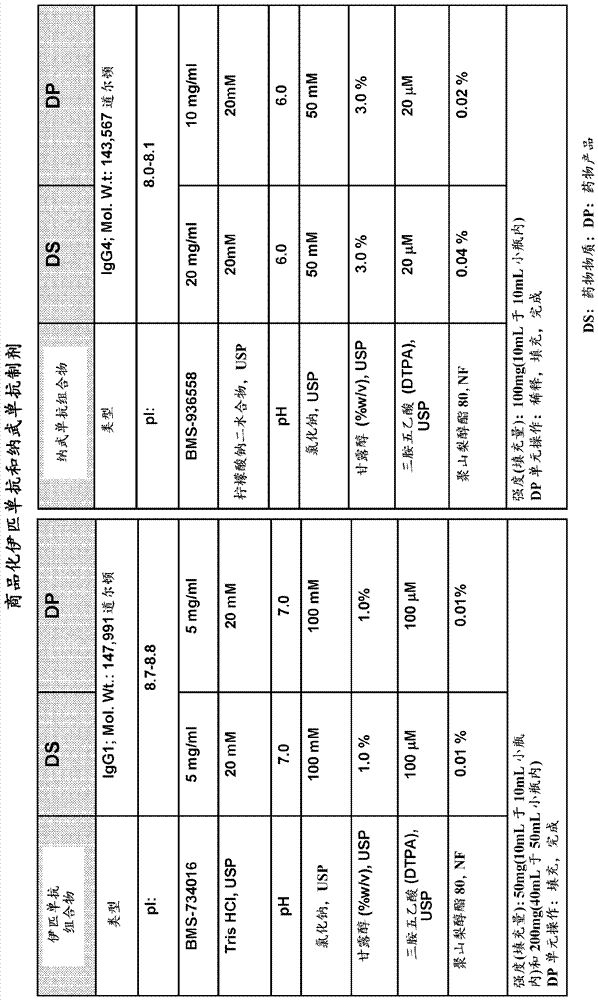
在本申请中,各种出版物通过作者姓名和日期在括号中引用,或通过专利号或专利公布号引用。这些出版物的公开内容以此通过引用整体并入本申请中,以便更全面地描述至本文描述和要求保护的发明之日时该领域技术人员已知的技术发展水平。然而,本文的参考文件的引用不应被解释为确认该参考文件是本发明的现有技术。发明领域本发明涉及药物组合物,其包含固定剂量制剂的免疫检查点抗体和第二抗体的组合。发明背景人类癌症具有许多遗传和表观遗传改变,产生潜在地可被免疫系统识别的新抗原(sjoblom等(2006)science314:268-74)。包含t和b淋巴细胞的适应性免疫系统具有强大的抗癌潜力,具有广泛的能力和极好的特异性以反应于多种肿瘤抗原。此外,免疫系统显示出相当大的可塑性和记忆成分。成功利用适应性免疫系统的所有这些属性将使免疫疗法在所有癌症治疗方式中是独一无二的。最近,几种免疫检查点途径抑制剂已经开始提供用于治疗癌症的新的免疫治疗方法,包括开发了结合和抑制细胞毒性t-淋巴细胞抗原-4(ctla-4)的抗体(ab),伊匹单抗(ipilimumab)用于治疗晚期黑色素瘤患者,和开发了抗体,如纳武单抗(nivolumab)和派姆单抗(pembrolizumab)(以前的lambrolizumab;usan委员会声明(2013)派姆单抗:usan委员会采用的非专属名称的声明(zz-165),2013年11月27日),其特异性结合于程序性死亡-1(pd-1)受体并阻断抑制性pd-1/pd-1配体途径。免疫检查点抗体可以与其他抗体组合施用。尽管如此,由于两种抗体之间的不同剂量和给药间隔,施用两种抗体可能是繁重的,从而引起在不同的时间点多次静脉内注射。此外,两种抗体可能具有显著不同的稳定性概况。由于每种抗体的独特本质,例如,fc糖基化、部分重链c末端lys加工、fc甲硫氨酸氧化、铰链区裂解和lys残基糖化的差异,每种抗体具有不同的物理化学和/或热力学性质例如当暴露于热、冷冻、光、ph极值、搅动、纯应力(sheer-stress)、一些金属和有机溶剂时不同的降解概况。因此,尽管含有两种抗体的单一制剂将提高方便性,每种抗体的独特本质使得这种单一制剂难以确定。发明概述本发明涉及药物组合物,该药物组合物包含x量的第一抗体或其抗原结合片段,其包含抗pd-1抗体或其抗原结合片段,以及y量的第二抗体或其抗原结合片段,其中x量与y量的比例为约50∶1至约1∶50。在一些实施方案中,x与y的比例为约50∶1,约40∶1,约30∶1,约20∶1,约10∶1,约5∶1,约3∶1,约1∶1,约1∶3,约1∶5,约1∶10,约1∶20,约1∶30,约1∶40或约1∶50。在一些实施方案中,抗pd-1抗体是纳武单抗(nivolumab)或派姆单抗(pembrolizumab)。在特定的实施方案中,抗pd-1抗体是纳武单抗。在某些实施方案中,第一抗体或其抗原结合片段的x量为至少约60mg,约80mg,约100mg,约120mg,约140mg,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg或约300mg。在一些实施方案中,第一抗体的x量为至少约80mg,约160mg或约240mg。在其他实施方案中,第一抗体或其抗原结合片段的x量为约60mg,约80mg,约100mg,约120mg,约140mg,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg或约300mg。在某些实施方案中,第一抗体或其抗原结合片段的x量为约80mg或约240mg。在其他实施方案中,第一抗体或其抗原结合片段的x量大于至少约300mg。在一些实施方案中,第一抗体或其抗原结合片段的x量为至少约300mg至至少约500mg,至少约300mg至至少约450mg,至少约300mg至至少约400mg,至少约300mg至至少约350mg,至少约350mg至至少约500mg,至少约400mg至至少约500mg,或至少约450mg至至少约500mg。在某些实施方案中,x量为至少约300mg,约310mg,约320mg,约330mg,约340mg,约350mg,约360mg,约370mg,约380mg,约390mg,约400mg,约410mg,约420mg,约430mg,约440mg,约450mg,约460mg,约470mg,约480mg,约490mg,约500mg。在一个特定实施方案中,第一抗体或其抗原结合片段的x量为约360mg。在另一个实施方案中,第一抗体或其抗原结合片段的x量为约480mg。一方面,第二抗体或其抗原结合片段可以是抗ctla4抗体。第一抗体(例如,抗pd-1抗体或抗pd-l1抗体)的x量与第二抗体(例如,抗ctla-4抗体)的y量的比例为约3∶1,约1∶1或约1∶3。在一些实施方案中,(i)抗pd-1抗体的x量为约240mg,抗ctla-4抗体的y量为约80mg,(ii)x量为约80mg,y量为约80mg;(iii)x量为约160mg,y量为约160mg;(iv)x量为约240mg,y量为约240mg;或(v)x量为约80mg,y量为约240mg。在某些实施方案中,抗ctla4抗体是曲美木单抗(tremelimumab)或伊匹单抗(ipilimumab)。另一方面,第二抗体可以是抗lag3抗体。第一抗体(例如抗pd-1抗体或抗pd-l1抗体)的x量与第二抗体(例如抗lag-3抗体)的y量的比例为约12∶1,约3∶1,或约1∶1。在特定实施方案中,抗lag3抗体是bms-986016。在其他方面,第二抗体是抗cd137抗体。在一些实施方案中,第一抗体(例如,抗pd-1抗体或抗pd-l1抗体)的x量与第二抗体(例如,抗cd-137抗体)的y量的比例为约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶10,约1∶20,约1∶30,约1∶40,约1∶50,约50∶1,约40∶1,约30∶1,约20∶1,约10∶1,约5∶1,约4∶1或约2∶1。在特定的实施方案中,抗cd137抗体是urelumab。在一些方面,第二抗体是抗kir抗体。在一些实施方案中,第一抗体(例如抗pd-1抗体或抗pd-l1抗体)的x量与第二抗体(例如,抗kir抗体)的y量的比例为约30∶1,约10∶1,约3∶1,约1∶1或约1∶2。在一些实施方案中,抗kir抗体是1-7f9或lirilumab。在某些方面,第二抗体可以是抗gitr抗体。在一些实施方案中,抗gitr抗体是mk4166或trx518。在其他实施方案中,第一抗体(例如,抗pd-1抗体或抗pd-l1抗体)的x量与第二抗体(例如如,抗gitr抗体)的y量的比例为约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶6,约1∶7,约1∶8,约1∶9,约1∶10,约2∶1,约3∶1,约4∶1,约5∶1,约6∶1,约7∶1,约8∶1,约9∶1或约10∶1。在其他方面,第二抗体选自抗tgfβ抗体、抗il-10抗体、抗b7-h4抗体、抗fas配体抗体、抗cxcr4抗体、抗间皮素抗体、抗cd27抗体、抗cd73抗体及其任何组合。本发明的药物组合物还可以包含一种或多种选自以下的其他组分:增量剂、稳定剂、螯合剂、表面活性剂、缓冲剂、离子剂及其任何组合。在一个实施方案中,将本发明的药物组合物配制于各种缓冲剂中的一种或多种中。例如,本发明的组合物可以配制于tris-cl、组氨酸、柠檬酸盐或tris-柠檬酸盐缓冲剂中。在一个实施方案中,将组合物配制于tris-cl缓冲剂中,tris-cl的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在另一个实施方案中,tris-cl的浓度为约20mm。在其他实施方案中,将组合物配制在柠檬酸盐缓冲剂中,柠檬酸盐的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在特定实施方案中,柠檬酸盐浓度为约10mm或约20mm。在一些实施方案中,将组合物配制在组氨酸缓冲剂中,组氨酸的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在一些实施方案中,组氨酸浓度为约20mm。在其他实施方案中,将组合物配制在tris-柠檬酸盐缓冲剂中,tris-cl的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm,柠檬酸盐的浓度为至少约2mm,约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在某些实施方案中,tris-cl的浓度为约13.3mm,柠檬酸盐的浓度为约6.7mm。本发明的组合物可以具有约5至约8的ph。例如,组合物的ph可以为至少约5,约5.1,约5.2,约5.3,约5.4,约5.5,约5.6,约5.7,约5.8,约5.9,约6.0,约6.1,约6.2,约6.3,约6.4,约6.5,约6.6,约6.7,约6.8,约6.9,约7.0,约7.1,约7.2,约7.3,约7.4,约7.5,约7.6,约7.7,约7.8,约7.9或约8.0。在一些实施方案中,组合物的ph为至少约6.0,约6.2,约6.5,约6.6或约7.0。组合物还可以包含增量剂。在某些实施方案中,增量剂选自nacl、甘露醇、甘氨酸、丙氨酸及其任何组合。在某些实施方案中,组合物包含稳定剂。该稳定剂选自蔗糖、海藻糖、棉子糖、精氨酸;或其任何组合。在其他实施方案中,组合物包含螯合剂。螯合剂选自二亚乙基三胺五乙酸(dtpa)、乙二胺四乙酸、次氮基三乙酸及其任何组合。在某些实施方案中,表面活性剂选自聚山梨醇酯80(ps80)、聚山梨醇酯20(ps20)及其任何组合。在一些实施方案中,组合物包含nacl,nacl浓度为至少约5mm,至少约10mm,至少约15mm,至少约20mm,至少约25mm,至少约30mm,至少约35mm,至少约40mm,至少约45mm,至少约50mm,至少约60mm,至少约70mm,至少约75mm,至少约80mm,至少约90mm,至少约100mm,至少约110mm,至少约120mm,至少约130mm,至少约140mm,至少约150mm,至少约175mm,至少约200mm,至少约225mm,至少约250mm,至少约275mm,至少约300mm,至少约350mm,至少约400mm,至少约450mm或至少约450mm。在一些实施方案中,nacl的浓度为约100mm,约96.15mm,约83.3mm,约78.57mm或约50mm。在一些实施方案中,组合物包含以下浓度的甘露醇(%w/v)usp:至少约0.25%,至少约0.5%,至少约0.75%,至少约1%,至少约1.5%,至少约2%,至少约2.5%,至少约3%,至少约3.5%,至少约4%,至少约4.5%,至少约5%,至少约7.5%或至少约10%。在一些实施方案中,甘露醇的浓度为约1%,约1.15%,约1.67%,约1.86%或约3%。在一些实施方案中,组合物包含以下浓度的dtpausp:至少约5μm,至少约10μm,至少约15μm,至少约20μm,至少约25μm,至少约30μm,至少约40μm,至少约50μm,至少约60μm,至少约70μm,至少约75μm,至少约80μm,至少约90μm,至少约100μm,至少约110μm,至少约120μm,至少约130μm,至少约140μm,至少约150μm,至少约175μm或至少约200μm。在一些实施方案中,dtpa的浓度为约20μm,约50μm,约65.71μm,约73.3μm,约93.85μm或100μm。在一些实施方案中,组合物包含以下浓度的ps80(%w/v):至少约0.005%,至少约0.01%,至少约0.015%,至少约0.02%,至少约0.03%,至少约0.04%,至少约0.05%,至少约0.06%,至少约0.07%,至少约0.08%,至少约0.09%或至少约0.1%。在一些实施方案中,ps80的浓度为约0.01%,约0.012%,约0.013%,约0.02%,约0.23%,约0.04%或约0.05%。在一些实施方案中,组合物包含以下浓度的蔗糖(%w/v):至少约1%,至少约2%,至少约3%,至少约4%,至少约4.5%,至少约5%,至少约5.5%,至少约6%,至少约6.5%,至少约7%,至少约7.5%,至少约8%,至少约8.5%,至少约9%,至少约9.5%,至少约10%,至少约12%或至少约15%。在一些实施方案中,蔗糖的浓度为约6%或约8.5%。在某些实施方案中,本发明包括以下组合物:(i)在约6.2的ph下,包含约13.3mmtris,约6.7mm柠檬酸盐,约1.67%甘露醇,约83.3mmnacl,约73.3μmdtpa和约0.013%ps80的缓冲剂中,包含1∶1比例的纳武单抗与伊匹单抗的药物组合物;(ii)在约6.6的ph下,包含约1.15%甘露醇,约96.15mmnacl,约93.85μmdtpa和约0.012%ps80的tris-柠檬酸盐缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(iii)在约6.0的ph下,包含约1.86%甘露醇,约78.57mmnacl,约65.71μmdtpa和约0.023%ps80的tris-柠檬酸盐缓冲剂中,包含1∶3比例的纳武单抗与伊匹单抗的药物组合物;(iv)在约ph6下,包含约50mmnacl,约50μmdtpa,约6%蔗糖和约0.05%ps80的20mm组氨酸缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(v)在约ph7下,包含约50mmnacl,约50μmdtpa,约6%蔗糖和约0.05%ps80的约20mm组氨酸缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(vi)在约ph6下,包含约50μmdtpa,约8.5%蔗糖和约0.05%ps80的约20mm组氨酸缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(vii)在约ph6下,包含约50mmnacl,约50μmdtpa,约6%蔗糖和约0.05%ps80的约20mm柠檬酸盐缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(viii)在约ph6下,包含约50mmnacl,约20μmdtpa,约3%甘露醇和约0.04%ps80的约20mm柠檬酸盐缓冲剂中,包含3∶1比例的纳武单抗与伊匹单抗的药物组合物;(ix)在约ph6下,包含约50mmnacl,约100μmdtpa,约3%甘露醇和约0.02%ps80的约20mm柠檬酸盐缓冲剂中,包含1∶1比例的纳武单抗与伊匹单抗的药物组合物;(x)在约ph6.5下,包含约50mmnacl,约100μmdtpa,约3%甘露醇和约0.02%ps80的约20mm柠檬酸盐缓冲剂中,包含1∶1比例的纳武单抗与伊匹单抗的药物组合物;(xi)在约ph6.5下,包含约100mmnacl,约100μmdtpa,约1.0%甘露醇和约0.02%ps80的约20mm柠檬酸盐缓冲剂中,包含1∶1比例的纳武单抗与伊匹单抗的药物组合物;或(xii)在约ph6.0下,包含约50mmnacl,约100μmdtpa,约6%蔗糖和约0.02%ps80的约20mm柠檬酸盐缓冲剂中,包含1∶1比例的纳武单抗与伊匹单抗的药物组合物。在其他实施方案中,本发明包括包含1∶3比例的纳武单抗与伊匹单抗的药物组合物,其在约ph6.0下包含约4.62mg/ml纳武单抗,约1.54mg/ml伊匹单抗,约18.5mmtris盐酸盐,约1.5mm柠檬酸钠二水合物,约96.2mmnacl,约1.2%甘露醇,约93.9μm三胺五乙酸(penteticacid)和约0.012%的ps80,或包含1∶3比例的纳武单抗与伊匹单抗的药物组合物,其在约ph6.3下包含约4.61mg/ml纳武单抗,约1.54mg/ml伊匹单抗,约18.46mmtris盐酸盐,约1.54mm柠檬酸钠二水合物,约96.15mmnacl,约1.15%甘露醇,约93.85μm三胺五乙酸和约0.012%ps80。配制后的本发明组合物可以在约5℃稳定并储存至少约1周,至少约2周,至少约1个月,至少约2个月,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约2年或至少约5年。在一些实施方案中,组合物在约40℃下是稳定的并且可以储存至少约1周,至少约2周,至少约1个月,至少约2个月,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约2年或至少约5年。在其他实施方案中,组合物在约25℃是稳定的并且可以储存至少约1周,至少约2周,至少约1个月,至少约2个月,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约2年或至少约5年。本发明的药物组合物在应力下,例如在特定温度下长时间储存之后,可以表现出酸性峰的最小变化。在一个实施方案中,组合物在约5℃下储存约6个月或约3个月后表现出酸性峰的变化小于约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%。在某些实施方案中,组合物在约25℃下储存约3个月后,表现出酸性峰的变化小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%。在其他实施方案中,组合物在约40℃下储存约3个月后,表现出酸性峰的变化小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%。本发明的组合物也可以在储存长时间,几周,几个月或几年后表现出高分子量峰的最小变化。在一个实施方案中,组合物在约4℃储存约3个月后,表现出高分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%或约0.1%。在另一个实施方案中,组合物在约25℃下储存约2个月或约3个月后,表现出高分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%或约0.1%。在其他实施方案中,组合物在约40℃下储存约2个月或约3个月后,表现出高分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%。此外,在某些实施方案中,组合物可以表现出通过毛细管等电聚焦(cief)分析确定的主峰的最小变化。在一个实施方案中,组合物在约4℃储存约1个月后,表现出主峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%或约0.1%。在一些实施方案中,组合物在约25℃储存约1个月后,表现出毛细管等电聚焦(cief)分析的主峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%。在一些实施方案中,组合物在约40℃储存约1个月后,表现出毛细管等电聚焦(cief)分析的主峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%或约0.1%。在一些实施方案中,组合物表现出低分子量峰的最小变化。在一个实施方案中,组合物在约40℃储存约2个月后,表现出低分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%。在某些实施方案中,组合物在约25℃储存约2个月后,表现出低分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%或约0.1%。在某些实施方案中,组合物在约4℃储存约2个月后,表现出低分子量峰的变化小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%。在一些实施方案中,在使用前将组合物稀释。在一些实施方案中,在使用前,将组合物用0.9%氯化钠注射液usp或5%葡萄糖注射液usp稀释。在一些实施方案中,稀释组合物以获得所需浓度的第一抗体和第二抗体。在一些实施方案中,本公开涉及包含本文公开的组合物的药盒。在一些实施方案中,本公开涉及制造本文公开的组合物的方法。在一些实施方案中,将包含抗pd-1抗体药物产品的制剂与包含第二抗体药物产品的制剂混合,以获得在最终药物产品中的所需比例,而没有缓冲剂变化。在一些实施方案中,包含抗pd-1抗体药物物质的制剂和包含第二抗体药物物质的制剂进行缓冲剂交换和/或浓缩,然后混合,以获得最终药物产品中所需的比例。在一些实施方案中,本公开涉及对有需要的患者调节免疫反应的方法,其包括向患者施用本文公开的组合物。在一些实施方案中,本公开涉及向有需要的患者同时施用两种抗体的方法,包括向患者施用本文公开的组合物,其中所述抗体能够治疗至少一种疾病或病症。在一些实施方案中,本公开涉及治疗疾病或病症的方法,包括向患者施用本文公开的组合物。在一些实施方案中,疾病或病症是传染性疾病。在一些实施方案中,该疾病是癌症。在一些实施方案中,癌症是黑色素瘤癌症、肾癌、前列腺癌、乳腺癌、结肠癌、肺癌、骨癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门区的癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食管癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌;慢性或急性白血病,包括急性骨髓性白血病、慢性骨髓性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病;儿童期实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾癌或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤;环境诱导的癌症,包括由石棉诱导的癌症;及其任何组合。在一些实施方案中,静脉内施用组合物。在一些实施方案中,组合物在施用前稀释。在一些实施方案中,组合物以绝对剂量(flatdose)施用。在一些实施方案中,以单剂量施用于患者的第一抗体的量和第二抗体的量分别与x量和y量相同。在一些实施方案中,组合物以基于重量的剂量施用。在一些实施方案中,施用于患者的第一抗体的量为至少约0.5mg/kg,约1mg/kg,约1.5mg/kg,约2mg/kg,约3mg/kg或约5mg/kg。在一些实施方案中,施用于患者的第一抗体的量为至少约1mg/kg。在一些实施方案中,组合物至少约每周地,至少约每周2次地,至少约每2周地,至少约每3周地,或至少约每月地施用。在一些实施方案中,施用持续至少约8周,至少约12周,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约18个月,至少约2年或大于2年。在一些实施方案中,患者还用另一种抗癌剂治疗。附图简述图1显示抗ctla4抗体(即伊匹单抗)和抗pd-1抗体(即纳武单抗)药物物质(ds)和药物产品(dp)制剂的组合物。图2a显示了抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)组合的1∶1比例固定剂量组合(fdrc=固定剂量比例组合)制剂尺寸排阻色谱(sec)的结果。图2b显示了抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)组合的1∶1比例固定剂量组合(fdrc=固定剂量比例组合)制剂成像毛细管等电聚焦(cief)分析。ec表示tris和柠檬酸盐缓冲剂的混合物。纳武单抗dp和伊匹单抗dp结果显示为对照;并且抗pd-1抗体和抗ctla4抗体(例如,纳武单抗和伊匹单抗)的组合在图2a-b中显示为ecfdrc。图2a显示了与第0天对照相比,在40℃下储存3个月的制剂高分子量(hmw)峰尺寸(%)的实际变化。对于每种原型制剂,25℃下调节的ph以及聚山梨醇酯80(ps80)、nacl和甘露醇的浓度显示在图2a的x轴下方。图2b显示了与第0天对照相比,在5℃下储存6个月的制剂纳武单抗和伊匹单抗酸性峰尺寸(%)的实际变化。每种制剂25℃下调节的ph以及nacl和甘露醇的浓度显示在图2b的x轴下方。数据点在图2a-b中标记为n(纳武单抗)、c(纳武单抗和伊匹单抗的组合)和i(伊匹单抗)。图3a-b显示了对于抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)的1∶3、1∶1或3∶1比例固定剂量制剂的sec分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照;并且抗pd-1抗体和抗ctla4抗体(例如,纳武单抗和伊匹单抗)的组合显示为ec(图3a-b)。图3a显示了每种样品和原型(ec:ph6.0(1伊匹单抗:3纳武单抗);ec:ph6.2(1伊匹单抗:1纳武单抗);和ec:ph6.6(3伊匹单抗:1纳武单抗))制剂第0天(初始)的hmw峰尺寸(%),40℃下2个月后的hmw峰尺寸以及在第0天对照和40℃下2个月时的制剂之间的hmw峰尺寸的变化。图3b显示了在第0天(初始)的lmw峰尺寸(%),在40℃下2个月后的lmw峰尺寸,第0天对照和40℃下储存2个月后每种制剂之间的lmw峰尺寸的变化,以及第0天对照和在25℃下储存3个月后每种制剂之间的lmw峰尺寸的变化。每种制剂25℃下调节的ph,伊匹单抗浓度,纳武单抗浓度,ps80和nacl的浓度显示在x轴下方(图3a-b)。图4a-c显示对于抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)的1∶3、1∶1或3∶1比例固定剂量制剂在25℃下储存3个月后(图4a),5℃下储存3个月后(图4b)和25℃下储存1个月后(图4c)的cief分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照(图4a-c)。对于对照和每种原型(ec:ph6.0(1伊匹单抗:3纳武单抗);ec:ph6.2(1伊匹单抗:1纳武单抗);和ec:ph6.6(3伊匹单抗:3纳武单抗))制剂显示了相对于第0天对照在选定时间点纳武单抗(n)和伊匹单抗(i)酸性峰尺寸(%)的实际差异(图4a-c)。在图4a-b中的x轴下方示出了每种制剂的25℃下的理论ph值,缓冲剂类型和伊匹单抗与纳武单抗的比例;并且每种制剂的nacl浓度,25℃下的理论ph以及伊匹单抗与纳武单抗的比例显示在图4c中的x轴下方。理论ph等于稳定性研究ph(图4a-c)。图5a-b显示了抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)新型实验设计(doe)3∶1比例固定剂量制剂的sec(图5a)和cief(图5b)分析的结果。纳武单抗dp和伊匹单抗dp结果显示为对照(图5a-b)。图5a显示了对于对照制剂和每种原型制剂(combo新、combo4、combo5、combo6和combo8),第0天(初始)的hmw峰尺寸(%),40℃下3个月后的hmw峰尺寸,第0天对照和40℃下储存3个月后的制剂之间的hmw峰尺寸的变化,以及第0天对照和25℃下储存3个月后的制剂之间的hmw峰尺寸的变化。图5b显示了每种制剂原型在25℃下储存3个月后相对于第0天对照的纳武单抗(n)和伊匹单抗(i)酸性峰尺寸(%)的实际差异。每种制剂的伊匹单抗与纳武单抗的比例;nacl、甘露醇和蔗糖的浓度;25℃下的理论ph,和缓冲剂类型示于x轴下方(图5a-b)。图6a-b显示了抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)平台组合(pc)1∶1;1∶3;或3∶1比例的固定剂量制剂在40℃储存3个月后(图6a)和在5℃储存3个月后(图6b)的sec分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照(图6a-b)。图6a显示了第0天对照和在40℃下储存3个月后每种对照及原型(pc:ph6.0-1∶1;pc:ph5.5-1∶3;pc:ph6.0-1∶3;pc:ph6.5-1∶3;以及pc:ph6.0-3∶1)制剂之间的hmw峰尺寸(%)的实际变化。图6b显示了每种制剂在第0天(初始)的hmw峰尺寸(%)和5℃下3个月后的hmw峰尺寸。每种制剂的缓冲剂类型和伊匹单抗与纳武单抗的比例显示在x轴下方(图6a-b)。图7a-b显示了抗pd-1抗体(例如,纳武单抗)和抗ctla-4抗体(例如,伊匹单抗)平台组合(pc)1∶1;1∶3;或3∶1比例的固定剂量制剂在25℃储存3个月后(图7a)和在5℃储存3个月后(图7b)的cief分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照(图7a-b)。图7a显示了每种对照和原型(pc:ph6.0-1∶1;pc:ph5.5-1∶3;pc:ph6.0-1∶3;pc:ph6.5-1∶3;和pc:ph6.0-3∶1)制剂在25℃下储存3个月后相对于第0天对照纳武单抗(n)和伊匹单抗(i)酸性峰尺寸(%)的实际差异。图7b显示了每种制剂在5℃下储存3个月后,相对于第0天对照的纳武单抗(n)和伊匹单抗(i)酸性峰尺寸(%)的实际差异。对于每种制剂,缓冲剂类型和伊匹单抗与纳武单抗的比例显示在x轴下方(图7a-b)。图8显示了基于纳武单抗-dp的fdrc(1∶1)制剂在40℃下储存1个月后的sec分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照(图8)。对于每种对照和原型(a、b、c和d)制剂显示了第0天对照和在40℃下储存1个月后的制剂之间hmw峰尺寸(%)的实际变化(图8)。每种制剂的伊匹单抗与纳武单抗的比例,缓冲剂类型和理论调节的ph显示在x轴下方(图8)。图9显示了基于纳武单抗-dp的fdrc(1∶1)制剂在25℃下储存3个月后的cief分析结果。纳武单抗dp和伊匹单抗dp结果显示为对照。图9显示了每种对照和原型(a、b、c和d)制剂在25℃下储存3个月后相对于第0天对照的纳武单抗(n)和伊匹单抗(i)酸性峰尺寸(%)的实际差异。每种制剂的伊匹单抗与纳武单抗的比例,缓冲剂类型和理论调节的ph显示在x轴下方。图10显示了在25℃/60%rh(相对湿度)下,fdrc和商品化组合物的伊匹单抗酸性峰降解速率。fdrc组合物如表7所示。图11显示了在25℃/60%rh下fdrc和商品化组合物的纳武单抗酸性峰降解速率。fdrc组合物如表7所示。图12显示了在ph范围研究中,伊匹单抗和纳武单抗在25℃下的酸性峰概况。图13显示了来自耐用性(ruggedness)研究的dp原型的尺寸排阻色谱高分子量概况。fdrcdp的hmw概况在2-8℃和25℃下储存6个月后保持不变。图14显示了fdrcdp在2-8℃和25℃下储存6个月后的尺寸排阻色谱单体概况。图15显示了伊匹单抗酸性峰概况。该评价指示了在25℃的加速温度下脱酰胺化的ph依赖性,如ph7.0的较高温度范围的酸性峰概况的增加所示。图16显示了纳武单抗酸性峰概况。该评价指示了在25℃的加速温度下脱酰胺化的ph依赖性,如ph7.0的较高温度范围的酸性峰概况的增加所示。图17显示了伊匹单抗主峰概况。该评价指示了在25℃的加速温度下脱酰胺化的ph依赖性,如ph7.0的较高温度范围的酸性峰概况的增加所示。图18显示了纳武单抗主峰概况。该评价指示了在25℃的加速温度下脱酰胺化的ph依赖性,如ph7.0的较高温度范围的酸性峰概况的增加所示。图19显示了ph对cief概况的影响。图20显示了在5.4-6.6的ph范围内的icief概况。本发明的详细说明本发明涉及包含抗pd-1抗体和第二抗体的药物组合物。在一些实施方案中,组合物是固定剂量制剂。这种单一制剂固定剂量组合物的优点可以包括通过减少治疗(对于给定的组合物,例如静脉内)时间提高医疗顺应性或降低施用负担(例如,多次静脉内注射),以及能够具有两种药物的组合药物概况。然而,这种单一制剂固定剂量组合物可以诱导两种抗体之间的不期望的相互作用,从而减少活性成分的总量,以及限制医生定制剂量的能力。术语为了可以更容易地理解本公开内容,首先定义某些术语。如本申请中使用的,除本文另有明确规定外,以下各术语具有以下含义。另外的定义在整个申请中阐述。在此使用的术语“和/或”将被视为具体公开两种特定特征或组分的每一种伴随或不伴随另一种。因此,在本文中例如“a和/或b”这样的短语中使用的术语“和/或”旨在包括“a和b”,“a或b”,“a”(单独)和“b”(单独)。同样地,在短语例如“a、b和/或c”中使用的术语“和/或”旨在包括以下各个方面:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。应当理解,本文中每当使用语言“包括”描述方面,还提供了以“组成”和/或“基本组成”描述的其他类似方面。除非另有定义,本文中使用的所有技术和科学术语具有与本公开相关领域的普通技术人员通常理解的相同的含义。例如,theconcisedictionaryofbiomedicineandmolecularbiology(简明生物医学和分子生物学词典),juo,pei-show,第2版,2002,crcpress;thedictionaryofcellandmolecularbiol0gy(细胞与分子生物学词典),第3版,1999,academicpress;和theoxforddictionaryofbiochemistryandmolecularbiology(牛津大学生物化学和分子生物学词典),修订版,2000,oxforduniversitypress为本领域技术人员提供了本公开中使用的许多术语的通用词典。单位、前缀和符号以其systemeinternationaldeunites(si)接受的形式表示。数字范围包括定义范围的数字。本文提供的标题不是本公开的各个方面的限制,本公开的各个方面可以通过参考整个说明书来实现。因此,下面紧接着定义的术语通过参考整个说明书而更完整地定义。“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任何一种将包含治疗剂的组合物物理地引至受试者。本文公开的制剂的优选施用途径包括静脉内,肌内,皮下,腹膜内,脊髓或其他肠胃外施用途径,例如通过注射或输注。本文所用的短语“肠胃外施用”是指通常通过注射而不同于肠内和局部施用的施用方式,并且包括但不限于静脉内,肌内,动脉内,鞘内,淋巴内,病灶内,囊内,眶内,心内,皮内,腹膜内,经气管,皮下,表皮下,关节内,囊下,蛛网膜下,脊柱内,硬膜外和胸骨内注射和输注,以及体内电穿孔。在一些实施方案中,制剂通过非肠胃外途径施用,优选口服施用。其他非肠胃外途径包括局部,表皮或粘膜施用途径,例如鼻内,阴道,直肠,舌下或局部。施用也可以进行例如一次,多次,和/或一个或多个延长时间段。本文使用的“不利事件”(ae)是与使用医学治疗相关的任何不利的和一般意外的或不期望的迹象(包括异常的实验室发现),症状或疾病。例如,不利事件可能与响应于治疗的免疫系统的激活或免疫系统细胞(例如,t细胞)的扩增有关。医学治疗可具有一种或多种相关的ae,并且每种ae可以具有相同或不同的严重程度。提及能够“改变不利事件”的方法是指治疗方案降低了与使用不同治疗方案相关的一种或多种ae的发生率和/或严重程度。“抗体”(ab)应包括但不限于特异性结合抗原并且包含通过二硫键相互连接的至少两个重(h)链和两个轻(l)链的糖蛋白免疫球蛋白或其抗原结合部分。每个h链包含重链可变区(本文缩写为vh)和重链恒定区。重链恒定区包含三个恒定域ch1、ch2和ch3。每个轻链包含轻链可变区(本文缩写为vl)和轻链恒定区。轻链恒定区包含一个恒定域cl。vh和vl区可以进一步细分为高变区域,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl包含三个cdr和四个fr,从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白结合于宿主组织或因子,包括免疫系统的各种细胞(例如效应细胞)和经典补体系统的第一组分(c1q)。免疫球蛋白可以衍生自任何公知的同种型,包括但不限于iga,分泌型iga,igg和igm。igg亚类也是本领域技术人员所熟知的,包括但不限于人igg1,igg2,igg3和igg4。“同种型”是指由重链恒定区基因编码的抗体类别或亚类(例如igm或igg1)。术语“抗体”包括例如天然存在和非天然存在的抗体;单克隆和多克隆抗体;嵌合和人源化抗体;人或非人抗体;全合成抗体;和单链抗体。非人抗体可以通过重组方法进行人源化以降低其在人中的免疫原性。在没有明确说明的情况下,除非上下文另有说明,术语“抗体”还包括任何上述免疫球蛋白的抗原结合片段或抗原结合部分,并包括一价和二价片段或部分,以及单链抗体。术语“单克隆抗体”(“mab”)是指非天然存在的单分子组成的抗体分子的制备物,即其基本序列基本相同并且表现出对特定的表位单一的结合特异性和亲和性的抗体分子。mab是分离的抗体的实例。mab可以通过杂交瘤,重组,转基因或本领域技术人员已知的其他技术产生。“人”抗体(humab)是指具有可变区的抗体,其中框架区和cdr区都源自人种系免疫球蛋白序列。此外,如果抗体含有恒定区,恒定区也源自人种系免疫球蛋白序列。本发明的人抗体可以包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。然而,本文所用的术语“人抗体”并不意图包括以下抗体:其中源自另一种哺乳动物物种(例如小鼠)的种系的cdr序列已经被移植到人框架序列上。术语“人”抗体和“完全人”抗体被同义地使用。“人源化抗体”是指其中非人抗体的cdr结构域之外的一些、大多数或全部氨基酸被源自人免疫球蛋白的相应氨基酸替代的抗体。在ab的人源化形式的一个实施方案中,cdr结构域外的一些、大多数或全部氨基酸已被源自人免疫球蛋白的氨基酸替代,而一个或多个cdr区内的一些、大多数或全部氨基酸未改变。只要不消除抗体与特定抗原结合的能力,氨基酸的少量添加、缺失、插入、取代或修饰是允许的。“人源化”抗体保留与原始抗体相似的抗原特异性。“嵌合抗体”是指可变区源自一个物种,并且恒定区源自另一个物种的抗体,例如其中可变区源自小鼠抗体并且恒定区源自人抗体的抗体。“抗抗原(anti-antigen)”抗体是指特异性结合抗原的抗体。例如,抗pd-1抗体特异性结合pd-1,抗ctla-4抗体特异性结合ctla-4。抗体的“抗原结合部分”(也称为“抗原结合片段”)是指一种或多种保留特异性结合由整个抗体结合的抗原的能力的抗体片段。“癌症”是指广泛的多种疾病,特征为异常细胞在体内不受控制的生长。不受调节的细胞分裂和生长(分裂和生长)导致恶性肿瘤的形成,恶性肿瘤侵入相邻组织并且还可以通过淋巴系统或血流转移到身体的远处的部分。“癌症”或“癌组织”可以包括肿瘤。“cd137”,“cd-137”,“肿瘤坏死因子受体超家族成员9(tnfrsf9)”,″4-1bb″和“淋巴细胞活化诱导(ila)”均指肿瘤坏死因子受体家族的相同成员。涉及cd137的一种活性是对于活化的t细胞的共刺激活性。(jang等(1998)biochem.biophys.res.commun.242(3):613-20)。本文所用的术语“cd137”包括人cd137(hctla-4),hcd137的变体、同工型和物种同源物,以及具有至少一个与hcd137共同的表位的类似物。hcd137的氨基酸序列可以在genbank登录号np_001552下找到。“细胞毒性t淋巴细胞抗原-4”(ctla-4)是指属于cd28家族的免疫抑制性受体。ctla-4在体内仅在t细胞上表达,并结合两种配体cd80和cd86(分别也称为b7-1和b7-2)。本文所用的术语“ctla-4”包括人ctla-4(hctla-4),hctla-4的变体、同工型和物种同源物,以及具有至少一个与hctla-4共同的表位的类似物。完整的hctla-4序列可以在genbank登录号aab59385下找到。“疾病”是指生物体中的任何结构或功能的紊乱,生物体例如不是物理损伤的直接结果的人。“传染性疾病”是由例如细菌、真菌、寄生虫病毒或其他病原体等生物体引起的疾病。本文使用的“给药间隔”是指在被施用于受试者的本文公开的制剂的多个剂量之间经过的时间量。给药间隔因此可以表示为范围。本文所用的术语“给药频率”是指在给定时间内施用本文公开的制剂的剂量的频率。给药频率可以表示为经给定时间的剂量数,例如每周一次或两周内一次。关于本发明的组合物使用的术语“固定剂量”是指单一组合物中的两种或更多种不同的抗体在组合物中以特定的(固定的)相互比例存在。在一些实施方案中,固定剂量基于抗体的重量(例如,mg)。在某些实施方案中,固定剂量基于抗体的浓度(例如,mg/ml)。在一些实施方案中,该比例为至少约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶6,约1∶7,约1∶8,约1∶9,约1∶10,约1∶15,约1∶20,约1∶30,约1∶40,约1∶50,约1∶60,约1∶70,约1∶80,约1∶90,约1∶100,约1∶120,约1∶140,约1∶160,约1∶180,约1∶200,约200∶1,约180∶1,约160∶1,约140∶1,约120∶1,约100∶1,约90∶1,约80∶1,约70∶1,约60∶1,约50∶1,约40∶1,约30∶1,约20∶1,约15∶1,约10∶1,约9∶1,约8∶1,约7∶1,约6∶1,约5∶1,约4∶1,约3∶1或约2∶1mg第一抗体比mg第二抗体。例如,3∶1比例的第一抗体和第二抗体可以意味着小瓶可以含有约240mg的第一抗体和80mg的第二抗体或约3mg/ml的第一抗体和1mg/ml第二抗体。关于本发明的组合物使用的术语“绝对剂量”是指不考虑患者的重量或体表面积(bsa)而施用于患者的剂量。因此,绝对剂量不以mg/kg剂量提供,而是作为药剂(例如抗ctla4抗体和/或抗pd-1抗体)的绝对量提供。例如,60kg的人和100kg的人将接受相同剂量的组合物(例如,在含有240mg抗pd-1抗体和80mg抗ctla4抗体的单一固定剂量制剂小瓶(或含有120mg抗pd-1抗体和40mg抗ctla4抗体的两个固定剂量制剂小瓶等)中的240mg抗pd-1抗体和80mg抗ctla4抗体)。本文提及的术语“基于重量的剂量”是指施用于患者的剂量基于患者的重量来计算。例如,当具有60kg体重的患者需要3mg/kg抗pd-1抗体与1mg/kg抗ctla4抗体的组合时,个体可以从抗pd-1抗体和抗ctla4抗体的3∶1比例固定剂量制剂一次获得适量的抗pd-1抗体(即180mg)和抗ctla4抗体(即60mg)。本文所用的术语“参考组合物”是指包括第一抗体或第二抗体,但不同时包括两者的组合物。参考组合物可以包含所述包含第一抗体和第二抗体的组合物的相同组分,除了存在一种抗体。在其他实施方案中,参考组合物是市售获得的相应组合物,例如对于抗pd-1抗体而言的或或者对于抗ctla-4抗体而言的术语“gitr”,“肿瘤坏死因子受体超家族成员18”,“可激活诱导的tnfr家族受体”或“糖皮质激素诱导的tnfr相关蛋白”都是指作为肿瘤坏死因子受体超家族成员的蛋白质。人类中,gitr由tnfrsf18基因编码。它是241个氨基酸的i型跨膜蛋白,其特征在于细胞外结构域中的三个半胱氨酸假重复序列(pseudo-repeats),并且特异性保护t细胞受体诱导的细胞凋亡,尽管它不针对其他凋亡信号保护细胞,所述其他凋亡信号包括fas触发、地塞米松治疗或紫外线照射(nocentini,g等(1997)proc.natl.acad.sci,usa94:6216-622)。本文使用的术语gitr包括人gitr(hgitr),hgitr的变体、同工型和物种同源物,以及具有至少一个与hgitr共同的表位的类似物。已经鉴定了hgitr的三种同工型,除了其c末端部分之外,都具有相同的细胞外结构域。变体1(登录号np_004186)由241个氨基酸组成,代表最长的转录物。与变体2相比,它包含导致移码的额外的编码段。与同工型2相比,所得到的蛋白质(同工型1)含有不同且较短的c末端。变体2(登录号np_683699)编码由255个氨基酸组成的最长的蛋白质(同工型2),并且是可溶的。与变体2相比,变体3(登录号np_683700)包含导致移码的额外编码段。与同工型2相比,所得蛋白质(同工型3)含有不同且较短的c末端,并由234个氨基酸组成。术语“免疫疗法”是指通过包括诱导、增强、抑制或以其他方式改变免疫反应的方法治疗患有疾病或有感染疾病或复发疾病风险的受试者。术语“lag3”,“lag-3”或“淋巴细胞激活基因-3”是指淋巴细胞激活基因-3。本文所用的术语lag-3包括人lag-3(hlag-3),hlag-3的变体、同工型和物种同源物,以及具有至少一个与hlag-3共同的表位的类似物。术语“人lag-3”是指人类序列lag-3,例如具有genbank登录号np002277的人lag-3的完整氨基酸序列。术语“小鼠lag-3”是指小鼠序列lag-3,例如具有genbank登录号np_032505的小鼠lag-3的完整氨基酸序列。lag-3在本领域中也称为例如cd223。人lag-3序列可以具有例如保守突变或非保守区域中的突变而不同于genbank登录号np_002277的人lag-3,并且lag-3具有与genbank登录号np_002277的人lag-3基本上相同的生物学功能。例如,人lag-3的生物学功能是具有被本公开的抗体特异性结合的lag-3的细胞外结构域中的表位,或者人lag-3的生物学功能是与mhcii类分子结合。本文所用的与根据本发明的制剂有关的术语“冷冻干燥物”表示通过本领域已知的冷冻干燥方法制造的制剂。真空升华并在升高的温度下解吸剩余水后冷冻除去溶剂(如水)。在制药领域,冷冻干燥物通常具有约0.1至5%(w/w)的残余水分,并且以粉末或物理稳定的饼状物存在。冷冻干燥物的特征在于加入重构介质后快速溶解。术语“杀伤者ig样受体”,“杀伤者抑制受体”或“kir”是指由kir基因家族成员基因或由这种基因制备的cdna编码的蛋白质或多肽。kir基因家族的详细综述,包括kir基因和kir基因产物的命名,以及示例性kir的genbank登录号,是m.carrington和p.norman的″thekirgenecluster(kir基因簇)″,可得自称为bookshelf的ncbi网站(可访问ncbi.nlm.nih.gov/books)。本文所用的术语kir包括人kir(hkir),hkir的变体、同工型和物种同源物,以及具有至少一个与hkir共同的表位的类似物。人kir基因和cdna及其蚤白质产物的序列可得自公共数据库,包括genbank。人kir的非限制性示例性genbank条目具有以下登录号:kir2dl1:genbank登录号u24076,nm_014218,aar16197,或l41267;kir2dl2:genbank登录号u24075或l76669;kir2dl3:genbank登录号u24074或l41268;kir2dl4:genbank登录号x97229;kir2ds1:genbank登录号x89892;kir2ds2:genbank登录号l76667;kir2ds3:genbank登录号nm_012312或l76670(剪接变体);kir3dl1:genbank登录号l41269;和kir2ds4:genbank登录号aar26325。kir可以包含1至3个细胞外结构域,并且可以具有长(即多于40个氨基酸)或短(即小于40个氨基酸)的胞质尾区。如本文中之前所述,这些特征确定了kir的命名。kir进一步描述于国际公布no.wo/2014/055648,其全部内容通过引用并入本文。“程序性死亡-1(pd-1)”是指属于cd28家族的免疫抑制受体。pd-1在体内主要在以前活化的t细胞上表达,并结合两种配体pd-l1和pd-l2。本文所用的术语“pd-1”包括人pd-1(hpd-1),hpd-1的变体、同工型和物种同源物,以及具有至少一个与hpd-1共同的表位的类似物。完整的hpd-1序列可以在genbank登录号u64863下找到。本文可互换使用“pd-1”和“pd-1受体”。“程序性死亡配体-1(pd-l1)”是pd-1的两种细胞表面糖蛋白配体之一(另一种是pd-l2),其在结合pd-1时下调t细胞活化和细胞因子分泌。本文所用的术语“pd-l1”包括人pd-l1(hpd-l1),hpd-l1的变体、同工型和物种同源物,以及具有至少一个与hpd-l1共同的表位的类似物。完整的hpd-l1序列可以在genbank登录号q9nzq7下找到。本文所用的术语“重构制剂”表示冷冻干燥并通过加入稀释剂再溶解的制剂。稀释剂可以含有例如0.9%氯化钠注射液usp或5%葡萄糖注射液usp。“受试者”包括任何人类或非人类动物。术语“非人类动物”包括但不限于脊椎动物,例如非人灵长类动物、绵羊、狗和啮齿动物如小鼠、大鼠和豚鼠。在一些实施方案中,受试者是人。术语“受试者”和“患者”在本文中可互换使用。药物或治疗剂的“治疗有效量”或“治疗有效剂量”是当单独使用或与另一种治疗剂组合使用时保护受试者免于疾病发作或促进疾病消退(由疾病症状严重程度的降低,疾病无症状时期的频率和持续时间的增加,或由于患疾病而导致的损伤或残疾的预防证明)的任何药物量。治疗剂促进疾病消退的能力可以使用本领域从业技术人员已知的各种方法来评估,例如在临床试验期间在人类受试者中评估,在预测人类中的功效的动物模型系统中评估,或通过在体外测定中测定药剂的活性评估。如本文所用,“亚治疗剂量”是指低于当单独施用以治疗过度增殖性疾病(例如癌症)时的治疗化合物的通常或典型剂量的治疗化合物(例如抗体)的剂量。受试者的“治疗”或“疗法”是指为了逆转、缓解、改善、抑制、减缓或预防症状、并发症或病况或与疾病相关的生化标志的发作、进展、发展、严重性或复发而对受试者进行的任何类型的干预或方法或给予受试者活性剂。替代物(例如,“或”)的使用应被理解为是指替代物的一种、两种或其任何组合。如本文所使用的,不定冠词“一”或“一种”应理解为指任何所述或列举的组件中的“一者或多者”。术语“约”或“主要包括”是指在由本领域普通技术人员确定的特定值或组成可接受的误差范围内的值或组成,这将部分地取决于值或组成如何测量或确定,即测量系统的限制。例如,根据本领域的实践,“约”或“主要包括”可以表示在1或多于1个标准偏差之内。或者,“约”或“主要包括”可以表示最高达10%或20%的范围(即±10%或±20%)。例如,约3mg可以包括2.7mg至3.3mg之间(10%)或2.4mg至3.6mg之间(20%)的任何数字。此外,特别是关于生物系统或方法,这些术语可以意味着最高达一个数量级或最高达值的5倍。当在申请和权利要求书中提供特定值或组成时,除另有说明外,“约”或“主要包括”的含义应假设在该特定值或组成的可接受的误差范围内。这里使用的术语“约每周一次”,“约每两周一次”,或者任何其他类似的给药间隔术语意指近似数字。“约每周一次”可以包括每七天±一天,即每六天至每八天。“约每两周一次”可以包括每十四天±三天,即每十一天至每十七天。类似的近似值适用于例如约每三周一次,约每四周一次,约每五周一次,约每六周一次,和约每十二周一次。在一些实施方案中,约每六周一次或约每十二周一次的给药间隔意味着可以在第一周的任何一天施用第一剂量,然后分别可以在第六或第十二周的任何一天施用下一剂量。在其他实施方案中,约每六周一次或约每十二周一次的给药间隔意味着第一剂量在第一周的特定日期(例如,星期一)施用,然后分别在第六或第十二周的同一天(即星期一)施用下一剂量。如本文所述,任何浓度范围、百分比范围、比例范围或整数范围应被理解为包括所述范围内的任何整数的值,并且在适当时包括其分数(诸如整数的十分之一和百分之一),除非另有说明。本发明的各个方面将在以下小节中进一步详细描述。抗pd-1和抗pd-l1抗体本发明的组合物包含1∶100至100∶1的比例的第一抗体和第二抗体。一方面,第一抗体是抗pd-1抗体或抗pd-l1抗体。pd-1是由活化的t细胞和b细胞表达的关键免疫检查点受体并介导免疫抑制。pd-1是cd28受体家族的成员,该家族包括cd28、ctla-4、icos、pd-1和btla。已经鉴定了pd-1的两种细胞表面糖蛋白配体,程序性死亡配体-1(pd-l1)和程序性死亡配体-2(pd-l2),其在抗原呈递细胞以及许多人类癌上表达,并且已显示与pd-1结合后下调t细胞活化和细胞因子分泌。临床前模型中pd-1/pd-l1相互作用的抑制介导了有效的抗肿瘤活性。以高亲和力特异性结合pd-1的humab已经公开于u.s.专利no.8,008,449和8,779,105。其他抗pd-1mab已经描述于例如u.s.专利no.6,808,710,7,488,802,8,168,757和8,354,509,以及pct公布no.wo2012/145493。u.s.专利no.8,008,449中公开的每种抗pd-1humab已被证明显示以下一个或多个特征:(a)以1x10-7m或更小的kd与人pd-1结合,通过使用biacore生物传感器系统的表面胞质基因共振(surfaceplasmonresonance)测定;(b)不显著结合人cd28、ctla-4或icos;(c)在混合淋巴细胞反应(mlr)测定中增加t细胞增殖;(d)在mlr测定中增加干扰素-γ产生;(e)在mlr测定中增加il-2分泌;(f)与人pd-1和猕猴pd-1结合;(g)抑制pd-l1和/或pd-l2与pd-1的结合;(h)刺激抗原特异性记忆反应;(i)刺激ab反应;和(j)在体内抑制肿瘤细胞生长。可用于本发明的抗pd-1抗体包括与人pd-1特异性结合并且显示前述特征中至少一个,优选至少五个的mab。在一个实施方案中,抗pd-1抗体是纳武单抗。纳武单抗(也称为以前称为5c4、bms-936558、mdx-1106或ono-4538)是完全人igg4(s228p)pd-1免疫检查点抑制剂抗体,其选择性地防止与pd-1配体(pd-l1和pd-l2)的相互作用,从而阻断抗肿瘤t细胞功能的下调(u.s.专利no.8,008,449;wang等,2014cancerimmunolres.2(9):846-56)。在另一个实施方案中,抗pd-1抗体或其片段与纳武单抗交叉竞争。在其他实施方案中,抗pd-1抗体或其片段与纳武单抗结合于相同的表位。在某些实施方案中,抗pd-1抗体具有与纳武单抗相同的cdr。在另一个实施方案中,抗pd-1抗体或其片段与派姆单抗交叉竞争。在一些实施方案中,抗pd-1抗体或其片段与派姆单抗结合相同的表位。在某些实施方案中,抗pd-1抗体具有与派姆单抗相同的cdr。在另一个实施方案中,抗pd-1抗体是派姆单抗。派姆单抗(也称为lambrolizumab和mk-3475)是针对人细胞表面受体pd-1(程序性死亡-1或程序性细胞死亡-1)的人源化单克隆igg4抗体。派姆单抗描述于例如u.s.专利no.8,354,509和8,900,587;也可见于http://www.cancer.gov/drugdictionary?cdrid=695789(最近访问日期:2014年12月14日)。派姆单抗已被fda批准用于治疗复发性或难治性黑色素瘤。在其他实施方案中,抗pd-1抗体或其片段与medi0608交叉竞争。在其他实施方案中,抗pd-1抗体或其片段与medi0608结合相同的表位。在某些实施方案中,抗pd-1抗体具有与medi0608相同的cdr。在其他实施方案中,抗pd-1抗体是medi0608(以前称为amp-514),其为单克隆抗体。medi0608描述于例如us专利no.8,609,089b2或http://www.cancer.gov/drugdictionary?cdrid=756047(最近访问日期:2014年12月14日)。在某些实施方案中,第一抗体是抗pd-1拮抗剂。抗pd-1拮抗剂的一个实例是amp-224,其是b7-dcfc融合蛋白。amp-224讨论于u.s.公布no.2013/0017199或http://www.cancer.gov/publicatiohs/dictionaries/cancer-drug?cdrid=700595(最近访问日期:2015年7月8日)。在其他实施方案中,抗pd-1抗体或其片段与bgb-a317交叉竞争。在一些实施方案中,抗pd-1抗体或其片段与bgb-a317结合相同的表位。在某些实施方案中,抗pd-1抗体具有与bgb-a317相同的cdr。在某些实施方案中,抗pd-1抗体是bgb-a317,其为人源化单克隆抗体。bgb-a317描述于u.s.公布no.2015/0079109。可用于所公开的组合物的抗pd-1抗体还包括与人pd-1特异性结合并与纳武单抗交叉竞争结合人pd-1的分离的抗体(参见例如u.s.专利no.8,008,449和8,779,105;wo2013/173223)。抗体交叉竞争结合抗原的能力表明这些抗体结合抗原的相同表位区域并空间阻碍了其他交叉竞争抗体与该特定表位区域的结合。这些交叉竞争抗体预期具有与纳武单抗非常相似的功能性质,这是由于它们与pd-1的相同表位区域结合。交叉竞争抗体基于它们在标准pd-1结合测定(如biacore分析、elisa测定或流式细胞术)中与纳武单抗交叉竞争的能力,可以被容易地鉴定(参见例如wo2013/173223)。在某些实施方案中,与纳武单抗交叉竞争结合人pd-1或与纳武单抗结合于人pd-1相同表位区域的抗体是mab。对于人受试者的施用,这些交叉竞争抗体可以是嵌合抗体,或人源化或人抗体。可以通过本领域熟知的方法制备和分离此类嵌合、人源化或人mab。可用于公开的发明的组合物的抗pd-1抗体还包括上述抗体的抗原结合部分。已经充分证明抗体的抗原结合功能可以通过全长抗体的片段进行。包括在抗体的“抗原结合部分”术语内的结合片段的实例包括(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab’)2片段,包含在铰链区通过二硫键连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;和(iv)由抗体的单臂的vl和vh结构域组成的fv片段。适用于所公开组合物的抗pd-1抗体是以高特异性和亲和力结合pd-1,阻断pd-l1和/或pd-l2的结合,和抑制pd-1信号通路的免疫抑制作用的抗体。在本文公开的任何组合物或方法中,抗pd-1“抗体”包括与pd-1受体结合并且在抑制配体结合和上调免疫系统中表现出与完整抗体相似的功能性质的抗原结合部分或片段。在某些实施方案中,抗pd-1抗体或其抗原结合部分与纳武单抗交叉竞争与人pd-1结合。在其他实施方案中,抗pd-1抗体或其抗原结合部分是嵌合的、人源化的或人单克隆抗体或其部分。在某些实施方案中,抗体是人源化抗体。在其他实施方案中,抗体是人抗体。可以使用igg1,igg2,igg3或igg4同种型的抗体。在某些实施方案中,抗pd-1抗体或其抗原结合部分包含人igg1或igg4同种型的重链恒定区。在某些其他实施方案中,抗pd-1抗体或其抗原结合部分的igg4重链恒定区的序列含有s228p突变,其将铰链区中的丝氨酸残基替换为脯氨酸残基(通常发现于igg1同种型抗体中相应的位置)。存在于纳武单抗中的这种突变阻止与内源性igg4抗体的fab臂交换,同时保持激活与野生型igg4抗体相关的fc受体的低亲和力(wang等,2014)。在其他实施方案中,抗体包含作为人k或λ恒定区的轻链恒定区。其他实施方案中,抗pd-1抗体或其抗原结合部分是mab或其抗原结合部分。在包括施用抗pd-1抗体的本文所述的任何治疗方法的某些实施方案中,抗pd-1抗体是纳武单抗。在其他实施方案中,抗pd-1抗体是派姆单抗。在其他实施方案中,抗pd-1抗体选自u.s.专利no.8,008,449中描述的人抗体17d8,2d3,4h1,4a11,7d3和5f4。在其他实施方案中,抗pd-1抗体是medi0608(以前称为amp-514)、amp-224或pidilizumab(ct-011)。在某些实施方案中,所公开组合物的第一抗体是抗pd-l1抗体。因为抗pd-1和抗pd-l1靶向相同的信号通路,并且已经在临床试验中显示出在各种癌症中表现出相似水平的功效,抗pd-l1抗体可以代替本文公开的任何治疗方法或组合物中的抗pd-1抗体。在某些实施方案中,抗pd-l1抗体是bms-936559(以前称为12a4或mdx-1105)(参见例加u.s.专利no.7,943,743;wo2013/173223)。在其他实施方案中,抗pd-l1抗体是mpdl3280a(也称为rg7446和atezolizumab)(参见例加herbst等2013jclinoncol31(suppl):3000;u.s.专利no.8,217,149),medi4736(khleif,2013,in:proceedingsfromtheeuropeancancercongress2013(见欧洲癌症大会会议录2013);2013年9月27日至10月1日;amsterdam,thenetherlands.摘要802)或msb0010718c(也称为avelumab;参见us2014/0341917)。在某些实施方案中,与上面提及的pd-l1抗体交叉竞争与人pd-l1结合或与上面提及的pd-l1抗体结合人pd-l1的相同表位区域的抗体是mab。对于人受试者的施用,这些交叉竞争抗体可以是嵌合抗体,或可以是人源化或人抗体。可以通过本领域熟知的方法制备和分离此类嵌合,人源化或人mab。抗ctla-4抗体用于本发明的抗ctla-4抗体与人ctla-4结合,以破坏ctla-4与人b7受体的相互作用。因为ctla-4与b7的相互作用转导导致携带ctla-4受体的t细胞失活的信号,该相互作用的破坏有效地诱导、增强或延长了这种t细胞的活化,从而诱导、增强或延长了免疫反应。以高亲和力特异性结合ctla-4的humab已经公开于u.s.专利no.6,984,720和7,605,238。其他抗ctla-4mab已经描述于例如u.s.专利no.5,977,318,6,051,227,6,682,736,和7,034,121。已经证实u.s.专利no.6,984,720和7,605,238中公开的抗ctla-4humab显示以下一个或多个特征:(a)以由biacore分析确定的至少约107m-1,或约109m-1,或约1010m-1至1011m-1或更高的平衡缔合常数(ka)反映的结合亲和力特异性结合人ctla-4;(b)至少约103,约104,或约105m-1s-1的动力学缔合常数(ka);(c)至少约103,约104,或约105m-1s-1的动力学解离常数(kd);和(d)抑制ctla-4与b7-1(cd80)和b7-2(cd86)的结合。可用于本发明的抗ctla-4抗体包括特异性结合人ctla-4并显示至少一个,至少两个,或至少三个前述特征的mab。示例性的临床抗ctla-4抗体是u.s.专利no.6,984,720中公开的人mab10d1(现在称为伊匹单抗并且以市售)。示例性的临床抗ctla-4抗体是u.s.专利no.6,984,720中公开的人mab10d1(现在称为伊匹单抗并且以市售)。伊匹单抗是用于本文公开的方法中的抗ctla-4抗体。伊匹单抗是完全人igg1单克隆抗体,阻断ctla-4与其b7配体的结合,从而刺激t细胞活化和改善晚期黑色素瘤患者的总生存期(os)。可用于本发明方法的另一种抗ctla-4抗体是曲美木单抗(也称为cp-675,206)。曲美木单抗是人igg2单克隆抗ctla-4抗体。曲美木单抗描述于wo/2012/122444,u.s.公布no.2012/263677,或wo公布no.2007/113648a2。可用于所公开组合物的抗ctla-4抗体还包括与人ctla-4特异性结合并与伊匹单抗或曲美木单抗交叉竞争结合人ctla-4或与伊匹单抗或曲美木单抗结合人ctla-4相同表位区域的分离抗体。在某些实施方案中,与伊匹单抗或曲美木单抗交叉竞争结合人ctla-4或与伊匹单抗或曲美木单抗结合人ctla-4相同表位区域的抗体是包含人igg1同种型的重链的抗体。对于人受试者的施用,这些交叉竞争抗体是嵌合抗体,或人源化或人抗体。有用的抗ctla-4抗体还包括上述抗体的抗原结合部分,例如fab,f(ab’)2,fd或fv片段。抗lag-3抗体本发明的抗lag-3抗体与人lag-3结合。结合lag-3的抗体已经公开在国际公布no.wo/2015/042246和u.s.公布no.2014/0093511和2011/0150892。可用于本发明的示例性lag-3抗体是25f7(描述于u.s.公布no.2011/0150892)。可用于本发明的另外的示例性lag-3抗体是bms-986016。在一个实施方案中,可用于该组合物的抗lag-3抗体与25f7或bms-986016交叉竞争。在另一个实施方案中,可用于该组合物的抗lag-3抗体与25f7或bms-986016结合相同的表位。在其他实施方案中,抗lag-3抗体包含25f7或bms-986016的6个cdr。抗cd137抗体抗cd137抗体特异性结合并激活表达cd137的免疫细胞,刺激针对肿瘤细胞的免疫反应,特别是细胞毒性t细胞反应。结合cd137的抗体已公开于u.s.公布no.2005/0095244和u.s.专利no.7,288,638,6,887,673,7,214,493,6,303,121,6,569,997,6,905,685,6,355,476,6,362,325,6,974,863,和6,210,669。在一些实施方案中,抗cd137抗体是urelumab(bms-663513),描述于u.s.专利no.7,288,638(20h4.9-igg4[10c7或bms-663513])。在一些实施方案中,抗cd137抗体是bms-663031(20h4.9-igg1),描述于u.s.专利no.7,288,638。在一些实施方案中,抗cd137抗体是4e9或bms-554271,描述于u.s.专利no.6,887,673。在一些实施方案中,抗cd137抗体是u.s.专利no.7,214,493;6,303,121;6,569,997;6,905,685;或6,355,476中公开的抗体。在一些实施方案中,抗cd137抗体是1d8或bms-469492;3h3或bms-469497;或3e1,描述于u.s.专利no.6,362,325。在一些实施方案中,抗cd137抗体是公开于授权的u.s.专利no.6,974,863中的抗体(例如53a2)。在一些实施方案中,抗cd137抗体是公开于授权的u.s.专利no.6,210,669中的抗体(例如1d8,3b8,或3e1)。在一些实施方案中,该抗体是pfizer的pf-05082566(pf-2566)。在其他实施方案中,可用于本发明的抗cd137抗体与本文公开的抗cd137抗体交叉竞争。在一些实施方案中,抗cd137抗体与本文公开的抗cd137抗体结合相同的表位。在其他实施方案中,可用于本发明的抗cd137抗体包含本文公开的抗cd137抗体的六个cdr。抗kir抗体特异性结合kir的抗体阻断nk细胞上的杀伤细胞免疫球蛋白样受体(kir)与其配体的相互作用。阻断这些受体促进nk细胞的活化,并且潜在地促进后者破坏肿瘤细胞。抗kir抗体的实例已经公开于国际公布no.wo/2014/055648,wo2005/003168,wo2005/009465,wo2006/072625,wo2006/072626,wo2007/042573,wo2008/084106,wo2010/065939,wo2012/071411和wo/2012/160448。可用于本发明的一种抗kir抗体是lirilumab(也称为bms-986015,iph2102或1-7f9的s241p变体),其首先描述于国际公布no.wo2008/084106。可用于本发明的另外的抗kir抗体是1-7f9(也称为iph2101),描述于国际公布no.wo2006/003179。在一个实施方案中,用于本发明组合物的抗kir抗体与lirilumab或i-7f9交叉竞争结合kir。在另一个实施方案中,抗kir抗体与lirilumab或i-7f9结合相同的表位。在其他实施方案中,抗kir抗体包含lirilumab或i-7f9的六个cdr。抗gitr抗体用于与抗pd-1抗体以固定剂量组合的抗gitr抗体可以是与人gitr靶特异性结合的任何抗gitr抗体,并激活糖皮质激素诱导的肿瘤坏死因子受体(gitr)。gitr是在多种类型的免疫细胞表面上表达的tnf受体超家族的成员,该免疫细胞包括调节性t细胞、效应t细胞、b细胞、天然杀伤(nk)细胞和活化的树突细胞)“抗gitr激动剂抗体”)。具体来说,gitr活化增加了效应t细胞的增殖和功能,并且消除了由活化的t调节细胞诱导的抑制。此外,gitr刺激通过增加其他免疫细胞如nk细胞、抗原呈递细胞和b细胞的活性来促进抗肿瘤免疫。抗gitr抗体的实例已经公开在国际公布no.wo/2015/031667,wo2015/184,099,wo2015/026,684,wo11/028683和wo/2006/105021,u.s.专利no.7,812,135和8,388,967以及u.s.公布no.2009/0136494,2014/0220002,2013/0183321和2014/0348841。在一个实施方案中,可用于本发明的抗gitr抗体是trx518(描述于例如schaer等curropinimmunol.(2012)apr;24(2):217-224,和wo/2006/105021)。在另一个实施方案中,可用于本发明的抗gitr抗体是mk4166或mk1248,以及描述于wo11/028683和u.s.8,709,424中的抗体,包括例如包含seqidno:104的vh链和包含seqidno:105的vl链,其中所述的seqidno来自wo11/028683或u.s.8,709,424)。在某些实施方案中,抗gitr抗体是wo2015/031667中公开的抗gitr抗体,例如包含vhcdr1-3(分别包含wo2015/031667的seqidno:31,71和63)和vlcdr1-3(包含wo2015/031667的seqidno:5,14和30)的抗体。在某些实施方案中,抗gitr抗体是公开于wo2015/184099中的抗gitr抗体,例如抗体hum231#1或hum231#2或其cdr,或其衍生物(例如pab1967,pab1975或pab1979)。在某些实施方案中,抗gitr抗体是公开于jp2008278814,wo09/009116,wo2013/039954,us20140072566,us20140072565,us20140065152,或wo2015/026684的抗gitr抗体,或是inbrx-110(inhibrx),lkz-145(novartis),或medi-1873(medimmune)。在某些实施方案中,抗gitr抗体是pct/us2015/033991中描述的抗gitr抗体(例如,包含28f3,18e10或19d3的可变区的抗体)。例如,抗gitr抗体可以是包含以下vh和vl链或其cdr的抗体:vh:qvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaviwyegsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarggsmvrgdyyygmdvwgqgttvtvs(seqidno:1),和vl:aiqltqspsslsasvgdrvtitcrasqgissalawyqqkpgkapklliydasslesgvpsrfsgsgsgtdftltisslqpedfatyycqqfnsypytfgqgtkleik(seqidno:2);或vh:qvqlvesgggvvqpgrslrlscaasgftfssygfhwvrqapgkglewvaviwyagsnkfyadsvkgrftisrdnskntlylqmnslraedtavyycarggqldyyyyyvmdvwgqgttvtvss(seqidno:3),和vl:diqmtqspsslsasvgdrvtitcrasqgisswlawyqqkpekapksliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqynsypytfgqgtkleik(seqidno:4);或vh:vqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaviwyagsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarggriavafyysmdvwgqgttvtvss(seqidno:5),和vl:diqmtqspsslsasvgdrvtitcrasqgisswlawyqqkpekapksliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqynsypytfgqgtkleik(seqidno:6).在某些实施方案中,包含一对上述vh和vl轻链或其cdr的抗体包含野生型或突变的(例如从而是无效应物的(effectorless))igg1同种型的重链恒定区。在一个实施方案中,抗gitr抗体包含以下重链和轻链氨基酸序列:重链:qvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaviwyegsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarggsmvrgdyyygmdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seqidno:7),和轻链:aiqltqspsslsasvgdrvtitcrasqgissalawyqqkpgkapklliydasslesgvpsrfsgsgsgtdftltisslqpedfatyycqqfnsypytfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:8),或重链:qvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaviwyegsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycarggsmvrgdyyygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapeaegapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpssiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seqidno:9),和轻链:aiqltqspsslsasvgdrvtitcrasqgissalawyqqkpgkapklliydasslesgvpsrfsgsgsgtdftltisslqpedfatyycqqfnsypytfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:8).在某些实施方案中,用于本发明组合物的抗gitr抗体与本文所述的抗gitr抗体(例如trx518,mk4166或包含本文所述的vh结构域和vl结构域氨基酸序列的抗体)交叉竞争。在一些实施方案中,用于本发明组合物的抗gitr抗体与本文所述的抗gitr抗体(例如trx518,mk4166或包含本文所述的vh结构域和vl结构域氨基酸序列的抗体)结合相同的表位。在某些实施方案中,抗gitr抗体包含trx518,mk4166或包含本文所述的vh结构域和vl结构域氨基酸序列的抗体的六个cdr。示例性药物组合物包含抗pd-1抗体,例如纳武单抗,mk-3475(派姆单抗)或atezolizumab,和抗gitr激动剂抗体,例如trx518,mk4166或包含本文所述的vh结构域和vl结构域氨基酸序列的抗体,其中抗pd-1抗体的量(例如浓度(例如mg/ml)或重量(例如mg))与抗gitr抗体的量(分别例如浓度(例如mg/ml)或重量(例如mg))的比例为约1∶1-20;约1∶1-10;约1∶1-5;约1∶2-5;约1∶2-3;约1∶3-5;约1-20∶1;约1-10∶1;约1-5∶1;约2-5∶1;约2-3∶1;或约3-5∶1。例如,(i)抗pd-1或抗pd-l1抗体与(2)抗gitr抗体的比例可以是1∶10,1∶9,1∶8,1∶7,1∶6,1∶5,1∶4,1∶3,1∶2,1∶1,2∶1,3∶1,4∶1,5∶1,6∶1,7∶1,8∶1,9∶1或10∶1。“∶”表示“比”,例如,“1∶1-20”是指1比选自1-20的数字的比例。该组合可以每周,每两周,每三周一次或每月施用。在某些实施方案中,抗pd-1抗体或抗pd-l1抗体,例如纳武单抗、派姆单抗或atezolizumab与抗gitr抗体共配制,其中抗gitr抗体为以下的剂量,例如绝对剂量:0.1至1000mg,例如0.1至100mg,0.5至100mg,1至100mg,5至100mg,10至100mg,50至100mg,0.1至300mg,0.5至300mg,1至300mg,5至300mg,10至300mg,50至300mg,100至300mg或200至300mg。可以与抗pd-1或抗pd-l1抗体共配制的抗gitr抗体的示例性量包括约0.1mg,约0.3mg,约0.5mg,约1mg,约3mg,约10mg,约30mg,约100mg,约200mg,约240mg,约250mg,约300mg,约400mg,约500mg,约600mg,约700mg,约800mg,约900mg或约1000mg。在某些实施方案中,抗pd-1或抗pd-l1抗体与抗gitr抗体共配制,其中抗pd-1或pd-l1抗体的剂量是以下剂量(例如,绝对剂量):100-300mg,例如200-300mg,220-260mg,230-250mg或240mg,例如约60mg,约80mg,约100mg,约120mg,约140mg,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280或约300mg。在示例性实施方案中,抗pd-1抗体或抗pd-l1抗体,例如纳武单抗、派姆单抗或atezolizumab与抗gitr抗体共配制,所述抗gitr抗体例如包含以下的抗体:(i)分别包含seqidno:1和2的氨基酸序列,分别包含seqidno:3和4的氨基酸序列,或分别包含seqidno:5和6的氨基酸序列的vh和vl结构域,或任何这些对可变区的vhcdr1、cdr2、cdr3和vlcdr1、cdr2和cdr3,或(ii)分别包含seqidno7和8的氨基酸序列,或分别包含seqidno:7和9的氨基酸序列的重链和轻链,按以下的固定剂量比:80-300mg的抗pd-1或抗pd-l1抗体比1-1000mg的抗gitr抗体;80-300mg的抗pd-1或抗pd-l1抗体比1-100mg的抗gitr抗体;80-300mg的抗pd-1或抗pd-l1抗体比10-100mg的抗gitr抗体;80-300mg的抗pd-1或抗pd-l1抗体比10-300mg的抗gitr抗体或80-300mg的抗pd-1或抗pd-l1抗体比100-300mg的抗gitr抗体。在示例性实施方案中,纳武单抗与抗gitr抗体共配制,其中纳武单抗的剂量为约80mg或约240mg。固定剂量组合可以静脉内输注施用,例如每约1,约2,约3或约4周静脉内输注施用约30,约30-60,约60或约60-90分钟。在某些实施方案中,约3mg/kg抗pd-1抗体,例如纳武单抗,可与以下抗体例如以固定剂量组合一起施用:约0.1-10mg/kg,约0.1-5mg/kg,约0.5-10mg/kg,约0.5-5mg/kg,约0.5-2mg/kg,约1-2mg/kg或约2-5mg/kg抗gitr抗体,例如trx518,mk4166,或包含本文所述的重链和轻链或可变区或cdr的抗体,例如静脉内输注,例如每约1,约2,约3或约4周静脉内输注约30,约30-60,约60或约60-90分钟。在某些实施方案中,约2mg/kg抗pd-1抗体,例如纳武单抗或mk-3475,与以下抗体例如以固定剂量组合一起施用:约0.1-10mg/kg,约0.1-5mg/kg,约0.5-10mg/kg,约0.5-5mg/kg,约0.5-2mg/kg,约1-2mg/kg或约2-5mg/kg抗gitr抗体,例如mk4166或包含本文所述的重链和轻链或可变区或cdr的抗体,例如静脉内输注,例如每约1,约2,约3或约4周静脉内输注约30,约30-60,或约60分钟。可以计算以mg/kg计的抗体的量,以确定固定剂量比例制剂所需抗体的重量(mg)或浓度(mg/ml)。在某些实施方案中,抗pd-1抗体和抗gitr抗体作为冷冻干燥组合物例如在小瓶或双室注射器中提供。冷冻干燥组合物可以包含例如约50mg抗pd-1或抗pd-l1抗体,例如纳武单抗,mk3475或atezolizumab和约5-250mg,约10-250,约30-100mg,约30-70mg或约50mg抗gitr抗体,例如trx-518,mk4166或包含本文所述的重链和轻链或可变区或cdr的抗体。其他抗体在一些实施方案中,与第一抗体组合的第二抗体是抗tgfβ抗体,如国际公布no.wo/2009/073533中公开的。在一些实施方案中,第二抗体是抗il-10抗体,如国际公布no.wo/2009/073533中公开的。在一些其他实施方案中,第二抗体是抗b7-h4抗体,如国际公布no.wo/2009/073533中公开的。在某些实施方案中,第二抗体是抗fas配体抗体,如国际公布no.wo/2009/073533中公开的。在一些实施方案中,第二抗体是抗cxcr4抗体,如u.s.公布no.2014/0322208中公开的(例加ulocuplumab(bms-936564))。在一些实施方案中,第二抗体是抗间皮素抗体,如u.s.专利no.8,399,623中公开的。在一些实施方案中,第二抗体是抗her2抗体,例如赫赛汀(u.s.专利no.5,821,337)、曲妥珠单抗(trastuzumab)或ado-曲妥珠单抗emtansine(ado-trastuzumabemtansine)(kadcyla,例加wo/2001/000244)。在实施方案中,与第一抗体组合的第二抗体是抗cd27抗体。在实施方案中,抗cd-27抗体是varlilumab(也称为″cdx-1127″和″1f5″),其是作为人cd27的激动剂的人igg1抗体,公开于例如u.s.专利no.9,169,325。在一些实施方案中,与第一抗体组合的第二抗体是抗cd73抗体。在某些实施方案中,抗cd73抗体是cd73.4.igg2c219s.igg1.1f。制剂、药物组合物和剂量在本发明的制剂中,将第一抗体和第二抗体配制在本发明的单一组合物中,例如含有第一抗体和第二抗体和药学上可接受的载体的药物组合物中。在一个实施方案中,第一抗体是抗pd-1抗体。在另一个实施方案中,第一抗体是抗pd-l1抗体。抗pd-l1抗体可以代替抗pd-1抗体用于本文所述的任何组合物或方法中。如本文所用,“药学上可接受的载体”包括生理上相容的任何和所有溶剂、分散介质、包衣、抗细菌和抗真菌剂、等张和吸收延迟剂等。在某些实施方案中,含有抗体的组合物的载体适用于静脉内、肌肉内、皮下、肠胃外、脊髓或表皮施用(例如通过注射或输注)。本发明的药物组合物可以包括一种或多种药学上可接受的盐、抗氧化剂、水性和非水性载体,和/或佐剂,例如防腐剂、润湿剂、乳化剂和分散剂。在一个实施方案中,包含第一抗体和第二抗体的组合物提供在一次使用的小瓶中。在另一个实施方案中,包含第一抗体和第二抗体的组合物提供在多次使用的小瓶中。在其他实施方案中,第一抗体(例如抗pd-1抗体或抗pd-l1抗体)与任何已知的第二抗体配制。在一些实施方案中,第二抗体是抗ctla4抗体。在某些实施方案中,抗ctla4抗体是曲美木单抗或伊匹单抗。在一些实施方案中,第二抗体是抗cd137抗体。在一些实施方案中,抗cd137抗体是urelumab。在一些实施方案中,第二抗体是抗lag3抗体。在一些实施方案中,抗lag3抗体为25f7。在一些实施方案中,第二抗体是抗gitr抗体。在一些实施方案中,抗gitr抗体是mk4166,trx518,包含pct/us2015/033991中描述的抗gitr抗体的cdr、可变链或重链和轻链(例如,28f3、18e10或19d3的那些)的抗体,或本文所述的任何其他抗gitr抗体。在一些实施方案中,第二抗体是抗kir抗体。在一些实施方案中,抗kir抗体是1-7f9或lirilumab。在一些实施方案中,第二抗体是抗tgfβ抗体、抗il-10抗体、抗b7-h4抗体、抗fas配体抗体、抗cxcr4抗体、抗间皮素抗体、抗cd27抗体、抗cd73抗体或其任何组合。在一些实施方案中,第一抗体和第二抗体以固定剂量(即固定比例)存在于组合物中。在其他实施方案中,该固定剂量为至少约1∶200至至少约200∶1,至少约1∶150至至少约150∶1,至少约1∶100至至少约100∶1,至少约1∶75至至少约75∶1,至少约1∶50至至少约50∶1,至少约1∶25至至少约25∶1,至少约1∶10至至少约10∶1,至少约1∶5至至少约5∶1,至少约1∶4至至少约4∶1,至少约1∶3至至少约3∶1,或至少约1∶2至至少约2∶1mg抗pd-1抗体(或抗pd-l1抗体)比mg第二抗体。在一些实施方案中,该固定剂量为至少约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶6,约1∶7,约1∶8,约1∶9,约1∶10,约1∶15,约1∶20,约1∶30,约1∶40,约1∶50,约1∶60,约1∶70,约1∶80,约1∶90,约1∶100,约1∶120,约1∶140,约1∶160,约1∶180,或约1∶200抗pd-1抗体(或抗pd-l1抗体)比第二抗体。在一些实施方案中,该固定剂量为至少约2∶1,约3∶1,约4∶1,约5∶1,约6∶1,约7∶1,约8∶1,约9∶1,约10∶1,约15∶1,约20∶1,约30∶1,约40∶1,约50∶1,约60∶1,约70∶1,约80∶1,约90∶1,约100∶1,约120∶1,约140∶1,约160∶1,约180∶1,或约200∶1mg第一抗体比mg第二抗体。在其他实施方案中,组合物包含一定比例(例如200∶1至1∶200,100∶1至1∶100,20-1∶1至1∶1-20,或本文公开的任何比例)的第一抗体和第二抗体,其中所述组合物具有一个或多个选自以下的特征:(i)在2℃至8℃储存6个月后,组合物中的聚集与参考组合物(即,包含第一抗体或第二抗体的组合物)中的聚集相当;(ii)在2℃至8℃储存6个月后,组合物中的碎裂与参考组合物(即,包含第一抗体或第二抗体的组合物)中的聚集相当;(iii)在2℃至8℃储存6个月后,组合物中第一抗体或第二抗体的脱酰胺化与参考组合物(即,包含第一抗体或第二抗体的组合物)中抗体的脱酰胺化相当;(iv)在2℃至8℃储存6个月后,组合物中颗粒物质的水平与参考组合物(即,包含第一抗体或第二抗体的组合物)中特定物质的水平相当;和(v)其任何组合。在其他实施方案中,组合物包含一定比例(例如200∶1至1∶200,100∶1至1∶100,20-1∶1至1∶1-20,或本文公开的任何比例)的第一抗体和第二抗体,其中所述组合物具有一个或多个选自以下的特征:(i)在25℃储存6个月后,组合物中的聚集与参考组合物(即,包含第一抗体或第二抗体的组合物)中的聚集相当;(ii)在25℃储存6个月后,组合物中的碎裂与参考组合物(即,包含第一抗体或第二抗体的组合物)中的聚集相当;(iii)在25℃储存6个月后,组合物中第一抗体或第二抗体的脱酰胺化与参考组合物(即,包含第一抗体或第二抗体的组合物)中抗体的脱酰胺化相当;(iv)在25℃储存6个月后,组合物中颗粒物质的水平与参考组合物(即,包含第一抗体或第二抗体的组合物)中特定物质的水平相当;和(v)其任何组合。在一些实施方案中,组合物的聚集通过组合物中高分子量(hmw)物质的水平来测量,其可通过尺寸排阻高效液相色谱(se-hplc)检测。在一些实施方案中,通过组合物中低分子量(lmw)物质的水平来测量组合物的碎裂,其通过se-hplc检测。在一些实施方案中,通过组合物中的酸性电荷变体的水平来测量组合物的脱酰胺化,其通过阳离子交换色谱(cex)或成像毛血管等电聚焦(icief)检测。在一些实施方案中,组合物中抗pd-1抗体的量为至少约60mg,约80mg,约100mg,约120mg,约140,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg,或约300mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约310mg,约320mg,约330mg,约340mg,约350mg,约360mg,约370mg,约380mg,约390mg,约400mg,约410mg,约420mg,约430mg,约440mg,约450mg,约460mg,约470mg,约480mg,约490mg,或约500mg。在一些实施方案中,组合物中抗pd-1抗体的量为约60mg至约300mg,约60mg至约100mg,约100mg至约200mg,或约200mg至约300mg。在一些实施方案中,组合物中抗pd-1抗体的量为约300mg至约500mg,约300mg至约450mg,约300mg至约400mg,约300mg至约350mg,约350mg至约500mg,约400mg至约500mg,或约450mg至约500mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约80mg,约160mg,或约240mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约240mg或至少约80mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约360mg或至少约480mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约0.5mg/kg,至少约1mg/kg,至少约2mg/kg,至少约3mg/kg或至少约5mg/kg。在一些实施方案中,组合物中抗pd-1抗体的量为约0.5mg/kg至约5mg/kg,约0.5mg/kg至约5mg/kg,约0.5mg/kg至约3mg/kg或约0.5mg/kg至约2mg/kg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约1mg/kg。在一些实施方案中,抗pd-1抗体是纳武单抗或派姆单抗。在一些实施方案中,抗pd-1抗体是派姆单抗,组合物中抗pd-1抗体的量为至少约50mg,至少约75mg,至少约100mg,至少约150mg,至少约200mg,至少约250mg,或至少约300mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约100mg或至少约200mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约300mg,至少约350mg,至少约400mg,至少约450mg,或至少约500mg。在一些实施方案中,抗pd-1抗体是派姆单抗,用于治疗疾病或病症的抗pd-1抗体的量可以是基于重量的剂量,例如至少约0.5mg/kg,至少约1mg/kg,至少约2mg/kg,至少约3mg/kg,至少约5mg/kg,至少约10mg/kg,至少约15mg/kg或至少约20mg/kg。在一些实施方案中,可用于治疗疾病或病症的抗pd-1抗体的量是基于重量的剂量,例如至少约1mg/kg,至少约2mg/kg或至少约10mg/kg。在一些实施方案中,第二抗体是抗ctla4抗体,固定剂量为约1∶1,约3∶1或约1∶3mg抗pd-1抗体比mg抗ctla4抗体。在一些实施方案中,组合物中抗ctla4抗体的量为至少约60mg,约80mg,约100mg,约120mg,约140,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg或约300mg。在一些实施方案中,组合物中抗ctla4抗体的量为约60mg至约300mg,约60mg至约100mg,约100mg至约200mg,或约200mg至约300mg。在一些实施方案中,组合物中抗ctla4抗体的量为至少约80mg,约160mg或约240mg。在一些实施方案中,组合物中抗ctla4抗体的量为至少约240mg。在一些实施方案中,组合物中抗ctla4抗体的量为至少约1mg/kg,至少约2mg/kg,至少约3mg/kg或至少约5mg/kg。在一些实施方案中,组合物中抗ctla4抗体的量用作基于重量的剂量,例如约1mg/kg至约10mg/kg,约1mg/kg至约5mg/kg或约2mg/kg至约5mg/kg。在一些实施方案中,组合物中抗ctla4抗体的量为至少约3mg/kg。在一些实施方案中,(i)x量为约240mg,y量为约80mg,(ii)x量为约80mg,y量为约80mg;(iii)x量为约160mg,y量为约160mg;(iv)x量为约240mg,y量为约240mg;或(v)x量为约80mg,y量为约240mg。在一些实施方案中,第二抗体是抗kir抗体,固定剂量为约30∶1,约10∶1,约3∶1,约1∶1,约1∶2或约3∶10mg抗pd-1抗体比mg抗kir抗体。在一些实施方案中,第二抗体是抗lag3抗体,并且固定剂量为约80∶3,约80∶1,约12∶1,约3∶1或约1∶1mg抗pd-1抗体比mg抗lag3抗体。在一些实施方案中,组合物中抗lag3抗体的量为至少约60mg,约80mg,约100mg,约120mg,约140,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg,约300mg或约350mg。在一些实施方案中,组合物中抗lag3抗体的量为约60至约350mg,约60至约300mg,约100至约300mg,或约150至约250mg。在一些实施方案中,抗lag3抗体的量为至少约240mg。在一些实施方案中,第二抗体是抗cd137抗体,固定剂量为约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶10,约10∶1,约5∶1,约4∶1或约2∶1mg抗pd-1抗体比mg抗cd137抗体。在一些实施方案中,组合物中抗cd137抗体的量为至少约1mg,至少约2mg,至少约3mg,至少约4mg,至少约5mg,至少约6mg,至少约7mg,至少约8mg,至少约9mg,至少约10mg,至少约12mg,至少约15mg,或至少约20mg。在一些实施方案中,组合物中抗cd137抗体的量为约lmg至约20mg,约1mg至约15mg,约5mg至约12mg或约5mg至约10mg。在一些实施方案中,组合物中抗cd137抗体的量为至少约8mg。在一些实施方案中,第二抗体是抗cd73抗体,固定剂量为约1∶1,约1∶2,约1∶3,约1∶4,约1∶5,约1∶10,约10∶1,约5∶1,约4∶1或约2∶1mg抗pd-1抗体比mg抗cd73抗体。在一些实施方案中,组合物中抗cd73抗体的量为约100mg至约2000mg或约150mg至约1600mg。在一些实施方案中,组合物中抗cd73抗体的量为至少约100mg,150mg,200mg,300mg,500mg,600mg,800mg,1000mg,1200mg或1600mg。在某些实施方案中,抗cd73抗体cd73.4.igg2c219s.igg1.1f和纳武单抗以以下组合剂量之一的固定剂量施用:每两周50mg抗cd73抗体和240mg纳武单抗;每三周50mg抗cd73抗体和360mg纳武单抗;每两周150mg抗cd73抗体和240mg纳武单抗;每三周150mg抗cd73抗体和360mg纳武单抗;每两周300mg抗cd73抗体和240mg纳武单抗;每三周300mg抗cd73抗体和360mg纳武单抗;每两周600mg抗cd73抗体和240mg纳武单抗;每三周600mg抗cd73抗体和360mg纳武单抗;每两周1200mg抗cd73抗体和240mg纳武单抗;每三周1200mg抗cd73抗体和360mg纳武单抗;每两周1600mg抗cd73抗体和240mg纳武单抗;每三周1600mg抗cd73抗体和360mg纳武单抗;每两周2000mg抗cd73抗体和240mg纳武单抗;每三周2000mg抗cd73抗体和360mg纳武单抗。在一些实施方案中,pd-1抗体和第二抗体使用两种抗体的当前制剂组合(例如,将基于柠檬酸盐的缓冲剂中的2ml抗pd-1抗体与基于tris的缓冲剂中的2ml抗ctla4抗体在没有缓冲剂交换的情况下组合)。在一些实施方案中,组合物包含一种或多种另外的选自以下的组分:增量剂、稳定剂、螯合剂、表面活性剂、缓冲剂及其任何组合。在一些实施方案中,缓冲剂包含柠檬酸盐缓冲剂,tris缓冲剂,tris-cl缓冲剂,组氨酸缓冲剂,tae缓冲剂,hepes缓冲剂,tbe缓冲剂,磷酸钠缓冲剂,mes缓冲剂,硫酸铵缓冲剂,磷酸钾缓冲剂,硫氰酸钾缓冲剂,琥珀酸盐缓冲剂,酒石酸盐缓冲剂,dipso缓冲剂,heppso缓冲剂,popso缓冲剂,pipes缓冲剂,pbs缓冲剂,mops缓冲剂,乙酸盐缓冲剂,磷酸盐缓冲剂,二甲胂酸盐缓冲剂,甘氨酸缓冲剂,硫酸盐缓冲剂,咪唑缓冲剂,盐酸胍缓冲剂,磷酸盐-柠檬酸盐缓冲剂,硼酸盐缓冲剂,丙二酸盐缓冲剂,3-甲基吡啶缓冲剂,2-甲基吡啶缓冲剂,4-甲基吡啶缓冲剂,3,5-二甲基吡啶缓冲剂,3,4-二甲基吡啶缓冲剂,2,4-二甲基吡啶缓冲剂,aces,二乙基丙二酸盐(diethylmalonate)缓冲剂,n-甲基咪唑缓冲剂,1,2-二甲基咪唑缓冲剂,taps缓冲剂,双tris缓冲剂,l-精氨酸缓冲剂,乳酸盐缓冲剂,乙醇酸盐缓冲剂。在一些实施方案中,将pd-1抗体和第二抗体配制在缓冲剂中,所述缓冲剂基于两种单独抗体制剂之一的缓冲剂条件。在一些实施方案中,使用的缓冲剂条件是抗pd-1抗体的缓冲剂条件。在一些实施方案中,抗pd-1抗体是纳武单抗,并且将两种抗体配制在纳武单抗的基于柠檬酸盐的缓冲剂系统中。在一些实施方案中,缓冲剂是柠檬酸盐缓冲剂。在一些实施方案中,将pd-1抗体和第二抗体配制在与两种抗体中的任一种自身的缓冲剂条件不同的缓冲剂条件中。在一些实施方案中,缓冲剂是基于柠檬酸盐的缓冲剂。在一些实施方案中,缓冲剂中柠檬酸盐的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在一些实施方案中,柠檬酸盐的浓度为约5mm至约50mm,在一些实施方案中为约5mm至约40mm,约5mm至约30mm,约5mm至约20mm,约5mm至约15mm,约10mm至约30mm,或约15mm至约25mm。在一些实施方案中,柠檬酸盐的浓度为约10mm。在一些实施方案中,柠檬酸盐的浓度为约20mm。在一些实施方案中,使用的缓冲剂是基于tris的缓冲剂。在一些实施方案中,tris缓冲剂是tris-cl缓冲剂。在一些实施方案中,缓冲剂中tris-cl的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在一些实施方案中,tris-cl的浓度为约5mm至约50mm,约10mm至约50mm,约10mm至约40mm,约10mm至约30mm或约15mm至约25mm。在一些实施方案中,tris-cl的浓度为约20mm。在一些实施方案中,使用的缓冲剂是基于组氨酸的缓冲剂。在一些实施方案中,组氨酸的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在一些实施方案中,组氨酸的浓度为约5mm至约50mm,约5mm至约40mm,约5mm至约30mm,约5mm至约25mm或约10mm至约15mm。在一些实施方案中,组氨酸的浓度为约20mm。在一些实施方案中,使用的缓冲剂是tris-柠檬酸盐缓冲剂。在一些实施方案中,tris-cl的浓度为至少约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm,柠檬酸盐的浓度为至少约2mm,约5mm,约10mm,约15mm,约20mm,约25mm,约30mm,约35mm,约40mm或约50mm。在一些实施方案中,tris-cl的浓度为约5至约20mm,约5至约15mm,或约10至约15mm,柠檬酸盐的浓度为约1mm至约15mm,约1mm至约10mm,或约5mm至约10mm。在一些实施方案中,tris-cl的浓度为约13.3mm,柠檬酸盐的浓度为约6.7mm。在一些实施方案中,组合物的ph为至少约5,约5.1,约5.2,约5.3,约5.4,约5.5,约5.6,约5.7,约5.8,约5.9,约6.0,约6.1,约6.2,约6.3,约6.4,约6.5,约6.6,约6.7,约6.8,约6.9,约7.0,约7.1,约7.2,约7.3,约7.4,约7.5,约7.6,约7.7,约7.8,约7.9,或约8.0。在一些实施方案中,组合物的ph为约5.0至约8.0,约5.5至约6.5,约6.0至约7.0,或约6.5至约7.5。在一些实施方案中,ph为约6.0,在其他实施方案中,ph为约7.0。在其他实施方案中,ph为约6.2。在其他实施方案中,ph为约6.5。在其他实施方案中,ph为约6.6。在其他实施方案中,ph为约5.5。在一些实施方案中,本发明的组合物还包含增量剂。增量剂可以选自nacl,甘露醇,甘氨酸,丙氨酸及其任何组合。在其他实施方案中,本发明的组合物包含稳定剂。稳定剂可以选自蔗糖,海藻糖,棉子糖,精氨酸;或其任何组合。在其他实施方案中,本发明的组合物包含表面活性剂。表面活性剂可以选自聚山梨醇酯80(ps80),聚山梨醇酯20(ps20)及其任何组合。在某些实施方案中,组合物还包含螯合剂。螯合剂可以选自二亚乙基三胺五乙酸(dtpa),乙二胺四乙酸,次氮基三乙酸及其任何组合。在一个实施方案中,组合物包含nacl,甘露醇,三胺五乙酸(penteticacid)(dtpa),蔗糖,ps80及其任何组合。在另一个实施方案中,组合物包含以下浓度的nacl:至少约5mm,至少约10mm,至少约15mm,至少约20mm,至少约25mm,至少约30mm,至少约35mm,至少约40mm,至少约45mm,至少约50mm,至少约60mm,至少约70mm,至少约75mm,至少约80mm,至少约90mm,至少约100mm,至少约110mm,至少约120mm,至少约130mm,至少约140mm,至少约150mm,至少约175mm,至少约200mm,至少约225mm,至少约250mm,至少约275mm,至少约300mm,至少约350mm,至少约400mm,至少约450mm或至少约450mm。在其他实施方案中,组合物包含约10至约200mmnacl,约25至约150mmnacl,约40至约125mmnacl,约25至约75mmnacl,约50至约100mmnacl或约75至125mmnacl。在一些实施方案中,组合物包含约100mmnacl。在某些实施方案中,组合物包含约50mmnacl。在其他实施方案中,组合物包含约83.3mmnacl。在其他的实施方案中,组合物包含约96.15mmnacl。在特定实施方案中,组合物包含约78.57mmnacl。在某些实施方案中,组合物包含以下浓度的甘露醇(%w/v)usp:至少约0.25%,至少约0.5%,至少约0.75%,至少约1%,至少约1.5%,至少约2%,至少约2.5%,至少约3%,至少约3.5%,至少约4%,至少约4.5%,至少约5%,至少约7.5%或至少约10%。在其他实施方案中,组合物包含约0.5%至约5%的甘露醇,约0.5%至约4%的甘露醇,约0.5%至约1.5%的甘露醇,约1%至约2%的甘露醇,或约2.5%至约3.5%的甘露醇。在其他实施方案中,组合物包含约1%的甘露醇。在进一步其他实施方案中,组合物包含约3.0%的甘露醇。在一些实施方案中,组合物包含约1.67%的甘露醇。在某些实施方案中,组合物包含约1.15%的甘露醇。在特定实施方案中,组合物包含约1.86%的甘露醇。在其他实施方案中,组合物包含以下浓度的三胺五乙酸(penteticacid)(dtpa)usp:至少约5μm,至少约10μm,至少约15μm,至少约20μm,至少约25μm,至少约30μm,至少约40μm,至少约50μm,至少约60μm,至少约70μm,至少约75μm,至少约80μm,至少约90μm,至少约100μm,至少约110μm,至少约120μm,至少约130μm,至少约140μm,至少约150μm,至少约175μm或至少约200μm。在一些实施方案中,组合物包含约10μm至约200μmdtpa,约10μm至约150μmdtpa,约10μm至约100μmdtpa,约10μm至约30μmdtpa,约50μm至约100μmdtpa,或约75μm至约125μmdtpa。在其他实施方案中,组合物包含约100μm的dtpa。在某些实施方案中,组合物包含约20μm的dtpa。在其他实施方案中,组合物包含约73.3μm的dtpa。在特定的实施方案中,组合物包含约50μm的dtpa。在具体实施方案中,组合物包含约93.85μm的dtpa。在某些实施方案中,组合物包含约65.71μm的dtpa。在一些实施方案中,组合物包含以下浓度的聚山梨醇酯80,nf(ps80)(%w/v):至少约0.005%,至少约0.01%,至少约0.015%,至少约0.02%,至少约0.03%,至少约0.04%,至少约0.05%,至少约0.06%,至少约0.07%,至少约0.08%,至少约0.09%,或至少约0.1%。在其他实施方案中,组合物包含约0.005%至约0.1%ps80,约0.005%至约0.02%ps80,约0.005%至约0.05%ps80,约0.01%至约0.02%ps80,约0.02%至约0.1%ps80或约0.01%至约0.03%ps80。在其他实施方案中,组合物包含浓度约为0.01%的ps80。在其他实施方案中,组合物包含浓度为约0.04%的ps80。在一些实施方案中,组合物包含浓度为约0.013%的ps80。在特定实施方案中,组合物包含浓度为约0.05%的ps80。在一些实施方案中,组合物包含浓度为约0.02%的ps80。在其他实施方案中,组合物包含浓度为约0.012%的ps80。在具体实施方案中,组合物包含浓度为约0.23%的ps80。在某些实施方案中,组合物包含以下浓度的蔗糖(%w/v):至少约1%,至少约2%,至少约3%,至少约4%,至少约4.5%,至少约5%,至少约5.5%,至少约6%,至少约6.5%,至少约7%,至少约7.5%,至少约8%,至少约8.5%,至少约9%,至少约9.5%,至少约10%,至少约12%或至少约15%蔗糖。在其他实施方案中,组合物包含约1%至约10%,约2%至约10%,约5%至约10%,约5%至约7%,或约7.5%至约10%蔗糖。在其他实施方案中,组合物包含约6%的蔗糖。在其他实施方案中,组合物包含约8.5%的蔗糖。在其他实施方案中,组合物包含约8.0%的蔗糖。在某些实施方案中,组合物在tris-柠檬酸盐缓冲剂中包含纳武单抗和伊匹单抗。在一些实施方案中,组合物在缓冲剂中包含1∶1比例的纳武单抗与伊匹单抗,所述缓冲剂包含约13.3mmtris(或13.3mmtris±10%,20%,30%,40%,或50%),约6.7mm柠檬酸盐(或6.7mm柠檬酸盐±10%,20%,30%,40%或50%),约1.67%甘露醇(1.67%甘露醇±10%,20%,30%,40%或50%),约83.3mmnacl(或83.3mmnacl±10%,20%,30%,40%或50%),约73.3μmdtpa(或73.3μmdtpa±10%,20%,30%,40%或50%)和约0.013%的ps80(或0.013%ps80±10%,20%,30%,40%或50%),ph为约6.2。在一些实施方案中,组合物在tris-柠檬酸盐缓冲剂中包含3∶1比例的纳武单抗与伊匹单抗,所述tris-柠檬酸盐缓冲剂包含约1.15%甘露醇(或1.15%甘露醇±10%,20%,30%,40%或50%),约96.15mmnacl(或96.15mmnacl±10%,20%,30%,40%或50%),约93.85μmdtpa(或93.85μmdtpa±10%,20%,30%,40%或50%)和约0.012%ps80(或0.012%ps80±10%,20%,30%,40%或50%),ph为约6.6。在一些实施方案中,组合物在tris-柠檬酸盐缓冲剂中包含1∶3比例的纳武单抗与伊匹单抗,该tris-柠檬酸盐缓冲剂包含约1.86%甘露醇(或1.86%甘露醇±10%,20%,30%,40%,或50%),约78.57mmnacl(或78.57mmnacl±10%,20%,30%,40%或50%),约65.71μmdtpa(或65.71μmdtpa±10%,20%,30%,40%或50%)和约0.023%的ps80(或0.023%ps80±10%,20%,30%,40%或50%),ph为约6.0。在其他实施方案中,组合物在组氨酸缓冲剂中包含纳武单抗和伊匹单抗。在一些实施方案中,组合物在20mm组氨酸缓冲剂(或20mm组氨酸缓冲剂±10%,20%,30%,40%或50%)中包含3∶1比例的纳武单抗与伊匹单抗,该组氨酸缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%,或50%),约50μmdtpa(或50μmdtpa±10%,20%,30%,40%或50%),约6%蔗糖(或6%蔗糖±10%,20%,30%,40%或50%)和约0.05%的ps80(或0.05%ps80±10%,20%,30%,40%或50%),ph为约6。在一些实施方案中,组合物在约20mm组氨酸缓冲剂中包含3∶1比例的纳武单抗与伊匹单抗,该组氨酸缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%,或50%),约50μμmdtpa(或50μmdtpa±10%,20%,30%,40%或50%),约6%蔗糖(或6%蔗糖±10%,20%,30%,40%或50%),和约0.05%的ps80(或0.05%ps80±10%,20%,30%,40%或50%),ph为约7。在一些实施方案中,组合物在约20mm组氨酸缓冲剂(或20mm组氨酸缓冲剂±10%,20%,30%,40%,或50%)中包含3∶1比例的纳武单抗与伊匹单抗,该组氨酸缓冲剂包含约50μmdtpa(或50μmdtpa±10%,20%,30%,40%或50%),约8.5%蔗糖(或8.5%蔗糖±10%,20%,30%,40%或50%)和约0.05%ps80(或0.05%ps80±10%,20%,30%,40%或50%),ph为约6。在一些实施方案中,组合物在组氨酸缓冲剂(20mm±10%,20%,30%,40%,或50%)中包含1∶1,3∶1或1∶3比例的纳武单抗与伊匹单抗,该组氨酸缓冲剂包含5μmdtpa(或50μmdtpa±10%,20%,30%,40%或50%),0.05%ps80(或0.05%ps80±10%,20%,30%,40%或50%)和8.0%蔗糖(或8.0%蔗糖±10%,20%,30%,40%或50%),ph为5.5,6.0或6.5。在一个实施方案中,组合物在柠檬酸盐缓冲剂中包含纳武单抗和伊匹单抗。在另一个实施方案中,组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%,或50%)中包含3∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%或50%),约50μmdtpa(或50μmdtpa±10%,20%,30%,40%或50%),约6%蔗糖(或6%蔗糖±10%,20%,30%,40%或50%)和约0.05%ps80(或0.05%ps80±10%,20%,30%,40%或50%),ph为约6。在其他实施方案中,组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%,或50%)中包含3∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%或50%),约20μmdtpa(或20μmdtpa±10%,20%,30%,40%或50%),约3%甘露醇(或3%甘露醇±10%,20%,30%,40%或50%)和约0.04%ps80(或0.04%ps80±10%,20%,30%,40%或50%),ph为约6。在其他实施方案中,组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%,或50%)中包含1∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%或50%),约100μmdtpa(或100μmdtpa±10%,20%,30%,40%或50%),约3%甘露醇(或3%甘露醇±10%,20%,30%,40%或50%)和约0.02%ps80(或0.02%ps80±10%,20%,30%,40%或50%),ph为约6。在某些实施方案中,组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%或50%)中包含1∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%或50%),约100μmdtpa(或100μmdtpa±10%,20%,30%,40%或50%),约3%甘露醇(或3%甘露醇±10%,20%,30%,40%或50%)和约0.02%ps80(或.02%ps80±10%,20%,30%,40%或50%),ph为约6.5。在一些实施方案中,组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%或50%)中包含1∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约100mmnacl(或100mmnacl±10%,20%,30%,40%或50%),约100μmdtpa(或100μmdtpa±10%,20%,30%,40%或50%),约1.0%甘露醇(或1.0%甘露醇±10%,20%,30%,40%或50%)和约0.02%ps80(或0.02%ps80±10%,20%,30%,40%或50%),ph为约6.5。在其他实施方案中,所述组合物在约20mm柠檬酸盐缓冲剂(或20mm柠檬酸盐缓冲剂±10%,20%,30%,40%或50%)中包含1∶1比例的纳武单抗与伊匹单抗,该柠檬酸盐缓冲剂包含约50mmnacl(或50mmnacl±10%,20%,30%,40%或50%),约100μmdtpa(或100μmdtpa±10%,20%,30%,40%或50%),约6%蔗糖(或6%蔗糖±10%,20%,30%,40%或50%)和约0.02%ps80(或0.02%ps80±10%,20%,30%,40%或50%),ph为约6.0。在一些实施方案中,组合物包含1∶3比例的纳武单抗与伊匹单抗,其包含约4.62mg/ml纳武单抗,约1.54mg/ml伊匹单抗,约18.5mmtris盐酸盐,约1.5mm柠檬酸钠二水合物,约96.2mmnacl,约1.2%甘露醇,约93.9μm三胺五乙酸,和约0.012%ps80,ph为约6.0。在一些实施方案中,组合物包含1∶3比例的纳武单抗与伊匹单抗,其包含约4.61mg/ml纳武单抗,约1.54mg/ml伊匹单抗,约18.46mmtris盐酸盐,约1.54mm柠檬酸钠二水合物,约96.15mmnacl,约1.15%甘露醇,约93.85μm三胺五乙酸,和约0.012%ps80,ph为约6.3。在一些实施方案中,药物组合物包含每小瓶30mg纳武单抗和90mg伊匹单抗。在其他实施方案中,组合物包含每小瓶40mg纳武单抗和120mg伊匹单抗。在其他实施方案中,组合物包含第三抗体。在一些实施方案中,第三抗体是本文公开的任何抗体。组合物的稳定性在一个实施方案中,本文公开的组合物在约0℃,约5℃,约10℃,约15℃,约20℃,约25℃,约30℃,约35℃,约40℃,约45℃,约50℃或约55℃稳定至少约1周,至少约2周,至少约1个月,至少约2个月,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约2年或至少约5年。在另一个实施方案中,组合物在约5℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的酸性峰(例如脱酰胺化)的变化。在其他实施方案中,组合物在约25℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的酸性峰的变化。在一些实施方案中,组合物在约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的酸性峰的变化。在一些实施方案中,使用成像毛细管等电聚焦测定法(cief)测量酸性峰。在一些实施方案中,如果组合物显示出与参考组合物的酸性峰相比小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的酸性峰(例如,脱酰胺化)的变化,则本发明组合物的脱酰胺化与参考组合物(包含第一抗体或第二抗体的组合物)的脱酰胺化相当。在某些实施方案中,组合物在约5℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的高分子量(hmw)峰(例如,聚集)的变化。在一些实施方案中,组合物在约25℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的hmw峰的变化。在一些实施方案中,组合物在约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的hmw峰的变化。在一些实施方案中,组合物表现出小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,约0.1%或小于约0.1%的hmw峰的变化。在某些实施方案中,组合物在约5℃,约25℃或约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2.5%,约2%,约1.5%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%的hmw峰。在一些实施方案中,使用色谱法测量高分子量峰。在一些实施方案中,色谱法是尺寸排阻色谱法。在一些实施方案中,如果组合物显示出与参考组合物的hmw物质峰相比小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的hmw物质峰的变化,则本发明组合物的聚集(例如hmw物质的水平)与参考组合物(包含第一抗体或第二抗体的组合物)的聚集相当。在一些实施方案中,组合物在约5℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的主峰的变化。在一些实施方案中,组合物在约25℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的主峰的变化。在一些实施方案中,组合物在约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的主峰的变化。在一些实施方案中,组合物表现出小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%的主峰的变化。在一些实施方案中,使用成像毛细管等电聚焦测定法(cief)测量主峰。在一些实施方案中,组合物在约5℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的低分子量(lmw)峰(例如,碎裂)的变化。在一些实施方案中,组合物在约25℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的lmw峰的变化。在一些实施方案中,组合物在约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的lmw峰的变化。在一些实施方案中,组合物表现出小于约5%,约4%,约3%,约2%,约1.5%,约1.4%,约1.3%,约1.2%,约1.1%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%的lmw峰的变化。在某些实施方案中,组合物在约5℃,约25℃或约40℃储存约1个月,约2个月,约3个月,约4个月,约6个月或约1年后表现出约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2.5%,约2%,约1.5%,约1%,约0.9%,约0.8%,约0.7%,约0.6%,约0.5%,约0.4%,约0.3%,约0.2%,或约0.1%的lmw峰。在一些实施方案中,使用色谱法测量低分子量峰。在一些实施方案中,色谱法是尺寸排阻色谱法。在一些实施方案中,如果包含第一和第二抗体的组合物显示出与参考组合物的lmw物质峰相比小于约15%,约14%,约13%,约12%,约11%,约10%,约9%,约8%,约7%,约6%,约5%,约4%,约3%,约2%或约1%的lmw物质峰的变化,则本发明的组合物的碎裂(例如,lmw物质的水平)与参考组合物(包含第一抗体或第二抗体的组合物)的碎裂相当。制备本文公开的组合物的方法在一个实施方案中,本发明涉及制造任何本文公开的组合物的方法。在另一个实施方案中,将包含抗pd-1抗体药物产品的制剂与包含第二抗体药物产品的制剂混合,以获得最终药物产品中的所需比例,且没有缓冲剂变化。在其他实施方案中,最终组合物在tris-柠檬酸盐缓冲剂中。在一些实施方案中,包含抗pd-1抗体药物物质的制剂和包含第二抗体药物物质的制剂进行缓冲剂交换和/或浓缩,然后混合以获得最终药物产品中所需的比例。在其他实施方案中,组合物在使用前被稀释。在某些实施方案中,在使用前,将组合物用0.9%氯化钠注射液usp或5%葡萄糖注射液usp稀释。在其他实施方案中,将组合物稀释以获得具有所需浓度的第一和第二抗体的输液。在其他实施方案中,第一和第二抗体的最终浓度为约1mg/ml至约500mg/ml,约1mg/ml至约450mg/ml,约1mg/ml至约400mg/ml,约1mg/ml至约350mg/ml,约1mg/ml至约300mg/ml,约1mg/ml至约250mg/ml,约1mg/ml至约200mg/ml,约1mg/ml至约150mg/ml,约1mg/ml至约100mg/ml,约1mg/ml至约90mg/ml,约1mg/ml至约80mg/ml,约1mg/ml至约70mg/ml,约1mg/ml至约60mg/ml,约1mg/ml至约50mg/ml,约1mg/ml至约40mg/ml,约1mg/ml至约30mg/ml,约1mg/ml至约20mg/ml,约1mg/ml至约15mg/ml,约1mg/ml至约10mg/ml,约1mg/ml至约9mg/ml,约1mg/ml至约8mg/ml,约1mg/ml至约7mg/ml,约1mg/ml至约6mg/ml,约1mg/ml至约5mg/ml,约1mg/ml至约4mg/ml,约1mg/ml至约3mg/ml,约1mg/ml至约2mg/ml,约0.5mg/ml至约3mg/ml,约50mg/ml至约400mg/ml,或约100mg/ml至约300mg/ml。在某些实施方案中,稀释后稀释的输液在室温下储存不超过约10,约9,约8,约7,约6,约5,约4,约3,约2或约1小时。在一些实施方案中,稀释后稀释的输液在冷藏(约2℃至约8℃)下储存不超过约1周,约6天,约5天,约4天,约3天,约2天,约1天或约12小时。本发明的方法本公开提供了用本文公开的任何组合物治疗患有疾病或病症的受试者的方法。在一个实施方案中,该方法涉及施用包含x量的第一抗体和y量的第二抗体的药物组合物,第一抗体是抗pd-1抗体或抗pd-l1抗体,其中第一抗体的量与第二抗体的量的比例在组合物中以约100∶1至约1∶100的固定剂量比例存在。在一些实施方案中,疾病或病症是传染性疾病。在其他实施方案中,疾病或病症是癌症。在其他实施方案中,癌症是黑色素瘤癌症、肾癌、前列腺癌、乳腺癌、结肠癌、肺癌、骨癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门区的癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食管癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌;慢性或急性白血病,包括急性骨髓性白血病、慢性骨髓性白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病;儿童期实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾癌或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤;环境诱导的癌症,包括由石棉诱导的癌症;及其任何组合。在其他实施方案中,癌症是肺癌,转移性黑色素瘤,成胶质细胞瘤或肾细胞癌。在某些实施方案中,癌症是鳞状细胞癌、小细胞肺癌、非小细胞肺癌、鳞状非小细胞肺癌(nsclc)、非鳞状nsclc、神经胶质瘤、胃肠癌、肾癌(例如透明细胞癌)、卵巢癌、肝癌、结肠直肠癌、子宫内膜癌、肾癌(例如肾细胞癌(rcc))、前列腺癌(例如激素难治性前列腺腺癌)、甲状腺癌、成神经细胞瘤、胰腺癌、成胶质细胞瘤(多形性成胶质细胞瘤)、宫颈癌、胃癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌和头颈癌(或癌症)、胃癌、生殖细胞肿瘤、儿科肉瘤、鼻腔鼻窦自然杀伤细胞(sinonasalnaturalkiller)、黑色素瘤(例如转移性恶性黑色素瘤,如皮肤或眼内恶性黑色素瘤)、骨癌、皮肤癌、子宫癌、肛门区癌、睾丸癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、食道癌、小肠癌、内分泌系统癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童期实体瘤、输尿管癌、肾盂癌、中枢神经系统肿瘤(cns)、原发性cns淋巴瘤、肿瘤血管生成、脊柱轴肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱导的癌症(包括石棉诱导的癌症)、病毒相关癌症(例如人乳头状瘤病毒(hpv)相关肿瘤);和血液恶性肿瘤,所述血液恶性肿瘤源自两种主要血细胞谱系,即骨髓细胞系(其产生粒细胞,红细胞,血小板,巨噬细胞和肥大细胞)或淋巴细胞系(其产生b,t,nk和浆细胞)的任一种,例如所有类型的白血病、淋巴瘤和骨髓瘤,例如急性、慢性、淋巴细胞性和/或骨髓性白血病,例如急性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞性白血病(cll)和慢性骨髓性白血病(cml)、未分化aml(m0)、成髓细胞白血病(m1)、成髓细胞白血病(m2;伴有细胞成熟)、早幼粒细胞白血病(m3或m3变体[m3v])、骨髓单核细胞白血病(m4或m4变体,伴有嗜曙红细胞增多[m4e])、单核细胞白血病(m5)、红白血病(m6)、成巨核细胞白血病(m7)、分离的粒细胞肉瘤和绿色白血病;淋巴瘤,如霍奇金淋巴瘤(hl)、非霍奇金淋巴瘤(nhl);b细胞血液恶性肿瘤,例如b细胞淋巴瘤、t细胞淋巴瘤、淋巴浆细胞样淋巴瘤、单核细胞样b细胞淋巴瘤、粘膜相关淋巴组织(malt)淋巴瘤、间变性(例如ki1+)大细胞淋巴瘤、成人t细胞淋巴瘤/白血病、套细胞淋巴瘤、血管免疫母细胞t细胞淋巴瘤、血管中心性淋巴瘤、肠t细胞淋巴瘤、原发性纵隔b细胞淋巴瘤、前体t成淋巴细胞性淋巴瘤、t成淋巴细胞性;和淋巴瘤/白血病(t-lbly/t-all)、外周t细胞淋巴瘤、成淋巴细胞性淋巴瘤、移植后淋巴增生性疾病、真性组织细胞性淋巴瘤、原发性中枢神经系统淋巴瘤、原发性渗出性淋巴瘤、成淋巴细胞性淋巴瘤(lbl)、淋巴系造血肿瘤、急性成淋巴细胞性白血病、弥漫性大b细胞淋巴瘤、布基特氏淋巴瘤、滤泡性淋巴瘤、弥漫性组织细胞性淋巴瘤(dhl)、免疫母细胞性大细胞淋巴瘤、前体b成淋巴细胞性淋巴瘤、皮肤t细胞淋巴瘤(ctlc)(也称为蕈样肉芽肿或sezary综合征)和伴有waldenstrom巨球蛋白血症的淋巴浆细胞淋巴瘤(lpl);骨髓瘤,如igg骨髓瘤、轻链骨髓瘤、非分泌性骨髓瘤、冒烟型骨髓瘤(也称为无痛型骨髓瘤)、孤立性浆细胞瘤和多发性骨髓瘤、慢性淋巴细胞性白血病(cll)、毛细胞性淋巴瘤;髓系的造血肿瘤,间充质源(mesenchymalorigin)的肿瘤,包括纤维肉瘤和横纹肌肉瘤;精原细胞瘤、畸胎癌、中枢和外周神经的肿瘤,包括星形细胞瘤,神经鞘瘤;间充质源的肿瘤,包括纤维肉瘤、横纹肌肉瘤和骨肉瘤;和其他肿瘤,包括黑色素瘤、着色性干皮病、角化棘皮瘤、精原细胞瘤、甲状腺滤泡癌和畸胎癌,淋巴系的造血肿瘤,例如t细胞和b细胞肿瘤,包括但不限于t细胞病症如t幼淋巴细胞白血病(t-pll),包括小细胞和脑形细胞类型的t幼淋巴细胞白血病(t-pll);大颗粒淋巴细胞白血病(lgl),优选t细胞型的大颗粒淋巴细胞白血病(lgl);a/dt-nhl肝脾淋巴瘤;外周/后胸腺t细胞淋巴瘤(多形性和免疫母细胞亚型);血管中心性(鼻)t细胞淋巴瘤;头或颈癌、肾癌、直肠癌、甲状腺癌;急性髓细胞性淋巴瘤,以及所述癌症的任何组合。本文所述的方法也可用于治疗转移性癌症。在某些实施方案中,组合物与任何另外的抗癌剂一起施用。在其他实施方案中,抗癌剂是本领域已知的任何抗癌剂。在其他实施方案中,抗癌剂是第三抗体。在一些实施方案中,第三抗体是本文公开的任何抗体。在其他实施方案中,静脉内施用组合物。在一些实施方案中,组合物在施用前重构。在其他实施方案中,组合物在施用前稀释。在特定实施方案中,组合物以绝对剂量施用。在其他实施方案中,组合物以基于重量的剂量施用。在一些实施方案中,组合物至少约每周,至少约每周2次,至少约每2周,至少约每3周,或至少约每月施用。在一些实施方案中,治疗持续至少约4周,至少约8周,至少约12周,至少约3个月,至少约6个月,至少约9个月,至少约1年,至少约18个月,至少约2年或大于2年。在一些实施方案中,本发明涉及调节免疫反应的方法,包括施用本文公开的任何组合物。在某些实施方案中,本发明的组合物(例如,施用抗pd-1抗体或施用抗pd-1抗体和另一种抗癌疗法)有效地增加了受试者的生存期。例如,与仅用另一种疗法(例如护理标准)或仅用所述组合物的两个成员中的仅一个成员(例如,单独的抗pd-1抗体)治疗的另外的受试者相比,受试者的生存期增加至少约1个月,至少约2个月,至少约3个月,至少约4个月,至少约5个月,至少约6个月,至少约7个月,至少约8个月,至少约9个月,至少约10个月,至少约11个月或至少约1年或更长时间。在一些实施方案中,生存期增加至少约2个月。在某些实施方案中,本发明的疗法有效地增加了受试者的无进展生存期。例如,与未治疗的受试者或仅用另一种疗法(例如护理治疗标准)或仅用所述组合物的两个成员中的仅一个成员(例如,单独的抗pd-1或pd-l1抗体)治疗的受试者相比,受试者的无进展生存期增加至少约1个月,至少约2个月,至少约3个月,至少约4个月,至少约5个月,至少约6个月,至少约7个月,至少约8个月,至少约9个月,至少约10个月,至少约11个月或至少约1年。在一些实施方案中,无进展生存期增加至少约2个月。在某些实施方案中,本发明的疗法有效地增加了受试者组的反应率。例如,与仅用另一种疗法(例如护理标准)或仅用所述组合物的两个成员中的仅一个成员(例如,单独的抗pd-1抗体)即单一疗法治疗的另外的受试者组相比,受试者组的反应率增加至少约2%,至少约3%,至少约4%,至少约5%,至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约55%,至少约60%,至少约70%,至少约75%,至少约80%,至少约85%,至少约90%,至少约95%,至少约99%或至少约100%。本文公开的组合物的剂量在一些实施方案中,组合物以绝对剂量施用,而与患者的重量无关。例如,伴有第二抗体的抗pd-1抗体可以按下面的绝对剂量施用:0.1,0.5,1,2,3,4,5,10,15,20,50,75,80,200,240,300,360,400,480,500,750或1500mg或本文公开的任何其他剂量,而不考虑患者的重量。在一些实施方案中,组合物以本文公开的任何剂量以基于重量的剂量施用。在一些实施方案中,以单剂量施用于患者的第一抗体的量和第二抗体的量分别与x量和y量相同。在本发明组合治疗方法的某些实施方案中,抗pd-1抗体或其抗原结合部分的治疗有效剂量包含60mg,约80mg,约100mg,约120mg,约140,约160mg,约180mg,约200mg,约220mg,约240mg,约260mg,约280mg或约300mg。在一些实施方案中,抗pd-1抗体或其抗原结合部分的治疗有效剂量包含约310mg,约320mg,约330mg,约340mg,约350mg,约360mg,约370mg,约380mg,约390mg,约400mg,约410mg,约420mg,约430mg,约440mg,约450mg,约460mg,约470mg,约480mg,约490mg或约500mg。在一些实施方案中,组合物中抗pd-1抗体的剂量为约60mg至约300mg,约60mg至约100mg,约100mg至约200mg,或约200mg至约300mg。在一些实施方案中,组合物中抗pd-1抗体的剂量为约300mg至约500mg,约300mg至约450mg,约300mg至约400mg,约300mg至约350mg,约350mg至约500mg,约400mg至约500mg,或约450mg至约500mg。在一些实施方案中,组合物中抗pd-1抗体的量为至少约80mg,约160mg或约240mg。在某些实施方案中,组合物中抗pd-1抗体的量为至少约360mg或480mg。在一些实施方案中,组合物中抗pd-1抗体的剂量为至少约240mg或至少约80mg。在一个实施方案中,组合物中抗pd-1抗体的量为约360mg。在另一个实施方案中,组合物中抗pd-1抗体的量为约480mg。在一些实施方案中,组合物中抗pd-1抗体的剂量为至少约0.5mg/kg,至少约1mg/kg,至少约2mg/kg,至少约3mg/kg或至少约5mg/kg。在一些实施方案中,组合物中抗pd-1抗体的剂量为约0.5mg/kg至约5mg/kg,约0.5mg/kg至约5mg/kg,约0.5mg/kg至约3mg/kg或约0.5mg/kg至约2mg/kg。在一些实施方案中,组合物中抗pd-1抗体的剂量为至少约1mg/kg。使用所需比例计算第二抗体的相应剂量。在一些实施方案中,抗pd-1抗体以亚治疗剂量施用,亚治疗剂量即显著低于作为治疗癌症的单一疗法施用时通常的或fda批准的剂量的治疗剂的剂量。基于所需比例计算组合物中第二抗体的量。低于典型的3mg/kg,但不低于0.001mg/kg的纳武单抗的剂量是亚治疗剂量。本文方法中使用的抗pd-1抗体的亚治疗剂量高于0.001mg/kg且低于3mg/kg。在一些实施方案中,亚治疗剂量为约0.001mg/kg-约1mg/kg,约0.01mg/kg-约1mg/kg,约0.1mg/kg-约1mg/kg或约0.001mg/kg-约0.1mg/kg体重。在一些实施方案中,亚治疗剂量为至少约0.001mg/kg,至少约0.005mg/kg,至少约0.01mg/kg,至少约0.05mg/kg,至少约0.1mg/kg,至少约0.5mg/kg或至少约1.0mg/kg体重。接受0.3mg/kg至10mg/kg剂量纳武单抗的15名受试者的受体占有率数据表明,pd-1占有率在该剂量范围内显示与剂量无关。所有剂量下的平均占有率为85%(范围为70%至97%),平均稳定水平占有率为72%(范围为59%至81%)。在一些实施方案中,0.3mg/kg剂量可以允许充分暴露以导致最大的生物活性。在一些实施方案中,组合物通过约每周一次,约每2周一次,约每3周一次,或约每月一次静脉内输注施用。在某些实施方案中,组合物约每3周施用一次。在一个实施方案中,每3周施用一次360mg抗pd-1抗体或抗原结合片段。在另一个实施方案中,约每4周施用一次480mg抗pd-1抗体或抗原结合片段。在一些实施方案中,输注进行至少约10分钟,约20分钟,约30分钟,约45分钟,约60分钟,约90分钟,约2小时,约3小时,约4小时或约5小时。本发明的药物组合物中活性成分的实际剂量水平可以是绝对的或变化的,以获得对于特定患者、组合物和施用方式而言有效地达到所需的治疗反应而不会对患者造成过度毒性的活性成分的量。所选择的剂量水平将取决于多种药代动力学因素,包括所用本发明特定组合物的活性,施用途径,施用时间,所用特定化合物的排泄速率,治疗持续时间,与所使用的特定组合物组合使用的其他药物、化合物和/或材料,所治疗的患者的年龄、性别、重量、情况、一般健康状况和先前病史以及医学领域中公知的类似因素。本发明的组合物可以通过使用本领域熟知的各种方法中的一种或多种经一种或多种施用途径施用。如本领域技术人员将理解的,施用途径和/或方式将根据期望的结果而变化。药盒在本发明的范围内的还有药盒,该药盒包含抗pd-1抗体/第二抗体组合物和用于治疗用途的说明书。药盒通常包括指示药盒内容物的预期用途的标签和使用说明书。术语标签包括在药盒上提供或随药盒提供或以其他方式随附于药盒的任何书写或记录材料。因此,本公开提供了药盒,其包含:(a)本文公开的组合物的合适剂量和(b)以本文公开的任何方法使用该组合物的说明书。通过以下实施例进一步说明本发明,该实施例不应被解释为进一步限制。本申请中引用的所有参考文献的内容明确地通过引用并入本文。实施例进行了几项可行性研究,以评估单一固定剂量比例组合(fdrc)制剂中伊匹单抗和纳武单抗的稳定性。图1显示了伊匹单抗和纳武单抗药物物质(ds)或药物产品(dp)制剂中伊匹单抗和纳武单抗的制剂,其在以下实施例中指出时用作对照。实施例1进行可行性研究以评估通过将伊匹单抗和纳武单抗的单独制剂(图1)混合得到1∶1的伊匹单抗与纳武单抗的最终比例所产生的单一固定剂量比例组合(fdrc)制剂中伊匹单抗和纳武单抗的稳定性。伊匹单抗(bms-734016)dp在20mmtris-hcl,100mmnacl,1.0%(w/v)甘露醇,100μm三胺五乙酸(dtpa)和0.01%聚山梨醇酯80(ps80)中含有5mg/ml的伊匹单抗,ph为7.0,并且可以以50ml瓶中的40ml以及10ml小瓶中的10ml的形式获得(图1)。纳武单抗(bms-936558)dp在20mm柠檬酸盐缓冲剂(柠檬酸钠二水合物),50mmnacl,3.0%(w/v)甘露醇,20μmdtpa和0.02%ps80中含有10mg/ml纳武单抗,ph为6.0,并且可以以10ml小瓶中的10ml的形式获得(图1)。为了达到伊匹单抗与纳武单抗的1∶1的比例,将80ml的伊匹单抗dp(2瓶)与40ml的纳武单抗dp(4个小瓶)混合,得到含有3.3mg/ml的伊匹单抗和3.3mg/ml纳武单抗的组合产品。如表1所示,得到的fdrc制剂含有13.3mmtris-hcl,6.7mm柠檬酸盐,83.3mmnacl,1.67%(w/v)甘露醇,73.3μmdtpa和0.013%w/vps80,ph为6.2。表1:组合的ecfdrc(1∶1)制剂将fdrc(1∶1)制剂过滤并分装到10cc玻璃小瓶(每小瓶5ml)中,塞住并密封。然后将小瓶在5℃或40℃下储存。在0天,1周,2周,1个月,2个月,3个月和6个月时分析样品。第0天样品用作对照。样品分析-方法在每个时间点,通过视觉外观、室温下的ph、hiac、尺寸排阻色谱法和成像毛细管等电聚焦(cief)分析样品小瓶。hiac(royco)是基于光阻的颗粒计数技术仪器。使用empowertm2软件,用2497双波长uv检测器,在2695hplc上,用具有guardswxl保护柱的g3000swxl,通过分析型尺寸排阻hplc(se-hplc)进行尺寸排阻色谱法(sec)。用ph6.8的0.1mnah2po4、0.1mna2so4和15%乙腈(acn)(流动相)来平衡系统。样品不经稀释直接分析,除非浓度大于125mg/ml。如果样品浓度大于125mg/ml,样品用相应的缓冲剂稀释至50mg/ml。将样品在分析前转移到hplc小瓶,并在5℃±3℃的温度下储存在分析型hplc系统中。总共100μg样品被注入用于分析,并使用流动相以22℃的柱温等度运行。流速为1.0ml/min,每个样品的运行时间为20分钟,检测波长为280nm。使用具有alcott采样器的proteinsimpletmice3仪器进行成像毛细管等电聚焦(cief)。被分析样品的浓度为25mg/ml,具有2m尿素和0.35%甲基纤维素(mc)。使用内径为100微米的50毫米毛细管进行分离。电解质溶液为0.1%mc中的80mmh3po4,阴极电解溶液为0.1%mc中的100mmnaoh。载体两性电解质为1%5-8和3%8-10.5。聚焦时间为13分钟,聚焦电压开始于1.5kv(300v/cm),持续第一分钟,然后其余12分钟为3kv(600v/cm)。在280nm进行检测。样品分析-结果在40℃下储存3个月后,对纳武单抗dp和伊匹单抗dp对照和1∶1比例固定剂量组合(ecfdrc(1∶1))制剂进行sec(图2a)。在40℃下储存3个月后,纳武单抗dp对照hmw峰尺寸增加约1.6%,并且伊匹单抗dp对照hmw峰尺寸增加约0.25%(图2a)。在40℃下储存3个月后,ecfdrc(1∶1)制剂hmw峰尺寸增加约0.7%(图2a)。在40℃下储存6个月后,ecfdrc(1∶1)制剂hmw峰尺寸从0.555%增加到2.82%的最终hmw峰尺寸,增加约2.265%(表2)。在5℃下储存6个月后,ecfdrc(1∶1)制剂hmw峰尺寸从0.555%降低至0.525%的最终hmw峰尺寸(表2)。表2:组合的ecfdrc(1∶1)毛细管等电聚焦和尺寸排阻色谱法结果在5℃下储存6个月后,对纳武单抗dp和伊匹单抗dp对照和ecfdrc(1∶1)制剂进行cief(图2b)。在5℃下储存6个月后,纳武单抗dp对照酸性峰尺寸增加约1.3%,并且伊匹单抗dp酸性峰尺寸增加约3%(图2b)。对于ecfdrc(1∶1)制剂,纳武单抗酸性峰尺寸增加了约3.56%,从第0天(初始)的35.09%增加到6个月时的38.65%,而伊匹单抗酸性峰尺寸增加了约4.16%,从第0天(初始)的34%增加到6个月时的38.16%(表2和图2b)。该研究可用于支持宽浓度范围的混合缓冲剂系统,即tris-柠檬酸盐缓冲剂组合物。实施例2进行了可行性研究,以评估通过将伊匹单抗和纳武单抗的单独制剂混合到3∶1,1∶1和1∶3的最终比例而产生的伊匹单抗/纳武单抗fdrc的稳定性(表3)。通过混合5mg/ml的伊匹单抗ds和20mg/ml的纳武单抗ds以达到3∶1,1∶1和1∶3的蛋白质比例,产生fdrc制剂(表3)。将每种合并的溶液用搅拌棒在室温下进一步混合30分钟,转移到小瓶中,并为一定时间的稳定性而储存。将小瓶在5℃,25℃和40℃下储存最长达12个月。表3:ecfdrc(3∶1;1∶1;1∶3)-伊匹单抗dp和纳武单抗dp的制剂的组合原型ec:ph6.6,具有3∶1比例的伊匹单抗与纳武单抗,含有4.62mg/ml伊匹单抗,1.54mg/ml纳武单抗,1.15%w/v甘露醇,96.15mmnacl,93.85μmdtpa和0.012%w/vps80,ph6.6。原型ec:ph6.0,具有1∶3比例的伊匹单抗与纳武单抗,含有2.86mg/ml伊匹单抗,8.57mg/ml纳武单抗,1.86%w/v甘露醇,78.57mmnacl,65.71μmdtpa和0.023%w/vps80,ph6.0。原型ec:ph6.2,具有1∶1比例的伊匹单抗与纳武单抗,含有4.00mg/ml伊匹单抗,4.00mg/ml纳武单抗,1.67%w/v甘露醇,83.33mmnacl,73.33μmdtpa和0.013%w/vps80,ph6.2。sec分析一般来说,在所有3种原型中都观察到hmw和lmw的微小增加(图3a-b)。在40℃储存2个月后,对纳武单抗dp对照、伊匹单抗dp对照和ecfdrc制剂ec:ph6.0(1∶3),ec:ph6.2(1∶1)以及ec∶ph6.6(3∶1)进行sec(图3a和3b)。伊匹单抗对照制剂在第0天具有约0.4%的初始hmw峰尺寸,其在40℃下2个月后增加约0.1%,达到刚刚超过0.5%的最终hmw峰尺寸(图3a)。纳武单抗对照制剂在第0天具有约0.8%的初始hmw峰尺寸,其在40℃下2个月后增加约0.7%,达到超过1.5%的最终hmw峰尺寸(图3a)。ec:ph6.0fdrc制剂(1∶3)在第0天具有约0.6%的初始hmw峰尺寸,其在40℃下2个月后增加约0.7%,达到约1.3%的最终hmw峰尺寸(图3a)。ec∶ph6.2fdrc制剂(1∶1)在第0天具有约0.5%的初始hmw峰尺寸,其在40℃下2个月后增加约0.5%,达到约1.0%的最终hmw峰尺寸(图3a)。ec:ph6.6fdrc制剂(3∶1)在第0天具有约0.5%的初始hmw峰尺寸,其在40℃下2个月后增加约0.3%,达到约0.8%的最终hmw峰尺寸(图3a)。还在第0天,40℃下2个月后和25℃下3个月后测量了各种制剂的低分子量(lmw)峰尺寸(图3b)。伊匹单抗对照制剂在第0天具有约0.2%的初始lmw峰尺寸,其在40℃下2个月后增加约0.65%,达到约0.85%的最终lmw峰尺寸(图3b)。在25℃储存3个月后,伊匹单抗对照制剂的lmw峰尺寸增加约0.1%(图3b)。纳武单抗对照制剂在第0天具有约0.2%的初始lmw峰尺寸,其在40℃下2个月后增加约0.6%,达到约0.8%的最终lmw峰尺寸(图3b)。在25℃下储存3个月后,纳武单抗对照制剂的lmw峰尺寸增加小于0.1%(图3b)。ec:ph6.0fdrc制剂(1∶3)在第0天具有约0.15%的初始lmw峰尺寸,其在40℃下2个月后增加约0.8%,达到约0.95%的最终lmw峰尺寸(图3b)。在25℃下储存3个月后,ec∶ph6.0(1∶3)fdrc制剂的lmw峰尺寸增加约0.2%(图3b)。ec:ph6.2fdrc制剂(1∶1)在第0天具有约0.15%的初始lmw峰尺寸,其在40℃下2个月后增加约1.2%,达到约1.35%的最终lmw峰尺寸(图3b)。在25℃下储存3个月后,ec:ph6.2(1∶1)fdrc制剂的lmw峰尺寸增加约0.3%(图3b)。ec:ph6.6fdrc制剂(3∶1)在第0天具有约0.15%的初始lmw峰尺寸,其在40℃下2个月后增加约1.5%,达到约1.65%的最终lmw峰尺寸(图3b)。在25℃储存3个月后,ec:ph6.6(3∶1)fdrc制剂的lmw峰尺寸增加约0.1%。cief分析在25℃下储存3个月后(图4a),5℃下储存3个月后(图4b),和25℃下储存1个月后(图4c),对纳武单抗dp对照、伊匹单抗dp对照和ecfdrc制剂ec:ph6.0(1∶3),ec:ph6.2(1∶1)以及ec:ph6.6(3∶1)进行cief。在25℃储存3个月后,纳武单抗dp对照酸性峰尺寸减少约0.05%,且伊匹单抗dp对照酸性峰尺寸增加约5.59%(图4a)。在25℃下储存3个月后,fdrc制剂ec:ph6.0(1∶3)纳武单抗和伊匹单抗酸性峰尺寸分别增加约5%和约5.7%(图4a)。在25℃下储存3个月后,fdrc制剂ec:ph6.2(1∶1)纳武单抗和伊匹单抗酸性峰尺寸分别增加约6.8%和约6.3%(图4a)。在25℃下储存3个月后,fdrc制剂ec:ph6.6(3∶1)纳武单抗和伊匹单抗酸性峰尺寸分别增加约4%和约7.8%(图4a)。在三种fdrc制剂中,伊匹单抗酸性峰尺寸增加了约5.7%-7.8%,或平均每月增加约2.2%;纳武单抗酸性峰尺寸增加约4%-6.8%,或平均每月增加小于2%(约1.76%)(图4a)。图4b显示了使用cief分析得到的在5℃下储存3个月的样品相对于初始(第0天)对照的酸性峰尺寸的实际变化。在5℃储存3个月后,纳武单抗dp对照酸性峰尺寸下降约5.1%,且伊匹单抗dp对照酸性峰尺寸下降约1%(图4b)。在5℃下储存3个月后,fdrc制剂ec:ph6.0(1∶3)纳武单抗和伊匹单抗酸性峰尺寸分别增加约0.1%和降低约1.5%(图4b)。在5℃下储存3个月后,fdrc制剂ec:ph6.2(1∶1)纳武单抗和伊匹单抗酸性峰尺寸分别增加约2.1%和约0.5%(图4b)。在5℃下储存3个月后,fdrc制剂ec:ph6.6(3∶1)显示伊匹单抗酸性峰尺寸没有改变,并且纳武单抗酸性峰尺寸小于0.1%的下降(图4b)。图4c显示了在25℃下储存1个月的样品相对于初始(第0天)对照的酸性峰尺寸的实际变化。在25℃下储存1个月后,纳武单抗dp对照酸性峰尺寸增加约1.05%,并且伊匹单抗dp对照酸性峰尺寸增加约1.16%(图4c)。在25℃储存1个月后,fdrc制剂ec:ph6.0(1∶3)纳武单抗和伊匹单抗酸性峰尺寸分别增加约2.8%和约1%(图4c)。在25℃下储存1个月后,fdrc制剂ec:ph6.2(1∶1)纳武单抗和伊匹单抗酸性峰尺寸分别增加约3.1%和约1.6%(图4c)。在25℃下储存1个月后,fdrc制剂ec:ph6.6(3∶1)纳武单抗酸性峰尺寸没有变化,并且伊匹单抗酸性峰尺寸增加约2.8%(图4c)。实施例3进行实验设计(doe)研究以鉴定新的候选伊匹单抗/纳武单抗制剂。原型伊匹单抗/纳武单抗fdrc(3∶1)制剂在选定的组氨酸或柠檬酸盐制剂中制备,如表4所示。所有doefdrc原型都制备为3∶1比例的10mg/ml的伊匹单抗/纳武单抗最终浓度(表4)。fdrc原型“combo4”含有20mm柠檬酸盐,50mmnacl,50μmdtpa,6%w/v蔗糖和0.05%w/vps80,理论ph为6。fdrc原型“combo5”含有20mm组氨酸,50mmnacl,50μmdtpa,6%w/v蔗糖和0.05%w/vps80,理论ph为6.0。fdrc原型“combo6”含有20mm组氨酸,50mmnacl,50μmdtpa,6%w/v蔗糖和0.05%w/vps80,理论ph为7。fdrc原型“combo新”包含20mm组氨酸,50μmdtpa,8.5%w/v蔗糖和0.05%w/vps80,理论ph为6。fdrc原型“combo8”与目前的纳武单抗dp制剂相似,含有20mm柠檬酸盐,50mmnacl,20μmdtpa,3%w/v甘露醇和0.04%w/vps80,理论ph为6。表4:doefdrc(3∶1)-新制剂doefdrc制剂根据以下“combo新”的实施例制备物产生。通过首先使伊匹单抗ds和纳武单抗ds(eln96488-024和-025)进行超滤/渗滤来制备“combo新”。特别地,将一次性ufdf盒(cassette)用于纳武单抗ds和伊匹单抗ds。使用渗滤/浓缩模式,将纳武单抗约250ml未配制的ds(~21mg/ml)用于uf/df。跨膜压力(tmp)设定为15psi,而为进料泵设定每分钟0.3升的流速。在使用3升缓冲剂之后完成渗滤。容器中的样品进一步基于天平重量减少(scaleweightreduction)而浓缩,并收集在250petg瓶中。ufdf后纳武单抗的浓度为30.6mg/ml。使用渗滤/浓缩模式,将伊匹单抗的约500ml未配制ds(~5.2mg/ml)用于uf/df。通过a280测定,最终产物中的伊匹单抗浓度为16.2mg/ml。接下来,将20ml在基于组氨酸-蔗糖的缓冲剂中的伊匹单抗ds和7.5ml在基于组氨酸-蔗糖的缓冲剂中的纳武单抗ds加入d-管渗析器(d-tubedialyzer)装置中,在具有足够容积的冷室(coldroom)中相对于如表4所示的“combo新”缓冲剂渗析24小时(3x缓冲剂更换)。然后通过hiac测量伊匹单抗和纳武单抗的蛋白质浓度。然后加入另外的伊匹单抗ds和/或纳武单抗ds和适当的缓冲剂以使伊匹单抗的最终浓度为7.5mg/ml,纳武单抗的最终浓度为2.5mg/ml(3∶1)。其余的原型combo4、combo5、combo6和combo8以与“combo新”相同的方式制备,修正为表4所示的具体浓度。然后将组合的dp制剂过滤并无菌装入10cc小瓶中(sap#1215125,批号#2l68780),塞住(sap#1239068,批号#0h49862),并卷边(crimped)。一些小瓶被保留,用于第0天对照分析。其余的在5℃、25℃和40℃下放在稳定性站(stabilitystations)上,直到在具体的时间点拉下小瓶进行分析。sec分析在40℃下储存3个月后,对纳武单抗dp对照、伊匹单抗dp对照和doefdrc(3∶1)制剂“combo新”、combo4、combo5、combo6和combo8进行sec(图5a)。伊匹单抗对照制剂在第0天具有约0.4%的初始hmw峰尺寸,其在40℃下3个月后增加约0.2%,至约0.6%的最终hmw峰尺寸(图5a)。纳武单抗对照制剂在第0天具有约0.7%的初始hmw峰尺寸,其在40℃下3个月后增加约1.6%,至约2.4%的最终hmw峰尺寸(图5a)。“combo新”fdrc制剂在第0天具有约0.4%的初始hmw峰尺寸,其在40℃下3个月后增加约0.1%,至刚刚超过0.5%的最终hmw峰尺寸(图5a)。combo4fdrc制剂在第0天具有约0.6%的初始hmw峰尺寸,其在40℃下3个月后增加约0.7%,至约1.3%的最终hmw峰尺寸(图5a)。combo5fdrc制剂在第0天具有刚刚低于0.5%的初始hmw峰尺寸,其在40℃下3个月后增加约0.3%,至小于0.8%的最终hmw峰尺寸(图5a)。combo6fdrc制剂在第0天具有约0.5%的初始hmw峰尺寸,其在40℃下3个月后增加约0.3%,至约0.8%的最终hmw峰尺寸(图5a)。combo8fdrc制剂在第0天具有约0.5%的初始hmw峰尺寸,其在40℃下3个月后增加约1.0%,至约1.5%的最终hmw峰尺寸(图5a)。在25℃储存3个月后,通过sec分析相同的制剂(图5a)。在25℃储存3个月后,伊匹单抗对照制剂和纳武单抗对照制剂的hmw峰尺寸各增加0.1%或更少(图5a)。在25℃储存3个月后,“combo新”和combo8fdrc制剂的hmw峰尺寸各增加0.1%或更少,并且combo4、combo5和combo6fdrc制剂的hmw峰尺寸各降低约0.1%或更少(图5a)。cief分析在25℃下储存3个月后,对纳武单抗dp对照、伊匹单抗dp对照和doefdrc(3∶1)制剂“combo新”、combo4、combo5、combo6和combo8进行cief(图5b)。在25℃储存3个月后,伊匹单抗对照酸性峰尺寸增加约5.59%,且纳武单抗dp对照酸性峰尺寸减少约0.05%(图5b)。在25℃储存3个月后,“combo新”fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约0.64%和5.98%(图5b)。在25℃储存3个月后,combo4fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加了约5.32%和6.97%(图5b)。在25℃储存3个月后,combo5fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约0.12%和5.34%(图5b)。在25℃下储存3个月后,combo6fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约7.01%和12.19%(图5b)。在25℃下储存3个月后,combo8fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸各增加约7.17%(图5b)。实施例4进行了可行性研究,以评估伊匹单抗与纳武单抗不同比例下的伊匹单抗/纳武单抗fdrc的稳定性,使用了实施例3中表征的doefdrc(3∶1)“combo新”制剂的改良形式作为基础制剂。以3∶1,1∶3和1∶1的伊匹单抗与纳武单抗的比例制备伊匹单抗/纳武单抗fdrc平台组合(pc)制剂,如表5所示。所有制剂在组氨酸缓冲剂中制备,最终浓度为50μmdtpa、0.05%w/vps80和8.0%w/v蔗糖(表5)。fdrcpc原型4(″pc:ph5.5-1∶3″)具有1∶3的比例,ph为5.5;fdrcpc原型5(″pc:ph6.0-1∶3″)具有1∶3的比例,ph为6.0;fdrcpc原型6(″pc:ph6.5-1∶3″)具有1∶3的比例,ph为6.5;fdrcpc原型7(″pc:ph6.0-1∶1″)具有1∶1的比例,ph为6.0;且fdrcpc原型8(″pc:ph6.0-3∶1″)具有3∶1的比例,ph为6.0(表5)。表5:伊匹单抗/纳武单抗fdrc平台组合制剂sec分析在40℃下储存3个月后,对纳武单抗dp对照、伊匹单抗dp对照和平台组合(pc)fdrc制剂pc:ph6.0-1∶1,pc:ph5.5-1∶3,pc:ph6.0-1∶3,pc:ph6.5-1∶3以及pc:ph6.0-3∶1进行sec(图6a)。在40℃储存3个月后,纳武单抗和伊匹单抗对照制剂的hmw峰尺寸分别增加约1.7%和0.25%(图6a)。在40℃下储存3个月后,pc:ph6.0-1∶1fdrc制剂的hmw峰尺寸增加约0.5%(图6a)。在40℃下储存3个月后,pc:ph5.5-1∶3fdrc制剂的hmw峰尺寸增加约1.25%(图6a)。在40℃下储存3个月后,pc:ph6.0-1∶3fdrc制剂的hmw峰尺寸增加约0.75%(图6a)。在40℃下储存3个月后,pc:ph6.5-1∶3fdrc制剂的hmw峰尺寸增加约0.1%(图6a)。在40℃下储存3个月后,pc:ph6.0-3∶1fdrc制剂的hmw峰尺寸增加约0.25%(图6a)。在5℃储存3个月后,通过sec分析相同的制剂(图6b)。纳武单抗对照制剂在第0天具有约0.70%的初始hmw峰尺寸,其在5℃下3个月后增加至约0.71%的最终hmw峰尺寸(图6b)。伊匹单抗对照制剂在第0天具有约0.4%的初始hmw峰尺寸,其在5℃下3个月后没有变化(图6b)。pc:ph6.0-1∶1fdrc制剂在第0天具有约0.44%的初始hmw峰尺寸,其在5℃下3个月后增加至约0.45%的最终hmw峰尺寸(图6b)。pc:ph5.5-1∶3fdrc制剂在第0天具有约0.47%的初始hmw峰尺寸,其在5℃下3个月后增加到约0.48%的最终hmw峰尺寸(图6b)。pc:ph6.0-1∶3fdrc制剂在第0天具有约0.51%的初始hmw峰尺寸,其在5℃下3个月后没变化(图6b)。pc:ph6.5-1∶3fdrc制剂在第0天具有约0.56%的初始hmw峰尺寸,其在5℃下3个月后增加至约0.58%的最终hmw峰尺寸(图6b)。pc:ph6.0-3∶1fdrc制剂在第0天具有约0.37%的初始hmw峰尺寸,其在5℃下3个月后增加至约0.39%的最终hmw峰尺寸(图6b)。cief分析在25℃下储存3个月后(图7a)和5℃下储存3个月后(图7b),对纳武单抗dp对照、伊匹单抗dp对照和平台组合(pc)fdrc制剂pc:ph6.0-1∶1,pc:ph5.5-1∶3,pc:ph6.0-1∶3,pc:ph6.5-1∶3和pc:ph6.0-3∶1进行cief。在25℃下储存3个月后,纳武单抗对照酸性峰尺寸减少约0.05%,且伊匹单抗对照酸性峰尺寸增加约5.59%(图7a)。在25℃下储存3个月后,pc:ph6.0-1∶1fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约2.6%和7%(图7a)。在25℃储存3个月后,pc:ph5.5-1∶3fdrc制剂纳武单抗和伊匹单抗酸性峰尺寸分别增加约2.1%和5.9%(图7a)。在25℃下储存3个月后,pc:ph6.0-1∶3fdrc制剂纳武单抗和伊匹单抗酸性峰尺寸分别增加约3.7%和6.8%(图7a)。在25℃下储存3个月后,pc:ph6.5-1∶3fdrc制剂纳武单抗和伊匹单抗酸性峰尺寸分别增加约5.9%和6.3%(图7a)。在25℃储存3个月后,pc:ph6.0-3∶1fdrc制剂纳武单抗和伊匹单抗酸性峰尺寸分别增加约1.3%和6.2%(图7a)。在25℃下储存3个月的所有pcfdrc制剂的伊匹单抗酸性峰尺寸增加约5.9-7.0%,或平均每月增加约2.0%(图7a)。fcfdrc制剂的纳武单抗酸性峰尺寸增加约1.3-5.9%,或每月最大增加约2%(图7a)。在5℃下储存3个月后,纳武单抗对照酸性峰尺寸减少约5.2%,且伊匹单抗对照酸性峰尺寸降低约1%(图7b)。在5℃下储存3个月后,pc:ph6.0-1∶1fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别降低约2%,和增加约2.2%(图7b)。在5℃下储存3个月后,pc:ph5.5-1∶3fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别降低约1.1%和约0.3%(图7b)。在5℃下储存3个月后,pc:ph6.0-1∶3fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸各降低约0.2%(图7b)。在5℃下储存3个月后,pc:ph6.5-1∶3fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约0.5%,和降低约3.1%(图7b)。在5℃下储存3个月后,pc:ph6.0-3∶1fdrc制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约0.1%,和降低约0.2%(图7b)。总之,ph5.5-6.5的1∶3制剂中伊匹单抗和纳武单抗酸性峰尺寸在5℃下储存3个月后显示基本上没有变化,并且在3种不同的比例下伊匹单抗和纳武单抗没有可辨别的变化(图7b)。实施例5进行可行性研究以评估在几种基于纳武单抗dp的制剂中伊匹单抗/纳武单抗(1∶1)fdrc的稳定性,如表6所示。通过改良纳武单抗dp制剂(图1)来设计这些制剂。使用分子量截止值为50kda的离心过滤器装置,将总共24小瓶伊匹单抗dp和纳武单抗dp进行缓冲剂交换,从其原来的dp缓冲剂制剂交换为含有20mm柠檬酸和50mmnacl的ph6.0的缓冲剂制剂(原型a)。以相同的方式制备原型b-d以达到表6所示的规定。原型a在ph6.0下含有7.5mg/ml伊匹单抗,7.5mg/ml纳武单抗,20mm柠檬酸盐,50mmnacl,3.0%w/v甘露醇,100μm三胺五乙酸(dtpa)和0.02%ps80。原型a与纳武单抗dp相同,只是原型a具有100μm三胺五乙酸,而纳武单抗dp具有20μm三胺五乙酸。原型b在ph6.5下含有7.5mg/ml伊匹单抗,7.5mg/ml纳武单抗,20mm柠檬酸盐,50mmnacl,3.0%w/v甘露醇,100μm三胺五乙酸(dtpa)和0.02%ps80。原型c在ph6.5下含有7.5mg/ml的伊匹单抗,7.5mg/ml纳武单抗,20mm柠檬酸盐,100mmnacl,1.0%w/v甘露醇,100μm三胺五乙酸(dtpa)和0.02%ps80。原型d在ph6.0下含有7.5mg/ml伊匹单抗,7.5mg/ml纳武单抗,20mm柠檬酸盐,50mmnacl,6%w/v蔗糖,100μm三胺五乙酸(dtpa)和0.02%ps80。表6:基于纳武单抗dp的fdrc(1∶1)制剂*注:原型a与纳武单抗dp制剂相似,除了三胺五乙酸(dtpa)浓度与伊匹单抗dp制剂(见图1)中相同。fdrc原型a,b,c和d用0.2微米装置过滤并填充于10cc小瓶中(1或2ml每小瓶),塞住并密封。然后将它们放在稳定性站上至多12个月,通过外观、ph、sec、hiac和cief进行稳定性分析。sec分析在40℃下储存1个月后,对纳武单抗dp对照、伊匹单抗dp对照和基于纳武单抗dp的fdrc(1∶1)原型a、b、c和d进行sec(图8)。在40℃储存1个月后,纳武单抗和伊匹单抗对照制剂的hmw峰尺寸分别增加约0.38%和0.02%(图8)。在40℃下储存1个月后,fdrc原型a制剂的hmw峰尺寸增加约0.36%(图8)。在40℃下储存1个月后,fdrc原型b制剂的hmw峰尺寸增加约0.41%(图8)。在40℃下储存1个月后,fdrc原型c的hmw峰尺寸增加约0.37%(图8)。在40℃下储存1个月后,fdrc原型d的hmw峰尺寸增加约0.24%(图8)。纳武单抗对照制剂和fdrc原型a和b制剂各自含有3%w/v甘露醇,而伊匹单抗对照制剂和fdrc原型c制剂具有1%甘露醇,fdrc原型d制剂没有甘露醇(参见表6)。cief分析在25℃下储存3个月后,对纳武单抗dp对照、伊匹单抗dp对照和基于纳武单抗dp的fdrc(1∶1)原型a、b、c和d制剂进行cief(图9)。在25℃下储存3个月后,纳武单抗对照酸性峰尺寸增加约7.5%,伊匹单抗对照酸性峰尺寸增加约8.8%(图9)。在25℃储存3个月后,fdrc原型a制剂的纳武单抗和伊匹单抗酸性峰尺寸各增加约9.4%(图9)。在25℃下储存3个月后,fdrc原型b制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约8.2%和13.8%(图9)。在25℃下储存3个月后,fdrc原型c制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约8.7%和10.2%(图9)。在25℃下储存3个月后,fdrc原型d制剂的纳武单抗和伊匹单抗酸性峰尺寸分别增加约10.1%和9%(图9)。可以通过将各具有100mmnacl的伊匹单抗对照制剂和fdrc原型c制剂与各具有50mmnacl的纳武单抗对照制剂和fdrc原型a、b和d制剂进行比较来观察nacl对酸性峰变化的影响(图9;表6)。实施例6以1∶3比例开发纳武单抗与伊匹单抗的固定剂量比例组合(fdrc)药物产品。伊匹单抗/纳武单抗fdrc是由伊匹单抗和纳武单抗的商品化药物物质制备的。见图1。伊匹单抗药物物质是在20mmtris盐酸盐,100mm氯化钠,1.0%(w/v)甘露醇,100μm三胺五乙酸,0.01%(w/v)聚山梨醇酯80中含有5mg/ml伊匹单抗的ph7.0的水溶液。纳武单抗药物物质是在20mm柠檬酸钠,50mm氯化钠,3.0%(w/v)甘露醇,20μm三胺五乙酸,0.04%(w/v)聚山梨醇酯80中含有20mg/ml纳武单抗的ph6.0的水溶液。伊匹单抗和纳武单抗药物物质都储存在2℃-8℃。通过将伊匹单抗和纳武单抗药物物质以3比1的伊匹单抗与纳武单抗蛋白质比例组合来配制伊匹单抗/纳武单抗fdrc(3∶1)药物产品。最长达6个月的发展稳定性数据表明,在2℃至8℃(预期的储存条件)储存时,fdrc药物产品稳定。fdrc药物产品是用于iv施用的无菌,非致热原,一次性使用,无防腐剂的等张水溶液。fdrc药物产品可以以6.2mg/ml的总蛋白质浓度未稀释而施用,或者用0.9%氯化钠注射液usp或5%葡萄糖注射液usp进一步稀释至所需浓度。fdrc包装在i型燧石玻璃管或模制小瓶中,并用膜涂覆的丁基橡胶塞塞住。fdrc的组成提供于表7。表7.fdrc、伊匹单抗和纳武单抗药物产品的组成的比较1也称为二亚乙基三胺五乙酸(dtpa)2盐酸和氢氧化钠的稀释溶液可用于伊匹单抗和纳武单抗ds制造期间的ph调节。在dp制造期间溶液ph未调节。如表7所示制备的fdrcdp样品的稳定性在预期(5℃),加速(25℃)和应力(40℃)储存条件下进行监测。鉴定了伊匹单抗和纳武单抗的主要降解途径是聚集(通过se-hplc检测到的hmw物质),碎裂(通过se-hplc检测到的lmw物质)和脱酰胺化(通过cex或icief检测到的酸性电荷变体),如实施例1-5所示。这些变化通过se-hplc和icief在fdrc发展稳定性研究中进行监测。另外,在这些研究中,在指定的时间点,分别通过hiac和elisa结合来监测颗粒物质和结合活性。从研究得到的结果表明,在2℃至8℃储存6个月后,在fdrcdp中,组合的hmw物质,组合的lmw物质,纳武单抗的酸性电荷变体,伊匹单抗的酸性电荷变体和颗粒物质的水平基本上保持不变。在25℃的加速条件下进行6个月的研究表明,fdrcdp、纳武单抗dp和伊匹单抗dp之间的hmw物质的形成速率是相当的。fdrcdp中lmw物质的形成速率为每月0.15%,与伊匹单抗dp中每月0.18%的形成速率相当,因为fdrc主要由伊匹单抗组成。fdrcdp中纳武单抗酸性变体的形成速率为每月1.98%,与纳武单抗dp中每月1.76%的形成速率相当。认为在fdrc和伊匹单抗dp中,伊匹单抗酸性变体的形成速率相当,分别是每月2.4%和1.9%。颗粒物质水平基本保持不变。通过在40℃下3个月储存进行的研究表明,在该条件下,在fdrcdp中观察到类似但更大的变化。使用时间研究数据证明了从fdrcdp和从组合单独的纳武单抗和伊匹单抗dp于iv袋中制备的给药溶液的稳定性,相容性和等同性。总之,在应力和加速条件下关键质量属性(cqa)如hmw物质、lmw物质和酸性变体的相当的形成速率以及在推荐的储存条件下这些cqa的可忽略的变化表明了用纳武单抗和伊匹单抗商品化的ds开发fdrcdp的潜能。以上列出的每项研究更详细地显示如下:通过se-hplc检测的聚集和碎裂通过se-hplc检查fdrc的聚集(hmw物质)和碎裂(lmw物质)的程度。伊匹单抗的hmw物质,单体和lmw物质分别与纳武单抗的hmw物质,单体和lmw物质共洗脱。列于表8中的结果报告为伊匹单抗和纳武单抗组合单体、组合hmw物质以及组合lmw物质的面积百分比。组合的hmw物质水平初始测试为0.5%,并且在5℃和25℃下储存6个月保持基本不变(范围为0.5至0.6%),并且在40℃下储存3个月时增加至1.0%。组合的lmw物质的水平初始测试为0.1%,在5℃下储存6个月基本保持不变(范围为0.1至0.2%),在25℃下储存6个月时增加到1.0%,在40℃下储存3个月时增加到2.4%。表8.通过se-hplc检测的fdrc中的组合单体、hmw物质和lmw物质nt=未测试将这些结果与伊匹单抗(5mg/ml)和纳武单抗(10mg/ml)商品化dp制剂对照进行比较,这些商品化dp制剂对照在5℃,25℃和40℃下与fdrcdp一起放置在站上,用此改良的sec-hplc方法以类似的方式分析,分别如表9和表10所示。基于现有数据,显示在2-8℃的推荐储存温度下,伊匹单抗、纳武单抗和fdrc都不易形成hmw物质;并且在25℃和40℃条件下,伊匹单抗、纳武单抗和fdrc之间的每月的hmw物质的形成速率是相当的,如表11所示。更重要的是,fdrc中hmw和lmw物质的形成速率等同于伊匹单抗中hmw&lmw物质的形成速率,因为fdrc主要由伊匹单抗组成,fdrc中的总蛋白质浓度即6.2mg/ml非常接近伊匹单抗dp浓度5mg/ml。在应力和加速条件下cqa例如hmw和lmw物质相当的形成速率和在推荐的储存条件下这些cqa可忽略的变化表明了开发fdrcdp的潜能。表9.通过se-hplc检测的伊匹单抗中的单体、hmw物质和lmw物质表10.通过se-hplc检测的纳武单抗中的单体、hmw物质和lmw物质表11.sehplc检测的伊匹单抗、纳武单抗和fdrc中单体、hmw物质和lmw物质的每月的形成速率icief检测的电荷变体通过icief分析确定fdrc的电荷变体概况(chargevariantprofile)。在色谱图(chromatographicprofile)中分离伊匹单抗和纳武单抗峰。表12中列出了伊匹单抗的酸性峰面积、主峰面积和碱性峰面积的相对量,表13中列出了纳武单抗的酸性峰面积、主峰面积和碱性峰面积的相对量。伊匹单抗和纳武单抗的酸性峰、主峰和碱性峰面积在5℃储存6个月后基本保持不变。对于伊匹单抗和纳武单抗,在25℃和40℃观察到电荷概况(chargeprofile)的变化。在40℃很短的时间内降解显著,因此不用于比较,并且被认为对于dp稳定性的评价过于剧烈。表12.icief检测的fdrc中伊匹单抗的电荷概况表13.icief检测的fdrc中纳武单抗的电荷概况此外,如前所讨论的,上面评价的fdrc组合物由tris.hcl和柠檬酸钠二水合物组成,因此容易由于胺缓冲剂tris-hcl而随温度发生ph变化。因此,fdrc和纳武单抗之间的电荷概况变化在25℃下进行,与样品制备温度和储存温度一致。表12所示的fdrc中的伊匹单抗酸性电荷概况与ph7(4℃)的tris-hcl缓冲剂中的伊匹单抗对照dp(商品化组合物)在25℃条件下的比较(表14)表明,酸性峰形成是相当的,分别为每月2.4%和1.93%,如图10所示。应力条件下此相对较小的差异被认为对于在推荐的储存条件(2-8℃)下fdrc药物产品的稳定性是不显著的,如表12所示。以前,伊匹单抗电荷概况的变化已经由cex监测,因此正在收集数据以鉴定伊匹单抗在各种条件下的电荷概况的可比性,然而,脱酰胺化(伊匹单抗的主要降解途径)潜力可能降低,因为脱酰胺化动力学在较低ph下通常较慢。表14.icief检测的在25℃下伊匹单抗的电荷概况表15中所示的fdrc中的纳武单抗酸性电荷概况与三个纳武单抗长期稳定性批次(ltsb)在25℃条件下的比较表明,酸性峰形成是相当的,分别为每月1.97%和1.75%,如图11所示。表15.icief检测的在25℃下纳武单抗(gmp批次)的电荷概况hiac检测的颗粒物质使用光阻颗粒计数程序(hiac)检查在5℃和25℃下储存最长达6个月的样品,以根据fdrcdp中的尺寸确定颗粒的尺寸和数量。如表16所示,≥2微米,≥5微米,≥10微米和≥25微米的颗粒物质值是可变的,但是完全落在usp<787>中概述的接受标准之内。表16.hiac检测的颗粒物质通过elisa测定法测定结合活性利用elisa测定法检测伊匹单抗与人ctla-4受体的特异性结合以及纳武单抗与人pd-1受体的特异性结合。分别相对于伊匹单抗和纳武单抗参考标准,计算了fdrc样品中的伊匹单抗和纳武单抗的结合活性。fdrc样品在25℃下储存2个月的结合活性在建议的接受标准(70%-130%)内(表17)。表17.通过elisa测定法测定的结合活性胰蛋白酶肽定位测定(mappingassay)进行胰蛋白酶肽定位测定以测量脱酰胺化和氧化。样品被还原,烷基化并用胰蛋白酶消化。胰蛋白酶肽在c-18柱上分离,并通过uv检测器在215和280nm检测,随后用质谱仪(ltq-orbitrap-elite)检测。通过比较所选离子色谱图中完整肽以及修饰肽的峰面积,实现相对定量。测定结果示于表18和表19中。表18.胰蛋白酶肽定位-脱酰胺化3纳武单抗h4=纳武单抗的重链胰蛋白酶肽#44伊匹单抗h5=伊匹单抗的重链胰蛋白酶肽#55伊匹单抗h37/纳武单抗h36脱酰胺化1=伊匹单抗的重链胰蛋白酶肽#37(asn#)和纳武单抗的重链胰蛋白酶肽#36(asn#)6伊匹单抗h37/纳武单抗h36脱酰胺化2=伊匹单抗的重链胰蛋白酶肽#37(asn#)和纳武单抗的重链胰蛋白酶肽#36(asn#)7伊匹单抗h37/纳武单抗h36脱酰胺化3=伊匹单抗的重链胰蛋白酶肽#37(asn#)和纳武单抗的重链胰蛋白酶肽#36(asn#)8伊匹单抗h37/纳武单抗h36脱酰胺化4=伊匹单抗的重链胰蛋白酶肤#37(asn#)和纳武单抗的重链胰蛋白酶肽#36(asn#)表19.胰蛋白酶肽定位-氧化9伊匹单抗h21/纳武单抗h22=伊匹单抗的重链胰蛋白酶肽#21(his/met#)和纳武单抗的重链胰蛋白酶肽#22(his/met#)10纳武单抗h4=纳武单抗的重链胰蛋白酶肽#411伊匹单抗h3=伊匹单抗的重链胰蛋白酶肽#3样品的ph分析测量fdcrdp的ph,如表20所示。表20.dp溶液的ph值储存条件25℃5℃初始6.586.582个月6.596.566个月6.446.38fdrc药物产品的使用时间稳定性进行了研究,以证明fdrcdp连同0.9%氯化钠注射液usp(ns)、iv袋、iv输注套件和在线过滤器的稳定性和相容性。在5℃下储存2个月后,将fdrcdp样品在iv袋中稀释至ns中,将其在25℃下储存4小时,然后在5℃下储存20小时。然后将iv袋中的溶液通过iv套件和在线过滤器输注。将样品收集并通过hiac、微流量成像(mfi)、se-hplc、ce-sds、icief和反相超高效液相色谱(rp-uplc)进行分析。研究结果见表21-23。数据显示,相容性研究完成后,对于颗粒物质(通过hiac)、聚集(通过se-hplc)、碎裂(通过(se-hplc)、纯度(通过ce-sds)、电荷变体概况(通过icief)和伊匹单抗/纳武单抗蛋白质比例(通过rp-uplc)而言,与初始值之间几乎没有或没有变化。结果表明,fdrcdp可用0.9%氯化钠注射液usp稀释至1.5/0.5至4.2/1.4mg/ml伊匹单抗/纳武单抗的浓度范围,用于iv输注。iv袋中的稀释溶液可以在5℃下储存最长达24小时,并且所述24小时中最多4小时可以是在室温(25℃)下储存。表21.fdrc药物产品的使用时间稳定性和可比性12在iv袋中稀释fdrcdp后,在零时间从iv袋收集的样品13储存24小时并通过iv套件和在线过滤器输注后收集的样品表22.fdrc药物产品的使用时间稳定性和可比性表23.fdrc药物产品的使用时间稳定性和可比性共同施用的伊匹单抗和纳武单抗药物产品的使用时间稳定性进行了研究,以证明共同施用的dp连同0.9%氯化钠注射液usp(ns)、iv袋、iv输注套件和在线过滤器的稳定性和相容性。将伊匹单抗和纳武单抗单一疗法dp小瓶在iv袋中稀释至ns中,将其在25℃下储存4小时,然后在5℃下储存20小时。然后将iv袋中的溶液通过iv套件和在线过滤器输注。将样品收集并通过hiac、微流量成像(mfi)、se-hplc、ce-sds、icief和反相超高效液相色谱(rp-uplc)进行分析。研究结果见表24-26。数据显示,相容性研究完成后,对于颗粒物质(通过hiac)、聚集(通过se-hplc)、碎裂(通过se-hplc)、纯度(通过ce-sds)、电荷变体概况(通过icief)和伊匹单抗/纳武单抗蛋白质比例(通过rp-uplc)而言,与初始值之间几乎没有或没有变化。结果表明,共同施用的dp可用0.9%氯化钠注射液usp稀释至1.5/0.5至4.2/1.4mg/ml伊匹单抗/纳武单抗的浓度范围,用于iv输注。iv袋中的稀释溶液可以在5℃下储存最长达24小时,并且所述24小时中最多4小时可以是在室温(25℃)下储存。表24.共同施用的伊匹单抗和纳武单抗药物产品的使用时间稳定性和可比性14在iv袋中稀释共同施用的dp后,在零时间从iv袋收集的样品15储存24小时并通过iv套件和在线过滤器输注后收集的样品表25.共同施用的伊匹单抗和纳武单抗药物产品的使用时间稳定性和可比性(续2)表26.共同施用的伊匹单抗和纳武单抗药物产品的使用时间稳定性和可比性(续3)实施例7对于纳武单抗-伊匹单抗1∶3固定剂量比例组合,测定了纳武单抗-伊匹单抗1∶3固定剂量比例组合(fdrc)中ph和聚山梨醇酯80的过程性能认证(processperformancequalification)(ppq)限值。fdrc药物产品的定量组成见表27。表27.fdrc药物产品的定量组成q.s.=足重ph限值16也称为二亚乙基三胺五乙酸17盐酸和氢氧化钠的稀释溶液可用于纳武单抗和伊匹单抗ds制造期间的ph调节。在fdrcdp制造期间溶液ph未调节。商品化伊匹单抗ds和纳武单抗ds分别具有6.6-7.6(4℃)和5.5-6.5的ph接受标准。由于是在没有对引入的ds进行任何进一步操作的情况下制造fdrcdp的,进行了研究以了解由于引入的ds的可变性的fdrcdp中ph的可能范围。表28.由于引入的ds的可变性的fdrcdpph的可变性通过添加42ml的20mmtris-hcl和3.5ml的20mm柠檬酸钠缓冲剂制备溶液以模拟fdrcdp制剂。该评价的结果(表28)表明,fdrcdp的ph范围可以在5.7-7.0的范围内,环境条件下目标ph为6.2-6.3。该属性在引入的纳武单抗和伊匹单抗的ds中得到很好的控制,因此,fdrcdp将不太可能经历5.7或7.0的ph极值。另外,基于目前对伊匹单抗和纳武单抗的cqa的了解,预计fdrcdp质量属性的风险在较高的ph范围更高。基于这一理解,开始了两项额外的研究,以评估ph对dp质量属性的影响,并了解来自引入的ds的各种赋形剂(包括ph)的可变性对dp质量属性的影响。来自ph范围研究的数据的评估集中于受ph变化影响的fdrc的质量属性,例如通过毛细管等电聚焦(icief)监测的电荷概况和通过尺寸排阻色谱(sec)监测的高分子量聚集体。在2-8℃推荐的储存条件下或在25℃下最多3个月,在5.4-6.6的ph范围(环境)内,fdrcdp的sec概况无可辨别的变化。仅在加速条件(40℃)下观察到可量化的变化,其中显示评估的ph范围对sec概况没有影响(表29)。表29.由于ph可变性的单体、hmw和lmw物质(%)如表30所示,在2-8℃的推荐储存温度下6个月后,伊匹单抗和纳武单抗的电荷概况没有显示出超出分析误差的任何显著差异。伊匹单抗和纳武单抗的电荷概况主要在25℃的储存温度下进行评估,因为差异更可辨别,不像40℃时,该概况显著改变,分子明显解离。图12显示了fdrcdp中的伊匹单抗和纳武单抗与其各自的对照相比在ph6.0的酸性概况。表30.在5℃下6个月后由于ph可变性的酸性峰和主峰概况(cief)此外,以表31中所示的变量发起的ph耐用性研究(其中评估的ph范围在5.8-7.0之间变化)已经得到类似的sec和cief概况观察结果。表31.dp耐用性研究设计fdrcdp的hmw概况在2-8℃和25℃下储存6个月后保持不变,如图13所示(单体概况见图14),表明即使在存在其他变量如氯化钠、甘露醇和ps80的浓度的情况下,也没有ph的影响。fdrcdp中伊匹单抗和纳武单抗酸性峰和主峰概况的评估(图15-18)清楚地表明在25℃的加速温度下脱酰胺化的ph依赖性,如在ph7.0的较高温度范围酸性峰概况的增加所示。然而,在加速温度下的这种作用没有转化为在2-8℃的推荐储存温度下的可量化差异。cief峰概况和ph值的影响如图19所示,icief概况:5.4-6.6的ph范围如图20所示。聚山梨醇酯80限值:nlt60μg/mlfdrcdp中的聚山梨醇酯80浓度主要由混合制备fdrcdp的伊匹单抗和纳武单抗ds的比例限定,其中fdrcdp中ps80的目标浓度为120μg/ml,伊匹单抗和纳武单抗ds的标称浓度分别为100μg/ml和400μg/ml。对于纳武单抗和伊匹单抗ds,ps80没有发布接受标准(releaseacceptancecriteria);然而,纳武单抗ds和伊匹单抗ds制造分别具有275-525μg/ml和60-140μg/ml的过程中(in-process)限值。受ps80可变性影响的dp属性如sechmw(%)的初步分析没有可辨别的变化(图13),10-25微米范围内的由hiac所测颗粒符合目前的usp接受标准。另外,fdrcdp制造方法被设计成使得在dp小瓶填充之前不需要过滤器冲洗,这是由于存在冗余无菌过滤器下游的中间罐(35-40l),其在启动填充操作前被填充。此外,在dp优化研究期间,在水平摇动器上以300rpm至多72小时的最坏的搅拌情况下,在fdrcdp中评估了120μg/ml-1000μg/ml的ps80浓度范围。这些研究通过视觉外观分析时显示72小时后没有任何可视颗粒,所有原型的sec概况与初始时间点没有可辨别的差异。在此基础上,决定通过在dp生产现场添加浓缩的ps80浓缩物从而不改变fdrcdp的目标浓度。但是,为了了解由于用输注溶液如盐水稀释后ps80水平显著降低造成颗粒产生或hmw物质形成的潜在风险,进行了研究,其中将具有目标浓度为120μg/ml的ps80的fdrcdp溶液用生理盐水进行20倍稀释(6μg/ml),所得溶液通过视觉外观、hiac所测颗粒和sechmw(%)评估至多24小时。该研究表明,从fdrcdp制备的输注溶液中降至6μg/ml的ps80的浓度没有引起溶液的视觉外观,hmw概况或hiac特征的任何变化,这加强了将目标浓度维持在120μg/ml的理由。此外,预期在临床和商品化施用期间,将使用输注溶液将fdrcdp稀释~3x,导致ps80浓度为40μg/ml。所提出的60μg/ml的nlt的ps80浓度仍然得到20μg/ml的最终输注溶液浓度,这超过了上面讨论的稀释研究中6μg/ml的评估浓度。本申请要求享有2016年3月4日提交的美国临时申请no.62/303,855,2015年12月17日提交的美国临时申请no.62/269,000,2015年12月9日提交的美国临时申请no.62/265,268,和2015年4月17日提交的美国临时申请no.62/149,325的利益,这些美国临时申请全部内容通过引用并入本文。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1