用于体重管理的胃内装置的制作方法
本发明涉及一种用于体重管理的胃内装置。
背景技术:
肥胖是当一个人的累积体重高于可能会产生负面的健康问题(如患糖尿病、心血管疾病、肌肉骨骼疾病、甚至癌症的机会增加)的特定阈值时的一种健康状况。当食物的摄入量高于体育活动形式的能量输出时,就会发生这种状况。根据世界卫生组织的一份报告,自1980年以来,全世界肥胖人口的数量翻了一番。在2008年,全球20岁及以上的成年人35%超重,11%肥胖。预计这个数字将每年增长。当然,解决肥胖引起的问题的最好方法是预防肥胖。然而,由于现代化和工作模式的转变,保持均衡饮食和定期锻炼变得更具挑战性。成年人倾向于食用大量高热量食物,同时过着久坐的生活方式,从而增加了肥胖的机会。
目前,市场上有各种各样的选择来促进成人减轻体重。非处方减肥草药,抗肥胖药,塑身以及体重管理计划许承的是无法交付且不可持续的结果并且具有各种轻微和不良的副作用。对于更严重肥胖的人,可以采用减肥手术和放置胃气囊等医疗过程。
减肥手术涉及通过胃旁路手术或使用胃带手动改变胃的大小或消化道。这些过程在促进体重减轻方面被证明是有效的,但它们是侵入性的,并且可能会导致不良影响,如手术并发症、骨代谢疾病和肾脏疾病。
引入胃气囊占据胃部空间从而减少胃容积和改善饱腹感[1],比减肥手术侵袭性小。商业化的第一个胃内气囊(IGB)是1985年的Garren-Edwards胃气泡(GEGB)[2]。之后,开发了几种不同的IGB,并且有些仍然在市场上销售[3][4]。虽然在某些临床报道[5]中IGB产生了最初的高功效,但由于长时间使用会导致胃容受性和饱腹感的丧失,从长远来看减肥效果会下降。而且,目前可用的IGB需要通过导致患者不适和可能的并发症的方法来放置和移除。由于这些限制,IGB仍然是不适合手术的患者或在其他干预之前可能需要适度的减轻体重的超级肥胖者的第二选择,并且尽管已熟知它们在促进体重减轻方面的功效,仍然没有作为一般的减肥方案被广泛接受。
技术实现要素:
目前公开的胃内装置是独立的,不需要与外部装置的物理连接。其也不包含机载电子设备,使其足够小以供口服给药。这消除了对手术植入或其他复杂的胃手术的需要,并且意味着患者在吞咽时感到不适较少,因为不使用从食管和鼻腔/口腔中出来的管进行充气。这进一步减少了患者的不适,潜在地增加了其摄入。
它在胃中的定位由射频检测器或磁性霍尔效应传感器网络确认,并且充气是按需、远程触发的一步法。为了安全起见,可以将自动和可选的手动放气方法结合到胶囊中。手动放气(如果提供)是一个类似的简单的一步法。
非侵入性的给药方法避免了住院并减少了恢复时间,并可以更方便和频繁地给药。较短的治疗周期引起较少的胃容受性问题,从而增加其整体功效。自动和可选的手动放气特征使其不太可能长期阻塞消化道,因此安全性增加。所涉及的材料的低成本和易用性意味着它可以比现有的商业解决方案更廉价地销售。
该胃内装置包括呈具有纵向轴线的细长胶囊形式的独立可摄入的体重管理药丸,具有包围胶囊的至少一部分的可充气的膜或气囊。该装置具有分离两个腔室的分离器,并且每个腔室包含不同的化学品,当混合在一起时,该化学品反应产生气体。化学品通过充气磁感应结构变化而彼此接触,该变化除去分离器并允许化学品混合,这又产生气体以使膜或气囊充气。充气的膜或气囊将在胃中占据更多的空间,并且这导致服用药丸的患者的饱腹感。
通过使用位于外部的霍尔效应传感器来跟踪该装置的充气磁性签名可以确定该装置在消化道内的位置。可替代的,可以将射频识别能力结合到该装置中,并在接近外部射频识别(RFID)传感器时被检测。该外部充气磁场也可以能够在期望的方向上向该装置提供推动力,以便将其定位以用于膨胀或药物释放。
充气子组件的机构完全位于该装置(胶囊的形式)内。当两种或更多种化学品(基于液体或固体)混合在一起时,通过发生化学反应来实现充气。在混合之前,化学品通过分离器被物理分离,并且当分离器被移除时磁力地触发该混合。这可以通过使分离器成为隔板的一部分来将该装置的内部体积分成两个分离的腔室,并且每个腔室容纳其中一种化学品来实现。该分离器被联接到该胶囊内的可滑动的充气磁体,所述可滑动的充气磁体被配置成,当具有特定的充气磁场通量的外部充气磁力靠近时,该可滑动的充气磁体朝胶囊的远端或第一端轴向移动。联接到该分离器的充气磁体的运动相应地将该分离器和该隔板拉开,使得这两种化学品(其中一种或两种是以溶质/固体形式)彼此混合并反应,从而产生气体。为了安全起见,该反应物应该是生物相容的,或者浓度足够低,以便在装置泄漏时无害。
产生的气体将导致弹性外包裹物(气囊)充气。然而,它也可能是先封装良好的内部膜,由气体压力充气。这种材料应该是生物相容的,并且能够抵抗自然产生的胃肠液的降解,直到其功能已经完成。
该装置可以包括允许该装置自动或手动放气的放气机构。这使得该装置可以安全地通过消化道并被排空。在自动化方法中,可以改变包装膜对充气气体的渗透性以使其持续所需的时间长度。可替代的,该膜/气囊或其他部分可随时间化学降解。
对于可选的手动放气,该装置可以包括辅助充气磁致动机构,类似于充气的机构,但是由完全相反的外部充气磁场触发。换言之,用于致动和放气的致动/触发机构可以通过所施加的充气磁场的方向来区分。所施加的充气磁场的方向因此可以确定哪个致动机构被触发。
在另一个实施例中,该装置可以包含药物,并且外部充气磁力或来自化学反应的压力可以使它们离开该装置并且对消化道区域提供治疗。
在另一个实施例中,该装置可以提供收集组织样本用于活组织检查的充气磁力致动装置。
根据第一方面,提供一种用于体重管理的胃内装置,所述胃内装置包括:
具有纵向轴线的胶囊,所述胶囊被配置为容易被人吞咽;
充气磁体,所述充气磁体被设置在所述胶囊内,使得所述充气磁体的北极和南极中的一个面向所述胶囊的第一端,所述充气磁体从所述胶囊的所述第一端移位,所述充气磁体被配置成,在所述充气磁体沿所述纵向轴线移动时,所述充气磁体可滑动地接合所述胶囊,所述充气磁体被配置成,在所述胃内装置被使用者吞咽之后,通过从外部向所述使用者施加充气磁场致动所述胃内装置期间,所述充气磁体朝所述胶囊的所述第一端移动;
第一腔室,被配置成在其中存储第一化学品;
第二腔室,被配置成在其中存储第二化学品;
隔板,所述隔板被配置成将所述第一腔室与所述第二腔室物理分离,所述隔板具有通孔,所述充气磁体被设置在所述隔板与所述胶囊的所述第一端之间,所述第一腔室被限定在所述胶囊内,至少部分地位于所述充气磁体和所述隔板之间,所述第二腔室至少部分地由所述隔板和所述胶囊限定;
分离器,所述分离器在所述胃内装置被致动之前密封所述隔板中的所述通孔,所述分离器被连接到所述充气磁体,其中,所述充气磁体朝向所述胶囊的所述第一端的移动使得所述分离器移动以打开所述通孔;
其中,当所述通孔被打开时,经由所述通孔在所述第一腔室与所述第二腔室之间建立流体连通,以允许所述第一化学品与所述第二化学品之间发生化学反应;
气囊,所述气囊被固定到所述胶囊,并在致动所述胃内装置之前被收缩抵靠于所述胶囊的外表面;和
可膨胀体积,至少部分地由所述气囊和所述胶囊的外表面限定,所述可膨胀体积被配置成当所述气囊被化学反应的气体产物充气时膨胀。
所述第二腔室和所述可膨胀的体积可以是同一个。
所述隔板可以包括所述胶囊的所述第二端。可替代的,所述隔板可以包括所述胶囊的侧壁。
所述第一腔室可以包括被限定在所述充气磁体和所述隔板之间的第一部分和被限定在所述隔板和所述胶囊的第二端之间的第二部分,其中所述隔板包括具有第一开口的第一层和具有第二开口的第二层,所述第一开口和所述第二开口限定所述隔板的所述通孔,所述第一层和所述第二层被间隔开并在其间限定通道,所述通道经由所述胶囊的侧壁内的通道开口与所述第二腔室流体连通。
所述第二腔室可以限定在所述胶囊内介于所述隔板与所述胶囊的第二端之间,并且,所述胶囊中设置有通气孔以在所述第二腔室与所述体积之间建立流体连通。
可以在所述胶囊的所述第二端处设置放气阀,所述放气阀允许所述气体产物流出所述气囊。
所述放气阀可以包括所述胶囊的所述第二端中的贯通开口,和在所述胃内装置放气之前密封所述贯通开口的塞子,所述胃内装置还包括设置在所述胶囊内并且在与所述充气磁体相同的方向上定向的放气磁体,所述放气磁体从所述胶囊的所述第二端移位,所述放气磁体被配置成,在所述放气磁体沿着所述纵向轴线移动期间可滑动地接合所述胶囊,所述放气磁体被配置成,在从外部向使用者施加充气磁场期间,朝向所述胶囊的第二端移动,其中所述放气磁体的移动导致所述塞子从所述贯通开口移开。
所述放气磁体可以经由在设置于所述胶囊中的滑轮上运行的柔性线缆连接到所述塞子,其中所述放气磁体朝向所述胶囊的所述第二端的移动将所述塞子拉入所述胶囊中以打开所述贯通开口。
所述放气磁体可以设置有朝向所述胶囊的第二端延伸的棒,其中所述放气磁体朝向所述胶囊的第二端的移动导致所述棒与所述塞子接触,并将所述塞子推出所述胶囊以打开所述贯通开口。
所述的胃内装置还可以包括从所述胶囊的内表面突出的挡柱,所述挡柱限制所述充气磁体朝向所述胶囊的第二端的移动范围。
所述充气磁体可以通过刚性杆和柔性线缆中的一种连接到所述分离器。
所述胃内装置还可以包括设置在所述胶囊中介于所述充气磁体和所述第一腔室之间的柔性膜,所述柔性膜的周边边缘被所述胶囊密封。
所述柔性膜可以经由可生物降解的连接器连接到所述充气磁体。
容纳所述充气磁体的胶囊的部分可以经由可生物降解的环连接到所述胶囊的其余部分,其中所述充气磁体和容纳所述充气磁体的胶囊的所述部分通过所述可生物降解的连接器和可生物降解的环的生物降解从所述胶囊的其余部分分离。
所述分离器可以经由与所述柔性膜的粘合连接而连接到所述充气磁体。
所述柔性膜可以允许气体产物随时间流出所述气囊。
所述气囊可以允许所述气体产物随时间流出所述气囊。
所述气囊可以包括允许所述气体产物随时间流出所述气囊的放气阀。
所述分离器被配置成当外部施加的充气磁场被去除时重新密封所述隔板中的所述通孔。
附图说明
为了使本发明可以被充分理解并且容易实际应用,现在将仅通过非限制性示例的方式来描述本发明的示例性实施例,该描述参照所附的说明性附图。
图1是示出了胃内装置在胃中的位置的RFID检测的示意图。
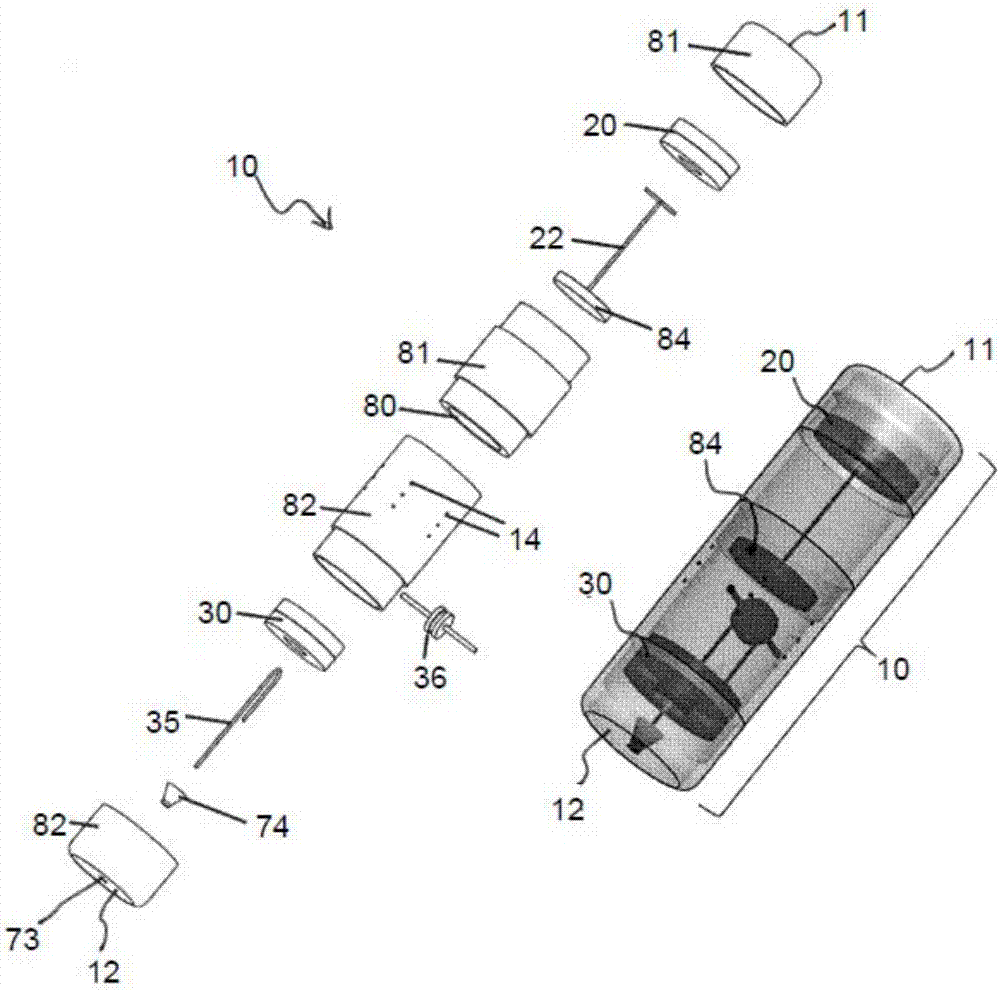
图2是该胃内装置的胶囊的第一实施例的分解组装图和透视图。
图3是使用外部磁体来对位于胃中的该胃内装置充气的示意图。
图4是该胃内装置的第一示例性实施例的示意性横截面图。
图5是该胃内装置的第二示例性实施例的示意性横截面图。
图6(a)是该胃内装置的放气机构的第一示例性实施例的示意性横截面图。
图7(b)是该胃内装置的放气机构的第二示例性实施例的示意性横截面图。
图7是使用外部磁体对位于胃中的该胃内装置放气的示意图。
图8(a)是被配置为允许多次充气的图4的胃内装置。
图8(b)是被配置成允许多次充气的图5的胃内装置。
图9是该胃内装置的第三示例性实施例的示意性横截面图。
图10是图9的该胃内装置在气囊充气之后分离含有充气磁体的胶囊的一部分期间的图。
图11是在气囊放气的第一示例性实施例中的图10的胃内装置。
图12是在气囊放气的第二示例性实施例中的图10的胃内装置。
图13是使用外部磁体使位于胃中的胃内装置充气的透视剖视图。
图14是胃内装置的另一示例性实施例的示意性横截面图。
图15是胃内装置的另一示例性实施例的示意性横截面图。
图16是胃内装置的可替代的示例性实施例的示意性横截面图。
图17是在胶囊上折叠的气囊的透视图。
图18是在胶囊上扭转的气囊的透视图。
图19是在胶囊上卷曲的气囊的透视图。
图20是同心地折叠在胶囊上的气囊的透视图。
图21是胃内装置的各个实施例的覆盖物的透视图。
详细描述
以下将参考附图1-21来描述用于体重管理的胃内装置99的示例性实施例。所有这些图中,使用相同的参考数字来表示各个实施例中的相同或相似的部分。
位置
该胃内装置99的优选实施例具有多个强的内部充气磁体,充气磁体的数量至少为一个。该胃内装置99可以在摄取之后通过霍尔效应传感器网络或RFID来定位,如图1所示。检测器优选就位于患者外部靠近胃200。检测器400被定位以覆盖由食管下部括约肌和幽门括约肌所界定的所有可能的位置。由于该充气磁体是强不透射线的,因此X射线也可以用于确认该胃内装置99的位置。强充气磁性允许该胃内装置99即使在其被确定的位置具有几厘米的误差时也能被致动,例如在胃内装置99可能在胃液中漂浮的胃内应用中。外部施加的充气磁场依赖于强度梯度来引导该胃内装置99,使得该胃内装置99能够被阻力组织表面支撑。与该胃内装置99上的净充气磁力相反的阻力表面的这个反作用力也引起充气机构被致动,如下面将更详细描述的。外部充气磁场可以由大的永久充气磁体或螺线管产生。其他实施例可以利用亥姆霍兹线圈或高斯线圈来产生充气磁场梯度。通过增加供应到电充气磁性装置的功率或者通过使永久充气磁体移动更接近胃内装置99,一旦在该胃内装置99的位置处的场强超过特定值,该充气机构就被触发。然而,为了防止对患者造成伤害,由胃内装置99施加在胃壁上的力不能太大。
结构
对于该胃内装置99的所有实施例而言,包括以下描述的示例性实施例,该胃内装置99充气磁性减肥胶囊包括多个部件。这些部件中有内胶囊10,具有纵向轴线X,该胶囊10被配置为容易被人吞咽。该胶囊10优选全部或部分地由模制塑料或明胶制成。该胶囊10优选为圆柱形。这种形状在吞咽时允许极小的患者不适。该胶囊10的最大直径应当小于食道的最小宽度。该胶囊10由生物相容且耐酸的材料如PDMS制成。
在致动该胃内装置99之前,将膜或气囊90(图2中未示出)固定93到该胶囊10上,并且以收缩状态抵靠在胶囊10的外表面19上。可以使用诸如PDMS 93的粘合剂硅橡胶将气囊90密封到胶囊10,或者可替代地,用于将气囊90密封到胶囊10的胶93可以是化学可降解的。至少部分地由气囊90和胶囊10的外表面19限定的可膨胀体积98被配置成当气囊90充气时膨胀。通过充气,气囊90膨胀成球体。气囊90优选由诸如硅树脂或橡胶的弹性材料制成。在其初始状态下,气囊90被包裹,折叠或以其他方式收缩抵靠在胶囊10的外侧19上。收缩的气囊的实施例如图17至20所示,其中气囊90可被折叠或扭曲以形成如图17和图18所示的褶皱94,或者如图19所示,气囊90可围绕胶囊10卷曲,或者如图20所示围绕胶囊10同心地折叠。如图21所示,优选使用由可生物降解材料如壳聚糖或胶凝物或由壳聚糖和PDMS的组合制成的弱结合/覆盖物或涂层300以保持球囊90收缩,并且在胃内装置99被使用者吞咽时促进胃内装置99沿食道向下通过。该覆盖物被配置成在胃内装置99被吞咽后几小时内溶解在胃酸环境中。气囊90被设计为保持其体积的至少60%,持续至少30天。
膜或气囊90可以具有弹性特性,这允许其容纳所产生的不精确量的气体同时保持所需的形状。然而,膜或气囊90不能由过于柔顺的材料制成,以避免其被吸入使用者的括约肌中。它的形状和大小也应当阻挡通过幽门括约肌,并且避免括约肌的阻塞。简单的球体形状可能就足够了,因为占用体积的子部件预计是易浮的,因此处于胃液的表面,远离幽门括约肌。其他可能的形状包括圆环,其在中间有一个孔以便允许部分消化的食物通过括约肌。
膜或气囊90的材料可以被设计成在胃中停留一定时间后失效。膜或气囊90的一个可能的实施例可以由不同的气体渗透特性和抵抗化学降解的多个层组成,使得气体的逸出速率初始较低,一旦不可渗透但可降解的层已经溶解,则以指数形式增加。溶解可以是由该装置内残留的化学品引起,其可以是作为放气子部件中概述的手动放气方法的一部分而被致动,或者其可能是由胃中的胃液引起的。
胃内装置99的充气机构被设计为,在装置99内完全物理上独立,使得患者不需要摄取任何其他物质。一旦胃内装置99在胃中的停留已被医生确认,通过外部充气磁力远程触发充气。这避免了装置99在食道中时的过早膨胀,或者当装置99已经进入小肠时装置99的延缓充气。
胃内装置99的体积通过产生气体的化学反应而增加。可能的反应包括酸和碱反应以产生二氧化碳气体,或者催化剂引起过氧化氢分解成氧和水。这些反应中涉及的化学品必须在装置99吞咽之前分开放置,这可以借助装置内99中提供的隔膜或隔板80来完成。为此,在使用之前,将诸如液体反应物A的第一化学品储存在胶囊10内部的胃内装置99的第一腔室81中。诸如粉状固体反应物B的第二化学品储存在胃内装置99的第二腔室82中。这两个腔室81、82被隔膜或隔板80隔开。隔板80具有通孔83。在使用胃内装置99之前,诸如可以被成形为圆盘或者截头圆锥的柔性硅树脂元件的分离器84密封通孔83。第二腔室82至少部分地由隔板90和胶囊10限定,并且可以完全位于胶囊10的内部,如图2至图4,图7和图8(a)所示,或者在胶囊10的外部,如图5,8(b),9至12,14和15所示。RFID芯片和天线优选整合到胶囊10的侧面。
第一腔室81被配置成容纳酸的水溶液,例如柠檬酸或乙酸,并且优选由惰性塑料或橡胶材料制成。与第一腔室81中的液体接触的所有机构都应当已经被处理成类似惰性的。
第二腔室82优选含有一些或全部的第二化学品B,例如碳酸氢钾粉末或碳酸氢盐粉末。
充气磁体20设置在胶囊10内,使得充气磁体20的北极N或南极S面向胶囊10的顶部或第一端11。充气磁体的定向决定了用于触发化学混合的致动充气磁体的极性。充气磁体20从胶囊10的第一端11移动距离D1,并被配置成在充气磁体20沿纵向轴线X的运动期间可滑动地接合胶囊10。在充气磁体20与胶囊10的第一端11之间存在足够的间隙,从而允许充气磁体20及其连接部件沿着胶囊10的纵向轴线X的运动。挡柱13被模制到胶囊10的内表面18,以限制充气磁体20的轴向运动范围。最初,在使用之前,充气磁体20靠在挡柱13上,并且分离器84或硅树脂元件形成隔膜或隔板80的一部分以密封通孔83,从而形成防水密封。充气磁体20可以是一种环形磁体,圆柱形磁体或球形磁体。
充气磁体20被配置成,在胃内装置10已经被使用者吞咽之后,通过在使用者的外部施加充气磁场致动胃内装置99期间,充气磁体20朝向胶囊10的第一端11移动。充气磁体20优选为具有中心孔的圆柱形钕充气磁体。充气磁体20可以涂覆聚四氟乙烯,以用于化学惰性并且容易在胶囊10内部滑动。
充气磁体20因此被设置在隔板80与胶囊10的第一端11之间,使得第一腔室81至少部分地在充气磁体20与隔板80之间限定在胶囊10内。气囊90优选被密封到胶囊10的外部19,与最靠近充气磁体20的第一腔室81的端部相邻。
分离器84通过包括刚性杆和柔性线22的连接器22连接到充气磁体20,以便充气磁体20朝向胶囊10的第一端11的移动使分离器84移动以开启通孔83。连接器22应当是耐酸的。
充气
确认了胶囊10进入胃中后,定位检测器被撤回,并且外部充气磁体100逐渐靠近胃,以其南极领先。参考图4,设R是从自由漂浮的胶囊10到外部充气磁体100测量的距离。当R低于R1时,施加在胶囊10上的充气磁力将使其移向并使其与外部充气磁体的相同的南北方向上对准。这将导致胶囊10的第一端11被支撑抵靠在胃的内粘膜。如果R现在小于R2,则充气磁体20上的力将克服硅树脂元件或分离器84与隔膜壁或隔板80的其余部分之间的摩擦力。如果R还没有降低到R2以下,则外部磁体100仍然继续接近胃壁,直到R<R2。充气磁力使充气磁体20和硅树脂元件或分离器84轴向移动,破坏密封以打开通孔83,由此将诸如柠檬酸的第一化学品从含有液体的第一腔室81释放到含有粉末的第二腔室82。
含有粉末的第二腔室82被设计成容纳足够的第二化学品,例如碱,使得气囊90在反应时间的10分钟内达到其占据体积的至少50%。这是为了防止装置99通过幽门括约肌排出,该排出对于大的食物颗粒会在15分钟之后发生。气囊90的90%充气将发生在长达6小时的较长时间范围内,因为这取决于患者给药后使第一腔室81中剩余的第一化学品(例如酸)与第二腔室82中的第二化学品(碱粉末)接触的正常运动。
示例性实施例1
在如图2至图4,图6(a)和图7所示的示例性实施例中,粉末或第二腔室82被限定在隔板80与胶囊10的第二端部12之间的胶囊10内。通气孔14被设置在胶囊10的侧壁15中,以建立第二腔室82与气囊90中的体积98之间的流体连通。第二腔室的通气孔14允许第一化学品A和第二化学品B之间化学反应的气体产物使气囊充气。例如,第一化学品A是酸的水溶液、第二化学品B是碳酸氢盐粉末时的酸碱反应会产生CO2气体。第二腔室82中的粉末优选被压实以减小其体积,并最小化其从通气孔中的移出。
在本实施例中,在化学反应期间,释放的诸如二氧化碳的气体将会把酸排出通气孔14。在反应中或第二腔室82中的未反应的第一化学品(例如酸溶液)也可能随时间经由通气孔14漏出。因此,在本实施例中,折叠的气囊膜90也可以在使用之前含有一些第二化学品(例如碱)以与第一化学品(例如排出的酸)反应。
示例性实施例2
在如图5所示的第二示例性实施例中,第二腔室82和可膨胀体积98是同一个。换言之,气囊90中的可膨胀体积98用作第二腔室82,以在混合第一和第二化学品之前存储第二化学品。在该实施例中,第一腔室81包括被限定在充气磁体20和隔板80之间的第一部分81-1,以及被限定在分隔板80和胶囊10的第二端12之间的第二部分81-2(图6中未示出)。在该实施例中,隔板80包括具有第一开口87的第一层85和具有第二开口88的第二层86。第一开口87和第二开口88限定该隔板80的通孔83,并且在使用装置99之前都被分离器84密封。第一层85和第二层86间隔开以在其间限定通道89。通道89经由胶囊10的侧壁15中的一个或多个通道开口17与第二腔室82、98流体连通。
因为充气磁体20被外部磁体100向朝向胶囊10的第一端11吸引,因此当分离器84远离通孔83而打开第一和第二开口87、88(图5中的虚线所示的打开位置)时,通道89与第一腔室81的第一部分81-1和第二部分81-2流体连通。由于通道89已经与第二腔室82、89流体连通,这允许存储在第一腔室81的第一部分81-1和第二部分81-2两者中的第一化学品与第二腔室82、89中的第二化学品混合以产生气体,对气囊90充气。
具有放气磁体的放气机构
参照图2至图5所述的第一和第二示例性实施例中,可以设置如图6(a)和6(b)所示的放气机构。该放气机构包括设置在胶囊10内的放气磁体30,使得放气磁体30的北极N和南极S定向在与充气磁体20北极和南极相同的方向上。在一个示例中,充气磁体20以其北极N面向胶囊10的第一端11的方式定向。因此,放气磁体30以其北极N面对胶囊10的第一端11的方式定向,使得放气磁体30的南极S面向胶囊10的第二端12。
放气磁体30优选是另一个圆柱形钕充气磁体。设置在胶囊10的内表面18上的挡柱16限制放气磁体30的初始位置。充气磁体20和放气磁体30之间将存在小的吸引力,在运输和摄取胶囊10的过程中将它们保持在适当的位置,从而防止该机构意外致动。由于放气磁体30在使用之前通过挡柱16从胶囊10的第二端12移位,在放气磁体30与腔室10的底部或第二端12之间存在位移D2的气隙,这允许放气磁体向下或朝向腔室10的第二端12运动。
该腔室的第二端12包含孔或贯通开口73,该孔或贯通开口73在胃内装置99放气之前由塞子74塞住,塞子74优选由硅树脂制成。通过放气磁体30向胶囊10的远端顶端或第二端12的移动,塞子74被拉出(图6(a))或被推出(图6(b))贯通开口73。放气磁体30被配置成在放气磁体30沿着纵向轴线X移动期间可滑动地接合胶囊10,放气磁体30被配置成在从外部向使用者施加充气磁场期间朝向胶囊10的第二端12移动,其中放气磁铁30的移动引起塞子74从贯通开口73中移出。
将放气磁体30机械耦合到塞子74的两个可能的实施例如图6(a)和(b)所示。在第一实施例(图6(b))中,放气磁体30具有朝向胶囊10的第二端12延伸的突出部或棒31,其中放气磁体30朝向胶囊10的第二端12的移动导致该棒31与塞子74接触并将塞子74推出胶囊10以打开贯通开口73。
在第二个实施例中(图2,3,6(a),7),硅树脂塞子74通过柔性线缆/线或缆绳35和滑轮36系统连接到放气磁体30,其中缆绳35在胶囊10内的滑轮36上运行。当放气磁体30朝胶囊10的第二端12移动时,塞子84被向内拉动并保持在胶囊10中以打开贯通开口73。塞子74优选为圆锥形,以防止由于胶囊10的内部气压而被推出胶囊10。
在放气过程中,胃内装置99在胃中的存在首先由恰好位于患者的胃部外侧的射频检测器(一个或多个)确认。然后撤回该射频检测器,并且使北极指向胃的外部磁体100靠近患者。随着放气磁体的南极S被吸引到外部磁体的北极,该胶囊10将自定向,使得在胶囊10的第二端12处的放气机构指向外部磁体100。然后将该外部磁体100靠近至小于R3的距离(图7),在该点,该放气磁体30移动并相应地使小的硅树脂塞子74移位,从而允许空气从气囊90泄漏出来。然后,放气的气囊90和胶囊10穿过幽门括约肌和消化道的其余部分,之后被从患者排出。
因为气囊90可以限制胶囊10与胃壁直接接触,所以高于R3作用的磁力将更小。这意味着放气机构的致动力应该小于充气机构的致动力。然而,塞子74的配合应足够强以抵抗内部气体压力。
多次充气
隔膜或隔板80的打开也可以是可逆的,使得外部磁体100的操作者可以控制充气的程度。可以通过使分离器84返回密封到其原始位置、并提供压力以保持隔板80中的孔83关闭的弹力或磁力而实现该可逆操作。
例如,参考图2至图6所示的上述第一和第二示例性实施例,其中,在设置有包括放气磁体30的放气机构的情况下,如果在充气过程中施加的外部磁体100在预定时间段之后被移除,则充气磁体20将由于该放气磁体30提供的吸引力滑到其初始位置,并且隔板80内的充气阀或通孔83被关闭。然后没有观察到更多的反应,并且在阀或通孔83打开之前不释放CO2或其它气体。这允许装置99多次充气,以对气囊90充气到期望的体积。为了允许装置90的多次充气,分离器84可以被设计成包括比图8(a)所示的孔83或者比图8(b)所示的截头圆锥体大的圆盘,以确保在第一次打开孔83后的良好的重新密封。
实验:
如图2至图4,6(a)和7中所示,如上文在示例性实施例1中所描述的,使用胃内装置99的第一实施例成功地进行了实时实验。装置99被放置在美国管家组的虚拟胃系统EMS培训师2068内。
对于充气阶段,外部磁体100由使用者保持。在该实验中,外部磁体100的南极被用于充气,其北极被用于放气。当外部磁体100的南极靠近胃时,胶囊10沿外部磁体100的轴向自动对齐。为了打开充气阀或通孔83,外部磁体100移动靠近胶囊10,并且然后打开充气阀或通孔83,以将分开存储在第一腔室81和第二腔室82中的两种化学品混合在一起。乙酸和碳酸氢钠分别用作酸和碱。经过一段时间(约1分钟)之后,由于CO2气体的增加,气囊90被完全充气。
为了给气囊放气,外部磁体100的北极朝向磁性胶囊或装置99放置。一旦外部磁体100被移动靠近装置99,放气阀的贯通开口73被打开,并且几秒钟之后,气囊90被完全放气到其初始形状。
示例性实施例3
在该实施例中,如图9所示,隔板80包括胶囊10的第二端12,使得通孔83位于胶囊10的第二端12中。第一腔室81因此由胶囊10的侧壁15和胶囊的第二端12限定。第二腔室82由气囊90限定,并且与气囊90的可膨胀体积98为同一个。
柔性膜40被设置在充气磁体20和第一腔室81之间的胶囊10中。柔性膜40的周边边缘由胶囊10密封。柔性膜40经由可生物降解的连接器50连接到充气磁体20。当充气磁体20现在经由可生物降解的连接器50连接到该柔性膜时,分离器84经由连接到柔性膜40的粘合剂连接70连接到充气磁体20。容纳充气磁体20的胶囊10的部分60经由可生物降解的环61连接到胶囊10的其余部分。
用于胶囊10、柔性膜40、分离器84以及在分离器84与柔性膜40之间的连接器22的表面材料应该是耐酸塑料或橡胶材料,如聚二甲基硅氧烷(PDMS)。可生物降解的连接器10和可生物降解的环61可以由可吸收材料(例如壳聚糖,明胶,聚乙醇酸,聚乳酸,可吸收缝合线(Monocryl)和聚二恶烷酮,或PDMS和壳聚糖之间的混合材料)制成,而粘合剂连接70可以是塑料或硅橡胶材料,如或PDMS。
充气磁体20和容纳充气磁体20的胶囊10的部分60被配置成,在可生物降解的连接器50和可生物降解的环61生物降解时与胶囊10的其余部分分离。这被设计成在已经对气囊90充气之后发生,如图10所示。
整个气囊90可以被设计成,在预定处理时间之后自动放气,其中气体反应产物穿过气囊90的材料扩散,如图11所示。这可以发生在整个气囊90上,或者部分地穿过设置在气囊90中的一个或多个半渗透膜,在一段时间内气体穿过半渗透膜从气囊90泄漏。在这种情况下,气囊90可以由防止气体从气囊90泄漏的生物相容的和耐酸性材料制成。这种气囊90的一般材料可以是一般的材料,可以是PDMS或涂覆PDMS的高度可拉伸的硅橡胶,如Ecoflex或龙鳞甲(Dragon skin)。
可替代的,整个气囊90可以由耐气体的柔性材料制成,并且气体可以通过设置在气囊90的材料中的放气阀96扩散,如图12所示。这样的耐气气囊90优选地由弹性生物相容材料制成,诸如硅树脂弹性体或诸如PDMS或医用尼龙的弹性材料或由日本的Kuraray提供的薄层非弹性降低渗透性包装膜EVAL。
柔性膜40也可以被配置成允许气体产物随时间从装置99中流出。用于该柔性膜40的一般材料可以是PDMS或PDMS涂覆的高度可拉伸的硅橡胶,如Ecoflex或龙鳞甲。
图13示出在外部磁体100的磁场下在胃200中的装置99的剖面示意图中充气之前和之后的胃内装置99。可以看出,在充气之后,气囊90在胃200中占据一定的空间,并且因此引起饱腹感,使得人们消耗更少的食物。
其它实施例
应该理解,可以制造上述不同示例性实施例中的特征的各种组合,以便提供胃内装置99的其它不同实施例。
例如,图14和15示出的实施例,其中如上所述的示例性实施例1和示例性实施例2的胃内装置99设置有示例性实施例3中所述的柔性膜40和可拆卸的充气磁体20以及包含充气磁体20的胶囊10的部分60。
图16示出了示例性实施例3,其被修改为使得隔板80包括胶囊10的侧壁15,使得在胶囊的侧壁15中提供多个通孔83。该多个通孔83通过相应数量的分离器84密封,分离器84通过相应数量的与柔性膜40粘合连接的连接器22类似地连接到充气磁体20。
在使用的实施例中,多个装置99可以被吞服以进行治疗。例如,后续的装置99可以距离第一装置99每2-3小时进行一次给药。在胃滞留期间,充气的气囊90中的气体将完全穿过气囊90的壁或者部分地从柔性膜40扩散(如果被这样设置),并且因此气囊90将自动放气。放气的气囊90和胶囊10足够小以便穿过胃肠道以使整个胃内装置99在使用后自然排泄。
尽管在前面的描述中已经描述了本发明的示例性实施例,但是本领域技术人员将会理解的是,可以在不背离本发明的情况下对设计、构造和/或操作的细节进行许多变化和组合。例如,隔膜或隔板可以通过充气磁性/充气亲磁性成分与外部充气磁场相互作用所提供的动力和来自胃肠壁的反作用力按需破裂。动力的各种应用可包括部分的移位或分离,穿孔,破坏,粉碎等,从而允许反应物在第一和第二腔室中混合。化学品的移动可以通过隔膜或隔板上的狭窄开口或使用芯吸材料被节流,从而实现受控反应。根据第一和第二化学品之间的化学反应的性质,该反应可以被限制在第一腔室或第二腔室内,或者允许在膜或气囊的整个膨胀体积内进行。该反应物可以分散在该装置的不同腔室中,以达到最佳反应速率或完成反应。在某些实施例中,该装置可以被制成将药物运送到目标位置。一旦其位置已经被位置感测子部件确认,来自重构的充气机构的动力就被用于分散药物或将其注入胃肠内层。在某些实施例中,该装置可以用于组织活检。由于充气过程将导致该装置被支撑在胃肠壁上,这提供了可以进行组织取样的界面。该充气机构的动力可以被重构用于切除小块的组织,然后将其存储在自密封腔室内。
参考文献
[1]O.G.聂奔,H.哈博,“胃内球囊作为人工牛黄用于治疗肥胖症”,《柳叶刀》,1(1982)198-199。
[2]J.B.韦德,R.P.哈特,D.F.柯比,P.R.米尔斯,“盖伦-爱德华兹饮食和行为改变计划的评估”,《Group》,12(1988)172-178。
[3]C.H.瓦伦,B.巴斯滕,J.赫维,C.马尔门迪尔,B.达勒马涅,C.杰哈斯,S.曼凯维奇,B.慕那美,J.韦尔茨,“胃内水球(BIB):如何使用它”,《肥胖外科学》,11(2001)524-527。
[4]P.弗雷斯蒂耶里,G.D.De帕尔马,A.福尔马托,M.E.朱利亚诺,A.蒙达,V.皮隆尼,A.罗马诺,S.特拉蒙塔诺,“袋在治疗严重肥胖症中的应用:初步经验”,《肥胖外科学》,16(2006)635-637。
[5]J.-M.杜蒙库,“生物医学胃肠气囊减肥的循证评论”,《肥胖外科学》,18(2008)1611-1617。
- 还没有人留言评论。精彩留言会获得点赞!