用于治疗AML的药物组合物和治疗有此需要的对象中的AML的方法与流程
本发明涉及用于治疗急性髓细胞性白血病(AML)的药物组合物和治疗有此需要的患者中的AML的方法。本发明还涉及使用基因表达签名预测患者对治疗的敏感性的方法。
背景技术:
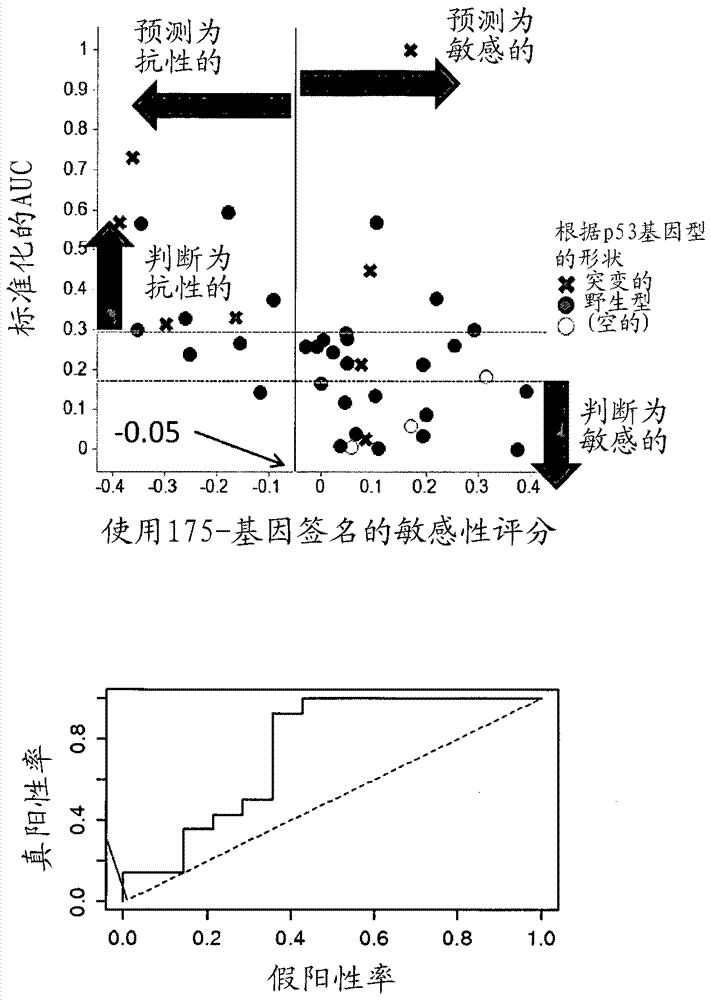
:位于染色体12q13-15上的MDM2是p53肿瘤抑制蛋白的负调控因子。90kDaMDM2蛋白包含在其N-末端的p53结合结构域和在其C-末端的RING(真正有趣基因,reallyinterestinggene)结构域,其作为泛素化p53的E3连接酶起作用。通过细胞刺激和胁迫活化野生型p53,导致MDM2与p53在N-末端结合,从而抑制p53的转录活化并通过泛素-蛋白酶体途径促进p53的降解。因此,MDM2可以干扰p53介导的凋亡和癌细胞增殖的停滞,促成MDM2在癌细胞中的显著致癌活性。在一些情况下,MDM2可引起独立于p53途径的致癌作用,例如在具有可变剪接形式的MDM2的细胞中(H.A.Steinmanetal.,2004,J.Biol.Chem.,279(6):4877-4886)。因此,已经开发出多种MDM2抑制剂以治疗癌症,包括(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺(WO2012/121361,US专利申请公开No.2012/0264738A和WO2015/108175)。已经报道,MDM2的过表达与具有肉瘤、神经胶质瘤和急性淋巴细胞白血病(ALL)的个体中的不良预后正相关。急性髓细胞性白血病(AML)是源自骨髓中的干细胞或骨髓祖细胞的恶性血液病,其也被称急性髓细胞性白血病或急性非淋巴细胞白血病(ANLL)。AML的症状包括疲劳、出血性病症和提高的感染风险。在患有AML的患者中,正常骨髓被白血病母细胞(leukemicblasts)代替。已经开发出很多药物,其中一些是MDM2抑制剂,例如Nutlin-3(Kojima等人,2005;Blood106(9):3150-3159;Secchiero等人,2007,Neoplasia,9(10):853-861),和MI219(Long等人,2010,Blood,116:71-80)。据报道,使用MDM2抑制剂RG7112在AML中的首个临床试验诱导了临床应答,包括完全缓解(Andreeff,M等人,Clin.CancerRes.2015,epubl.)。技术实现要素:本发明提供用于治疗急性髓细胞性白血病(AML)的药物组合物和治疗有此需要的患者中的AML的方法。本发明还提供了使用基因表达签名预测患者对治疗的敏感性的方法。本发明人已经发现了可以使用(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺或其盐有疗效地治疗AML,其为由下式(I)表示的高度有效的基于二螺吡咯烷的MDM2抑制剂。本发明人还已经发现AML对象中对上述化合物的敏感性是可预测的。[化学式1]本发明提供了:(1)用于治疗有此需要的患者中的急性髓细胞性白血病(AML)的药物组合物,其包含治疗有效量的(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺或其盐,和药学上可接受的载体。(2)根据上述(1)的药物组合物,其中所述盐是对甲苯磺酸盐单水合物。(3)根据上述(1)或(2)的药物组合物,其中已经通过在从所述患者获得的样品中测量选自图1中列出的177个基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的。(4)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量图1中列出的177个基因的表达水平,预测所述患者对所述治疗是敏感的。(5)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量图1中列出的除EDA2R和SPATA18之外的175个基因的表达水平,预测所述患者对所述治疗是敏感的。(6)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC。(7)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:RPS27L、FDXR、CDKN1A和AEN。(8)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和/或CDKN2A。(9)根据上述(3)的药物组合物,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、RPS27L、XPC、DDB2、FDXR、MDM2、CDKN1A、AEN、RRM2B、SESN1、CCNG1、ZMAT3和/或TNFRSF10B。(10)根据上述(3)、(4)、(5)、(6)、(7)、(8)或(9)的药物组合物,其中所述患者在待治疗的AML细胞的基因组中具有野生型TP53基因。(11)治疗有此需要的患者中的急性髓细胞性白血病(AML)的方法,其包括向所述患者施用治疗有效量的(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺或其盐。(12)根据上述(11)的方法,其中所述盐是对甲苯磺酸盐单水合物。(13)根据上述(11)或(12)的方法,其中已经通过在从所述患者获得的样品中测量选自图1中列出的177个基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的。(14)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量图1中列出的177个基因的表达水平,预测所述患者对所述治疗是敏感的。(15)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量图1中列出的除EDA2R和SPATA18之外的175个基因的表达水平,预测所述患者对所述治疗是敏感的。(16)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC。(17)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:RPS27L、FDXR、CDKN1A和AEN。(18)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和/或CDKN2A。(19)根据上述(13)的方法,其中已经通过在从所述患者获得的样品中测量选自以下基因的组中的至少一个基因或所有基因的表达水平,预测所述患者对所述治疗是敏感的:BAX、RPS27L、XPC、DDB2、FDXR、MDM2、CDKN1A、AEN、RRM2B、SESN1、CCNG1、ZMAT3和/或TNFRSF10B。(20)根据上述(13)、(14)、(15)、(16)、(17)、(18)或(19)的方法,其中所述患者在待治疗的AML细胞的基因组中具有野生型TP53基因。(21)预测患有AML的患者对MDM2i治疗的敏感性的方法,其包括测量图1中所示的177个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平。(22)根据上述(21)的方法,其包括测量图1中所示基因的除EDA2R和SPATA18之外的175个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平。(23)根据上述(21)的方法,其包括测量以下四十个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平:BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC。(24)根据上述(21)的方法,其包括测量RPS27L、FDXR、CDKN1A和AEN的表达水平。(25)根据上述(21)至(24)中任一项的方法,其进一步包括测定所述AML在其基因组中是否具有野生型TP53基因。(26)预测患有AML的患者对MDM2i治疗的敏感性的方法,其包括:测定所述AML在其基因组中是否具有突变的TP53基因,当所述AML具有突变的TP53基因时,则预测所述患者具有抗性,并且当所述AML具有野生型TP53基因时,随后在所述AML中测量图1中所示的177个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平,当所述AML具有与预定截断值相比的低签名评分时,则预测所述患者具有抗性,并且当所述AML具有与预定截断值相比的高签名评分时,则预测所述患者是敏感的。(27)根据上述(26)的方法,其中所述测量步骤是测量所述AML中选自以下基因组中的至少一个基因或所有基因的表达水平:BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC。(28)根据上述(26)或(27)的方法,其中所述测量步骤是测量所述AML中选自以下基因组中的至少一个基因或所有基因的表达水平:RPS27L、FDXR、CDKN1A和AEN。(29)根据上述(26)至(28)任一项的方法,其中所述测量步骤是测量所述AML中选自以下基因组中的至少一个基因或所有基因的表达水平:BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和/或CDKN2A。(30)根据上述(26)至(29)任一项的方法,其中所述测量步骤是测量所述AML中选自以下基因组中的至少一个基因或所有基因的表达水平:BAX、RPS27L、XPC、DDB2、FDXR、MDM2、CDKN1A、AEN、RRM2B、SESN1、CCNG1、ZMAT3和/或TNFRSF10B。附图说明图1以表格形式呈现了如本文所述,在对MDM2i敏感的癌症或肿瘤样品或细胞中差异表达的177个基因签名生物标志物。图2A和2B呈现了在暴露于化合物248小时后,敏感样品中活细胞%的代表性检测结果。图2A和2B分别显示了编号2和15的样品的结果。图3呈现了在使用175-基因签名的预测中,每个TP53野生型样品对式(I)的化合物的测量敏感性和预测敏感性(敏感性评分)之间的关系(上部小图),和预测中的接受者操作特征(ROC)曲线(下部小图)。上部小图中的垂直线表示预测中的截断值。图4呈现了在使用40-基因签名的预测中,每个TP53野生型样品对式(I)的化合物的测量敏感性和预测敏感性(敏感性评分)之间的关系(上部小图),和预测中的接受者操作特征(ROC)曲线(下部小图)。上部小图中的垂直线表示预测中的截断值。图5呈现了在使用175-基因签名的预测中,所有样品中的每一个对式(I)的化合物的测量敏感性和预测敏感性(敏感性评分)之间的关系(上部小图),和预测中的接受者操作特征(ROC)曲线(下部小图)。上部小图中的垂直线表示预测中的截断值。图6呈现了在使用40-基因签名的预测中,所有样品中的每一个对式(I)的化合物的测量敏感性和预测敏感性(敏感性评分)之间的关系(上部小图),和预测中的接受者操作特征(ROC)曲线(下部小图)。上部小图中的垂直线表示预测中的截断值。图7呈现了在本发明的优选实施方式中,对MDM2i敏感性的预测方案。发明详述如本文使用的术语“包含”意指开放式、包括并且不排除额外的未列举的特征,并且因此涵盖封闭式术语“由……组成”或“基本由……组成”。术语“患者”是指患有AML的哺乳动物,特别是人。所述患者可以是已经或此前通过其他疗法治疗的患者。所述患者也可以是具有新诊断的、复发的或难治的AML的患者。所述患者也可以是患有骨髓增生异常综合征的患者,或者具有新诊断的或复发的骨髓增生异常综合征的患者。术语“治疗”在广义上是指实现或获得期望的生理和/或药理学作用,无论是预防性、治疗性的,还是二者。有此需要的患者的治疗通常涉及使用或施用有效量或治疗有效量的化合物。有效量是指在施用或递送至患者后,在患者中诱导期望应答的化合物的数量(量)。术语“MDM2”是指可以与p53相互作用并导致p53降解的E3泛素连接酶。MDM2包括但不限于小鼠MDM2和MDM2的人直系同源物(也称作“人双微体2”或“HDM2”)。术语“MDM2抑制剂”是指抑制MDM2对p53降解的功能或活性的抑制剂。术语“MDM2i”涵盖多种低分子量MDM2抑制剂。如本文使用的术语“化合物1”是指如式(1)所示的(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺,或其药学上可接受的盐。如本文使用的术语“化合物2”是指化合物1的对甲苯磺酸盐单水合物。本领域技术人员可以根据通过引用以其全文并入本文的WO2012/121361制备这些化合物。如本文使用的术语“化合物1治疗”是指使用化合物1,优选使用化合物2治疗AML对象。[化学式1]。如本文使用的术语“阵列”是指放置在表面、基质或基板之上或之中的离散的、分配的和可寻址的位置的生物分子(例如,核酸、多肽、肽、生物样品)的布置,通常为有序的布置。微阵列是阵列的微型化版本,其通常通过显微镜评价或分析。核酸(例如RNA或DNA)阵列是在固体表面或基质上的分配的和可寻址的位置的核酸(例如探针)的布置。核酸阵列涵盖cDNA阵列和寡核苷酸阵列和微阵列;它们可以被称作生物芯片,或DNA/cDNA芯片。微阵列,及其构建、试剂组分和用途是所属领域中的技术人员已知的。例如,US2011/0015869中提供了可用于测定和测量基因表达状态的微阵列技术。术语“生物标志物”通常是指基因、源自所述基因的表达序列标签(EST)、基因的组、或蛋白或肽的组,其表达水平在特定条件下变化,或在特定细胞背景中不同,例如在对特定治疗敏感的细胞中的表达水平与在对治疗不敏感的那些细胞中的表达水平相对。通常,当基因或基因的组的表达水平对应于特定条件时,所述基因充当该条件的一个或多个生物标志物。根据预后和疾病状态,生物标志物可以在个体(例如,具有癌症或肿瘤类型的那些)之间差异表达;因此,生物标志物可以预测不同的存活结果,以及有益的药物易感性和敏感性。如本文使用的术语“基因”是指在对象中作为RNA转录本表达的DNA序列;基因可以是全长基因(编码或不编码蛋白)。术语“基因签名”、“基因表达签名”和“基因敏感性签名”在本文中可互换地使用,因为它们是指预测对使用根据本发明的化合物1的治疗敏感的AML中的细胞应答的基因的表达,例如差异表达或表达模式。例如,在一个实施方式中,显示对使用化合物1的治疗的敏感性的AML样品具有与对照相比,包含在本发明的基因签名中的基因的提高或升高的表达水平。如根据本发明使用的,“基因表达”是指通过基因的转录(例如,如通过RNA聚合酶的酶促作用介导的),将基因中编码的遗传信息转化成RNA(例如mRNA、rRNA、tRNA或snRNA)的过程,并且对于编码蛋白的基因,是指通过mRNA的“翻译”将基因中编码的遗传信息转化成蛋白的过程。基因表达中的变化,例如差异表达,可以包括但不限于,与对照(例如非癌细胞)相比,或相对于标准化的表达水平的过表达、增加的表达、低表达,或受抑制的表达。核酸分子表达的变化可以与对应蛋白表达的变化相关,并且在一些情况下,导致对应蛋白表达的变化。例如,可以测量基因表达,以测定表明患者的AML样品对使用化合物1的治疗的敏感性的基因签名中的基因的差异表达,从而预测所述患者响应所述治疗的可能性,以用于以下的目的:向所述患者施用化合物1,和/或将使用化合物1的有效治疗个性化,和/或预测所述患者的存活时间。关于基因或核酸分子使用的表达提高(也可以称作上调或活化的表达)是指导致或造成基因产物(例如所有类型的RNA或蛋白)的生产提高或升高的任何过程。提高或升高的基因表达包括提高基因的转录或mRNA至蛋白的翻译的任何过程。提高(或上调)的基因表达可包括基因产物的生产中的任何可检测或可测量的提高。例如,基因产物(例如图1的至少三个、至少四个或所有基因;或BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC的基因中的至少一个、至少两个、至少三个、至少四个或所有的基因;MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少一个、至少两个、至少三个、至少四个或所有的基因;BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少一个、至少两个、至少三个、至少四个或所有的基因;或RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有的基因),相对于对照以可测量的相对量提高,例如且不限于,至少1.5倍,至少2倍,至少3倍,至少4倍,至少5倍或至少6-10倍的提高。所述对照可以是在生物样品(例如正常细胞)中的基因表达量,或细胞基因表达的参考值或标准化值。在一个实例中,对照是来自不具有AML的对象的,与所讨论的对象(正接受测试的对象)相同的组织类型的活检样品中的基因表达的相对量。在另一个实例中,对照是取自具有肿瘤并且正接受测试的对象的,与所述肿瘤相同的组织类型(例如外周血和骨髓)的非肿瘤组织的组织活检样品中的基因表达的相对量。在一些情况下,公开的基因(例如图1的基因签名中列出的至少一个、至少两个、至少三个、至少四个、至少五个、至少六个、至少十个或所有基因;BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC的基因中的至少一个、至少两个、至少三个、至少四个或所有的基因;MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少一个、至少两个、至少三个、至少四个或所有的基因;BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少一个、至少两个、至少三个、至少四个或所有的基因;或RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有的基因)的表达水平相对于一个或多个管家基因(例如在相同或不同的癌症或赘生物样品中)的表达水平标准化。在一些情况下,通过计算所述基因中每一个(例如,基因签名中的每个基因)的表达水平,并且依赖于所述基因受到条件的正或负调控(例如,对化合物1治疗的敏感性或存活风险评分),对每个基因使用正或负的加权值,从而获得总值。在一些情况下,测定对于癌症或癌症类型的组,基因或基因签名的标准化表达或总值相对于所述基因或基因签名的中值标准化表达或相对于总值提高或降低。在一些情况下,中值标准化表达或总值从公众可得的微阵列数据库获得,例如白血病、淋巴瘤、黑素瘤或骨髓瘤癌症微阵列数据库。在一个实例中,使用微阵列数据库测定对于基因签名的表达基因的中值标准化表达或总值。在一些情况下,从标准化的表达水平测量值计算评分(敏感性评分)。可以利用所述评分提供截断点或截断值,以鉴定各种参数,例如AML对化合物1敏感或不太可能敏感,和/或具有AML的患者对化合物1治疗或疗法的低、中或高敏感性。在一些情况下,常使用训练和有效数据库测定截断点。例如,可以利用监督式方法,以确立将对化合物1治疗敏感者(应答者)与无应答者区分的截断,例如通过比较应答者与无应答者中的基因签名表达。在另一实例中,可以利用无监督的方法,以通过经验测定截断水平(例如,顶部50%对比底部50%,顶部四分位值对比底部四分位值,或者顶部百分位值对比底部百分位值),其预测结果,即对化合物1治疗的敏感性。可以在一个或更多个独立的有效数据库中测试在训练库中测定的截断。术语“诊断”是指通过体征或症状识别或确定疾病或病症,常常涉及外部测试、评估和分析的使用。疾病或病症的诊断来自于参与作出和得到结论的程序的整体,以确定疾病或病症。根据本发明,可以通过其中测量基因签名中的基因的表达水平的上述方法的实施诊断患者对化合物1的敏感性,以及患者将对化合物1治疗做出应答的可能性。在各种实施方式中,测量图1的至少三个、至少四个或所有的基因的表达水平;或测量BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC中的至少一个、至少两个、至少三个、至少四个或所有的基因签名基因的表达;测量MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少一个、至少两个、至少三个、至少四个或所有的基因;测量BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少一个、至少两个、至少三个、至少四个或所有的基因;或测量RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有的基因签名基因的表达。例如,在接受测试患者癌症或肿瘤样品中并且表明化合物1敏感性的的基因签名基因的表达,用于诊断所述患者将对化合物1治疗敏感。如本文使用的,“差异表达”是指在基因编码信息(例如,与化合物1敏感性相关的基因)向RNA(例如mRNA)的转化,和/或在mRNA向蛋白的转化中的表达的差异或变化,例如提高或降低。在一些情况下,所述差异或变化是相对于对照或参考值,或相对于对照或参考值的范围,例如对象组或群体的平均表达,例如对化合物1治疗具有良好应答或不良应答(例如,化合物1敏感对比化合物1不敏感群体)的对象组。在一些情况下,所述差异或变化可以是相对于来自相同对象或健康对象的非肿瘤组织。差异表达的检测可以涉及测量基因或蛋白表达中的变化,例如与化合物1敏感性相关的图1的至少三个或至少四个基因签名基因的表达中的变化。检测基因产物的表达,以及检测基因产物的差异表达是指,通过本领域中已知的一种或更多种适合的方式,定性或定量地测量或测定样品中核酸或蛋白的表达水平,例如通过微阵列分析、PCR(RT-PCR)、免疫组织化学、免疫荧光、质谱、Northern杂交、Western杂交等。术语“预后”是指如从疾病或病症的正常过程预期的,或通过对象呈现的特别特征所指示的,有望从该疾病或病症存活或康复的预测。预后还可以预测与具体治疗相关的病程,例如通过测定患者将或很可能将存活给定的时间段,其依赖于例如患者对涉及一种或多种药物或化合物的给定疗法或治疗方案的应答或敏感性。因此,通过测量所述化合物1敏感基因签名的基因的表达水平测定患者AML对化合物1的敏感性的本发明方法的实施,与患者将对化合物1治疗做出应答或很可能做出应答的预后相关。在各种实施方式中,测量图1的至少一个、至少两个、至少三个、至少四个或所有的基因的表达水平;或测量BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC中的至少一个、至少两个、至少三个、至少四个或所有的基因签名基因的表达;测量MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少一个、至少两个、至少三个、至少四个或所有的基因;测量BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少一个、至少两个、至少三个、至少四个或所有的基因;或测量RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有的基因签名基因的表达。如本文所述,“对治疗的敏感性”是指对初始疗法或治疗做出应答,并且在一些情况下,对后续或进行中的疗法或治疗做出应答的AML。敏感性可以是指AML的疾病、症状或进展,例如AML或AML细胞的生长,对化合物1的应答性。例如,提高的(相对)敏感性是指与对治疗不敏感的AML相比,AML对给定疗法或治疗剂或治疗的应答更多的状态。术语“药学上可接受的盐”是指活性化合物的盐,其为相对无毒的酸或碱加成盐。酸加成盐的非限定性实例包括盐酸、氢溴酸、硝酸、碳酸、磷酸、乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、富马酸、乳酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、草酸和甲磺酸的盐。术语“药学上可接受的盐”包括药学上可接受的溶剂化物或其盐。溶剂化物是一个分子和一个或多个溶剂分子的化学计量复合物。药学上可接受的溶剂化物的非限定性实例包括水、甲醇、乙醇、二甲基亚砜和乙酸作为溶剂。包含作为溶剂的水的溶剂化物是水合物。在本发明的优选实施方式中,化合物的药学上可接受的盐可以是水合物,且更优选单水合物。本文使用的术语“约”是指在该术语之后的具体值和所述具体值的±10%的数值范围。例如,短语“约100”是指100(在这种情况下,100是具体值),和90至110的范围。式(I)的化合物及其药学上可接受的盐,包括对甲苯磺酸盐,作为MDM2抑制剂之一公开(参见WO2012/121361的实施例70,和US专利申请公开No.2012/0264738A的实施例70)。在本发明的优选实施方式中,式(I)的化合物的盐可以是式(II)的化合物:(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺单(4-甲基苯磺酸盐)单水合物(也称作“式(I)的化合物的单对甲苯磺酸盐单水合物”或称作“化合物2”)。[化学式2]化合物1或2可以向患有AML,例如新诊断的、复发的或难治的AML的患者每天施用一次,以治疗所述患者中的AML。化合物1或2可以充当MDM2抑制剂。MDM2是p53肿瘤抑制蛋白的负调控因子。90kDaMDM2蛋白包含在其N-末端的p53结合结构域和在其C-末端的RING(真正有趣基因)结构域,其作为泛素化p53的E3连接酶起作用。通过细胞刺激和胁迫活化野生型p53,导致MDM2与p53在N-末端结合,从而抑制p53的转录活化并通过泛素-蛋白酶体途径促进p53的降解。因此,MDM2可以干扰p53介导的凋亡和癌细胞增殖的停滞,促成MDM2在癌细胞中的显著致癌活性。在一些情况下,MDM2可导致独立于p53途径的致癌作用,例如在具有可变剪接形式的MDM2的细胞中(H.A.Steinmanetal.,2004,J.Biol.Chem.,279(6):4877-4886)。此外,观察到约50%的人类癌症具有TP53基因的突变或缺失。MDM2在多种人类癌症中过表达,包括例如黑色素瘤、非小细胞肺癌(NSCLC)、乳腺癌,食道癌、白血病、非霍奇金淋巴瘤和肉瘤。因此,优选在本发明中待治疗的AML在患有AML的患者的基因组上具有扩增的MDM2基因,或在AML中具有活化的MDM2。在本发明的具体实施方式中,在本发明中待治疗的AML可以是在AML的基因组上具有扩增的MDM2基因的AML。还优选在本发明中待治疗的AML在AML的基因组上具有野生型TP53基因。在本发明的具体实施方式中,在本发明中待治疗的AML可以是在AML的基因组上具有一个或多个野生型TP53基因的AML。在本发明的更具体的实施方式中,在本发明中待治疗的AML可以是在AML的基因组上具有野生型TP53基因和扩增的MDM2基因的AML。在这些具体实施方式中,在AML的基因组上具有野生型TP53基因和/或扩增的MDM2基因的AML可以通过施用化合物1或2有效地治疗。本发明人已经发现如在WO2015/108175中公开的预测MDM2i敏感性的基因签名,也可用于预测AML对化合物1或2的敏感性。从得自于WO2015/108175中的多癌细胞系组的数据,确定图1中显示的177个基因。所述177个基因的每一个的表达都与癌症对MDM2i治疗的敏感性正相关。WO2015/108175证实了所述177个基因的基因签名预测癌症或肿瘤样品对MDM2i的敏感性。此外,WO2015/108175中,包括在所述177个基因中,由BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC组成的40个基因也显示为预测MDM2i敏感性的签名基因。WO2015/108175中,即使所述177个基因之中的4个基因:RPS27L、FDXR、CDKN1A和AEN被确定为可用于预测癌症的MDM2i敏感性的基因签名,并且可用作本发明的基因签名。MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少四个或所有的基因,优选包括上述四个签名基因,也可以用作本发明中的基因签名。在本发明的另一个实施方式中,BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少四个或所有的基因,优选包括上述四个签名基因,也可以用作本发明中的基因签名。本发明人已经发现,也可以使用所述签名基因预测AML对MDM2i(例如化合物1或2)的敏感性。本发明人还已经发现,也可以通过使用所述签名基因和TP53基因型二者,预测AML对MDM2i(例如化合物1或2)的敏感性。因此,本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括:测量RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有四个基因的表达水平。本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测量以下的至少一个、至少两个、至少三个、至少四个或所有基因的表达水平:MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测量以下的至少一个、两个、三个、四个或所有基因的表达水平:BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测量BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC的四十个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测量所述175个签名基因(即,图1中呈现的基因,除EDA2R和SPATA18之外)中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测量图1中所示177个签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在优选的实施方式中,本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测定TP53基因的基因型和测量上述签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平。在具体实施方式中,本发明提供了预测患有AML的患者对化合物1或2治疗的敏感性的方法,其包括测定TP53基因的基因型和测量上述签名基因中的至少一个、至少两个、至少三个、至少四个或所有签名基因的表达水平,当所述患者具有突变的TP53基因或所述患者具有野生型TP53基因并且具有与预定截断值相比的低签名评分时,则预测AML是抗性的,并且当所述患者具有野生型TP53基因并且具有与预定截断值相比的高签名评分时,则预测AML是敏感的。在一些情况下,签名基因的表达水平(例如图1的基因签名中列出的至少三个、至少四个、至少五个、至少六个、至少十个或所有基因的表达;BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC的基因的组中的至少三个或所有的基因;MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN的基因的组中的至少一个、至少两个、至少三个或所有的基因;BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A的基因的组中的至少一个、至少两个、至少三个或所有的基因;或RPS27L、FDXR、CDKN1A和AEN的基因的组中的至少一个、至少两个、至少三个或所有的基因)相对于一个或多个管家基因(例如在相同或不同的癌症或赘生物样品中)的表达水平标准化。在一些情况下,通过计算所述基因中每一个(例如,基因签名中的每个基因)的表达水平,并且依赖于所述基因受到条件的正或负调控(例如,对化合物1或2治疗的敏感性或存活风险评分),对每个基因使用正或负的加权值,从而获得总和值。在一些情况下,基因或基因签名的标准化表达或总和值被测定为相对于对AML的所述基因或基因签名的中值标准化表达或相对于总和值提高或降低。在一些情况下,中值标准化表达或总和值从公众可得的微阵列数据库获得,例如白血病、淋巴瘤、黑素瘤或骨髓瘤癌症微阵列数据库。在一个实例中,使用微阵列数据库测定对于基因签名的表达基因的中值标准化表达或总和值。在一个实施方式中,敏感性评分的应用会是有利的,因为所述评分能够用作限定AML是否对化合物1或2敏感的基础,并且因此能够预测具有对所述化合物敏感的AML的个体将对使用所述化合物的治疗做出有利的应答。例如,在测定表明AML样品对化合物1或2的敏感性的敏感性评分后,医师可以选择使用化合物1或2治疗具有AML的患者。或者,在测定表明AML样品对化合物1或2的不敏感性的敏感性评分后,医师可以选择不使用化合物1或2治疗具有AML的患者,因为预测所述患者不会从使用化合物1或2的治疗得到临床或药物益处。如果在使用化合物1或2的治疗或疗法过程期间,评价患者的AML样品对化合物1或2的敏感性,则表示对化合物1或2的敏感性的敏感性评分可辅助医师决定继续或者改变患者的AML治疗或疗法和/或使用化合物1或2治疗。在一些情况下,从标准化的表达水平测量值计算敏感性评分。可以利用所述评分提供截断点或截断值,以确定各种参数,例如AML对化合物1或2敏感或不太可能敏感,和/或具有AML的患者对用化合物1或2的治疗或疗法的低、中或高敏感性。在一些情况下,常使用训练和有效数据库测定截断点。例如,可以利用监督式方法,以确立将对化合物1或2治疗敏感者(应答者)与无应答者区分的截断,例如通过比较应答者与无应答者中的基因签名表达。在另一实例中,可以利用无监督的方法,以通过经验测定截断水平(例如,顶部50%对比底部50%,顶部四分位值对比底部四分位值,或者顶部百分位值对比底部百分位值),其预测结果,即对化合物1或2治疗的敏感性。可以在一个或更多个独立的有效数据库中测试在训练库中测定的截断。可以考虑期望的假阳性率和假阴性率,而测定或调整所述截断值。在一个实施方式中,截断值可以等于或大于患有AML的患者组的中值签名评分,优选所述签名评分是上述签名基因的每一个的表达水平的Z-评分的总和。在一个实施方式中,截断值可以等于或大于患有AML的患者组的签名评分第一四分位值(Q1/4),优选所述签名评分是上述签名基因的每一个的表达水平的Z-评分的未加权或加权的平均值。在一个实施方式中,截断值可以等于或大于患有AML的患者组的签名评分第三四分位值(Q3/4),优选所述签名评分是上述签名基因的每一个的表达水平的Z-评分的未加权或加权的平均值。在一个实施方式中,截断值可以在患有AML的患者组的签名评分的四分位间距范围内,优选所述签名评分是上述签名基因的每一个的表达水平的Z-评分的未加权或加权的平均值。在本发明的另一方面,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过如上文所述的预测敏感性的方法,预测所述患者为敏感的。在一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量RPS27L、FDXR、CDKN1A和AEN中的至少一个、至少两个、至少三个或所有四个基因的表达水平。在另一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量以下:MDM2、CDKN1A、ZMAT3、DDB2、FDXR、RPS27L、BAX、RRM2B、SESN1、CCNG1、XPC、TNFRSF10B和AEN中的至少一个、至少两个、至少三个、四个或所有基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在另一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的化合物的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量以下:BAX、RPS27L、EDA2R、XPC、DDB2、FDXR、MDM2、CDKN1A、TRIAP1、BBC3、CCNG1、TNFRSF10B和CDKN2A中的至少一个、至少两个、至少三个、四个或所有基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在另一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC的40个签名基因中的至少一个、至少两个、至少三个、四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在另一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量所述175个签名基因(即,图1中呈现的基因,除EDA2R和SPATA18之外)中的至少一个、至少两个、至少三个、四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在另一个具体实施方式中,本发明提供了用于治疗有此需要的患者中的AML的药物组合物,其包含化合物1或2,其中已经通过预测患者对化合物治疗的敏感性的方法,预测所述患者是敏感的,所述方法包括在从所述患者获得的样品中测量图1中所示177个签名基因中的至少一个、至少两个、至少三个、四个或所有签名基因的表达水平,待测量的基因优选包括基因:RPS27L、FDXR、CDKN1A和AEN。在本发明的另一方面,本发明提供了用于治疗有此需要的患者中的AML的方法,包括向所述患者施用化合物1或2。在本发明的一个实施方式中,本发明提供了用于治疗有此需要的患者中的AML的方法,包括向所述患者施用化合物1或2,其中已经通过如上文所述的预测对象中对化合物1或2的敏感性的方法中的任一种,预测所述患者为敏感的。本发明的药物组合物可以包含化合物1或2和药学上可接受的载体,并且可以作为各种注射剂,诸如静脉内注射剂、肌内注射剂和皮下注射剂,或通过各种方法诸如口服施用或经皮施用来施用。“药学上可接受的载体”是指参与化合物1或2或含有化合物1或2的组合物从给定器官到另一器官的运输的药理学上可接受的材料(例如,赋形剂、稀释剂、添加剂、溶剂等)。可以通过依据施用方法选择合适的制剂形式(例如,口服制剂或注射剂)并使用用于制备制剂的各种常用方法制备制剂。口服制剂的实例包括片剂、粉剂、颗粒剂、胶囊剂、丸剂、锭剂、溶液剂、糖浆剂、酏剂、乳剂和油性或水性混悬剂,等。在口服施用中,可以使用游离化合物或盐形式。可以通过与药理学上可接受的酸形成酸加成物,或通过形成碱金属盐(诸如钠盐)来制备水性制剂。作为注射剂,可以在制剂中使用稳定剂、防腐剂、溶解助剂等。在将可含有这些助剂等的溶液填充在容器中之后,可以通过冻干等将供使用的制剂制备为固体制剂。此外,一个剂量可以填充在一个容器中,或者两个或更多个剂量可以填充在一个容器中。固体制剂的实例包括片剂、粉剂、颗粒剂、胶囊剂、丸剂和锭剂。这些固体制剂可含有药学上可接受的添加剂连同化合物1或2。添加剂的实例包括填充剂、增量剂、粘合剂、崩解剂、溶解促进剂、皮肤润湿剂和润滑剂,并且可根据需要,选择和混合这些添加剂以制备制剂。液体制剂的实例包括溶液剂、糖浆剂、酏剂、乳剂和混悬剂。这些液体制剂可含有药学上可接受的添加剂连同化合物1或2。添加剂的实例包括悬浮剂和乳化剂,并且根据需要,选择和混合这些添加剂以制备制剂。化合物1或2可用于哺乳动物,特别是人类的AML治疗。根据医师的判断,剂量和施用间隔可以依据疾病的位点、患者的身高、体重、性别或病史进行适当选择。当将化合物1或2施用于人时,剂量范围为每天约0.01至500mg/kg体重,优选约0.1至100mg/kg体重。优选地,将化合物1或2每天一次施用于人,或者将剂量分成两至四次,并以适当的间隔重复施用。此外,如果需要,每日剂量可以超过上述剂量,由医师酌情决定。化合物1或2可以与另外的抗肿瘤剂组合使用。其实例包括抗肿瘤抗生素、抗肿瘤植物成分、BRM(生物应答调节剂)、激素、维生素、抗肿瘤抗体、分子靶向药物和其它抗肿瘤剂(例如MDM2i)。更具体而言,烷化剂的实例包括以下:烷化剂诸如氮芥、氮芥N-氧化物、苯达莫司汀和苯丁酸氮芥;脒基烷化剂诸如卡波醌和噻替派;环氧化物烷化剂诸如二溴甘露醇和二溴卫矛醇;亚硝基脲烷化剂诸如卡莫司汀、洛莫司汀、司莫司汀、盐酸尼莫司汀、链脲霉素、氯脲霉素和雷莫司汀;以及白消安、甲苯磺酸英丙舒凡,和达卡巴嗪。各种代谢拮抗剂的实例包括以下:嘌呤代谢拮抗剂诸如6-巯基嘌呤、6-硫鸟嘌呤和硫代肌苷;嘧啶代谢拮抗剂诸如氟尿嘧啶、替加氟、替加氟-尿嘧啶、卡莫氟、去氧氟尿苷、溴尿苷、阿糖胞苷和依诺他滨;和叶酸代谢拮抗剂诸如甲氨蝶呤和三甲曲沙。抗肿瘤抗生素的实例包括:丝裂霉素C、博来霉素、培洛霉素、道诺霉素、阿柔比星、多柔比星、伊达比星、吡柔比星、THP-阿霉素、4'-表阿霉素和表柔比星;和色霉素A3和放线菌素D。抗肿瘤植物成分及其衍生物的实例包括以下:长春花生物碱诸如长春地辛、长春新碱和长春花碱;紫杉烷类诸如紫杉醇、多西他赛和卡巴他赛;和表鬼臼毒素类诸如依托泊苷和替尼泊苷。BRM的实例包括肿瘤坏死因子和吲哚美辛。激素的实例包括氢化可的松、地塞米松、甲泼尼龙、泼尼松龙、普拉睾酮、倍他米松、去炎松、羟甲烯龙、诺龙、美替诺龙、磷雌酚、炔雌醇、氯地孕酮、甲羟孕酮和美雄烷。维生素的实例包括维生素C和维生素A。抗肿瘤抗体和分子靶向药物的实例包括曲妥珠单抗、利妥昔单抗、西妥昔单抗、尼妥珠单抗、地诺单抗、贝伐珠单抗、英夫利昔单抗、伊匹单抗、纳武单抗、派姆单抗、阿维单抗(avelumab)、pidilizumab、阿特朱单抗(atezolizumab)、雷莫芦单抗、甲磺酸伊马替尼、达沙替尼、吉非替尼、厄洛替尼、舒尼替尼、拉帕替尼、威罗菲尼、达拉菲尼、曲美替尼、帕唑帕尼、帕博西尼、帕比司他、索拉非尼、伊布替尼、硼替佐米、卡菲佐米、埃沙佐米和奎扎替尼。其它抗肿瘤剂的实例包括顺铂、卡铂、奥沙利铂、他莫昔芬、来曲唑、阿那曲唑、依西美坦、柠檬酸托瑞米芬、氟维司群、比卡鲁胺、氟他胺、米托坦、亮丙瑞林、醋酸戈舍瑞林、喜树碱、异环磷酰胺、环磷酰胺、美法仑、L-天冬酰胺酶、醋葡醛内酯、西索菲兰、毕西巴尼、丙卡巴肼、哌泊溴烷、新制癌菌素、羟基脲、乌苯美司、氮杂胞苷、地西他滨、沙利度胺、来那度胺、泊马度胺、艾瑞布林、维甲酸和苛丽碱(krestin)。在下文中,仅出于说明的目的提供以下实施例,并且应理解,本发明不限于所述实施例。实施例实施例1使用如下文所述的测试化合物处理从具有新诊断的或复发的/难治的AML的患者的外周血或骨髓分离的白血病样品。测试化合物如WO2014/038606中所述,制备(3'R,4'S,5'R)-N-[(3R,6S)-6-氨甲酰四氢-2H-吡喃-3-基]-6''-氯-4'-(2-氯-3-氟吡啶-4-基)-4,4-二甲基-2''-氧代-1'',2''-二氢二螺[环己烷-1,2'-吡咯烷-3',3''-吲哚]-5'-甲酰胺单(4-甲基苯磺酸盐)单水合物(化合物2)。白血病样品依照赫尔辛基宣言,根据德克萨斯大学MD安德森癌症中心(MDA,Houston,TX,USA)的指南知情同意后,从具有新诊断的或复发的/难治的AML的AML患者获得包含多于1.6×107个单核细胞的肝素化外周血和骨髓样品。在每个样品中,由临床实验室技师从常规形态学差异计数测定母细胞计数(母细胞%),通过MDA的血液病理学家确认(通常计数500个细胞)。选择具有大于50%母细胞的骨髓或外周血细胞,并用作实施例中的AML样品。在四十四个样品中的三个样品中,观察到高百分比(>30%)的自发凋亡,为此目的将其排除。AML样品的特征显示在表1中。[表1]表1:待分析的患者的总结M:男性;F:女性;PB:外周血;BM:骨髓;*1,*2和*3:由相同注记表示的样品来自相同的患者。TP53基因分型使用Autopure提取器(Qiagen,Valencia,CA),从每个病例的骨髓抽吸物或外周血提取基因组DNA(gDNA),并且使用QubitDNABR测定试剂盒(LifeTechnologies,Carlsbad,CA)定量。使用250ng的DNA模板和添加了用于五个基因的客户-设计探针对的商购可得的48-基因TruSeq扩增子癌症组(IlluminaInc.,SanDiego,CA),制备基因组文库。包括TP53的53-基因的组此前已经公开(Oketal,LeukemiaResearch(2015)39,348-354)。使用AMPure磁珠(Agencourt,Brea,CA)纯化产生的文库,并且随后使用MiSeq测序仪(IlluminaInc.,SanDiego,CA)对其进行下一代测序。进行Sanger测序以确认TP53中的突变。凋亡的检测通过密度梯度离心纯化单核细胞。将细胞培养在包含10%胎牛血清的RPMI1640培养基中,并使用测试化合物(0,25,50,100,250,500,或1000nM)离体处理48小时,并通过使用膜联蛋白V和碘化丙锭(PI,购自Sigma-Aldrich)结合测定法,由凋亡分析测定活细胞数目。膜联蛋白V-和PI-阴性细胞计数为活细胞。凋亡量化为膜联蛋白V-阳性细胞的比例,并且通过以下等式计算特异性凋亡:特异性凋亡%=(测试–对照)×100/(100-对照)。AUC%活细胞为了定义药物敏感性/抗性,计算曲线下面积(AUC)值,这样,敏感样品将具有相对低的AUC值且抗性样品将具有相对大的AUC值。具体地,使用RDevelopmentCoreTeam提供的3.2.0版R软件,通过计算拟合至给定x和y(x)值{x:化合物2的浓度;y(x):测量的活细胞%}的平滑样条线下的面积,近似计算函数的积分,从而计算AUC。敏感性的测定在具有野生型TP53的33个病例中,基于AUC值,将11个样品各自测定为对测试化合物敏感(低AUC组)或抗性(高AUC组)的。在混合基因型的样品中,基于AUC值,选择各自为对测试化合物敏感或抗性的14个样品。基因签名测定41个AML样品的基线全基因组RNA表达谱(AffymetrixHumanGenomeU133Plus2.0Array)。使用来自Affymetrix的3’IVTExpress试剂盒扩增RNA。将RNA(100ng)反转录以合成第一链cDNA。随后,将这个cDNA转化成双链DNA模板,用于转录以产生aRNA(cRNA)并引入生物素缀合的核苷酸,片段化以用于在HumanGeneU133_2.0阵列上杂交。使用AffymetrixGeneChip杂交、清洗和染色试剂盒,使用由ffymetrixGeneChipCommandConsole(AGCC)软件控制的AffymetrixFluidics工作站450,处理阵列。使用AGCC软件控制的AffymetrixGeneChip扫描仪3000,7G扫描阵列。使用AffymetrixExpressionConsole默认分析设置,由MAS5算法分析阵列。将如在WO2015/108175中的宽范围的癌细胞中确定的175-基因签名或40-基因签名应用于抗性或敏感的样品。在175-基因签名中,测定了175个基因(即图1中呈现的基因,除EDA2R和SPATA18之外)的mNRA表达谱。在40-基因签名中,测定了40个基因(即,由BAX、C1QBP、FDXR、GAMT、RPS27L、SLC25A11、TP53、TRIAP1、ZMAT3、AEN、C12orf5、GRSF1、EIF2D、MPDU1、STX8、TSFM、DISC1、SPCS1、PRPF8、RCBTB1、SPAG7、TIMM22、TNFRSF10B、ACADSB、DDB2、FAS、GDF15、GREB1、PDE12、POLH、C19orf60、HHAT、ISCU、MDM2、MED31、METRN、PHLDA3、CDKN1A、SESN1和XPC组成的基因)的mNRA表达谱。为了将每个基因在签名中的作用标准化,对签名基因进行Z-评分标准化(从每个样品内的数值减去每个基因的平均表达值,并且将差值除以标准偏差)。通过测定每个签名基因的Z-评分标准化表达值的未加权平均值,产生敏感性评分(签名评分)。结果在样品中,使用测试化合物诱导了AML的凋亡。活细胞数%(与未处理孔相比)的结果显示在表2中。[表2]表2:活细胞数%(与未处理孔相比)ND:无数据。进一步地,在表3中总结了样品的AUC结果、TP53状态以及对测试化合物的敏感性。在表3中,使用为样品中最大AUC的样品编号13的AUC,对每个样品的AUC标准化。[表3]表3:每个样品的AUC、TP53状态和敏感性的总结这些结果表明,测试化合物可用于治疗具有新诊断的或复发的/难治的AML的患者中的AML。进一步地,在一些样品中,通过较高浓度的测试化合物的处理,诱导了多于80%的白血病细胞的凋亡(参见图2和表2),同时在其他样品中,仅诱导了少于20%的白血病细胞的凋亡。为了测定样品对测试化合物的敏感性是否是可以预测的,使用如在WO2015/108175中的广泛范围的癌细胞中公开的175个基因或40个基因,对样品进行基因签名分析。基于活细胞AUC%,选择11个各自作为对测试化合物敏感或抗性的p53野生型样品,并且应用175-基因签名或40-基因签名。当截断值为0.02时,175-基因签名的预测正确率为72%(参见图3和表4)。同样,当截断值为0.05时,40-基因签名的预测正确率为68%(参见图4和表5)。[表4]表4:敏感性的预测性能(仅TP53野生型样品)预测为抗性样品的数量预测为敏感样品的数量抗性样品的数量65敏感样品的数量110预测准确率:(6+10)/22×100%=72%。[表5]表5:敏感性的预测性能(仅TP53野生型样品)预测为抗性样品的数量预测为敏感样品的数量抗性样品的数量65敏感样品的数量29预测准确率:(6+9)/22×100%=68%。在混合基因型的样品中,选择14个各自为敏感或抗性的样品,并且应用175-基因签名或40-基因签名。当截断值为-0.05时,175-基因签名的预测正确率为79%(参见图5和表6)。同样,当截断值为-0.04时,40-基因签名的预测正确率为71%(参见图6和表7)。[表6]表6:敏感性的预测性能(所有样品)预测为抗性样品的数量预测为敏感样品的数量抗性样品的数量95敏感样品的数量113预测准确率:(9+13)/28×100%=79%。[表7]表7:敏感性的预测性能(所有样品)预测为抗性样品的数量预测为敏感样品的数量抗性样品的数量86敏感样品的数量212预测准确率:(8+12)/28×100%=71%。这些结果表明,在TP53野生型AML对象中,以及在没有测定TP53基因型的所有AML对象中,对测试化合物的敏感性是可以预测的。进一步地,注意到在TP53突变样品中,三个敏感样品全被预测为敏感的,且其他三个抗性样品被预测为抗性的。因此,在TP53突变AML对象中,对测试化合物的敏感性也是可以预测的。我们进一步显示了在并入作为对抗性的第一预测因子的TP53突变状态后,应用175-基因签名时的预测性能。具体地,当样品具有TP53突变时,以及使用基因签名预测的具有野生型TP53的其他样品的对MDM2i的敏感性为低时,我们预测为抗性的;并且当具有野生型TP53的其他样品的对MDM2i的预测敏感性为高时,预测为敏感的(参见图7中所示的一般预测方案)。当截断值为-0.5时,175-基因签名的预测正确率为82%(参见表8),显示出与单独的TP53突变状态或单独的基因签名相比,高度准确的性能。[表8]表8:通过图7的方法的敏感性预测性能(所有样品)预测为抗性样品的数量预测为敏感样品的数量抗性样品的数量113敏感样品的数量212预测准确率:(11+12)/28×100%=82%。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1