用于通过抑制外泌体释放来治疗疾病的组合物和方法与流程
本公开内容主要涉及用于医学治疗的组合物和方法,特别是涉及用于通过抑制外泌体释放来治疗癌症和感染性疾病的方法。
背景技术:
膜外泌体(exosome)是球形膜微泡,直径通常小于200nm。外泌体由含有胞质组分的脂质双层组成。特定的膜囊泡更具体地由细胞产生,通过与细胞的细胞质膜融合而从细胞内区室产生,使得它们释放到生物体的细胞外生物流体中或释放到培养物中的细胞的上清液中。这些外泌体可以以多种方式释放。经典分泌途径主要通过内质网(er)膜处理传统膜信号携带受体(lee等,(2004)annu.rev.celldev.biol.20,87-123)。
将分泌蛋白包装到运输囊泡中,递送至高尔基体,并最终释放到细胞外空间中。或者,非经典分泌途径介导细胞质非信号携带分子向细胞外空间的转运(lippincott-schwartz等,(1989)cell56,801-813;和misumi等,(1986)j.biol.chem.261,11398-11403)。其中两个涉及内吞膜系统的细胞内囊泡,例如分泌性溶酶体(muesch等,(1990)trendsbiochem.sci.15,86-88)和外泌体(johnstone等,(1987)j.biol.chem.262,9412-9420),后者是多泡体(mvb)或晚期内体的内囊泡。当特异性内吞结构(例如细胞毒性t淋巴细胞的分泌性溶酶体)与质膜融合时,溶酶体内容物得以到达细胞外部。当mvb与质膜融合时,晚期内吞结构的腔内含物被释放到细胞外空间中,使得内部多囊泡内体与其货物分子(cargomolecule)一起释放到细胞外空间(称为外泌体)。其他非经典途径涉及使用蛋白质传导通道或称为细胞膜起泡的过程将胞质因子直接转运跨过质膜(nickel,w.(2005)traffic.6,607-614)。细胞膜起泡的特征在于将质膜衍生的微泡排出到细胞外空间中。
已经在不同的生理环境中从不同的细胞类型证明了外泌体释放。已经证明肿瘤细胞分泌外泌体,例如以受调控的方式分泌外泌体,其可以携带可以呈递给抗原呈递细胞的肿瘤抗原(专利申请号wo99/03499)。此外,已知含有fasl或tnf的外泌体会引起可以促进肿瘤生长的免疫赦免/免疫抑制状态。类似地,已知病毒感染的细胞,包括感染hiv的细胞,释放含有nef的外泌体(guy等,(1990)virology176,413-425;和campbell等,(2008)ethn.dis.18,s2-s9),其用于抑制免疫系统,从而允许hiv存活。已显示外泌体分泌利用与感染细胞中病毒体释放相关的相同内体运输途径(sanfridson等,(1997)proc.natl.acad.sci.usa94,873-878;和esser等,(2001)jvirol.75,6173-6182)。
已知肿瘤释放大量外泌体,其可通过免疫细胞杀死或失调引起免疫抑制,从而促进允许快速肿瘤生长的免疫抑制状态(lindnerk.等,2015,salido-guadarramai.等,2014)。同样,hiv感染导致大量外泌体,这似乎有助于免疫赦免/抑制状态,最终可能导致获得性免疫缺陷综合症(aids)。
外泌体分泌途径在调节癌症平衡、免疫系统和受感染细胞的病毒体释放中起双重作用。鉴于前述内容,本领域需要用于抑制外泌体释放的组合物和有效的治疗方法。
技术实现要素:
本公开内容的一个方面涉及抑制外泌体从细胞中释放的多部分肽。所述肽含有至少一种来自hiv-1nef的分泌修饰区(smr)肽和至少一种凝聚素(clu)-结合肽(clu-bp)。
在一个实施方式中,所述肽含有至少一种smr肽序列,例如vgfpv(seqidno:1)或vgfpvaavgfpv(seqidno:2),和至少一种选自由hplskhpywsqp(seqidno:3)、ntywsqllhfqt(seqidno:4)和shalpltwstaa(seqidno:5)组成的组的clu-bp肽序列。在一个实施方式中,所述肽在其n-末端具有smr肽基序,并且在其c-末端具有clu-bp肽基序。在另一个实施方式中,所述肽在其n-末端具有clu-bp肽,并且在其c-末端具有smr肽。
在某些实施方式中,所述肽具有由合适的间隔肽分隔的多个smr肽基序、由合适的间隔肽分隔的多个clu-bp肽基序、或两者。
在一个具体实施方式中,所述肽包含选自由vgfpvaavgfpvhplskhpywsqp(seqidno:6)、vgfpvaavgfpvaahplskhpywsqp(seqidno:7)、vgfpvaavgfpvaahplskhpywsqpaahplskhpywsqp(seqidno:8)组成的组的氨基酸序列。
在另一个实施方式中,药学组合物包含根据本公开内容的多部分肽和药学上可接受的载体。
另一方面涉及编码本文所述的多部分肽的多核苷酸和表达载体。
在另一方面,治疗癌症或感染性疾病的方法包括向需要这种治疗的对象施用有效量的根据本公开内容的多部分肽。
另一方面,治疗aids的方法包括给需要这种治疗的对象施用有效量的根据本公开内容的多部分肽。
附图说明
通过结合附图和段落考虑以下详细描述,本申请的上述和其他目的和优点将是显而易见的。以下是本文附图的简要描述,其说明了本申请的某些方面和实施方式,但无论如何不能视为限制。
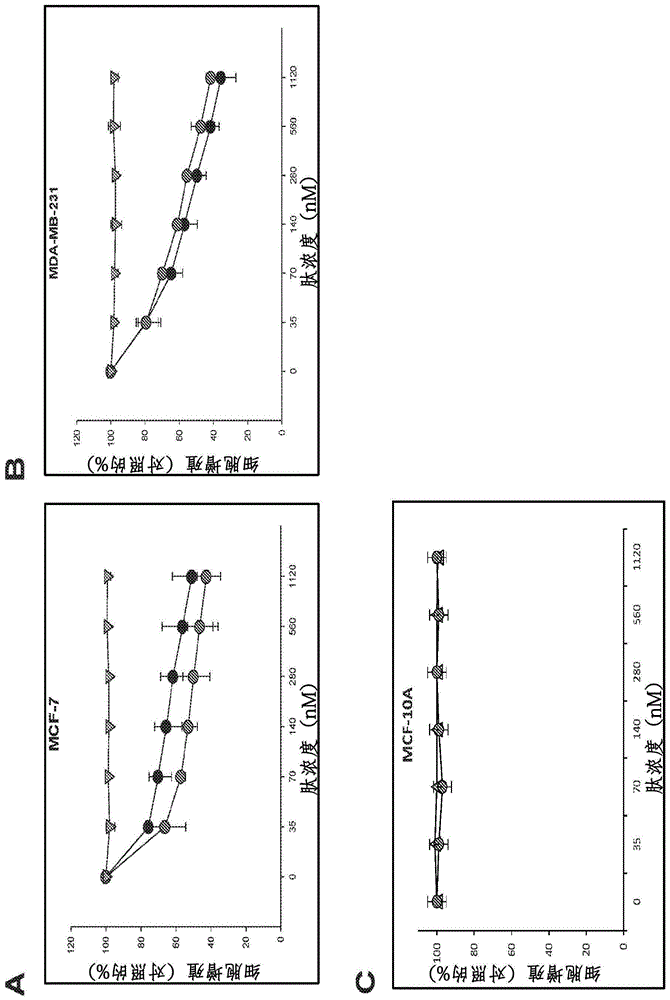
图1显示smrwt肽拮抗剂抑制mcf-7和mda-mb-231乳腺癌细胞的增殖,但不抑制非致瘤性细胞的增殖。将细胞与不同剂量(0-1120nm)的肽一起温育24小时,之后通过mtt测定法测量增殖。显示了三个独立实验的结果。图a:mcf-7乳腺癌细胞的增殖。图b:mda-mb-231乳腺癌细胞的增殖。图c:非致瘤性mcf-10a细胞的增殖。红点表示peg-smrwt肽,黑点表示peg-smrwt-clu肽,并且绿色三角表示peg-smrmut肽。
图2显示peg-smrwt-clu肽拮抗剂和化学治疗剂在mcf-7和mda-mb-231乳腺癌细胞中诱导细胞周期停滞(cellcyclearrest)。用smr肽单独处理或与紫杉醇或顺铂组合处理细胞48小时,并通过cellometer成像细胞计数法测定,表明mcf-7(图a)和mda-mb-231(图b)在各种细胞周期中的百分比。显示了两个独立实验的结果。相对于未处理对照的显著性差异表示如下:对于mcf-7细胞,*p<0.01,**p<0.001,和对于mda-mb-231,*p<0.02,**p<0.01,***p<0.0001。
图3显示peg-smrwt-clu肽拮抗剂增加mcf-7中的细胞毒性,但不增加mda-mb-231乳腺癌细胞中的细胞毒性。凋亡细胞(图a)mcf-7和(图b)mda-mb-231的百分比通过利用单独的肽或肽与紫杉醇或顺铂组合处理48小时的细胞的膜联蛋白v-fitc测定来确定。误差棒代表四次独立实验的平均值±sd。相对于smrwt肽的显著性差异表示如下:*p<0.01,***p<0.0001。
图4显示peg-smrwt-clu肽拮抗剂阻断外泌体从mcf-7和mda-mb-231细胞中释放。细胞利用单独的肽或肽与紫杉醇或顺铂组合处理48小时。图a和b分别显示了通过ache测定法测定的从mcf-7和mda-mb-231细胞释放的外泌体的相对水平。误差棒代表四次独立实验的平均值±sd。相对于smrwt肽的显著差异:对于mcf-7细胞,*p<0.01,**p<0.001,***p<0.0001;对于mda-mb-231细胞,*p<0.01。图c和d分别显示了通过nanosight测量确定的由mcf-7和mda-mb-231细胞释放的外泌体的相对数量。误差棒表示两次独立实验的平均值±sd。相对于smrwt肽的显著性差异:对于mcf-7细胞,*p<0.01,**p<0.001,***p<0.0001,并且对于mda-mb-231细胞,*p<0.03,**p<0.02,***p<0.01和****p<0.001。
图5显示可以在来自mcf-7乳腺癌细胞的外泌体上检测到外泌体特异性蛋白质。细胞利用单独的smrwt肽或其与紫杉醇或顺铂组合处理48小时。图a:通过western印迹分析的外泌体蛋白的表达。图b:通过nanosight测量的外泌体数。图c:显示条带相对强度的光密度测定分析。数据代表三次独立实验的平均值±sd。相对于用肽处理的显著性差异表示如下:*p<0.01,**p<0.001,***p<0.0001。
图6显示可以在来自mda-mb-231乳腺癌细胞的外泌体上检测到外泌体特异性蛋白质。细胞利用单独的smrwt肽或其与紫杉醇或顺铂组合处理48小时。图a显示通过western印迹分析的外泌体蛋白的表达。外泌体数量通过nanosight(图b)测量,并且光密度分析显示条带的相对强度(图c)。数据代表三次独立实验的平均值±sd。相对于用肽处理的显著性差异表示如下:*p<0.01,**p<0.001,****p<0.0001。
图7显示致死蛋白(mortalin)抗体抑制外泌体从mcf-7乳腺癌细胞分泌。mcf-7细胞用抗致死蛋白或α-微管蛋白的抗体转染,或用smrwt或smrmut肽处理。图a:ache测定48小时后的相对外泌体释放水平。图b:通过nanosight分析在48小时后释放的外泌体的相对数量。误差棒代表三次独立实验的平均值±sd。相对于未处理细胞的显著差异:*p<0.0001,**p<0.0001。
图8显示通过敲低致死蛋白表达,mcf-7乳腺癌细胞中外泌体分泌减少。用表达抗致死蛋白(hspa9)的sirna或阴性对照rna的克隆转染mcf-7细胞。分离外泌体并在24、48、72和96小时后通过ache测定分析外泌体分泌水平的变化(图a)。示出相对于对照的显著性差异:***p<0.0001,和通过n-rh-pe检测的外泌体分泌(图b)。示出相对于对照的显著性差异:***p<0.0001。图c:在每个时间点保留的活细胞百分比,*p<0.05,**p<0.002,***p<0.0001。图d:通过western印迹法测定的致死蛋白和cd63蛋白质的表达水平。图e:western印迹数据的光密度测定分析。示出相对于对照的显著性差异:*p<0.01,**p<0.001,***p<0.0001。
具体实施方式
除非另外定义,否则本文使用的所有技术和科学术语具有与所公开的方法和组合物所属领域的技术人员通常理解的含义相同的含义。必须注意的是,如本文和所附权利要求中所使用的,单数形式“一”,“一个”和“所述”包括复数指代,除非上下文另有明确说明。因此,例如,提及“一种肽”包括“一种或多种”肽或“多种”这样的肽。关于本申请中的教导,本申请中描述的任何已授权的专利或专利申请公布文本通过引用明确地并入本文。此外,在使用短语“在一些实施方式中......”或“在某些实施方式中......”中的情况下,本公开内容应被解释为包含限定本文所述的不同实施方式的任何特征的组合,除非这些特征与另一个特征的组合是相互排斥的,或在此明确声明放弃的。
定义
如本文所用,术语“治疗”和“处理”是指改善与疾病例如癌症或感染性疾病相关的一种或多种症状;预防或延迟一种或多种疾病症状的发作;和/或减轻疾病的一种或多种症状的严重程度或频率。
术语“癌症”是指多种恶性肿瘤中的任何一种,这些恶性肿瘤的特征在于具有侵入周围组织和/或转移至新的定植位点的能力的细胞增殖,并且包括白血病、淋巴瘤、癌、黑素瘤、肉瘤、生殖细胞肿瘤和胚细胞瘤。用本公开内容的方法治疗的示例性癌症包括脑癌、膀胱癌、乳腺癌、宫颈癌、结肠癌、头颈癌、肾癌、肺癌、非小细胞肺癌、间皮瘤、卵巢癌、前列腺癌、胃癌和子宫癌、白血病和髓母细胞瘤。
术语“感染性疾病”包括由侵入和破坏哺乳动物体的正常功能的病毒、细菌、真菌和/或寄生物引起的那些病理状况。默克手册(merckmanual)第13版的第3-147页描述了这些状态中的一些状态,并且它们通过引用并入本文。
短语“对有此需要的患者”,“对需要治疗的患者”或“需要治疗的对象”包括受益于施用本公开内容的上述多部分肽来治疗细胞增殖性疾病的对象,例如哺乳动物对象。
术语“治疗有效量”,“药理学有效量”和“生理学有效量”可互换使用,表示在血流中或在目标组织中提供阈值水平的活性拮抗剂所需的多部分肽的量。精确的量将取决于许多因素,例如特定的活性剂、组合物的组分和物理特征、预期的患者群体、患者考虑因素等,并且可以由本领域技术人员基于本文提供的信息或从相关文献中可以获得的信息容易地确定。
在上下文中使用的术语“改善”,“增加”或“减少”表示相对于基线测量的值或参数,例如在开始本文所述治疗之前在同一个体中的测量结果,或在没有本文所述治疗的情况下在一个对照个体(或多个对照个体)中的测量结果。
“对照个体”是患有与正在治疗的个体相同疾病的个体,其与被治疗个体的年龄大致相同(以确保被治疗的个体和对照个体的疾病阶段具有可比性)。被治疗的个体(也称为“患者”或“对象”)可以是患有细胞增殖性疾病的胎儿、婴儿、儿童、青少年或成年人。
“小分子”是指不是聚合物的有机或无机分子,其具有药用活性,并且具有小于1kda的分子量。该术语包括除蛋白质或核酸(尽管小分子肽或核酸类似物可被认为是“小分子”)之外称为“药物”的大多数药物化合物。小分子药物可以合成、半合成(即,来自天然存在的前体)或生物学来源。如本文所用,短语“大分子”是指基于聚合物蛋白质或核酸的产物,其分子量大于1kda。
肽
本公开内容的一个方面涉及抑制外泌体从细胞中释放的多部分肽。在一个实施方式中,所述肽包含至少一种来自hiv-1nef的分泌修饰区(smr)肽和至少一种凝聚素(clu)-结合肽(clu-bp)。
在一个具体实施方式中,所述smr肽包含氨基酸序列vgfpv(seqidno:1)或vgfpvaavgfpv(seqidno:2),和选自hplskhpywsqp(seqidno:3)、ntywsqllhfqt(seqidno:4)和shalpltwstaa(seqidno:5)的至少一种clu-bp肽,如美国专利公开号2012/0121507中所述。
在一个实施方式中,所述肽包含位于n-末端的smr肽和位于c-末端的clu-bp肽。在另一个实施方式中,所述肽包含位于n-末端的clu-bp肽和位于c-末端的smr肽。
在某些实施方式中,所述肽包含至少两个被间隔肽分开的smr肽、至少两个被间隔肽分开的clu-bp肽、或两者。
在某些特定实施方式中,所述肽包含选自由vgfpvaavgfpvhplskhpywsqp(seqidno:6)、vgfpvaavgfpvaahplskhpywsqp(seqidno:7)、vgfpvaavgfpvaahplskhpywsqpaahplskhpywsqp(seqidno:8)组成的组的氨基酸序列。
在某些实施方式中,本发明的所述多部分肽还包含在多部分肽内的一个或多个功能结构域之间的一个或多个间隔子。设计间隔子以促进每个结构域相对于彼此独立地折叠,确保所述肽中的各个结构域不会彼此干扰或与smr肽干扰和/或增加蛋白质的柔性并促进采用延展构象(extendedconformation)。在一些实施方式中,所述间隔子包含1至50个氨基酸,优选包含2至10个氨基酸。
在一些实施方式中,所述间隔子包括一个或多个甘氨酸和/或丝氨酸残基以迫使所述间隔子采用环构象,因为β-碳的缺失允许多肽骨架接近二面角,这对于其他氨基酸来说在能量上是不允许的。另外,包含甘氨酸和/或丝氨酸的间隔子具有高的用于两个肽连接的自由度,即它们使融合蛋白质折叠并产生功能性蛋白质。可以增强稳定性和折叠的其他残基包括如下氨基酸:丙氨酸、脯氨酸、赖氨酸及其组合。在一个实施方式中,所述间隔子是ala-ala二肽接头。在另一个实施方式中,所述间隔子具有式[(gly)n-ser/ala]m,其中n为1至4,包括端值,m为1至4,包括端值。
在一些实施方式中,所述多部分肽还包含细胞穿膜肽(cpp)结构域。cpp结构域增强多部分肽摄取进入真核细胞。用于本申请的示例性cpp结构域包括但不限于hivtat49-57肽、hivtat48-60肽、低分子量鱼精蛋白(lmwp)肽;chariottm,也称为pep-1(morris等,nat.biotechnol.,19:1173-1176,2001);antp43-58肽、mpg(hivgp41-sv40nls)、sap、mpgr9、map、k-fgf、穿透素(penetratin)、抗菌肽(buforin)ii、转运子(transportan)、ku70、朊粒(prion)、pvec、pep-1-k、pep-7、hn-1、tp10和cp26(参见例如joliot等,naturecellbiol.,6(3):189-196,2004和heitz等,br.j.pharmacol.,157:195-206,2009)。
在某些特定实施方式中,所述多部分肽还包括线粒体穿透序列或线粒体靶向信号序列,以促进所述多部分肽被摄入定位有致死蛋白的线粒体。示例性的线粒体靶向序列包括美国专利公开2004/0192627中描述的前序列肽,包括核编码的人细胞色素c氧化酶(cox)亚基viii(msvltplllrgltgsarrlpvprakihsl(seqidno:9));大鼠鸟氨酸转氨甲酰酶(otc)的氨基末端前导肽(mlsnlrillnkaalrkahtsmvrnfrygkpvqc(seqidno:10)),细胞色素氧化酶亚基iv的前序列(mlslrqsirffkpatrtl(seqidno:11))和触角足突变(antennapedia)α-螺旋结构域,例如rqikiwfqnrrmkwkk(seqidno:12);美国专利公开号2014/0196172中描述的各种线粒体靶向肽,包括n-末端线粒体靶向肽,mfsylpryplraasaralvratrpsyrsallryq(seqidno:13)、maawmrslfsplkklwirmh(seqidno:14)、mkllwrlilsrkw(seqidno:15)、mwwrrsrtnslryt(seqidno:16)和mlfrlrrsvrlrglla(seqidno:17);以及n-末端线粒体靶向肽mwtlgrravagllaspspaq(seqidno:18),如美国专利公开号2016/0237129所述。引导蛋白质或肽到线粒体的示例性线粒体靶向信号肽序列包括rrivvlhgygavkevllnhk(seqidno:19)、大鼠细胞色素p4502e1(cyp2e1)的氨基酸74-95、来自酵母细胞色素c氧化酶iv前体的可切割前片段(prepiece)(mlslrqdirffkpatrtlcssr(seqidno:20))、来自流感病毒的pb2蛋白的线粒体靶向信号、血红素裂解酶中包含的输入信号(importsignal),以及线粒体基质酶鸟氨酸转氨甲酰酶(otc)的前导肽,如美国专利公开no.2014/0142121所述。
在一些实施方式中,所述多部分肽可包括靶向结构域,用于将所述肽靶向特定类型的细胞,包括肿瘤细胞、病毒感染的细胞等。靶向结构域可以包含与多部分肽融合的肽,或者它可以是与其化学偶联或共价连接的非肽基结构域。示例性靶向结构域包括肽、小分子、配体、抗体片段和适体。另外,靶向结构域可以是小分子(例如叶酸、腺苷、嘌呤)或特异性地结合至所需目标靶细胞的大分子(例如肽或抗体)。在一些实施方式中,所述靶向结构域存在于所述多部分肽的c-末端。在其他一些实施方式中,所述靶向结构域存在于所述多部分肽的n-末端。
在一些实施方式中,所述多部分肽可以与免疫球蛋白fc区连接。fc区可以增强稳定性和体内半衰期,并且可以促进携带fc受体的天然杀伤细胞、巨噬细胞、中性粒细胞和肥大细胞的募集,这可以刺激吞噬性细胞或细胞毒性细胞通过抗体介导性的吞噬作用或抗体依赖性细胞介导性的细胞毒性作用来破坏微生物或感染细胞。当使用抗体衍生的靶向试剂或fc区时,这些结构域优选使用本领域技术人员熟知的方法进行“人源化”。
在表达载体中编码的所述多部分肽可以进一步包括位于一个或多个功能结构域之间的用于蛋白水解的切割识别序列或内肽酶切割序列。内肽酶切割识别序列的引入可以促进真核或哺乳动物细胞中存在的合适的内肽酶进行位点特异性切割,所述内肽酶为例如天冬酰胺内肽酶、因子xa、弗林蛋白酶(furin)、凝血酶、组织蛋白酶b、纤溶酶和各种基质金属蛋白酶(mmp)例如mmp2、mmp7、mmp9或mmp14。合适的内肽酶切割识别序列的放置可用于释放与肽连接的脂质体部分和/或连接的peg部分,或者用于使一个或多个肽结构域彼此释放,使得一个或多个这些肽结构域可以在例如它们的靶向位点处彼此独立地起作用。
天冬酰胺内肽酶,也称为豆荚蛋白(legumain),是溶酶体半胱氨酸蛋白酶,其切割天冬酰胺的c-末端侧上的蛋白质底物,例如asn-asp。mmp2、mmp7、mmp9或mmp14可切割的序列包括plglag、plg-c(me)-ag、rplalwrs(seqidno:21)、espayyta(seqidno:22)、dprsfl(seqidno:23)、pprsfl(seqidno:24)、rlqlkl(seqidno:25)和rlqlk(ac)(seqidno:26)。组织蛋白酶b是肿瘤相关蛋白酶,其可作用于二肽序列缬氨酸-瓜氨酸和phe-lys。弗林蛋白酶切割识别序列arg-x-x-arg(seqidno:27),更优选为arg-x-(lys/arg)-arg(seqidno:28)。因子xa在精氨酸残基之后在其优选的切割位点中切割ile-(glu或asp)-gly-arg(seqidno:29),并且有时在其他碱性残基处切割,这取决于蛋白质底物的构象。在已经测序的那些中,最常见的二级位点是gly-arg。凝血酶优先在例如序列lvprgs(seqidno:30)中的arg和gly残基之间切割。
可以使用一种或多种方法化学修饰本公开内容的多部分肽,所述方法包括但不限于酰胺化、乙酰化(包括n-末端乙酰化)、羧化、糖基化、甲基化(例如利用甲基进行的α-氢取代)、羰基化、磷酸化、聚乙二醇化、二聚化、链间和/或链内二硫键的添加、反式烯烃的添加、利用已知保护基团/封闭基团进行的衍生化、环化、d-氨基酸取代、与抗体分子的连接或其他细胞配体等的连接。
可以修饰本公开内容的所述多部分肽以包含本领域已知的并且容易获得的其他非蛋白质性质的部分。优选地,适于蛋白质衍生化的部分是水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于:聚乙二醇(peg)、聚乙烯醇(pva)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)、和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、丙二醇(ppg)均聚物、聚丙烯氧化物/氧化乙烯共聚物(prolypropyleneoxide/ethyleneoxideco-polymer)、聚氧乙烯化的多元醇(例如甘油;pog)、聚乙烯醇及其混合物。聚乙二醇丙醛由于其在水中的稳定性而在制造中具有优势。
另外的修饰包括例如点突变、插入、缺失、截短和骨架取代,例如nh至nch3。此外,可以通过插入一个或多个d-氨基酸来修饰所述肽。此外,可以使用其中脯氨酸残基的环大小为5员环变为4、6或7员环的脯氨酸类似物。环状基团可以是饱和的或不饱和的,如果是不饱和的,可以是芳族或非芳族。
所述的多部分肽可包括修饰,包括在所述肽的n-末端、所述肽的c-末端或两者处引入本文所述的任何功能结构域。替代地或另外地,n-末端的修饰可包括c-末端的乙酰化(ac)残基和/或酰胺化(nh2)残基。当c-末端被酰胺化时,氨基酸的羧酸被转化为酰胺,即nh2-ch2-c(o)-nh2。
所述多部分肽可以进一步含有一个或多个共价连接的官能团,优选连接到所述多肽的n-末端和c-末端中的任一个或两个上。这些共价连接的基团可包括稳定剂、偶联剂、配体、酶底物和/或其组合。优选的基团包括n-末端的酰基和c-末端的半胱胺酸(cya)偶联基团。对后者可以方便地连接其他化学部分,例如染料、配体、小分子药物、蛋白质、酶、酶底物等。半胱胺酸(cya)的替代物也是本领域技术人员已知的。为了稳定和/或阻断,例如,可以用烷基如甲基或乙基代替cya,这些烷基已知可方便地定位于-cooh基团上。
n-末端修饰还可以包括但不限于:甲基化(即-nhch3或-nh(ch3)2)、加入1-氨基-环己烷-羧酸部分(chex);加入羧基苯甲酰基(carbobenzoyl),或用含有由rcoo-限定的羧酸官能团的任何封闭基团封闭氨基末端,其中r选自由萘基、吖啶基、甾基和类似基团组成的组。
衍生基团包括但不限于:含巯基的基团或部分,其可以位于所述多部分肽的c-末端,即使它不与另一个化学部分偶联。在一个实施方式中,c-末端可以用半胱胺基团(-nh-ch2-ch2-sh)修饰,其可以允许进一步与药物偶联。半胱胺基团与使用fmoc策略的肽合成相容,并产生c-末端保护的肽。或者,所述肽可包括含有巯基(-sh)基团的c-末端半胱氨酸残基,所述巯基可任选地用于与其他部分偶联。在另一个实施方式中,c-末端包含2,4-二氨基-丁酸(dab)部分。c-末端修饰可以进一步包括用羧酰胺基团取代游离酸或在羧基末端形成环状内酰胺以引入结构限制。
20个遗传编码的氨基酸(或d-氨基酸)的天然存在的侧链可以被具有相似性质的其他侧链替换,例如具有诸如烷基、低级烷基、环状4-、5-、6-乃至7-员环烷基、酰胺、酰胺低级烷基、酰胺二(低级烷基)、低级烷氧基、羟基、羧基及其低级酯衍生物,以及4-、5-、6-乃至7-员杂环。
这些取代可包括但不必限于:(1)非标准带正电荷的氨基酸,如:鸟氨酸;n-(4-氨基丁基)-甘氨酸,其赖氨酸侧链与“n-末端”连接并且氨基丙基或氨基乙基与甘氨酸的氨基连接;(2)非天然存在的氨基酸,其没有净电荷,侧链类似于精氨酸,如瓜氨酸,其带有或不带有亚甲基;(3)具有oh的非标准非天然存在的氨基酸(例如丝氨酸),例如高丝氨酸、羟脯氨酸、羟基缬氨酸和青霉胺;(4)脯氨酸衍生物,如d-pro,包括3,4-脱氢脯氨酸、焦谷氨酰胺、在环上带有氟取代的脯氨酸、1,3-噻唑烷-4-羧酸;(5)组氨酸衍生物,如β-(2-噻吩基)-丙氨酸;或(6)烷基衍生物,如2-氨基丁酸、正缬氨酸、正亮氨酸、高亮氨酸和α-氨基异丁酸。
在其他一些实施方式中,可以通过分别以n-末端的氨基分别对羧基或酯的-oh或酯基(-or)进行内部取代来诱导c-末端羧基或c末端酯基环化以形成环肽。例如,在合成和切割得到肽酸后,通过合适的羧基活化剂如在溶液例如在二氯甲烷(ch2cl2)、二甲基甲酰胺(dmf)混合物中的二环己基碳二亚胺(dcc)将游离酸转化为活化的酯。然后通过以n-末端胺对活化酯进行内部取代形成环肽。通过使用非常稀的溶液可以增强内部环化,这与聚合相反。这些方法在本领域中是公知的。
在其他一些实施方式中,本公开内容的所述多部分肽被环化或在肽末端包含脱氨基或脱羧基残基,使得不存在末端氨基或羧基。这可以降低对蛋白酶的易感性和/或限制肽的构象。本公开内容化合物的c-末端官能团包括酰胺、酰胺低级烷基、酰胺二(低级烷基)、低级烷氧基、羟基和羧基及其低级酯衍生物,以及它们的药学上可接受的盐。所述多部分肽可以通过添加n-末端和/或c-末端半胱氨酸进行环化和通过二硫键或其他侧链相互作用环化所述肽。
在一个优选的实施方式中,所述多部分肽(或其药学组合物)具有结构a-b-c-d,其中a是peg,例如10kdpeg;b是内肽酶例如天冬酰胺内肽酶的肽切割接头序列;c是含有smr的肽序列,例如vgfpvaavgfpv(seqidno:2);d是clu-bp肽序列,例如hplskhpywsqp(seqidno:3)。
本公开内容的所述多部分肽可以作为具有或不具有peg部分的裸肽施用,或者它们可以引入合适的载体中,所述载体为例如脂质体、纳米颗粒、水凝胶、微胶囊、病毒或噬菌体或病毒样颗粒(vlp)。
肽编码多核苷酸
本公开内容的另一方面涉及编码本文所述的任何所述多部分肽的多核苷酸。在一个实施方式中,所述多核苷酸是表达载体。如本文所用,术语“表达载体”是指包含编码本公开内容的所述多部分肽的多核苷酸的非病毒载体或病毒载体,其中肽编码序列与足以在细胞中表达所述肽的调控序列可操作地连接。一种类型的非病毒载体是“质粒”,其包括环状双链dna环,在所述dna环内可以连接额外的dna区段。在本说明书中,“质粒”和“载体”可互换使用,因为质粒是最常用的载体形式。
可以基于待用于表达的宿主细胞来选择调控序列,使得设计表达载体和包括调控序列取决于诸如待转化的宿主细胞的选择、所需蛋白质的表达水平、所述肽是否要分泌到细胞外环境等因素。可以将本发明的表达载体引入宿主细胞中以指导本公开内容的所述多部分肽的在体外为生产目的的表达或在体内为治疗目的的表达。
如本文所用,术语“控制序列”或“调控序列”是指在特定宿主生物中表达可操作连接的编码序列所必需的dna序列。术语“控制/调控序列”旨在包括启动子、增强子和其他表达控制元件(例如多腺苷酸化信号)。控制/调控序列包括在许多类型的宿主细胞中指导核苷酸序列的组成型表达的那些序列和仅在某些宿主细胞中指导核苷酸序列表达的那些序列(例如组织特异性调控序列)。
当核酸序列与另一核酸序列处于功能关系时,前者与后者彼此是“可操作地连接的”。例如,在某些实施方式中,表达载体编码前序列或信号肽,其与肽编码序列可操作地连接,用于表达参与所述多肽分泌的前蛋白。另外,如果启动子或增强子影响序列的转录,则认为启动子或增强子与编码序列可操作地连接,并且如果核糖体结合位点被定位以便于翻译,则它与编码序列可操作地连接。通常,“可操作地连接”是指被连接的dna序列是连续的,并且在分泌前导序列的情况下,是连续的并且处于阅读阶段。但是,增强子不必是连续的。连接这些序列可以通过在方便的限制性位点的连接或通过使用合成的寡核苷酸衔接子(adatpor)、引物和/或接头根据本领域的常规实践来完成。
在某些情况下,可以通过使用病毒载体固有的或工程化到所述病毒载体中的靶向特征,将这些载体工程化以靶向某些疾病或细胞群。特异性细胞可以对于多核苷酸的递送以及表达被“靶向”。因此,在这种情况下,术语“靶向”可以基于以用于递送至特定细胞的抗体、衣壳或包膜蛋白的形式的内源或异源结合剂的使用,用于将表达限制于特定细胞亚群的组织特异性调控元件的使用,或两者。
在某些实施方式中,表达载体经工程改造以指导所述肽在特定细胞类型中普遍或优先地表达(例如,组织特异性调控元件被用于表达多核苷酸)。因此,在某些实施方式中,所述肽的表达处于组织特异性或普遍存在的启动子例如cmv启动子或cmv-鸡β-肌动蛋白杂合体(cag)启动子的控制下。在其他一些实施方式中,可以使用组织特异性或肿瘤特异性启动子。示例性组织特异性调控元件是本领域已知的,并且可包括肝特异性启动子(例如白蛋白启动子)、淋巴特异性启动子、上皮细胞特异性启动子、t-细胞受体和免疫球蛋白的启动子、神经元特异性启动子(例如,神经细丝启动子)、胰腺特异性启动子(例如,胰岛素启动子)和乳腺特异性启动子(例如,奶乳清启动子)。还包括发育调节的启动子(例如,α-胎蛋白启动子)。
在某些实施方式中,多部分表达构建体可以与线粒体靶向肽或前导序列连接,以促进表达构建体被摄取到线粒体细胞中,如美国专利公开号20040192627中所述。常规方案可以用于将表达构建体与线粒体靶向肽偶联,例如pgenegriptm技术(genlantis/genetherapysystems,inc.,sandiego,ca)。或者,如上所述,多部分肽编码序列可以融合到线粒体靶向序列,以指导表达的肽易位到线粒体中。
在其他一些实施方式中,多部分肽编码序列可以与线粒体穿透部分或如上所述的线粒体靶向信号序列融合。充当线粒体穿透部分的示例性的核酸(如在美国专利号5569754所描述的那些)包括,例如,ccgccaagaagcg(seqidno:31)、gcgtgcacacgcgcgtagacttcccccgcaagtcactcgttagcccgccaagaagcgacccctccggggcgagctgagcggcgtggcgcgggggcgtcat(seqidno:32)、acgtgcatacgcacgtagacattccccgcttcccactccaaagtccgccaagaagcgtatcccgctgagcggcgtggcgcgggggcgtcatccgtcagctc(seqidno:33)或acttcccccgcaagtcactcgttagcccgccaagaagcgacccctccggggcgagctg(seqidno:34)。
在一些实施方式中,多部分肽编码序列可以与信号肽结构域融合,用于从表达所述肽的细胞分泌所述肽。当成熟肽从细胞分泌时,从成熟肽中除去信号肽序列。由于给定的信号肽序列可以影响肽表达水平,因此肽编码多核苷酸可以包括本领域已知的多种不同n-末端信号肽序列中的任何一种。
在一些实施方式中,表达载体是病毒载体。病毒载体可来源于腺相关病毒(aav)、腺病毒、疱疹病毒、痘苗病毒、脊髓灰质炎病毒、天花病毒、逆转录病毒(包括慢病毒如hiv-1和hiv-2)、辛德毕斯和其他rna病毒、甲病毒、星状病毒、冠状病毒、正粘病毒、乳多空病毒、副粘病毒、细小病毒、小核糖核酸病毒、披膜病毒等。非病毒载体简单地是“裸露的”表达载体,其不与病毒衍生的组分(例如衣壳和/或包膜)一起包装。
通过直接注射裸dna或通过将多部分肽编码多核苷酸包封在脂质体、纳米颗粒、水凝胶、微胶囊或病毒样颗粒中,非病毒表达载体可用于非病毒基因转移。此类组合物可通过化学偶联进一步连接至靶向结构域,以促进核酸靶向递送和/或进入所需的目的细胞。另外,质粒载体可以与合成的基因转移分子例如聚合dna结合阳离子如聚赖氨酸、鱼精蛋白和白蛋白一起温育,并连接至细胞靶向配体如脱唾液酸血清类粘蛋白(asialoorosomucoid)、胰岛素、半乳糖、乳糖或转铁蛋白。
或者,可以使用裸dna。通过压实或使用可生物降解的乳胶珠可以改善裸dna的摄取效率。通过处理珠子以增加疏水性从而促进内体的破坏和dna释放到细胞质中,可以进一步改善这种递送。
药学组合物
在一些实施方式中,药学组合物包含多部分肽,所述多部分肽包含至少一种来自hiv-1nef的smr肽、至少一种凝聚素(clu)-结合肽(clu-bp)和药学上可接受的载体。另外,所述多部分肽可包括任何上述修饰。
在另一个实施方式中,药学组合物包含编码多部分肽的表达载体,所述多部分肽包含至少一种来自hiv-1nef的smr肽、至少一种凝聚素(clu)-结合肽(clu-bp)和药学上可接受的载体。因此,编码的肽被设计为包括任何上述修饰。
如本文所用,术语“药学上可接受的”是指当酌情施用于动物或人时不产生不利的、过敏的或其他不良反应的分子实体或组合物。如本文所用,术语“药学上可接受的载体”包括任何和所有与药物施用相容的溶剂、增溶剂、填充剂、稳定剂、表面活性剂、粘合剂、吸收剂、碱、缓冲剂、赋形剂、润滑剂、控释载体、稀释剂、乳化剂、保湿剂、润滑剂、凝胶、分散介质、涂层、抗细菌或抗真菌试剂、等渗和吸收延迟剂等。这些载体和试剂用于药物活性物质的用途是本领域熟知的。参见例如a.h.kibbehandbookofpharmaceuticalexcipients,第3版,制药出版社,英国伦敦(2000年)。
示例性载体或赋形剂包括但不限于碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶、聚合物如聚乙二醇、水、盐水、等渗水溶液、磷酸盐缓冲盐水、右旋糖、0.3%甘氨酸水溶液、甘油、乙醇等,以及它们的组合。在许多情况下,优选在组合物中包含等渗剂,例如糖,多元醇如甘露醇、山梨糖醇,或氯化钠,或用于增强稳定性的糖蛋白,例如白蛋白、脂蛋白和球蛋白。药学上可接受的载体可以进一步包含少量辅助物质,例如润湿剂或乳化剂,防腐剂或缓冲剂,这些试剂增强治疗剂的保质期或有效性。在某些实施方式中,药学上可接受的载体包含血清白蛋白。
可以改变的制剂特征包括例如ph和渗透压。例如,可能希望获得具有与人血液或组织相似的ph和渗透压的制剂,以在胃肠外施用时促进制剂的有效性。
缓冲剂可用于本发明,除了其他目的之外,还用于操纵药物制剂的总ph(特别是胃肠外使用所需的ph)的目的。本领域已知的各种缓冲剂可用于本发明制剂中,例如有机或无机酸、碱或氨基酸的各种盐,并包括各种形式的柠檬酸盐、磷酸盐、酒石酸盐、琥珀酸盐、己二酸盐、马来酸盐、乳酸盐、乙酸盐、碳酸氢盐或碳酸盐离子。用于本发明中的本发明公开组合物的肠胃外施用形式的特别有利的缓冲剂包括钠或钾缓冲剂,包括磷酸钠、磷酸钾、琥珀酸钠和柠檬酸钠。
氯化钠可用于在0-300mm的浓度改变溶液的张力(对于液体剂型,最佳为150mm)。可以包括冷冻保护剂以用于冻干剂型,主要是0-10%蔗糖(最佳地为0.5-1.0%)。其他合适的冷冻保护剂包括海藻糖和乳糖。可以包括用于冻干剂型的填充剂,主要是1-10%甘露醇(最佳地为2-4%)。稳定剂可以以液体和冻干剂型使用,主要是1-50mm的l-甲硫氨酸(最佳地为5-10mm)。其他合适的增量剂包括甘氨酸、精氨酸,其可以包含0-0.05%聚山梨醇酯-80(最佳地为0.005-0.01%)。
在一个实施方式中,磷酸钠以接近20mm的浓度使用以达到约7.0的ph。特别有效的磷酸钠缓冲体系包含磷酸二氢钠一水合物和磷酸氢二钠七水合物。当使用这种磷酸钠一元碱和磷酸钠二元碱的组合时,各自的有利浓度为约0.5至约1.5mg/ml一元碱和约2.0至约4.0mg/ml二元碱,优选浓度为约0.9mg/ml一元碱和约3.4mg/ml的磷酸二元碱。制剂的ph根据使用的缓冲剂的量而变化。
取决于剂型和预期的施用途径,可替代地使用不同浓度的缓冲剂或使用其他添加剂来调节组合物的ph以包括其他范围是有利的。本发明组合物的有用ph范围包括约2.0的ph至约12.0的ph。
在一些实施方式中,在本发明公开的制剂中使用表面活性剂也是有利的,其中那些表面活性剂不会破坏所用的药物递送系统。证明有用的表面活性剂或抗吸附剂包括聚氧乙烯山梨糖醇、聚氧乙烯山梨糖醇酐单月桂酸酯、聚山梨醇酯-20如tween-20tm、聚山梨醇酯-80、聚山梨醇酯-20、羟基纤维素、偕胺醇(genapol)和brij表面活性剂。举例来说,当在本发明中使用任何表面活性剂来制备可肠胃外施用的组合物时,以约0.01至约0.5mg/ml的浓度使用所述组合物是有利的。
根据组合物和配方设计师的特定需要或预期用途,本领域技术人员容易确定其他有用的添加剂。一种这样的特别有用的额外物质是氯化钠,其可用于调节制剂的渗透压以获得所需的渗透压。用于肠胃外施用所公开的组合物的特别优选的渗透压范围为约270至约330mosm/kg。用于肠胃外施用特别是可注射的组合物的最佳渗透压约为300mosm/kg,可通过使用浓度为约6.5至约7.5mg/ml的氯化钠实现,氯化钠浓度为约7.0mg/ml是特别有效的。
所述多部分肽可以在无菌条件下作为冻干粉末储存,并在施用前与无菌水溶液混合。如上所述,用于重悬所述肽的水溶液可以含有接近物理条件所需的药学上可接受的辅助物质,例如ph调节剂和缓冲剂和张力调节剂等。或者,所述多部分肽可在施用前作为悬浮液储存,优选作为水悬液储存。
在某些优选的实施方式中,药学组合物中的多部分肽是聚乙二醇化的。聚乙二醇化是将聚乙二醇聚合物链共价连接到另一分子(通常是药物或治疗性肽/蛋白质)的过程。peg化可以通过将peg的反应性衍生物与多部分肽一起温育来实现。peg与多部分肽的共价连接可以“掩盖”宿主免疫系统中的多部分肽(降低的免疫原性和抗原性),增加多部分肽的流体动力学尺寸(溶液中的尺寸),通过减少肾清除来延长其循环时间。peg化还可以为疏水蛋白提供水溶性。
peg分子通常表征为具有例如约2至约1000,或约2至约300个重复单元。例如,水溶性聚合物,包括但不限于peg、聚(环氧乙烷)(peo)、聚氧乙烯(poe)、聚乙烯醇、羟乙基纤维素或葡聚糖,通常偶联至蛋白质以增加蛋白质的稳定性或尺寸等,如美国专利公开号2012/0171115中所述的那样。
peg、peo和poe是环氧乙烷的低聚物或聚合物。在peg的情况下,这些低聚物或聚合物通过例如环氧化物环上的氢氧根离子的亲核攻击引发的环氧乙烷的阴离子开环聚合来制备。用于蛋白质修饰的更有用的peg形式之一是单甲氧基peg(mpeg)。
优选的peg是单分散的或多分散的,优选为单分散的。技术人员将认识到peg可以是多分散的或单分散的。多分散peg包含具有不同分子量的peg的混合物。在多分散peg的情况下,提及特定分子量将被理解为指混合物中peg的数均分子量。尺寸分布在统计学上通过其重均分子量(mw)和其数均分子量(mn)表征,其比率称为多分散指数(mw/mn)。在某些方面,通过质谱法测量mw和mn。大多数peg-蛋白质偶联物,特别是偶联至大于1kd的peg的那些偶联物,由于母体peg分子的30的多分散性质而表现出一系列分子量。例如,在mpeg2k(sunbrightme-020hs,nof)的情况下,实际分子量分布在1.5-3.0kd的范围内,多分散指数为1.036。基于前述内容,本领域技术人员将认识到单分散peg包含具有基本相同的分子量的peg的混合物。单分散peg可商购获得,例如购自挪威的polypureas。
peg的平均或优选的分子量可以为500da至200kda、1至100kda、2至50kda、5至25kda、或5kda至10kda,包括包含在这些范围内的任何整数。
peg衍生物的合适官能团的选择基于将与peg偶联的分子上可用的反应性基团的类型。对于肽或蛋白质,典型的反应性氨基酸包括赖氨酸、半胱氨酸、组氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸。n-末端氨基和c-末端羧酸也可以通过与醛官能聚合物偶联而用作位点特异性位点。
在某些实施方式中,peg衍生物通过使peg聚合物与可与羟基反应的基团(通常为酸酐、酰氯、氯甲酸酯和碳酸酯)反应来制备。在其他一些实施方式中,更有效的官能团如醛、酯、酰胺等可用于蛋白质偶联。
在某些实施方式中,异双功能peg用于偶联。这些异双功能peg可用于连接两个实体,其中需要亲水的、柔性的和生物相容的间隔子。异双功能peg的优选端基是马来酰亚胺、乙烯基砜、吡啶基二硫化物、胺、羧酸和nhs酯。在其他一些实施方式中,聚乙二醇化试剂含有支化的y形或梳形的聚合物,所述聚合物显示出降低的粘度和没有器官累积。
如美国专利公开号2012/0171115中所述,本领域已知多种方法用于将peg偶联至肽或蛋白质。peg的偶联可包括使用可切割或不可切割的间隔子部分。在一些实施方式中,可切割的间隔子部分是氧化还原可切割的间隔子部分,使得间隔子部分在具有较低氧化还原电位的环境中是可切割的,例如细胞质和具有较高浓度的具有游离巯基的分子的其他区域。可能由于氧化还原电位的变化而被切割的间隔子部分的实例包括含有二硫化物的那些物质。可以在偶联蛋白摄取到细胞内时提供切割刺激,其中细胞质的较低氧化还原电位促进间隔子部分的切割。在peg的情况下,可以活化分子以促进其与胺或咪唑、羧基、羟基或巯基的结合。
在另一个实例中,ph的降低引起间隔子的切割,从而将化合物释放到靶细胞中。ph的降低涉及许多生理和病理过程,例如内体运输、肿瘤生长、炎症和心肌缺血。ph在内体中从生理学上的7.4降至5-6或在溶酶体中降至4-5。可用于靶向癌细胞的溶酶体或内体的酸敏感间隔子部分的实例包括具有酸可切割键的那些物质,例如在缩醛、缩酮、原酸酯、腙、三苯甲基、顺式-福寿草基(cis-aconityl)或硫代氨基甲酰基中发现的那些(参见例如美国专利号4,569,789、4,631,190、5,306,809和5,665,358)。其他示例性的酸敏感性间隔子部分包含二肽序列phe-lys和val-lys。
可切割的间隔子部分可以对与特定靶细胞相关的生物学供应的切割剂敏感,例如溶酶体或肿瘤相关酶。可以酶促切割的连接部分的实例包括但不限于酯和内肽酶切割识别位点。
活化的peg可与氰尿酰氯一起使用以产生peg二氯三嗪衍生物。该衍生物可与多种功能性亲核官能团反应,例如赖氨酸、丝氨酸、酪氨酸、半胱氨酸和组氨酸。用于与蛋白质偶联的两种广泛使用的peg形式是琥珀酰亚胺基碳酸酯peg和苯并三唑碳酸酯peg(btc-peg;美国专利号5,560,234)。这两种化合物均优先与赖氨酸残基反应形成氨基甲酸酯键,但已知也与组氨酸和酪氨酸反应。sc-peg比btc-peg稍微更耐水解。
可用于偶联蛋白质的另一种peg是peg-丙醛(美国专利号5,252,714)。该化学物的一个优点是在酸性条件下(约ph5),它对n-末端α-胺具有很大的选择性,从而避免了非特异性偶联的潜在问题。peg-丙醛的缩醛衍生物,即peg-乙醛提供了额外的益处,因为它提供比peg-丙醛更长的储存(美国专利no.5,990,237)。
peg羧酸的活性酯可能是最常用的蛋白质偶联的酰化剂之一。活性酯在接近生理条件下与伯胺反应形成稳定的酰胺。通过使peg-羧酸与n-羟基琥珀酰亚胺(nhs或hosu)和碳二亚胺反应,实现peg-羧酸活化成琥珀酰亚胺基活性酯。peg的示例性羧酸衍生物包括羧甲基化peg(cm-peg)、丁酸衍生物和丙酸衍生物(美国专利no.5,672,662)。通过添加亚甲基单元改变活性酯和peg主链之间的距离可以显著影响对水和胺的反应性(例如通过减少水解)。替代地或另外地,通过将α-支化部分引入羧酸可以降低水解。
蛋白质中游离半胱氨酸残基的peg化可用于位点特异性偶联(例如,使用经修饰以包括如本文所述的半胱氨酸残基的蛋白质)。用于半胱氨酸偶联的示例性peg衍生物包括peg-马来酰亚胺、peg-乙烯基砜、peg-碘乙酰胺和peg-正吡啶基二硫化物。用于将peg偶联至半胱氨酸残基和使用peg-乙烯基砜偶联的示例性方法是本领域熟知的。
美国专利no.5,985,263描述了将peg偶联至组氨酸的仲胺基团的方法,其具有比伯胺更低的pka。该方法的一个优点是酰基-组氨酸键不稳定,这意味着肽或蛋白质被缓慢释放(即,偶联物表现为缓释制剂或前药)。
peg化的另一种方法是利用n-末端丝氨酸或苏氨酸,其可以如上所述转化为高碘酸盐。使用这种方法,peg已经与生物活性蛋白偶联(例如,gaertner和offord,1996)。peg也可以与碳水化合物基团偶联。
配制本公开内容的药学组合物以与其预期的施用途径相容。施用途径的实例包括肠胃外,例如鞘内、动脉内、静脉内、皮内、皮下、口服、透皮(局部)和经粘膜施用。用于肠胃外、皮内或皮下应用的溶液或悬浮液可包括以下组分:无菌稀释剂,例如注射用水、盐溶液、固定油、聚乙二醇、甘油等。丙二醇或其他合成溶剂;抗细菌试剂如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐和调节渗透压的试剂如氯化钠或葡萄糖。可以用酸或碱调节ph,例如盐酸或氢氧化钠。肠胃外制剂可以封装在安瓿,一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
适于注射使用的药学组合物包括无菌水溶液(水溶性的)或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophoreltm(basf,parsippany,nj)或磷酸盐缓冲盐水(pbs)。在所有情况下,可注射组合物应该是无菌的并且应该是达到易于注射的程度的流体。它在制造和储存条件下必须是稳定的,并且必须防止微生物如细菌和真菌的污染作用。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液态聚乙二醇等),以及它们的合适混合物。例如,通过使用诸如卵磷脂的涂层,通过在分散的情况下保持所需的颗粒尺寸和通过使用表面活性剂,可以保持适当的流动性。通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等,可以防止微生物的作用。在许多情况下,优选在组合物中包含等渗剂,例如糖、多元醇如甘露醇、山梨糖醇和氯化钠。通过在组合物中包含延迟吸收的试剂,例如单硬脂酸铝和明胶,可以实现可注射组合物的延长吸收。
无菌可注射溶液可以通过将所需量的多部分肽与上面列举的成分中的一种或成分组合(根据需要)加入适当的溶剂中,然后过滤灭菌来制备。通常,通过将多部分肽加入无菌载体中来制备分散体,所述无菌载体含有基础分散介质和来自上面列举的那些的其他需要成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其获得活性肽加上来自其先前无菌过滤溶液的任何其他所需成分的粉末。
口服组合物通常包括惰性稀释剂或可食用载体。它们可以封装在明胶胶囊中或压制成片剂。片剂、丸剂、胶囊剂、锭剂等可含有下列任何成分或具有类似性质的化合物,包括:粘合剂如微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉或乳糖,崩解剂如海藻酸、primogel或玉米淀粉;润滑剂如硬脂酸镁或stertes;助流剂如胶体二氧化硅;甜味剂如蔗糖或糖精;或调味剂如薄荷、水杨酸甲酯或橙子调味剂。
对于通过吸入施用,所述肽以气溶胶喷雾的形式从容纳有合适的推进剂例如气体(如二氧化碳)的加压容器或分配器或喷雾器递送。
全身施用也可以通过透粘膜或透皮方式进行。对于透粘膜或透皮施用,在制剂中使用适合于待渗透屏障的渗透剂。这种渗透剂通常是本领域已知的,并且包括例如用于经粘膜施用的去污剂、胆盐和夫西地酸衍生物。透粘膜施用可以通过使用鼻喷雾剂或栓剂来完成。对于透皮施用,将药学组合物配制成本领域公知的软膏、油膏、凝胶或乳膏。
在某些实施方式中,配制药学组合物用于控制释放或延迟释放活性成分。例如,在某些实施方式中,所述肽可以与肠溶包衣一起递送,所述肠溶包衣用作口服制剂的屏障,以便所述肽在到达小肠之前防止它们释放。如本文所用,术语“肠溶包衣”是包含一种或多种具有ph依赖性或ph非依赖性释放曲线的聚合物的包衣。肠溶包衣丸不溶于胃部酸液(ph~3),但它们将溶解在存在于小肠或结肠中的碱性(ph7-9)环境中。肠溶聚合物涂层通常抵抗活性剂的释放,直到在施用后约3-4小时的胃排空滞后期之后的某个时间。
这种肠溶包衣或屏障包衣也用于保护酸不稳定的肽以免暴露于受胃酸,将它们递送到碱性ph环境(肠道ph5.5及以上),在那里它们不会降解并且可以介导它们所需的作用。口服制剂可包含多种屏障涂层,该图层包含多种不同的材料以促进以时间方式释放。所述涂层可以是糖衣、薄膜包衣(例如,基于羟丙基甲基纤维素、甲基纤维素、甲基羟乙基纤维素、羟丙基纤维素、羧甲基纤维素、丙烯酸酯共聚物、聚乙二醇和/或聚乙烯吡咯烷酮)或基于如下物质的涂层:甲基丙烯酸共聚物、邻苯二甲酸醋酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、羟丙基甲基纤维素乙酸酯琥珀酸酯、邻苯二甲酸聚乙酸乙烯酯、虫胶和/或乙基纤维素。此外,制剂可另外包括延时材料,例如单硬脂酸甘油酯或二硬脂酸甘油酯。
可以使用可生物降解性、生物相容性的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备这种制剂的方法对于本领域技术人员来说是显而易见的。该材料也可以从例如alzacorporation和novapharmaceuticals,inc.在商业上获得。脂质体悬浮液(包括用抗肿瘤抗原或病毒抗原的单克隆抗体靶向感染细胞的脂质体)也可用作药学上可接受的载体。
将肽组合物配制成剂量单位形式对施用便利性和剂量均匀性是特别有利的。合适的单位剂型包括但不限于粉末、片剂、丸剂、胶囊、锭剂、栓剂、贴剂、鼻喷雾剂、注射剂、可植入的缓释制剂、脂质复合物等。
治疗方法
在另一方面,本公开内容提供了用于治疗癌症和感染性疾病的方法。在一些实施方式中,本申请涉及用于治疗癌症的方法。所述方法包括给有此需要的受试者施用有效量的药学组合物的步骤,所述药学组合物包含含有至少一种来自hiv-1nef的分泌修饰区(smr)肽和至少一种凝聚素(clu)-结合肽(clu-bp)的多部分肽。所述受试者可患有选自由白血病、淋巴瘤、癌、黑素瘤、肉瘤、生殖细胞肿瘤和胚细胞瘤组成的组的癌症。
如本文所用,术语“白血病”是指血液形成器官的进行性恶性疾病,其特征通常在于血液和骨髓中白细胞及其前体的不正常增殖和发育。示例性白血病包括例如急性非淋巴细胞白血病、慢性淋巴细胞白血病、急性粒细胞白血病、慢性粒细胞白血病、急性早幼粒细胞白血病、成人t-细胞白血病、白细胞不增多性白血病、白细胞性白血病(leukocythemicleukemia)、基底细胞白血病、胚细胞白血病、牛白血病、慢性髓细胞白血病、皮肤白血病、胚胎白血病、嗜酸粒细胞白血病、格罗斯白血病、毛细胞白血病、成血细胞白血病(hemoblasticleukemia)、血干细胞白血病(hemocytoblasticleukemia)、组织细胞白血病、干细胞白血病、急性单核细胞白血病、白细胞减少症白血病、淋巴细胞性白血病(lymphaticleukemia)、淋巴母细胞白血病(lymphoblasticleukemia)、淋巴球性白血病(lymphocyticleukemia)、成淋巴性白血病(lymphogenousleukemia)、淋巴样白血病(lymphoidleukemia)、淋巴肉瘤细胞白血病、肥大细胞白血病、巨核细胞白血病、微小细胞白血病、单核细胞白血病、成髓细胞白血病、髓细胞白血病、骨髓性粒细胞白血病、髓单核细胞白血病、内格利白血病(naegelileukemia)、浆细胞白血病(plasmacellleukemia)、浆细胞性白血病(plasmacyticleukemia)、早幼粒细胞性白血病、里德细胞白血病(riedercellleukemia)、希林氏性白血病(schilling′sleukemia)、干细胞白血病、亚白血性白血病和未分化细胞白血病。
术语“淋巴瘤”是指由淋巴细胞发展而来的一组血细胞肿瘤。示例性淋巴瘤包括例如霍奇金淋巴瘤(hl)和非霍奇金淋巴瘤。
术语“癌”是指上皮细胞的恶性生长,其倾向于渗入周围组织并引起转移。示例性癌包括,例如,腺泡癌、腺样癌、腺囊性癌、腺样囊性癌、腺瘤、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌、癌基底细胞癌、基底细胞样癌、基底鳞状细胞癌、支气管肺泡癌、支气管癌、支气管肺癌、脑癌、胆管细胞癌、绒毛膜癌、胶体癌、粉刺癌、子宫体癌、筛状癌、铠甲状癌(carcinomaencuirasse)癌切除术、癌疮(carcinomacutaneum)、圆柱形癌、圆柱形细胞癌、导管癌、硬癌、胚胎癌、脑鳞癌、表皮样癌、癌上皮腺样瘤、外生癌、癌前病变、癌纤维、明胶癌、凝胶状癌、巨细胞性癌(giantcellcarcinoma)、巨细胞癌(carcinomagigantocellulare)、腺癌、颗粒细胞癌、毛基质癌、多血癌(hematoidcarcinoma)、肝细胞癌、贺氏细胞癌、透明癌、甲状腺癌、婴儿胚胎癌、原位癌、表皮内癌、上皮内癌、克氏癌(krompecher′scarcinoma)、古氏细胞癌(kulchitzky-cellcarcinoma)、大细胞癌、透镜状癌(lenticularcarcinoma)、透镜癌(carcinomalenticulare)、脂肪瘤癌、淋巴上皮癌、髓癌(carcinomamedullare)、髓样癌(medullarycarcinoma)、黑色素瘤、软癌(carcinomamolle)、粘液癌(mucinouscarcinoma)、黏液分泌性癌(carcinomamuciparum)粘液细胞癌(carcinomamucocellulare)、粘液表皮样癌(mucoepidermoidcarcinoma)、粘膜癌(carcinomamucosum)、粘液质癌(mucouscarcinoma)、粘液瘤样癌(carcinomamyxomatodes)、鼻咽癌、燕麦细胞癌、骨化癌、骨样癌、乳头状癌、门静脉癌、浸润前癌、刺细胞癌、松软癌(pultaceouscarcinoma)、肾脏的肾细胞癌、储备细胞癌、癌肉瘤、施耐德氏癌(schneideriancarcinoma)、硬化癌(scirrhouscarcinoma)、阴囊癌、印戒细胞癌、单纯癌(carcinomasimplex)、小细胞癌、类囊体癌、球状细胞癌、梭形细胞癌、海绵母癌、鳞状细胞癌、鳞状细胞癌、绳捆癌(stringcarcinoma)、毛细血管扩张癌(carcinomatelangiectaticum)、毛细血管扩张性癌(carcinomatelangiectodes)、移行细胞癌、结节性皮癌(carcinomatuberosum)、结节癌、疣状癌、和绒毛状癌(carcinomavillosum)。
术语“肉瘤”是指由诸如胚胎结缔组织的物质构成的肿瘤,并且通常由嵌入纤维状或均质物质中的紧密堆积的细胞组成。示例性肉瘤包括,例如,软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑色肉瘤、粘液肉瘤、骨肉瘤、阿氏肉瘤(abemethy′ssarcoma)、脂肉瘤(adiposesarcoma)、脂肪肉瘤(liposarcoma)、肺泡软组织肉瘤、成釉细胞肉瘤、葡萄状肉瘤、绿色肉瘤(chloromasarcoma)、绒毛膜癌、胚胎肉瘤、威氏肿瘤肉瘤(wilns′tumorsarcoma)、子宫内膜肉瘤、间质肉瘤、尤文氏肉瘤、筋膜肉瘤、成纤维肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金肉瘤、特发性多发性色素性出血性肉瘤、b-细胞的免疫母细胞肉瘤、淋巴瘤(如非霍奇金淋巴瘤)、t-细胞的免疫母细胞肉瘤、简森氏肉瘤(jensen′ssarcoma)、卡波西氏肉瘤、枯氏细胞肉瘤、血管肉瘤、白细胞肉瘤、恶性间质肉瘤、骨肉瘤、网状肉瘤、劳斯肉瘤、浆细胞肉瘤、滑膜肉瘤和毛细血管肉瘤。
术语“黑素瘤”是指由皮肤和其他器官的黑素细胞系统产生的肿瘤。黑素瘤包括,例如,肢端黑色素瘤、无色素黑素瘤、良性青少年黑素瘤、克劳德曼氏黑素瘤(cloudman′smelanoma)、s91黑素瘤、哈-帕二氏黑素瘤、幼年黑素瘤、雀斑恶性黑色素癌、恶性黑素瘤、结节性黑色素瘤、萨邦格尔黑色素瘤(subungalmelanoma)和表面扩散黑素瘤。
其他癌症包括,例如,霍奇金病、多发性骨髓瘤、神经母细胞瘤、乳腺癌、卵巢癌、肺癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、小细胞肺肿瘤、原发性脑肿瘤、胃癌、结肠癌、恶性胰腺软脑膜瘤、恶性类癌、癌前皮肤病变、睾丸癌、甲状腺癌、神经母细胞瘤、食道癌、泌尿生殖道癌、恶性高钙血症、宫颈癌、子宫内膜癌和肾上腺皮质癌。在一个实施方式中,受试者患有乳腺癌。
在其他一些实施方式中,本申请涉及治疗感染性疾病的方法。所述方法包括给有此需要的受试者施用有效量的药学组合物的步骤,所述药学组合物包含含有至少一种来自hiv-1nef的分泌修饰区(smr)肽和至少一种凝聚素(clu)-结合肽(clu-bp)的多部分肽。
在一些实施方式中,感染性疾病由细菌引起。在一些实施方式中,感染性疾病由真菌引起。在一些实施方式中,感染性疾病由寄生物引起。
在一些实施方式中,所述感染性疾病由选自如下病毒组成的组的病毒引起:人免疫缺陷病毒1型和2型(hiv-1和hiv-2)、人t-细胞嗜淋巴细胞病毒i型和ii型(htlv-i和htlv-ii)、甲型肝炎病毒、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、丁型肝炎病毒(hdv)、戊型肝炎病毒(hev)、庚型肝炎病毒(hgv)、细小病毒b19病毒、甲型肝炎病毒、庚型肝炎病毒、戊型肝炎病毒、输血传播病毒(ttv)、爱泼斯坦-巴尔病毒、人巨细胞病毒1型(hcmv-1)、人疱疹病毒6型(hhv-6)、人疱疹病毒7型(hhv-7)、人疱疹病毒8型(hhv-8)、甲型流感病毒(包括亚型h1n1和h5n1)、人间质肺病毒、严重急性呼吸综合征(sars)冠状病毒、汉坦病毒和来自沙粒病毒科的rna病毒(例如,拉沙热病毒(lfv))、肺病毒科(例如人偏肺病毒)、丝状病毒科(例如埃博拉病毒(ebov)、马尔堡病毒(mbgv)和塞卡病毒);布尼亚病毒科(例如,裂谷热病毒(rvfv)、克里米亚-刚果出血热病毒(cchfv)和汉坦病毒);黄病毒科(西尼罗河病毒(wnv)、登革热病毒(denv)、黄热病病毒(yfv)、gb病毒c(gbv-c;以前称为庚型肝炎病毒(hgv));轮状病毒科(如轮状病毒)以及它们的组合。在一个实施方式中,受试者感染hiv-1或hiv-2。
剂量和施用途径
根据疾病靶标的性质,本公开内容的多部分肽可以通过任何途径施用,包括但不限于任何各种如下途径:肠胃外、胃肠道、吸入和局部(表皮)施用途径。肠胃外施用通常包括注射或输注,并且包括例如静脉内、动脉内、瘤内、心内、肌肉内、囊内(例如,膀胱)、脑内、脑室内、骨内输注、玻璃体内、关节内、鞘内、硬膜外、皮内、皮下、透皮和腹膜内施用。胃肠道施用包括口服、口腔内、舌下和直肠施用。施用途径可涉及多部分肽的局部或全身递送。
作为一般建议,无论是通过一次施用还是多次施用,所施用的多部分肽的治疗有效量将处在约1ng/kg体重/天至约100mg/kg体重/天的范围内。在一个具体实施方式中,施用的多组肽的范围为约1ng/kg体重/天至约1μg/kg体重/天、1ng/kg体重/天至约100ng/kg体重/每天、1ng/kg体重/天至约10ng/kg体重/天、10ng/kg体重/天至约1μg/kg体重/天、10ng/kg体重/天至约100ng/kg体重/天、100ng/kg体重/天至约1μg/kg体重/天、100ng/kg体重/天至约10μg/kg体重/天、1μg/kg体重/天至约10μg/kg体重/天、1μg/kg体重/天至约100μg/kg体重/天、10μg/kg体重/天至约100μg/kg体重体重/天、10μg/kg体重/天至约1mg/kg体重/天、100μg/kg体重/天至约10mg/kg体重/天、1mg/kg体重/天至约100mg/kg体重/天和10mg/kg体重/天至约100mg/kg体重/天。
在其他一些实施方式中,多部分肽以如下剂量范围施用:每次注射1ng-10ng、每次注射10ng-100ng、每次注射100ng-1μg、每次注射1μg-10μg、每次注射10μg-100μg、每次注射100μg-1mg、每次注射1mg-10mg、每次注射10mg-100mg、每次注射100mg-1000mg。可以每天注射多部分肽,或每2、3、4、5、6和7天注射多部分肽。
在其他一些实施方式中,所施用的多部分肽的剂量范围为约1ng/kg至约100mg/kg。在另一个具体实施方式中,施用的抗体范围为约1ng/kg至约10ng/kg、约10ng/kg至约100ng/kg、约100ng/kg至约1μg/kg、约1μg/kg至约10μg/kg、约10μg/kg至约100μg/kg、约100μg/kg至约1mg/kg、约1mg/kg至约10mg/kg、约10mg/kg至约100mg/kg、约0.5mg/kg至约30mg/kg、和约1mg/kg至约15mg/kg。
在其他一些特定实施方式中,施用的多部分肽的量为或约为0.0006、0.001、0.003、0.006、0.01、0.03、0.06、0.1、0.3、0.6、1、3、6、10、30、60、100、300、600和1000毫克/天。
多部分肽的具体剂量由个体患者的特定情况决定,包括患者的大小、体重、年龄和性别、疾病的性质和阶段、疾病的侵袭性以及施用药学组合物的途径。
在某些实施方式中,多部分肽可以每天施用至少一次,通常每天施用一次、两次、三次或四次,并且在整个白天和晚上以相等的间隔给予剂量以维持药物的恒定存在从而提供足够的疗效。然而,技术人员应当理解的是,可以针对任何给定患者优化治疗方案,并且化合物的施用可以比每天一次更少地发生。
如本文所用的剂量单位形式包括适合作为待治疗受试者的单位剂量的物理上离散的单元;每个单元含有预定量的多部分肽,所述预定量经计算可与所需的药物载体一起产生所需的治疗效果。本发明的剂量单位形式的说明书由直接取决于多部分肽的独特特征和要实现的特定治疗效果决定。
本公开内容的多部分肽的毒性和治疗功效可以通过细胞培养物或实验动物中的标准药学程序来确定,例如,用于确定ld50(对50%的群体致死的剂量)和ed50(在50%的人口中有治疗效果的剂量)。毒性和治疗效果之间的剂量比是治疗指数,并且可以表示为ld50/ed50比。表现出大治疗指数的肽是优选的。虽然可以使用表现出毒副作用的肽,但应该注意设计出将这些肽靶向受影响组织部位的递送系统,以便使对非病变细胞的潜在损害最小化,从而减少副作用。
从细胞培养测定和动物研究获得的数据可用于配制用于人类的剂量范围。这些肽的剂量优选在包括ed50且几乎没有毒性或没有毒性的循环浓度范围内。剂量可以在该范围内变化,这取决于所用的剂型和所用的施用途径。对于本公开内容的方法中使用的任何肽,最初可以根据细胞培养测定估计治疗有效剂量。可以在动物模型中配制剂量以达到循环血浆浓度范围,该范围包括在细胞培养中测定的ic50(即,实现症状的半数最大抑制的测试化合物的浓度)。这些信息可用于更准确地确定人体中的有用剂量。药学组合物可以与施用说明书一起包括在容器、包装或分配器中。
当治疗癌症时,可以规定本公开内容的任何多部分肽与一种或多种其他抗癌剂组合服用。当在这种组合疗法中使用时,本公开内容的多部分肽和其他试剂可以在治疗期间通过相同或不同途径同时施用或在不同时间施用。特别地,多部分肽可以与如下物质组合施用:致死蛋白sirna,抗癌剂例如烷化剂;蒽环类抗生素;抗代谢物;解毒剂;干扰素;多克隆抗体或单克隆抗体;egfr抑制剂;her2抑制剂;组蛋白去乙酰化酶抑制剂;激素;有丝分裂抑制剂;磷脂酰肌醇-3-激酶(pi3k)抑制剂;akt抑制剂;哺乳动物雷帕霉素靶蛋白(mtor)抑制剂;蛋白酶体抑制剂;聚(adp-核糖)聚合酶(parp)抑制剂;ras/mapk途径抑制剂;中心体分裂剂;多激酶抑制剂;丝氨酸/苏氨酸激酶抑制剂;酪氨酸激酶抑制剂;vegf/vegfr抑制剂;紫杉烷或紫杉烷衍生物,芳香酶抑制剂,蒽环类,微管靶向药物,拓扑异构酶毒物,分子靶标或酶(如激酶或蛋白质甲基转移酶)的抑制剂,胞苷类似物和它们的组合。
在一些实施方式中,本公开内容的多部分肽与化学治疗剂(例如紫杉醇或顺铂)组合施用或同时施用。
同样地,当治疗感染性疾病时,可以规定将本公开内容的多部分肽与一种或多种抗病毒药物组合服用。在某些实施方式中,抗病毒药物是选自下组的抗逆转录病毒药物:蛋白酶抑制剂、核苷逆转录酶抑制剂、核苷酸逆转录酶抑制剂、非核苷逆转录酶抑制剂、整合酶抑制剂、进入抑制剂和成熟抑制剂。示例性抗病毒药物包括但不限于:阿巴卡韦、阿昔洛韦、阿德福韦、金刚烷胺、氨多索韦、安普那韦、抗蛋白酶、阿普力比、阿比朵尔、青蒿素、阿扎那韦、阿特里普拉、叠氮胸苷(azt)、贝伐马特、波普瑞韦、丁基化羟基甲苯(bht)、西多福韦(combivir)、卡贝兹(combivir)、地瑞那韦(darunavir)、地拉韦定(delavirdine)、地达诺新(didanosine)、阿德福韦酯(dipivoxil)、二十二烷醇、依度尿苷(edoxudine)、依法韦仑vefavirenz)、埃替拉韦(elvitegravir)、艾夫他滨(elvucitabine)、恩曲他滨(emtricitabine)、恩福维里肽(enfuviritide)、恩替卡韦(entecavir)、依曲韦林(etravirine)、泛昔洛韦、磷甲酸钠(foscarnet)、福沙那韦(fosamprenavir)、丙氧鸟苷(gancyclovir)、格娄博丹a(globoidnana)、gsk-572、hiv融合抑制剂、金丝桃素、伊巴里佐昔(ibalizumab)、脱氧碘尿核苷(idoxuridine)、衣努诺韦(immunovir)、英地那韦(indinavir)、干扰素(i型、ii型和iii型)、拉米夫定、勒西韦林(lersivirine)、伊普列韦、洛韦利、马拉维洛克、马瑞巴韦、mk-2048、莫利克森素(nov-205)、莫罗韦、奈尔芬纳韦、奈韦拉平、奈克斯韦、非核苷酸hivrt抑制剂、奥司他韦、聚乙二醇化干扰素(例如,聚乙二醇化干扰素-2a)、彭西洛韦(penciclovir)、潘昔洛韦(pencyclovir)、帕拉米韦(peramivir)、布列康纳利(pleconaryl)、鬼臼毒素(podophyllotoxin)、雷西韦(racivir)、雷特格拉韦(raltegravir)、雷基莫德(resquimod)、利巴韦林(ribavirin)、利福平(rifampin)、利比韦林(rilpivirine)、利曼替丁(rimantidine)、利托纳韦(ritonavir)、沙奎尼韦(saquinivir)、雄吡啶(stampidine)、斯塔夫定(stavudine)、塔里巴韦林(taribavirin)、替诺福韦(tenofovir)、替普兰纳韦(tipranavir)、三氟脲苷(trifluridine)、三噻韦(trizivir)、洛曼替丁(tromantidine)、特卢韦达(truvada)、瓦拉西洛韦(valaciclovir(valtrex))、瓦拉西洛韦(valacyclovir)、瓦兰西洛韦(valganciclovir)、维克里韦罗韦(vicriviroc)、维达拉宾(vidarabine)、维韦康(vivecon)、扎尔西塔宾(zalcitabine)、扎纳米韦(zanamivir(relenza))、齐多夫定(zidovudine),以及它们的组合。
治疗可以进行足以达到治疗效果的时间。通常,预期治疗将在疾病状态持续时无限期地继续,但如果药学组合物不再产生有益效果,则可指示停止。主治医生将根据患者的反应知道如何增加、减少或中断治疗。
多部分肽的制备
本发明的多部分肽可以化学合成或由用编码多部分肽的多核苷酸表达载体转化的细胞产生。可以使用传统的液相或固相合成来合成本公开内容的多部分肽。fmoc和t-boc固相肽合成(spps)可用于从羧基到氨基末端使肽生长。
在其他一些实施方式中,使用本领域技术人员熟知的重组dna技术合成多部分肽。可以设计多核苷酸表达载体以促进许多不同细胞宿主中的制备表达水平,所述宿主包括细菌、酵母、昆虫细胞和哺乳动物细胞。
在一个方面,本公开内容提供了用编码多部分肽的多核苷酸或表达载体转化的宿主细胞。宿主细胞可以是能够表达本文所述的多部分肽编码核酸或表达载体的任何细菌或真核细胞。
在另一个方面,根据本发明的制备多部分肽的方法包括在允许产生多部分肽的条件下培养用编码多部分肽的多核苷酸或表达载体转化的宿主细胞,并从所述细胞纯化多部分肽。可以通过培养瞬时或稳定表达多部分肽的细胞来产生所述肽;并从培养的细胞中纯化所述肽。可以使用任何能够产生功能肽的细胞。表达肽的细胞可以是原核或细菌来源的,例如大肠杆菌,或者它可以是真核或哺乳动物来源的,例如人细胞。在其他一些实施方式中,细胞是酵母细胞或昆虫细胞。当细胞是真核来源时,产生肽的细胞优选用多核苷酸稳定转化以表达所述肽。
通过以下实施例进一步说明本公开内容,这些实施例不应解释为限制性的。本申请通篇引用的所有参考文献、专利和公开的专利申请的内容以及附图和表格在此引入作为参考。
实施例1:材料和方法
1-1.细胞系、试剂和抗体。mcf-7细胞系,非侵入性雌激素受体阳性(er+)和mda-mb-231细胞系(er阴性)购自美国典型培养物保藏中心(americantypeculturecollection,atcc,manassas,va)。mcf-10a细胞系,非致瘤性上皮细胞系也购自atcc。3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑(mtt),具有高葡萄糖的dulbecco′s改良伊格培养基(eagle′smedium)(dmem)和fluorobritetm无酚红dmem,(mcf-7)购自thermofisherscientific(rockford,il)rpmi1640培养基(mda-mb-231细胞)获自生命技术公司(lifetechnologiescompany)(carlsbad,ca)。基础培养基mebm和添加剂megm(mcf-10a细胞)获自lonzal/cloneticscorporation(lonza,walkersville,md)。紫杉醇购自sellck-chemon(houston,tx)。顺铂购自emd/millipore(billerica,ma)。膜联蛋白v-fitc/piapopto和pi细胞周期试剂盒购自nexcelombioscience(lawrence,ma)。cd63兔多克隆抗体和alix山羊多克隆抗体购自santacruzbiotechnologyinc.(santacruz,ca)。peg-smrwt-clupeg-smrwt和peg-smrmuthiv-1nef肽购自innopepcompany(sandiego,ca)。
1-2.细胞培养。将细胞在上述培养基中培养,加入无外泌体的胎牛血清(systembiosciencesinc.,mountainview,ca)、100单位/ml青霉素和100mg/ml链霉素,并保持在37℃和5%co2的湿润气氛中。
1-3.生活力和增殖。将人乳腺癌细胞系接种到96孔板(5000个细胞/孔)中,并用各种浓度的smr肽(包括peg-smrwt-clu、peg-smrwt和peg-smrmut)处理24小时,以测定ic50(抑制浓度)。使用mtt测定法(moleculardevices,sunnyvale,ca)测定细胞增殖。用mtt单独处理的细胞和未处理的细胞进行对照实验,并在此基础上,24小时和48小时的温育时间用于肽处理细胞的mtt测定(stockertajc.等,2012和risstl.等,2015)。
1-4.细胞周期分析。将mcf-7和mda-mb-231乳腺癌细胞以每孔4×105个细胞培养到6孔板中,并用紫杉醇和顺铂各自处理或与peg-smrwt-clu肽组合处理24和48小时。使用碘化丙啶细胞周期测定进行细胞周期分析,并使用cellometer(nexcelom,ma)测量。用ic50浓度的smr进行进一步的实验;结果显示在mcf-7细胞上有1.12μmpeg-smrwt-clu,0.28μm的peg-smrwt,持续24小时,并且在mda-mb-231细胞上有0.28μm的peg-smrwt-clu,0.42μm的peg-smrwt,持续24小时,每个细胞时间两个阶段。将乳腺癌细胞以5×103个细胞/ml接种到96孔板中,并用1.6μm/ml紫杉醇或3mg/ml顺铂处理,或以1.12μm/mlpeg-smrwt-clu肽,smr肽与紫杉醇或顺铂(mcf-7细胞)进行处理。或者,对于mda-mb-231细胞,将1.6μm/ml紫杉醇或2mg/ml顺铂或0.28μm/mlpeg-smr-clu肽,或与这些药物中的每一种组合的肽。对于不同的细胞类型,顺铂和紫杉醇的浓度通过实验确定ic50剂量(数据未显示)。在24小时或48小时温育结束时,通过cellometry成像细胞计数测定法评估细胞。
所有上述步骤独立地在mcf-7和mda-mb-231细胞上进行。为了进一步了解这种肽是否与化学治疗药物协同作用,6组癌细胞处理如下:1)未处理,2)peg-smrwt-clu,3)紫杉醇,4)紫杉醇与peg-smrwt-clu的组合,5)顺铂,6)顺铂与peg-smrwt-clu组合。
1-5.评估细胞凋亡。将乳腺癌细胞以每孔4×105个细胞接种到6孔板中,并用紫杉醇或顺铂或各种浓度的smr肽处理24小时或不同的时间点。smr如上所述。使用annexinv-fitc检测试剂盒(nexcelom,ma)测定细胞凋亡,并通过cellometer成像细胞计量可视化。
1-6.外泌体分离和纯化。如前所述(alisa。等人,2010)通过差速离心从乳腺癌细胞中分离外泌体。未处理的肿瘤细胞用作对照。简而言之,将上述处理和未处理的细胞上清液以400×g离心10分钟。将上清液转移到透明管中并以10,000xg离心30分钟。将来自第二次旋转的上清液以200,000×g超速离心2小时以沉淀外泌体。最后,用pbs重悬外泌体沉淀,并在4℃下储存直至用于分析。
7-7.通过乙酰胆碱酯酶(ache)测定的外泌体表征。如所述那样(ellman等,1961),通过测量ache来定量纯化的外泌体。简言之,制备100mm二硫代硝基苯甲酸(dtnb)溶液用作颜色指示剂母液,并制备在pbs溶液中的28.9mg/ml乙酰硫代胆碱碘化物作为基质母液。基质母液基质可以在-20℃下储存最长达一个月,而颜色指示剂可以在4℃下储存两周。通过将10mlpbs与200μl底物和500μldtnb混合制备工作溶液。将50μl的每种外泌体样品转移到96孔微量滴定板中,并使用ache从0.98mu/ml至2000mu/ml制备标准曲线。将50μl标准品加入分开的孔中后,向所有孔中加入200μl工作溶液。温育20分钟后,使用spectromaxm5荧光计在450nm下测量ache活性。
1-8.外泌体纳米粒子跟踪分析(nta)。使用具有nta23的nanosightlm10(nanosightltd.,mintonpark,uk)进行外泌体的绝对尺寸分布的分析。基于布朗运动和扩散系数自动跟踪和确定粒子的尺寸。分离后,将未处理和处理的乳腺癌外泌体重悬于0.5mlpbs中。对照培养基和过滤的pbs用作该技术中的对照。nta测量条件为:温度=21.0+/-0.5℃;粘度=0.99+/-0.01cp,每秒帧数=25,测量时间=30s。所有样品的检测阈值相似。每个样品记录两次。
1-9.western印迹分析。如上所述,从培养上清液中分离外泌体。通过测量280nm处的吸光度来确定蛋白质浓度(nanodrop2000)。通过在95℃加热15分钟,在sds-page样品缓冲液中使蛋白质样品变性。使用标准tgx预制凝胶(4-20%bio-rad,richmond,ca)分离蛋白质并如前所述进行印迹(huangmb.等,2004)。将印迹与一抗、抗cd63和抗-alix一起温育,然后与山羊或兔抗ig二抗一起温育。使用ecl化学发光底物(santacruzbiotechnology,santacruz,ca)检测特异性条带,并在imagequantlas4000成像系统(gehealthcare,piscataway,nj08854)上可视化。
1-10.荧光n-rh-pe测量。荧光磷脂类似物n-rh-pe[n-(丽丝胺罗丹明b磺酰基)磷脂酰乙醇胺]是如前所述的外泌体和多泡体的腔内囊泡的脂质标记物(willemj等,1990)。简而言之,将10mm的n-rh-pe储存在氯仿/甲醇(2:1)中。然后将在预冷却的反应介质中的5μm的n-rh-pe溶液加入用sirna-negative或sirna-hspa9转染的处理过的mcf-7乳腺癌细胞,然后在4℃温育1小时。在该温育期后,除去培养基并用冷培养基充分洗涤细胞以除去过量的未结合的脂质。将标记的细胞在含有10%的外泌体耗尽的fbs培养基,在37℃灭活的完全rpmi-1640中培养过夜。使用光谱仪分别在550nm和590nm激发和发射波长对所收集的上清液/外泌体中的n-rh-pe进行测量。
1-11.用致死蛋白抗体转染。使用chariot试剂盒(activemotif,carlsbad,ca)根据制造商的程序用致死蛋白抗体转染mcf-7乳腺癌细胞。温育这些细胞48小时后,分离外泌体并通过ache测定和nanosight分析进行测量。
1-12.用小干扰rna(sirna)瞬时转染。使用amaxa的nucleofector试剂盒(lonzawalkersvilleinc.,walkersville,md)根据制造商的程序用双链sirna转染mcf-7乳腺癌细胞。如供应商所推荐的那样,使用amaxabiosystemsnucleofectorii进行质粒转染。如前所述制备致死蛋白sirna(sheltonmn等,2012)。转染后,将细胞在37℃下温育24、48、72和96小时,分离外泌体并通过ache测定和western印迹测量。
1-13.统计分析。数据表示为平均值±标准偏差(s.d.)。假设方差相等的双样本t-检验用于比较每组中对照和处理样品之间的差异。p≤0.05的值被认为具有统计学上的显著性。
实施例2:smr肽抑制乳腺癌细胞的细胞生长
用递增浓度(35nm/ml、70nm/ml、140nm/ml、280nm/ml、560nm/ml和1120nm/ml)的peg-smrwt-clu肽与peg-smrwt或peg-smrmut肽组合处理乳腺癌细胞24小时作为对照。含有smrwt序列的两种肽都以剂量依赖性方式抑制乳腺癌细胞生长(图1)。对于mcf-7细胞,用1.12μm/ml的peg-smrwt-clu和0.28μm/ml的peg-smrwt观察到50%的抑制。对于mda-mb-231细胞,用0.28μm/ml的peg-smrwt-clu和0.42μm/ml的peg-smrwt实现50%的抑制。peg-smrmut肽不抑制增殖。
实施例3:smrwt肽诱导乳腺癌细胞中的细胞周期停滞
数据表明,在48小时测定,peg-smrwt-clu肽在mcf-7细胞和mda-mb-231细胞中诱导细胞周期停滞(图2)。当细胞用peg-smrwt-clu肽或所述肽与紫杉醇或顺铂联合处理时,它们在g2/m期被阻断,表明peg-smrwt-clu肽有助于诱导乳腺癌细胞中的g2/m期阻滞。
实施例4:smrwt肽增加mcf-7乳腺癌细胞中乳腺癌细胞对顺铂和紫杉醇的敏感性
在单独的实验中,mcf-7和mda-mb-231细胞用peg-smrwt-clu或peg-smrmut-clu单独处理,或者与紫杉醇或顺铂进一步组合处理,然后通过annexinv-fitc/pi测定法测定细胞凋亡。在与紫杉醇和顺铂一起温育48小时后,这两种细胞系相对于未修饰的对照肽显示出增加的细胞凋亡(图3)。有趣的是,peg-smrwt-clu肽增加了mcf-7细胞中药物诱导的细胞凋亡水平,但在mda-mb-231细胞中却没有诱导。
实施例5:smr肽阻断乳腺癌细胞中的外泌体释放
进行乙酰胆碱酯酶(ache)测定、nanosight分析和western印迹分析以表征用各种肽处理48小时的mcf-7和mda-mb-231人乳腺癌细胞释放的外泌体。结果表明smrwt肽抑制外泌体释放。
测定外泌体中的ache活性,该分析的结果示于图4的图a和图b中。在mcf-7细胞中,发现对照外泌体含有113.49mu/ml的ache活性。相反,在用peg-smrwt-clu肽处理的细胞中,发现41.95mu/ml的活性;在用peg-smrwt-clu与紫杉醇组合处理的细胞中发现51.87mu/ml活性;在用peg-smrwt-clu与顺铂组合处理的细胞中发现16.95mu/ml的活性(图4的图a)。在mda-mb-231细胞中,对照外泌体含有118.48mu/ml的ache活性,而在用peg-smrwt-clu肽处理的细胞中发现66.77mu/ml活性;在用peg-smrwt-clu肽与紫杉醇组合处理的细胞中发现64.15mu/ml活性;在用peg-smrwt-clu与顺铂组合处理的细胞中发现27.0mu/ml活性(图4的图b)。
通过nanosightlm10纳米颗粒追踪分析(nanosightlm10nanoparticletrackinganalysis,nta)测定法进行外泌体浓度和尺寸分布分析。使用nta,可以根据布朗运动和相关的扩散系数自动跟踪和确定粒子尺寸。在通过nta分析样品之前,确定来自pbs的盐聚集体对背景没有影响并且设备没有污染物颗粒。未处理的mcf-7细胞对照培养基显示相当数量的颗粒(5.16×109个颗粒/ml)(图4的图c)。然而,在用peg-smrwt-clu处理(3.28×108颗粒/ml,p<2.40e-06)、在用peg-smrwt-clu与紫杉醇组合处理(5.7×108颗粒/ml,p<0.0008)和在用peg-smrwt-clu与顺铂组合处理(3.77×108个颗粒/ml,p<0.0001)的mcf-7细胞中发现数量减少的颗粒(图4c)。
类似地,尽管来自mda-mb-231培养物的对照培养基也显示出相当数量的颗粒(4.7×109个颗粒/ml),但在用peg-smrwt-clu肽处理(6.8×108颗粒/ml,p<3.96e-05)、用peg-smrwt-clu肽与紫杉醇组合处理(7.5×108颗粒/ml,p<0.001)和用peg-smrwt-clu肽与顺铂组合处理(3.06×108个颗粒/ml,p<5.37e-05)(图4的图d)的mda-mb-231细胞中发现了减少数量的颗粒。通过nta分析,在两种乳腺癌细胞系中,外泌体的尺寸估计在30至47nm的范围。
最后,使用western印迹分析检测对照培养物和肽处理培养物中的外泌体蛋白。该分析的结果揭示,在从mcf-7细胞(图5)和mda-mb-231细胞(图6)分离的所有外泌体中存在人cd63和alix标记物。对照外泌体显示来自mcf-7细胞的人cd63的更高表达和来自mda-mb-231细胞的alix的更高表达。
实施例6:smr-致死蛋白相互作用的阻断阻断了乳腺癌细胞中的外泌体释放
先前的研究鉴定了hsp70家族蛋白,致死蛋白(由hspa9编码)作为hiv-1nefsmr的结合配偶体,并且显示hiv-1nefsmr-致死蛋白结合的破坏干扰了外泌体释放(sheltonmn.等,2012)。为了测试类似的相互作用是否负责所观察到的peg-smrwt-clu对来自乳腺癌细胞的外泌体释放的影响,用抗致死蛋白的抗体或抗α-微管蛋白的抗体(作为对照)转染mcf-7细胞。通过ache测定法测量,发现抗致死蛋白处理细胞在外泌体释放中显著受损(图7的图a),并且当通过nta测定法测量时略低(图7的图b)。抗致死蛋白处理的效果类似于用peg-smrwt-clu肽处理mcf-7细胞的效果。
为了进一步验证这种致死蛋白介导的过程在癌细胞中的重要性,通过用表达致死蛋白sirna的质粒构建体转染mcf-7细胞来敲低致死蛋白的表达。发现致死蛋白sirna阻断外泌体分泌,如通过ache测定法和膜荧光(n-rh-pe)测定法在所测试的所有时间点(图8的图a和图8的图b)且在没有任何细胞毒性(图8的图c)所证实的那样。通过western印迹分析,进一步测定来自sirna转染细胞的外泌体的致死蛋白和外泌体标记物cd63(四跨膜蛋白)的表达。该分析的结果显示,从第48小时一直到96小时,致死蛋白和cd63的表达均显著降低(图8的图d和图8的图e)。
以上描述的目的是为了教导本领域普通技术人员如何实施本公开内容,并且不是要在详细描述对阅读了本说明书后的技术人员显而易见的所有那些明显的修改和变化。然而,所有这些明显的修改和变化都要包括在本实施方式的范围内,所述范围由所附权利要求限定。除非上下文有明确相反的指示,否则权利要求旨在以任何有效实现预期目标的顺序覆盖所要求保护的组件和步骤。
序列表
<110>文森特·c·邦德
詹姆斯·w·利拉德
黄明博
<120>用于通过抑制外泌体释放来治疗疾病的组合物和方法
<130>263364
<160>34
<170>patentinversion3.5
<210>1
<211>5
<212>prt
<213>人工序列
<220>
<223>合成
<400>1
valglypheproval
15
<210>2
<211>12
<212>prt
<213>人工序列
<220>
<223>合成
<400>2
valglypheprovalalaalavalglypheproval
1510
<210>3
<211>12
<212>prt
<213>人工序列
<220>
<223>合成
<400>3
hisproleuserlyshisprotyrtrpserglnpro
1510
<210>4
<211>12
<212>prt
<213>人工序列
<220>
<223>合成
<400>4
asnthrtyrtrpserglnleuleuhispheglnthr
1510
<210>5
<211>12
<212>prt
<213>人工序列
<220>
<223>合成
<400>5
serhisalaleuproleuthrtrpserthralaala
1510
<210>6
<211>24
<212>prt
<213>人工序列
<220>
<223>合成
<400>6
valglypheprovalalaalavalglypheprovalhisproleuser
151015
lyshisprotyrtrpserglnpro
20
<210>7
<211>26
<212>prt
<213>人工序列
<220>
<223>合成
<400>7
valglypheprovalalaalavalglypheprovalalaalahispro
151015
leuserlyshisprotyrtrpserglnpro
2025
<210>8
<211>40
<212>prt
<213>人工序列
<220>
<223>合成
<400>8
valglypheprovalalaalavalglypheprovalalaalahispro
151015
leuserlyshisprotyrtrpserglnproalaalahisproleuser
202530
lyshisprotyrtrpserglnpro
3540
<210>9
<211>29
<212>prt
<213>人工序列
<220>
<223>合成
<400>9
metservalleuthrproleuleuleuargglyleuthrglyserala
151015
argargleuprovalproargalalysilehisserleu
2025
<210>10
<211>33
<212>prt
<213>人工序列
<220>
<223>合成
<400>10
metleuserasnleuargileleuleuasnlysalaalaleuarglys
151015
alahisthrsermetvalargasnpheargtyrglylysprovalgln
202530
cys
<210>11
<211>18
<212>prt
<213>人工序列
<220>
<223>合成
<400>11
metleuserleuargglnserileargphephelysproalathrarg
151015
thrleu
<210>12
<211>16
<212>prt
<213>人工序列
<220>
<223>合成
<400>12
argglnilelysiletrppheglnasnargargmetlystrplyslys
151015
<210>13
<211>34
<212>prt
<213>人工序列
<220>
<223>合成
<400>13
metphesertyrleuproargtyrproleuargalaalaseralaarg
151015
alaleuvalargalathrargprosertyrargseralaleuleuarg
202530
tyrgln
<210>14
<211>20
<212>prt
<213>人工序列
<220>
<223>合成
<400>14
metalaalatrpmetargserleupheserproleulyslysleutrp
151015
ileargmethis
20
<210>15
<211>13
<212>prt
<213>人工序列
<220>
<223>合成
<400>15
metlysleuleutrpargleuileleuserarglystrp
1510
<210>16
<211>14
<212>prt
<213>人工序列
<220>
<223>合成
<400>16
mettrptrpargargserargthrasnserleuargtyrthr
1510
<210>17
<211>16
<212>prt
<213>人工序列
<220>
<223>合成
<400>17
metleupheargleuargargservalargleuargglyleuleuala
151015
<210>18
<211>20
<212>prt
<213>人工序列
<220>
<223>合成
<400>18
mettrpthrleuglyargargalavalalaglyleuleualaserpro
151015
serproalagln
20
<210>19
<211>20
<212>prt
<213>人工序列
<220>
<223>合成
<400>19
argargilevalvalleuhisglytyrglyalavallysgluvalleu
151015
leuasnhislys
20
<210>20
<211>22
<212>prt
<213>人工序列
<220>
<223>合成
<400>20
metleuserleuargglnaspileargphephelysproalathrarg
151015
thrleucysserserarg
20
<210>21
<211>8
<212>prt
<213>人工序列
<220>
<223>合成
<400>21
argproleualaleutrpargser
15
<210>22
<211>8
<212>prt
<213>人工序列
<220>
<223>合成
<400>22
gluserproalatyrtyrthrala
15
<210>23
<211>6
<212>prt
<213>人工序列
<220>
<223>合成
<400>23
aspproargserpheleu
15
<210>24
<211>6
<212>prt
<213>人工序列
<220>
<223>合成
<400>24
proproargserpheleu
15
<210>25
<211>6
<212>prt
<213>人工序列
<220>
<223>合成
<400>25
argleuglnleulysleu
15
<210>26
<211>5
<212>prt
<213>人工序列
<220>
<223>合成
<220>
<221>mod_res
<222>(5)..(5)
<223>乙酰化作用
<400>26
argleuglnleulys
15
<210>27
<211>4
<212>prt
<213>人工序列
<220>
<223>合成
<220>
<221>新的或少见的特征
<222>(2)..(3)
<223>xaa可以是任何自然存在的氨基酸
<400>27
argxaaxaaarg
1
<210>28
<211>4
<212>prt
<213>人工序列
<220>
<223>合成
<220>
<221>新的或少见的特征
<222>(2)..(2)
<223>xaa可以是任何自然存在的氨基酸
<220>
<221>新的或少见的特征
<222>(3)..(3)
<223>xaa是lys或arg
<400>28
argxaaxaaarg
1
<210>29
<211>4
<212>prt
<213>人工序列
<220>
<223>合成
<220>
<221>新的或少见的特征
<222>(2)..(2)
<223>xaa是glu或asp
<400>29
ilexaaglyarg
1
<210>30
<211>6
<212>prt
<213>人工序列
<220>
<223>合成
<400>30
leuvalproargglyser
15
<210>31
<211>13
<212>dna
<213>人工序列
<220>
<223>合成
<400>31
ccgccaagaagcg13
<210>32
<211>100
<212>dna
<213>人工序列
<220>
<223>合成
<400>32
gcgtgcacacgcgcgtagacttcccccgcaagtcactcgttagcccgccaagaagcgacc60
cctccggggcgagctgagcggcgtggcgcgggggcgtcat100
<210>33
<211>101
<212>dna
<213>人工序列
<220>
<223>合成
<400>33
acgtgcatacgcacgtagacattccccgcttcccactccaaagtccgccaagaagcgtat60
cccgctgagcggcgtggcgcgggggcgtcatccgtcagctc101
<210>34
<211>58
<212>dna
<213>人工序列
<220>
<223>合成
<400>34
acttcccccgcaagtcactcgttagcccgccaagaagcgacccctccggggcgagctg58
- 还没有人留言评论。精彩留言会获得点赞!