一种含有钠‑葡萄糖协同转运蛋白2抑制剂的药物组合物的制作方法
本发明属于药物制剂领域,具体涉及一种含有1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖和至少一种药学上可接受的载体、赋形剂或稀释剂,该药物组合物具有溶出迅速、稳定性良好的特点。
背景技术:
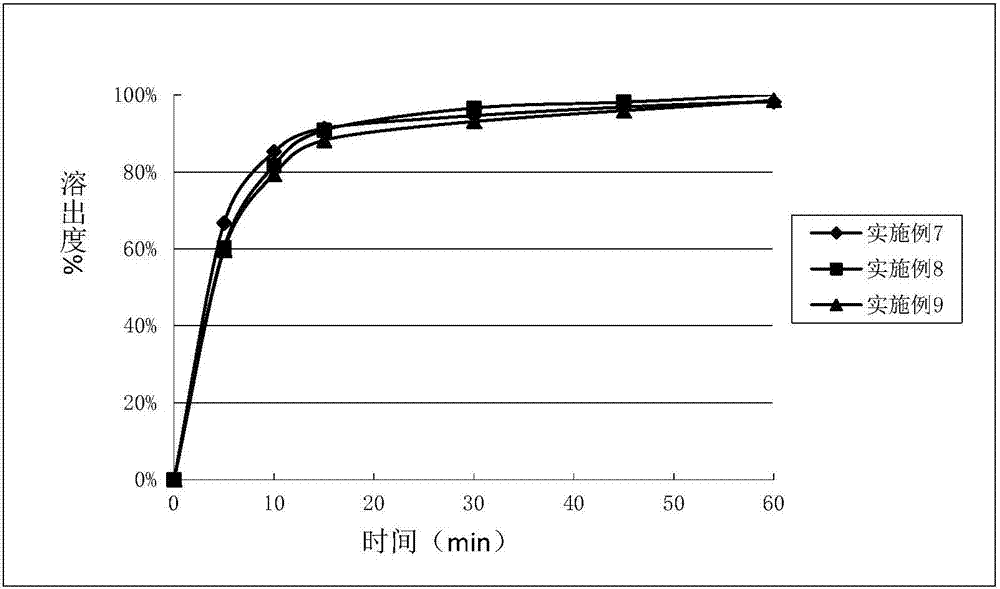
:随着社会经济的发展和物质生活水平的提高,全球范围内糖尿病患者急剧增长,糖尿病通常分为ⅰ型糖尿病和ⅱ型糖尿病两种,其中90%以上为ⅱ型糖尿病。已上市的糖尿病药物的种类很多,但迄今为止,还没有哪种药物能够凭一己之力将ⅱ型糖尿病患者的血糖水平长期保持在目标范围之内。近年来对糖尿病发病机制的深入研究,为ⅱ型糖尿病的治疗提供了越来越多的途径,而钠-葡萄糖协同转运蛋白2(sodium-glucosetransporter2,sglt-2)抑制剂的发现,为糖尿病的治疗提供了又一新的思路。sglt-2抑制剂的治疗机制是通过选择性抑制sglt-2的活性来降低血糖。选择sglt-2作为靶点,一方面是因为它对葡萄糖的绝对重吸收作用,另一方面是因为它仅表达于肾脏。目前的研究还发现,sglt-2的作用机制不依赖于β细胞的功能异常或胰岛素抵抗的程度,其效果也不会随着β细胞功能的衰竭或严重胰岛素抵抗而下降。因此,有理由认为sglt-2抑制剂用于当前ⅱ型糖尿病的治疗具有良好的前景。cn102482290b公开了一种新的sglt-2抑制剂1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖化合物(式i),该化合物表现出了优异的sglt-2蛋白抑制效果和降糖作用。pct/cn2015/089128记载了1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖l-脯氨酸复合物(式ii)及其一水合物,该复合物的一水合物能够以结晶形式存在。该复合物具有优异的化学稳定性,利于制成药物制剂。在制备该药物的组合物的过程中我们发现,由于原料药属于糖类化合物,本身性质较黏,遇水后易成团。cn104017031a公开了含有1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖l-脯氨酸与硬脂酸或其盐的药物组合物。其说明书中记载当稀释剂或填充剂使用糖醇(该糖醇选自:甘露醇、乳糖、或其组合)时可以有益地克服药片溶出时的胶凝现象,溶出效果好,而使用预胶化淀粉等其他填充剂的药片溶出时则会出现严重凝胶的现象。技术实现要素:本发明的目的在于提供一种溶出迅速且完全的药物组合物,并且该药物组合物制备工艺简单,可操作性强。本发明提供的药物组合物包括1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖或其与氨基酸形成的复合物,还包含预胶化淀粉。其中1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖的含量为0.35-80mg,优选0.5-70mg,其与预胶化淀粉的重量比可为1:0.5-100。进一步地,所述氨基酸优选l-脯氨酸,所形成的复合物可以以一水合物形式存在。所述一水合物可以是结晶形式,使用cu-ka辐射,得到以2θ角度和晶面间距表示的x-射线粉末衍射图谱,所述结晶具有如图5所示的x-射线粉末衍射图谱,其中在约5.41,7.69,10.22,12.04,12.46,14.42,17.30,18.79,19.38,20.24,22.73,24.58,27.55,28.82和31.03处有特征峰。本发明人意外地发现,由于预胶化淀粉易分散,混悬性能较好,有利于药物制剂的制备;采用预胶化淀粉为填充剂制备的制剂的溶出迅速且完全,有利于药物进入体内迅速起效,发挥药效。而采用常规的填充剂,如甘露醇、乳糖制备的片剂溶出效果不如预胶化淀粉。本发明提供的药物组合物可以含有粘合剂、崩解剂及润滑剂中的一种或多种。其中粘合剂包括但不限于交联聚乙烯吡咯烷酮、羟丙基甲基纤维素及羟丙基纤维素中的一种或多种。基于组合物的总重量,所述粘合剂的含量可为1%~10%。崩解剂包括但不限于交联羧甲基纤维素钠、羧甲基淀粉钠及交联聚维酮中的一种或多种。基于组合物的总重量,所述崩解剂含量可为1%~20%。润滑剂包括但不限于滑石粉、硬脂酸镁、硬脂酸锌、山嵛酸甘油酯、月桂基硫酸钠、氢化植物油、胶体二氧化硅中的一种或多种。基于组合物的总重量,润滑剂的含量可为0.5%~5%。本发明还提供了一种药物组合物,其以单位剂量片剂或胶囊形式包括:1)1-40wt%的1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖l-脯氨酸一水合物;2)30-70wt%的预胶化淀粉;3)1-12wt%的崩解剂,所述崩解剂选自交联羧甲基纤维素钠、羧甲基淀粉钠及交联聚维酮中的一种或多种;4)1-8wt%的粘合剂,所述粘合剂选自交联聚乙烯吡咯烷酮、羟丙基甲基纤维素及羟丙基纤维素中的一种或多种;5)0.5-5wt%的润滑剂,所述润滑剂选自硬脂酸镁和滑石粉的一种或多种;以及6)任选10-40wt%的微晶纤维素。将本发明的药物组合物进行溶出测试,根据中国药典2010版二部附录溶出度测定第二法(桨法),使用0.1mol/l盐酸溶液作为溶出介质,对于本发明药物组合物的单位剂量,所述溶出介质优选为900ml,并在37±0.5℃下以50rpm的桨速进行溶出,实验测得1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖在60分钟内的溶出度可达到92%以上,优选93%以上,更优选94%以上,最优选95以上。本发明的药物组合物具有优异的sglt-2蛋白抑制效果,可用于与钠-葡萄糖协同转运蛋白2有关的疾病,特别是糖尿病的治疗。本发明的药物组合物可以采用本领域常见的方法制备,包括将1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖或其与氨基酸形成的复合物、预胶化淀粉以及至少一种药学上可接受的赋形剂混合,制粒。制粒方法例如高剪切湿法制粒或一步制粒方法制备药物组合物颗粒。其后可制成片剂或胶囊剂等口服固体制剂。附图说明图1显示实施例1至6的片剂在0.1mol/l盐酸溶液中的溶出曲线。图2显示实施例7至9的片剂在0.1mol/l盐酸溶液中的溶出曲线。图3显示实施例10至12的片剂在0.1mol/l盐酸溶液中的溶出曲线。图4显示实施例13至15的片剂在0.1mol/l盐酸溶液中的溶出曲线。图5显示1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖l-脯氨酸一水合物结晶的x-射线粉末衍射图谱。具体实施方式通过以下实施例和实验例进一步详细说明本发明。这些实施例和实验例仅用于说明性目的,而并不用于限制本发明的范围。实验所用的测试仪器:x-射线衍射谱仪器型号:brukerd8focusx-射线粉末衍射仪射线:单色cu-kα射线(λ=1.5406)扫描方式:θ/2θ,扫描范围:2-40o电压:40kv,电流:40ma下述实施例中以复合物a代替1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖l-脯氨酸一水合物。实施例1至6将复合物a、甘露醇、乳糖、预胶化淀粉、微晶纤维素、交联羧甲基纤维素钠,按表1中的比例混合均匀,以10%的交联聚乙烯吡咯烷酮水溶液为润湿剂进行湿法制粒,压片,制备片剂。表1成分实施例1实施例2实施例3实施例4实施例5实施例6复合物a1.251560185050甘露醇———95.5272.64—乳糖—————77.55预胶化淀粉53.3997.4865.6———微晶纤维素2648.832.047.7635.030.0ccna3.67.210.87.210.810.8pvpk304.869.729.89.729.769.85纯化水43.7487.4888.287.4887.8488.65硬脂酸镁0.91.81.81.81.81.8总计90180180180180180单位:mg实施例7~9以表2的处方比例,将复合物a、预胶化淀粉、微晶纤维素、羧甲基淀粉钠混合均匀,分别以10%的聚乙烯吡咯烷酮、10%的羟丙基纤维素和4%羟丙基甲基纤维素的水溶液为润湿剂,进行湿法制粒,压片,制备实施例7~9的片剂。表2成分实施例7实施例8实施例9复合物a202020预胶化淀粉91.8692.1995.9微晶纤维素46.046.048.0羧甲基淀粉钠10.810.810.8pvpk309.54——hpc—9.21—hpmce5——3.5纯化水85.8682.8984.0硬脂酸镁1.81.81.8总计180180180单位:mg实施例10~12以表3的处方比例,将复合物a、预胶化淀粉、微晶纤维素、交联聚维酮混合均匀,分别以10%的交联聚乙烯吡咯烷酮、10%的羟丙纤维素为润湿剂,进行湿法制粒,压片,制备实施例10~12的片剂。表3成分实施例10实施例11实施例12复合物a2.52070预胶化淀粉51.591.9663.08微晶纤维素25.745.925交联聚维酮5.410.810.8pvpk304.86——hpc—9.549.32纯化水43.7485.8683.88滑石粉0.91.81.8总计90180180单位:mg实施例13~15以表4的处方比例,将复合物a、预胶化淀粉、微晶纤维素、羧甲基淀粉钠混合均匀,以10%的hpc水溶液为润湿剂,进行湿法制粒,压片,制备实施例13~15的片剂。表4成分实施例13实施例14实施例15复合物a1.25530预胶化淀粉51.9349.4885.17微晶纤维素26.024.742.5羧甲基淀粉钠5.45.410.8hpc4.524.529.73纯化水40.6840.6887.57硬脂酸镁0.90.91.8总计9090180单位:mg实施例16:复合物a的制备取(1.0g,2.2mmol)1,6-脱水-1-c-{4-氯-3-[(3-氟-4-乙氧苯基)甲基]苯基}-5-c-(羟甲基)-β-l-艾杜吡喃糖(按wo2012019496公开的方法制备),于7.20g乙醇中,加毕,搅拌溶解。常温下加入l-脯氨酸(0.2786g,2.42mmol,1.1eq),加毕,搅拌下升温回流反应10min,使反应液溶清,趁热过滤,滤液搅拌降至室温,有大量白色固体析出,放置过夜,过滤,干燥,得到复合物a的白色结晶固体1.14g,收率88%。该结晶样品的x-射线衍射谱图见图5。该结晶在约5.41,7.69,10.22,12.04,12.46,14.42,17.30,18.79,19.38,20.24,22.73,24.58,27.55,28.82和31.03处有特征峰。实验例1:溶出实验根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例1~15的片剂进行溶出度测定。使用900ml的0.1mol/l盐酸溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。溶出曲线图见图1、图2、图3和图4。溶出度结果见表5、表6、表7和表8。表5实施例1-6中不同处方的溶出度结果实施例1-3采用预胶化淀粉为填充剂,即使原料药含量较大,也能保证制备的片剂溶出迅速且完全,实施例4-5采用甘露醇为填充剂,制备的片剂溶出不完全,实施例6采用乳糖为填充剂,制备的片剂同样溶出不完全。表6实施例7-9中不同处方的溶出度结果表7实施例10-12中不同处方的溶出度结果表8实施例13-15中不同处方的溶出度结果实施例1~15的结果表明,采用预胶化淀粉为填充剂时,即使原料药含量较大,也能保证制备的片剂溶出迅速且完全;而采用常规的填充剂甘露醇、乳糖,不能起到这样的效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1