一种分子影像纳米颗粒探针及其制备与应用的制作方法
本发明属于核医学分子影像探针领域,具体涉及一种分子影像纳米颗粒探针及其制备与应用。
背景技术:
分子影像技术由于其灵敏性,无创等特点,在生物医学研究和临床诊断方面得到了越来越广泛的应用,特别是正电子发射断层扫描(PET)技术具有很高的活体成像灵敏度,已经广泛用于临床诊断。目前临床PET显像使用的探针主要是基于组织/细胞葡萄糖代谢的F18标记的葡萄糖类似物:F18-FDG。但F18-FDG不具有分子特异性,只能用于基于葡萄糖代谢的功能显像,而不能用于特定分子事件如蛋白或药物的检测与示踪等。目前在核素探针制备方面,主要是通过将正电子核素F18(半衰期109分钟)通过共价键连接到探针分子上,反应步骤多、条件苛刻、时间长、产率低、分离纯化困难等问题,严重限制了F18标记探针的发展和应用。因此,发展具有特异性、灵敏度高、易标记、高产率、易分离的F18标记分子影像探针具有非常重要的意义。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供一种分子影像纳米颗粒探针及其制备与应用。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明的第一方面,提供一种分子影像纳米颗粒探针,其基础纳米颗粒为稀土纳米颗粒。
优选地,所述稀土纳米颗粒,为含一种或多种稀土元素掺杂的纳米颗粒。
优选地,所述稀土元素选自镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)、钪(Sc)或钇(Y)。
优选地,所述稀土纳米颗粒为含一种或多种稀土元素掺杂的氟化物颗粒、氧化物颗粒、复合氧化物颗粒、氢氧化物颗粒、硫化物颗粒、碳酸化合物颗粒、磷酸化合物颗粒、钛酸化合物颗粒、硼酸化合物颗粒、钒酸化合物颗粒、钨酸化合物颗粒、复合阳离子化合物或复合阴离子化合物颗粒。
优选地,所述稀土纳米颗粒为含一种或多种稀土元素掺杂的氟化物颗粒。
优选地,所述稀土纳米颗粒选自REF3、MREF4或REOF,其中,RE是指三价稀土元素,M选自碱金属元素Li,Na或K。
进一步优选地,所述稀土纳米颗粒为NaGdF4纳米颗粒。
优选地,所述基础纳米颗粒表面修饰有分子识别基团,使其获得主动靶向待示踪对象的能力。所述基础纳米颗粒表面修饰的分子识别基团与待示踪对象表面修饰的分子识别基团组成分子识别对。
优选地,所述分子识别对选自抗体-抗原、配体-受体、蛋白质-底物、蛋白质-抑制剂、蛋白质/多肽-蛋白质/多肽、核酸适配体-蛋白、互补寡核昔酸对、生物正交反应基团和包合物/络合物。
本发明的一些实施方式中列举了所述分子识别对为四嗪与反式环辛烯。亦即,基础纳米颗粒表面修饰有分子识别基团四嗪,从而赋予了分子影像纳米颗粒探针主动靶向修饰有反式环辛烯的待示踪对象的能力。
优选地,所述分子影像纳米颗粒探针标记有正电子核素,使其可用于PET显像。本发明的一些实施方式中列举了所述正电子核素为F18。亦即,在基础纳米颗粒上标记正电子核素F18,形成可用于PET成像的分子影像纳米颗粒探针。
优选地,所述分子影像纳米颗粒探针的粒径范围是1~10nm。本发明的一些实施方式中列举了所述分子影像纳米颗粒探针的粒径为≤4nm。
本发明的第二方面,提供了前述分子影像纳米颗粒探针的制备方法,包括步骤:
(1)制备基础颗粒;(2)将步骤(1)所得基础纳米颗粒进行分子识别基团修饰;(3)将步骤(2)所得修饰有分子识别基团的基础纳米颗粒,继续进行正电子核素标记。
本发明的一些实施方式中,列举了所述基础颗粒为稀土纳米颗粒-NaGdF4纳米颗粒,步骤(1)中,采用溶剂热法制备基础颗粒-NaGdF4纳米颗粒,具体包括步骤:1)将稀土元素钆离子盐、油酸和十八烯在真空下加热形成透明溶液,待冷却到室温后加入含有NaOH和NH4F的甲醇溶液,室温搅拌反应,加热移除甲醇,用乙醇洗涤离心,收集沉淀,分散于环己烷中,获得油相稀土NaGdF4纳米粒子;2)将步骤(1)获得的油相稀土NaGdF4纳米粒子,加入二氯甲烷和三氯过氧苯甲酸,搅拌反应,加入L-半胱氨酸,继续搅拌反应,用得到的溶液用乙醇离心收集沉淀,洗涤沉淀后真空干燥得到水相稀土NaGdF4纳米粒子。
步骤1)中,稀土元素钆离子盐可以是稀土钆的氯化物,例如氯化钆六水合物:分子式为H12Cl3GdO6;分子量为371.7936;CAS号为13450-84-5;氯化钆:分子式为Cl3Gd;分子量为263.61;CAS号为10138-52-0。
相应地,步骤(2)中,采用点击化学(Click chemistry)的方法将步骤(1)所得水相稀土NaGdF4纳米粒子与式I所示物质进行反应,进行分子识别基团-四嗪修饰;
相应地,步骤(3)中,将F18阴离子溶液加入到步骤(2)所得修饰有分子识别基团的基础纳米颗粒溶液中,孵育,获得进行正电子核素F18标记。
本发明的第三方面,提供了前述分子影像纳米颗粒探针在体内外分子影像检测、诊断与示踪中的用途。
具体地,前述分子影像纳米颗粒探针可用于生物检测、诊断与示踪,包括体外的分子、病毒、细菌、细胞和材料的检测、诊断与示踪,体内的分子、病毒、细菌、细胞、器官与组织,和通过某种方式给到体内的分子(包括小分子化合物,高分子聚合物和生物大分子如多肽,蛋白和核酸等)、药物制剂、纳米粒子、生物材料等检测、诊断与示踪,或是用前述分子影像纳米颗粒探针将上述物质在体外标记后进行体内的检测、诊断与示踪。
本发明的一些实施方式中,列举了优选的生物检测是动物体内的肿瘤诊断与药物和细胞组织分布成像,其中动物是活体动物。
优选地,前述分子影像纳米颗粒探针可用于制备PET造影剂。
与现有技术相比,本发明具有如下有益效果:
与已知的核医学分子影像探针相比,本发明的分子影像纳米颗粒探针尺寸小于10nm,表面修饰生物反应活性基团或分子识别基团;制备方法简单,分离纯化方便快速,具有很强的吸附F18能力,可作为放射性探针用于分子影像检测、诊断与示踪,成像灵敏度高、特异性强。
附图说明
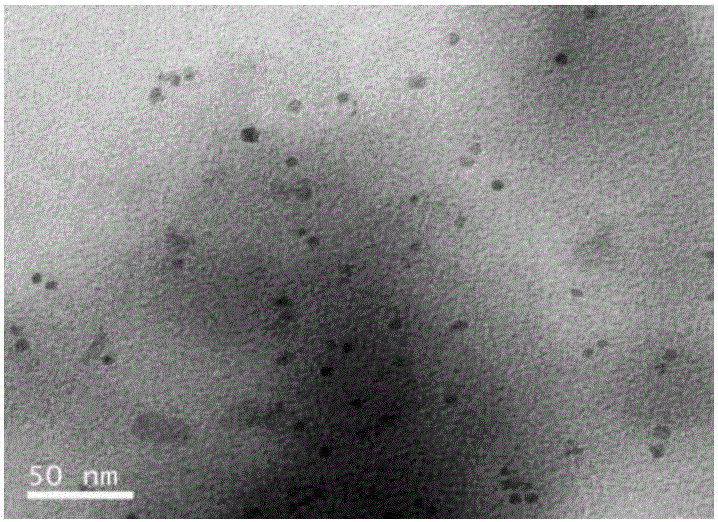
图1:油相超小稀土纳米颗粒NaGdF4的TEM表征图。
图2:水相超小稀土纳米颗粒NaGdF4的TEM表征图。
图3:NaGdF4的Tz修饰表征。
图4:NaGdF4-Tz吸附F18在不同溶液中稳定性测定。
图5:吸附F18的NaGdF4-Tz纳米粒子在小鼠体内分布与代谢。
图6:Tz-NaGdF4纳米颗粒对肿瘤预靶向分布TCO-SNP的PET示踪与肿瘤预靶向成像。
图7:Ad-PEG的氢谱图。
图8:6-ots-β-CD的氢谱图。
图9:CD-PEI的氢谱图。
具体实施方式
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实施例1油性和水性超小NaGdF4纳米颗粒的制备
1mmol氯化钆六水合物与4ml油酸和15ml十八烯在真空下加热到140℃直至形成透明溶液,待冷却到室温,逐滴滴加含有氢氧化钠2.5mmol和NH4F 4mmol的甲醇溶液10mL,过夜搅拌15h,混合物缓慢加热到70℃,移去甲醇,冷却至室温,用乙醇4500rpm离心两次,最后分散在5ml环己烷中。得到的油相稀土NaGdF4纳米粒子的TEM图如图1所示。
20mg油相稀土NaGdF4纳米粒子分散在4ml环己烷中,加入2ml二氯甲烷和5mg 3-氯过氧苯甲酸在40℃下混合搅拌3h,冷却至室温后,加入0.02g L-半胱氨酸,混合溶液在室温下搅拌5h,离心分离用乙醇洗涤几次真空干燥收集得到的水相稀土纳米粒子。得到的水相稀土NaGdF4纳米粒子的TEM图如图2所示。
实施例2超小NaGdF4纳米颗粒的四嗪(Tetrazine,Tz)功能化修饰
经半胱氨酸修饰过的纳米粒子表面有氨基,将水相NaGdF4纳米粒子分散在PH=7.4的mes缓冲液中,加入一定量溶解了2mg的Tetrazine-PEG5-NHS Ester的DMF溶液,反应3h,透析三天除去未反应的Tetrazine-PEG5-NHS Ester,冻干收集。将冻干后的样品取一些溶在DMSO中进行核磁表征,核磁结果如图3所示。核磁出峰中既有Tz-PEG5-NHS的峰,也有纳米粒子的峰,说明Tz已成功接在纳米粒子上。
本实施例中Tetrazine-PEG5-NHS Ester:分子式为C27H36N9O10;分子量为604.41,结构式为:
实施例3超小Tz-NaGdF4纳米颗粒的F18标记与稳定性测试
将Tz-NaGdF4溶解在生理盐水中,加入正电子核素F18-水溶液,室温下孵育10min,透析除去游离的F18-。将吸附了F18的纳米粒子分别置于纯水、生理盐水、PBS、血清中放置一段时间后,测量管中溶液放射剂量,然后进行透析,测定溶液中纳米粒子吸附F18的效率。观察一段时间后吸附效率是否有变化。结果如图4所示,纳米粒子吸附F18在纯水、生理盐水、血清在4个小时内基本可以保持稳定。
实施例4F18标记超小Tz-NaGdF4纳米颗粒的体内分布与清除PET显像
我们将实施例3标记好F18的纳米粒子在PET扫描前通过尾静脉注射到小鼠体内,分别在0h,2h,4h进行扫描,扫描结果如图5所示。观察Tz-NaGdF4纳米颗粒在小鼠体内脏器的清除情况,从图5我们得出,Tz-NaGdF4纳米颗粒在经过2h血液循环后,脏器内的纳米颗粒基本可被清除干净。
实施例5F18标记超小Tz-NaGdF4纳米颗粒对肿瘤预靶向分布的TCO修饰的自组装药物载体(TCO-SNP)的PET示踪显像与肿瘤预靶向成像
金刚烷修饰的聚乙二醇Ad-PEG的制备:称取分子量为187.74g/mol的金刚烷盐酸盐47mg溶于10mlCH2Cl2,加入搅拌子,以适当的转速搅拌使得1-Ad溶解在二氯甲烷中。随后依次加入三乙胺26mg和50mg的mPEG-NHS,室温搅拌2h,用旋转蒸发仪除去二氯甲烷后加水溶解,将液体置于分子量为3500的透析袋透析三天,放入冻干机中过夜冻干。
对产物的结构进行表征,表征数据如图7所示:
表征数据如下:1H NMR(400MHz,DMSO-d6):δ3.42-3.54(440H,OCH2),1.13-1.18(15H,protons on Ad)。
6-O-(p-对甲基苯磺酸)-β-环糊精的制备:500ml三颈瓶中将20gβ-CD(17.6mmol)加入400mL 0.4mol/L NaOH溶液中,完全溶解后剧烈搅拌至无色(预先冰水浴0-5℃)。氮气保护下,用恒压漏斗在90.0min内缓慢加入15ml溶有6.723g对甲苯磺酰氯(35.2mmol)的乙腈溶液中,再于反应器中冰水浴反应5h,抽滤弃去未反应的TsCl,取滤液。用1mol/L的HCl酸化至pH2-3有白色固体生成,将滤液在4摄氏度下静置12h过夜,抽滤,白色固体用水重结晶两次,真空干燥得白色粉末。
对产物的结构进行表征,表征数据如图8所示:
对产物的结构表征数据如下:1H NMR(400MHz,DMSO),δ3.18-3.78(C-2,-3,-4,-5);4.79(C-1);5.74(C-2,-3OH)。
β-环糊精修饰的聚乙烯亚胺CD-PEI的制备:将100mg PEI(分子量为10KD)溶解在100ml DMSO中,将实施例4制备的6-OTs-β-CD加入到该溶液中,在70℃条件下反应3天,用分子量为10KD的透析袋透析六天,过滤去除未反应的6-OTs-β-CD,冻干收集样品。
对产物的结构进行表征,表征数据如图9所示:
对产物的结构表征数据如下:1H NMR(400MHz,DMSO)δ4.92(环糊精上C1H),3.27-3.66(环糊精上C2-6H),2.3-3.0(PEI上OCH2)。
金刚烷修饰的PAMAM Ad-PAMAM的制备:本实施例所使用的PAMAM是带有1,4-二氨基丁烷芯核和胺末端的第一代聚酰胺树枝状聚合物。所述PAMAM可购于Dendritic Nanotechnologies,Inc(Mount pleasant,MI)。
将含有PAMAM(20%wt,100mg,0.069mmol)的甲醇溶液加入圆底烧瓶中。使甲醇在真空中蒸发,将粘性固体重溶于10ml干THF中。将含1-金刚烷异氰酸酯(244.6mg,1.38mmol)的10ml THF直接加入PAMAM溶液中。反应混合物在室温下搅拌2小时后,真空除去溶剂。向反应残留物中加入乙醚(100ml)以产生白色沉淀,过滤收集沉淀。以乙醚清洗白色沉淀(100ml×3),干燥后获得白色固体状Ad-PAMAM。根据表征数据分析,每个PAMAM上连接有8个Ad。
我们将TCO组分接在金刚烷修饰的PEG(Ad-PEG)的长链上,同环糊精修饰的PEI(CD-PEI),金刚烷修饰的PAMAM(Ad-PAMAM)通过Ad和CD之间的包结络合作用自组装形成纳米粒子TCO-SNPs,粒径大约在150nm左右。具体方法,包括步骤:Ad-PEG-TCO(10mg/ml):52.8ul;Ad-PAMAM:(2.1mg/ml)18.86ul;涡旋仪涡旋10s,静置3min,加入CD-PEI(10mg/ml):15ul涡旋10s静置20min。
通过尾静脉注射到小鼠体内后,该TCO-SNPs可以通过肿瘤EPR效应聚集在肿瘤部位。24小时后通过尾静脉注射F18标记超小Tz-NaGdF4纳米颗粒,2h后进行PET扫描,图中白色虚线圈部位为皮下肿瘤位置。得到的PET图像如图6所示,肝、肺、脾等脏器等基本没有放射性信号,而肿瘤显示非常高的放射性信号。结果表明与TCO组分结合的超小稀土纳米粒子留在肿瘤部位,未被结合的纳米粒子则被快速排出体外,实现了对TCO-SNPs的体内示踪,也得到高肿瘤/组织对比度成像。我们这种成像方法是基于肿瘤EPR效应,目前临床上多使用的是18F-FDG造影剂,是基于肿瘤高葡萄糖代谢的性质。对比之下我们这种探针具有普适性,而且排除了假阳性的可能。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!