ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制作方法
本发明涉及生物医学领域,具体涉及ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用。
背景技术:
KRAB型锌指蛋白(KRAB-containing zinc finger protein,KZNF)家族是哺乳动物中最大的转录因子/转录调控因子家族,其蛋白结构主要由N端含有保守的具有较强转录抑制功能的KRAB(Krüppel-associated box)结构域,中部及C端含有持续识别连续DNA序列的多个C2H2型锌指结构组成。KRAB结构域通过与KAP-1(KRAB-associated protein-1)结合募集多种转录抑制因子,形成转录抑制复合体,C端锌指区与靶基因调控区中的DNA和/或其它转录因子结合后,将与KAP-1形成的转录抑制复合体锚定在特定的靶序列附近,发挥特异的转录抑制功能。
p53基因是迄今发现与人类肿瘤相关性最高的基因,在人类50%以上的肿瘤组织中均发现了p53基因的突变,而p53基因未突变的肿瘤中大部分存在p53基因调控机制的缺陷。它不仅作为抑癌基因发挥抗增殖作用,而且在不同的时间空间下,针对不同的应激信号,产生不同的细胞效应,决定细胞的“生”或“死”。
p53基因这些纷繁复杂的生物学效应,主要是通过作为转录因子对上百种靶基因表达的调节来完成的,这些靶基因的功能涉及周期调控、细胞凋亡、血管生成及肿瘤转移、代谢、免疫、生殖、DNA损伤修复等等。
技术实现要素:
本发明所要解决的技术问题是如何抑制p53蛋白的活性。
为解决上述技术问题,本发明首先提供了ZNF383蛋白在制备产品中的应用;所述产品的功能可为如下A1)至A11)中的至少一种:
A1)抑制p53蛋白的活性;A2)下调凋亡相关靶基因的表达量;A3)下调puma基因的表达量;A4)下调p53AIP1基因的表达量;A5)下调免疫相关靶基因的表达量;A6)下调IRF5基因的表达量;A7)下调ISG15基因的表达量;A8)下调IFN-β基因的表达量;A9)降低puma蛋白的表达水平;A10)抑制与p53蛋白有关的信号通路;A11)与p53蛋白结合。
ZNF383蛋白的应用也属于本发明的保护范围。ZNF383蛋白的应用可为如下A1)至A11)中的至少一种:
A1)抑制p53蛋白的活性;A2)下调凋亡相关靶基因的表达量;A3)下调puma基因的表达量;A4)下调p53AIP1基因的表达量;A5)下调免疫相关靶基因的表达量;A6)下调IRF5基因的表达量;A7)下调ISG15基因的表达量;A8)下调IFN-β基因的表达量;A9)降低puma蛋白的表达水平;A10)抑制与p53蛋白有关的信号通路;A11)与p53蛋白结合。
所述A1)中,所述“抑制p53蛋白的活性”为抑制细胞中p53蛋白的活性;所述细胞为人结肠癌细胞、宫颈癌细胞或胚胎成纤维细胞。
所述A2)中,所述凋亡相关靶基因可为p53基因下游的凋亡相关靶基因(即p53基因调控的凋亡相关靶基因)。
所述A3)中,所述“下调puma基因的表达量”可为下调细胞中p53基因下游的puma基因的表达量。所述细胞为人结肠癌细胞。
所述A4)中,所述“下调p53AIP1基因的表达量”可为下调细胞中p53基因下游的p53AIP1基因的表达量。所述细胞为人结肠癌细胞。
所述A5)中,所述免疫相关靶基因可为p53基因下游的免疫相关靶基因(即p53基因调控的免疫相关靶基因)。
所述A6)中,所述“下调IRF5基因的表达量”可为下调细胞中p53基因下游的IRF5基因的表达量。所述细胞可为人结肠癌细胞或胚胎成纤维细胞。
所述A7)中,所述“下调ISG15基因的表达量”可为下调细胞中p53基因下游的ISG15基因的表达量。所述细胞可为人结肠癌细胞。
所述A8)中,所述“下调IFN-β基因的表达量”可为下调细胞中IFN-β基因的表达量。所述细胞可为胚胎成纤维细胞。
所述A9)中,所述“降低puma蛋白的表达水平”可为降低细胞中puma蛋白的表达水平。所述细胞可为人结肠癌细胞。
所述A10)中,所述“与p53蛋白有关的信号通路”可为与p53蛋白有关的细胞凋亡通路和/或与p53蛋白有关的IFN-β通路。
所述A1)中,ZNF383蛋白可以剂量依赖的方式抑制p53蛋白的活性。所述人结肠癌细胞的生长条件可为正常生长条件或DNA损伤应激条件。所述宫颈癌细胞的生长条件可为正常生长条件。所述胚胎成纤维细胞的生长条件可为病毒感染应激条件。
所述A3)、A4)、A6)和A7)中,所述人结肠癌细胞的生长条件可为正常生长条件。
所述A6)或A8)中,所述胚胎成纤维细胞的生长条件可为病毒感染应激条件。
所述A9)中,所述人结肠癌细胞的生长条件可为正常生长条件或DNA损伤应激条件。
抑制ZNF383蛋白活性和/或表达量的物质在制备产品中的应用也属于本发明的保护范围;所述产品的功能可为如下C1)至C11)中的至少一种:
C1)增加p53蛋白的活性;C2)上调凋亡相关靶基因的表达量;C3)上调puma基因的表达量;C4)上调p53AIP1基因的表达量;C5)上调免疫相关靶基因的表达量;C6)上调IRF5基因的表达量;C7)上调ISG15基因的表达量;C8)上调IFN-β基因的表达量;C9)增加puma蛋白的表达水平;C10)增加与p53蛋白有关的信号通路;C11)与p53蛋白结合。
所述C1)中,所述“增加p53蛋白的活性”可为增加细胞中p53蛋白的活性。所述细胞可为人结肠癌细胞或宫颈癌细胞。
所述C9)中,所述“增加puma蛋白的表达水平”可为增加细胞中puma蛋白的表达水平。所述细胞可为人结肠癌细胞。
所述C1)中,所述人结肠癌细胞的生长条件可为正常生长条件或DNA损伤应激条件。所述宫颈癌细胞的生长条件可为正常生长条件。
所述C9)中,所述人结肠癌细胞的生长条件可为DNA损伤应激条件。
所述C10)中,所述“与p53蛋白有关的信号通路”可为与p53蛋白有关的细胞凋亡通路和/或与p53蛋白有关的IFN-β通路。
上述任一所述的应用中,所述产品可为药物。
为解决上述技术问题,本发明还提供了产品甲或产品乙。
所述产品甲含有ZNF383蛋白;所述产品甲的功能可为如下A1)至A11)中的至少一种:
A1)抑制p53蛋白的活性;A2)下调凋亡相关靶基因的表达量;A3)下调puma基因的表达量;A4)下调p53AIP1基因的表达量;A5)下调免疫相关靶基因的表达量;A6)下调IRF5基因的表达量;A7)下调ISG15基因的表达量;A8)下调IFN-β基因的表达量;A9)降低puma蛋白的表达水平;A10)抑制与p53蛋白有关的信号通路;A11)与p53蛋白结合。
所述产品乙含有抑制ZNF383蛋白活性和/或表达量的物质;所述产品乙的功能可为如下C1)至C11)中的至少一种:
C1)增加p53蛋白的活性;C2)上调凋亡相关靶基因的表达量;C3)上调puma基因的表达量;C4)上调p53AIP1基因的表达量;C5)上调免疫相关靶基因的表达量;C6)上调IRF5基因的表达量;C7)上调ISG15基因的表达量;C8)上调IFN-β基因的表达量;C9)增加puma蛋白的表达水平;C10)增加与p53蛋白有关的信号通路;C11)与p53蛋白结合。
所述产品甲或产品乙可为药物。
上述任一所述“抑制ZNF383蛋白活性和/或表达量的物质”可为z1)或z2)或z3)或z4):
z1)寡聚核酸siRNA1;所述寡聚核酸siRNA1由序列表中的序列5所示单链RNA分子和序列表的序列6所示的单链RNA分子组成;
z2)寡聚核酸siRNA2;所述寡聚核酸siRNA2由序列表中的序列7所示单链RNA分子和序列表的序列8所示单链RNA分子组成。
z3)以所述寡聚核酸siRNA1为靶点,由shRNA表达系统合成的shRNA;
z4)以所述寡聚核酸siRNA2为靶点,由shRNA表达系统合成的shRNA。
上述任一所述人结肠癌细胞可为p53+/+HCT116细胞或p53-/-HCT116细胞。
上述任一所述宫颈癌细胞可为Hela细胞。
上述任一所述胚胎成纤维细胞可为p53-/-MDM2-/-MEF细胞。
上述任一所述ZNF383蛋白可为a1)或a2)或a3):
a1)氨基酸序列是序列表中序列1所示的蛋白质;
a2)在a1)的N端或/和C端连接标签得到的融合蛋白质;
a3)将序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。
上述任一所述p53蛋白可为b1)或b2)或b3):
b1)氨基酸序列是序列表中序列3所示的蛋白质;
b2)在b1)的N端或/和C端连接标签得到的融合蛋白质;
b3)将序列表中序列3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。
所述ZNF383蛋白也属于本发明的保护范围。
编码所述ZNF383蛋白的核苷酸分子也属于本发明的保护范围。
编码所述ZNF383蛋白的核苷酸分子可为如下(k1)或(k2)或(k3)或(k4)所示的DNA分子:
(k1)编码区是序列表中序列2所示的DNA分子;
(k2)核苷酸序列是序列表中序列2所示的DNA分子;
(k3)与(k1)或(k2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述ZNF383蛋白的DNA分子;
(k4)在严格条件下与(k1)或(k2)限定的核苷酸序列杂交,且编码所述ZNF383蛋白的DNA分子。
其中,编码所述ZNF383蛋白的核苷酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
其中,序列表中序列2由1428个核苷酸组成,序列表中序列2的核苷酸编码序列表中序列1所示的氨基酸序列。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码ZNF383蛋白的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的ZNF383蛋白的核苷酸序列75%或者更高同一性的核苷酸,只要编码ZNF383蛋白,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表中序列1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
含有编码所述ZNF383蛋白的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系也属于本发明的保护范围。
所述重组载体具体可为Myc-ZNF383质粒。所述Myc-ZNF383质粒为将pCMV-Myc质粒的限制性内切酶SalⅠ和NotⅠ的识别序列间的小片段替换为序列表中序列2所示的DNA分子,得到的重组质粒。
所述寡聚核酸siRNA1也属于本发明的保护范围。
所述寡聚核酸siRNA2也属于本发明的保护范围。
实验证明,ZNF383蛋白可抑制p53蛋白的活性、下调凋亡相关靶基因(如puma基因或p53AIP1基因)的表达量、下调免疫相关靶基因(如IRF5基因、ISG15基因或IFN-β基因)的表达量、降低puma蛋白的表达水平、抑制与p53蛋白有关的信号通路和与p53蛋白结合。因此,ZNF383蛋白在制备抑制p53蛋白的活性的产品中具有重要的应用价值。
附图说明
图1为实施例2的实验一的结果。
图2为实施例2的实验二的结果。
图3为实施例3的实验一的结果。
图4为实施例3的实验二的结果。
图5为实施例4的实验一的结果。
图6为实施例4的实验二的结果。
图7为实施例4的实验三的结果。
图8为实施例4的实验四的结果。
图9为实施例4的实验五的结果。
图10为实施例5的实验一的结果。
图11为实施例5的实验二的结果。
图12为实施例5的实验三的结果。
图13为实施例5的实验四的结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
ZNF383蛋白的氨基酸序列如序列表中序列1所示,其编码基因(以下简称ZNF383基因)的核苷酸序列如序列表中序列2所示。p53蛋白的氨基酸序列如序列表中序列3所示,其编码基因(以下简称p53基因)的核苷酸序列如序列表中序列4所示。
pG13L质粒(又称pG13-Luc质粒)记载于如下文献中:Chunyan Tian,et al.KRAB-type zinc-finger protein Apak specifically regulates p53-dependent apoptosis.Nat Cell Biol.2009May;11(5):580-91.,公众可从中国人民解放军军事医学科学院放射与辐射医学研究所获得。该质粒是一种报告基因质粒,在其启动子区上游构建了13个串联的p53结合原件,如果p53蛋白存在会与p53结合原件结合从而引起该质粒的表达,进而发出荧光,然后根据荧光强度判断p53蛋白的活性。
pCMV-Myc质粒为Clontech公司的产品。pCMV-Flag质粒为Sigma公司的产品,产品目录号为E3762。pRL-TK质粒为Promega公司的产品,产品目录号为E2241。双荧光素酶报告基因试剂盒为Promega公司的产品,产品目录号为E1980。Myc抗体为Medical Biological Baboratoris公司的产品,产品目录号为M047-3。p53抗体为Calbiochem公司的产品,产品目录号为OP43L。Puma抗体为Cell Signaling Technology公司的产品,产品目录号为4976S。GAPDH抗体为proteintach公司的产品,产品目录号为60004-1。Etoposide为Sigma公司的产品,产品目录号为E1383。proein-A/G Plus agrose为Santa Cruz公司的产品,产品目录号为sc-2003。Poly(I:C)为Sigma公司的产品,产品目录号为P0913。
Hela细胞保藏于美国模式培养物集存库(American type culture collection,ATCC;网址为:http://www.atcc.org/),保藏编号为PTA-5659。
p53野生型的HCT116细胞(又称p53+/+HCT116cells或p53+/+HCT116细胞)和p53缺失型的HCT116细胞(又称p53-/-HCT116cells或p53-/-HCT116细胞)均记载于如下文献中:Chunyan Tian,et al.KRAB-type zinc-finger protein Apak specifically regulates p53-dependent apoptosis.Nat Cell Biol.2009May;11(5):580-91.,公众可从中国人民解放军军事医学科学院放射与辐射医学研究所获得。
p53和MDM2缺失型的MEF细胞(又称p53-/-HDM2-/-MEF cells或p53-/-HDM2-/-MEF细胞)记载于如下文献中:Jing Nie,et al.Smad ubiquitylation regulatory factor 1/2(Smurf1/2)promotes p53 degradation by stabilizing the E3 ligase MDM2.J Biol Chem.2010Jul 23;285(30):22818-30.,公众可从中国人民解放军军事医学科学院放射与辐射医学研究所获得。
下述实施例中共转染时采用的转染试剂为TurboFect Transfection Reagent,具体步骤参考TurboFect Transfection Reagent的说明书。TurboFect Transfection Reagent为Thermo Scientific公司的产品。
封闭液:将5mg脱脂奶粉溶解于100mL TBST溶液得到。TBST溶液为含有140mM NaCl和0.1%(v/v)Tween-20的pH7.5、20mM Tris-HCl缓冲液。
2×上样缓冲液:含200mM DTT、2%(2g/100mL)SDS、20%(v/v)甘油和0.016%(0.016g/100mL)溴酚蓝的pH8.0、20mM Tris-HCl缓冲液。
puma基因的genebank号为27113。p53AIP1基因的genebank号为63970。p21基因的genebank号为1026。14-3-3σ基因的genebank号为2810。p53R2基因的genebank号为50484。DDB2基因的genebank号为1643。XPC基因的genebank号为7508。TLR3基因的genebank号为7098。IRF5基因的genebank号为3663。ISG15基因的genebank号为9636。PML基因的genebank号为5371。HDM2基因的genebank号为4193。MDR基因的genebank号为5243。CDC25c基因的genebank号为995。IFN-β基因的genebank号为3456。
实施例1、质粒的构建和寡聚核酸的制备
1、Myc-ZNF383质粒的构建
将pCMV-Myc质粒的限制性内切酶SalⅠ和NotⅠ的识别序列间的小片段替换为序列表中序列2所示的DNA分子,得到的重组质粒即为Myc-ZNF383质粒。
Myc-ZNF383质粒表达序列表中序列1所示的ZNF383蛋白。
2、Flag-p53质粒的构建
将pCMV-Flag质粒的限制性内切酶EcoRⅠ和BamHⅠ的识别序列间的小片段替换为序列表中序列4所示的DNA分子,得到的重组质粒即为Flag-p53质粒。
Flag-p53质粒表达序列表中序列3所示的p53蛋白。
3、寡聚核酸的制备
人工合成表1所示的正义链和反义链。用去离子水将正义链稀释,得到正义链稀释液。用去离子水将反义链稀释,得到反义链稀释液。取正义链稀释液和相应的反义链稀释液,进行退火反应,形成寡聚核酸。
本步骤共制备表1所示的3个寡聚核酸。各个寡聚核酸中的A、G、C和U依次表示腺嘌呤核糖核苷酸、鸟嘌呤核糖核苷酸、胞嘧啶核糖核苷酸和尿嘧啶核糖核苷酸,T表示胸腺嘧啶脱氧核苷酸。
siRNA-con的核苷酸序列为随机序列(作为阴性对照)。siRNA1和siRNA2的核苷酸序列根据序列表中序列2设计。
表1
将Myc-ZNF383质粒、Flag-p53质粒、siRNA1、siRNA2和siRNA-con进行后续实验。
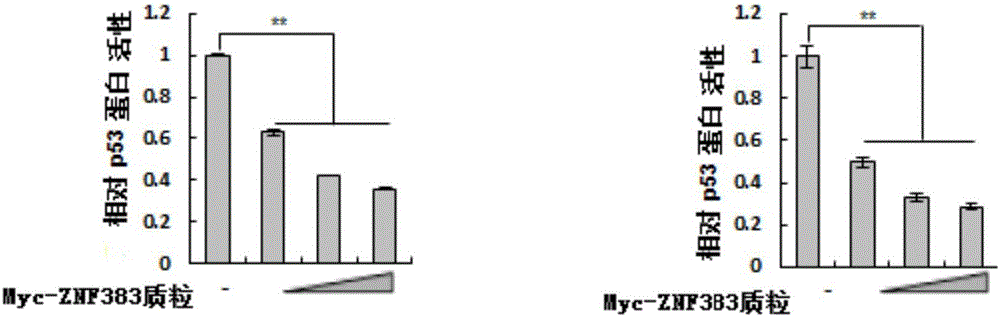
实施例2、ZNF383蛋白以剂量依赖的方式抑制内源p53蛋白的活性
一、实验一
实验重复三次取平均值,每次重复的步骤如下:
1、将细胞(p53+/+HCT116细胞或Hela细胞)接种于装有0.5mL DMEM培养基的24孔板中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成四组,每组设置三个复孔,进行如下处理:
第一组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.4μg pCMV-Myc质粒,共转染;
第二组:每孔加入0.1μg Myc-ZNF383质粒、20ng pG13L质粒、0.2ng pRL-TK质粒和0.3μg pCMV-Myc质粒,共转染;
第三组:每孔加入0.2μg Myc-ZNF383质粒、20ng pG13L质粒、0.2ng pRL-TK质粒和0.2μg pCMV-Myc质粒,共转染;
第四组:每孔加入0.3μg Myc-ZNF383质粒、20ng pG13L质粒和0.2ng pRL-TK质粒,共转染。
2、完成步骤1 36h后,采用双荧光素酶报告基因试剂盒检测荧光强度,然后按组分别取平均值,得到各组的荧光强度。
将第一组荧光强度作为1(即相对p53蛋白活性为1),计算其它组的荧光强度(即相对p53蛋白活性)。
实验结果见图1(左图为p53+/+HCT116细胞,右图为Hela细胞)。结果表明,在p53+/+HCT116细胞或Hela细胞中,ZNF383蛋白以剂量依赖的方式明显抑制内源p53蛋白的活性。
二、实验二
实验重复三次取平均值,每次重复的步骤如下:
1、将细胞(p53+/+HCT116细胞或Hela细胞)接种于装有0.5mL DMEM培养基的24孔板中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成三组,每组设置三个复孔,进行如下处理:
第一组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA-con,共转染;
第二组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA1,共转染;
第三组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA2,共转染。
2、完成步骤1 36h后,采用双荧光素酶报告基因试剂盒检测荧光强度,然后按组分别取平均值,得到各组的荧光强度。
将第一组荧光强度作为1(即相对p53蛋白活性为1),计算其它组的荧光强度(即相对p53蛋白活性)。
实验结果见图2中A(左图为p53+/+HCT116细胞,右图为Hela细胞)。
3、完成步骤1 36h后,分别提取各个细胞的总RNA,然后采用逆转录酶反转录出第一链cDNA,得到各个细胞的cDNA。然后采用实时荧光定量分析各个细胞的cDNA中ZNF383基因的相对表达量(内参为GAPDH基因)。检测ZNF383基因的引物为5’-GAGAACGGCCTCAAGGAAGA-3’和5’-TGTATAAGTCCCTCTGAACAGG-3’。检测GAPDH基因的引物为5’-GGGAAGGTGAAGGTCGGAGT-3’和5’-TTGAGGTCAATGAAGGGGTCA-3’。
将第一组细胞的cDNA中ZNF383基因的相对表达量作为1,计算第二组和第三组细胞的cDNA中ZNF383基因的相对表达量。
p53+/+HCT116细胞的实验结果见图2中B。
上述结果表明,siRNA1和siRNA2均能够显著抑制内源ZNF383基因的表达;在p53+/+HCT116细胞或Hela细胞中,siRNA1和siRNA2显著抑制内源ZNF383基因表达后,能显著增加内源p53蛋白活性。
实施例3、ZNF383蛋白依赖p53蛋白选择性下调p53基因下游凋亡和免疫相关靶基因的表达量
一、实验一
实验重复三次取平均值,每次重复的步骤如下:
1、将p53+/+HCT116细胞接种于装有2mL DMEM培养基的6孔板中(每孔2.0×105个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成两组,每组设置三个复孔,进行如下处理:
第一组:每孔加入2.0μg pCMV-Myc质粒,共转染;
第二组:每孔加入2.0μg Myc-ZNF383质粒,共转染。
2、完成步骤1 48h后,分别提取各个细胞的总RNA,然后采用逆转录酶反转录出第一链cDNA,得到各个细胞的cDNA。然后采用实时荧光定量分析p53基因下游靶基因的相对表达量(内参为GAPDH基因)。p53基因下游靶基因为puma基因、p53AIP1基因、p21基因、14-3-3σ基因、p53R2基因、DDB2基因、XPC基因、TLR3基因、IRF5基因、ISG15基因、PML基因、HDM2基因、MDR基因或CDC25c基因。
检测puma基因的引物:5’-GGACGACCTCAACGCACAGT-3’和5’-AATTGGGCTCCATCTCGGGG-3’。检测p53AIP1基因的引物:5’-TCTTCCTCTGAGGCGAGCT-3’和5’-AGGGTGCTGCGAAGCTGACGC-3’。检测p21基因的引物:5’-CACCGAGACACCACTGGAGG-3’和5’-GAGAAGATCAGCCGGCGTTT-3’。检测14-3-3σ基因的引物:5’-GGCCATGGACATCAGCAAGAA-3’和5’-CGAAAGTGGTCTTGGCCAGAG-3’。检测p53R2基因的引物:5’-TGGCTTCGTCGTTGCGAGCG-3’和5’-TCTGAAGATGATCTCCCGGCCT-3’。检测DDB2基因的引物:5’-CTGAACCCATGCTGTGATTG-3’和5’-AAACTCGGATCTCGCTCTTC-3’。检测XPC基因的引物:5’-ACGGGCCCAAGAGTGAGGC-3’和5’-TTGAGGCCAGGAGGCAGCCA-3’。检测TLR3基因的引物:5’-CAGCATCAAAAGAAGCAGAAAA-3’和5’-CAATAGCTTGTTGAACTGCATGA-3’。检测IRF5基因的引物:5’-CCAGTGACAAGCAGCGCTTCTACAC-3’和5’-TCTGGCCCTTTTGGAACAGGATGAG-3’。检测ISG15基因的引物:5’-CTGAGAGGCAGCGAACTCAT-3’和5’-AGCATCTTCACCGTCAGGTC-3’。检测PML基因的引物:5’-CGCCCTGGATAACGTCTTTTT-3’和5’-TCCACAATCTGCCGGTACAC-3’。检测HDM2基因的引物:5’-ATCTTGGCCAGTATATTATG-3’和5’-GTTCCTGTAGATCATGGTAT-3’。检测MDR基因的引物:5’-ATAATGCGACAGGAGATAGG-3’和5’-CCAAAATCACAAGGGTTAGC-3’。检测CDC25c基因的引物:5’-GAACAGGCCAAGACTGAAGC-3’和5’-GCCCCTGGTTAGAATCTTCC-3’。检测GAPDH基因的引物:5’-GGGAAGGTGAAGGTCGGAGT-3’和5’-TTGAGGTCAATGAAGGGGTCA-3’。
将第一组细胞中基因的相对表达量作为1,第二组细胞中相应基因的相对表达量见图3(“-”为pCMV-Myc质粒;“+”为Myc-ZNF383质粒;A为puma基因,B为53AIP1基因,C为p21基因,D为14-3-3σ基因,E为p53R2基因,F为DDB2基因,G为XPC基因,H为TLR3基因,I为IRF5基因,J为ISG15基因,K为PML基因,L为HDM2基因,M为MDR基因,N为CDC25c基因)。
结果表明,ZNF383蛋白选择性下调p53基因下游凋亡相关靶基因(puma基因和p53AIP1基因)和免疫相关靶基因(IRF5基因和ISG15基因)的表达量。
二、试验二
实验重复三次取平均值,每次重复的步骤如下:
1、将p53-/-HCT116细胞接种于装有0.5mL DMEM培养基的24孔板的4个孔中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,进行如下处理:
第1个孔:加入0.2μg Flag-p53质粒和0.4μg pCMV-Myc质粒,共转染;
第2个孔:加入0.2μg Flag-p53质粒和0.4μg Myc-ZNF383质粒,共转染;
第3个孔:加入0.6μg pCMV-Myc质粒,共转染;
第4个孔:加入0.4μg Myc-ZNF383质粒和0.2μg pCMV-Myc质粒,共转染。
2、完成步骤1 36h后,分别提取各个细胞的总蛋白,以Puma抗体、p53抗体、Myc抗体或GAPDH抗体为一抗进行Western Blot(采用GAPDH蛋白作为内参)。
实验结果见图4。结果表明,在P53-/-HCT116细胞中,ZNF383蛋白依赖p53蛋白降低puma蛋白(Gene ID为:27113)的表达水平。
实施例4、DNA损伤应激条件下,ZNF383蛋白抑制p53蛋白的结合能力增加
本实施例中,采用etoposide处理细胞来模拟DNA损伤。
一、实验一
通过免疫共沉淀实验检测ZNF383蛋白与p53蛋白在体内的结合能力,具体步骤如下:
1、将p53-/-HCT116细胞传入装有5mL DMEM培养基的培养瓶中(培养瓶的规格为25cm2;每个培养瓶5.0×105个细胞),置于37℃、5%CO2培养箱中培养18h(此时融合率达到70~90%),然后进行如下处理:
第1个培养瓶:加入6.0μg pCMV-Myc质粒和1.5μg Flag-p53质粒,共转染48h;
第2个培养瓶:加入6.0μg Myc-ZNF383质粒和1.5μg Flag-p53质粒,共转染48h;
第3个培养瓶:加入6.0μg pCMV-Myc质粒和1.5μg Flag-p53质粒,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h,然后弃液相,用预冷的pH7.4、0.01M的PBS缓冲液洗涤3次(最后1次洗涤需将pH7.4、0.01M的PBS缓冲液吸干);
第4个培养瓶:加入6.0μg Myc-ZNF383质粒和1.5μg Flag-p53质粒,共转染36h;然后加入etoposide),得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h,然后弃液相,用预冷的pH7.4、0.01M的PBS缓冲液洗涤3次(最后1次需将pH7.4、0.01M的PBS缓冲液吸干)。
2、完成步骤1后,向各个培养瓶中分别加入胰酶消化液(目的为对细胞进行消化),然后分别转移至离心管(规格为10mL),1000rpm离心5min,分别收集沉淀。
3、取步骤2分别收集的沉淀,洗涤2次。每次洗涤的步骤为:加入1mL pH7.4、0.01M的PBS缓冲液,1000rpm离心5min。最后1次洗涤需将pH7.4、0.01M的PBS缓冲液吸干。
4、取步骤3分别收集的沉淀,加入600μL预冷的NETN裂解液,混合均匀后冰上孵育30min;然后4℃、12000rpm离心10min,收集上清液。
NETN裂解液:向1mL含150mM NaCl、1mM EDTA和0.5%(m/m)NP-40的pH8.0、20mM Tris-Cl缓冲液中加入0.02mL 50×蛋白酶抑制剂,混匀。50×蛋白酶抑制剂为含1mM DTT、1mM NaV3O4和1mM NaF的水溶液。
5、取40μL步骤4分别收集的上清液,加入40μL 2×上样缓冲液,混匀,100℃煮10min,得到的溶液即为Lysate。
6、将步骤4分别收集的上清液分别转移至离心管(规格为1.5mL),每管加入1μL myc抗体,4℃缓慢摇动3h;然后每管加入40μL proein-A/G Plus agrose,置于旋转混合仪上,4℃过夜。
7、完成步骤6后,分别收集沉淀(即agrose与抗原抗体复合物),然后冰上放置1min(目的为使琼脂糖珠沉降),4℃、3000rpm离心5min,收集沉淀。
8、取步骤7分别收集的沉淀,洗涤4次。每次洗涤的步骤为:加入1mL预冷的NETN裂解液,4℃、3000rpm离心2min。
9、取步骤8分别收集的沉淀,先加入40μL NETN裂解液重悬,再加入40μL 2×上样缓冲液,混匀,100℃煮10min,得到的溶液即为Myc-IP。
以Flag-HRP抗体稀释液(用封闭液稀释Flag-HRP抗体至1000倍体积得到)或Myc-HRP抗体稀释液(用封闭液稀释Myc-HRP抗体至1000倍体积得到)为一抗,对Lysate和Myc-IP进行Western Blot。
实验结果见图5。结果表明,etoposide处理后(即DNA损伤应激条件下),ZNF383蛋白与p53蛋白的结合能力增加。
二、实验二
实验重复三次取平均值,每次重复的步骤如下:
1、将p53+/+HCT116细胞接种于装有0.5mL DMEM培养基的24孔板中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成四组,每组设置三个复孔,进行如下处理:
第一组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.4μg pCMV-Myc质粒,共转染48h;
第二组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.3μg Myc-ZNF383质粒,共转染48h;
第三组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.4μg pCMV-Myc质粒,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第四组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.3μg Myc-ZNF383质粒,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h。
2、完成步骤1后,采用双荧光素酶报告基因试剂盒检测荧光强度,然后按组分别取平均值,得到各组的荧光强度。
将第一组荧光强度作为1(即相对p53蛋白活性为1),计算其它组的荧光强度(即相对p53蛋白活性)。
实验结果见图6(1为第一组,2为第二组,3为第三组,4为第四组)。结果表明,在p53+/+HCT116细胞中,etoposide处理后p53蛋白的活性均增加,ZNF383蛋白对内源p53蛋白的活性的抑制能力增加。
三、实验三
实验重复三次取平均值,每次重复的步骤如下:
1、将p53+/+HCT116细胞接种于装有0.5mL DMEM培养基的24孔板中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成四组,每组设置三个复孔,进行如下处理:
第一组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA-con,共转染48h;
第二组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA1,共转染48h;
第三组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA2,共转染48h;
第四组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA-con,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第五组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA1,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第六组:每孔加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.5μg siRNA2,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h。
2、完成步骤1后,采用双荧光素酶报告基因试剂盒检测荧光强度,然后按组分别取平均值,得到各组的荧光强度。
将第一组荧光强度作为1(即相对p53蛋白活性为1),计算其它组的荧光强度(即相对p53蛋白活性)。
实验结果见图7(1为第一组,2为第二组,3为第三组,4为第四组。5为第五组,6为第六组)。结果表明,etoposide处理p53+/+HCT116细胞后,p53蛋白的活性均增加;siRNA1和siRNA2能显著增加内源p53蛋白的活性,且与未经etoposide处理的p53+/+HCT116细胞相比,经etoposide处理的p53+/+HCT116细胞中内源p53蛋白的活性显著增加。
四、实验四
实验重复三次取平均值,每次重复的步骤如下:
1、将p53+/+HCT116细胞接种于装有0.5mL DMEM培养基的24孔板的4个孔中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,进行如下处理:
第1个孔:加入0.4μg pCMV-Myc质粒,共转染48h;
第2个孔:加入0.4μg Myc-ZNF383质粒,共转染48h;
第3个孔:加入0.4μg pCMV-Myc质粒,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第4个孔:加入0.4μg Myc-ZNF383质粒,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h。
2、完成步骤1后,分别提取各个细胞的总蛋白,以Puma抗体、p53抗体、Myc抗体或GAPDH抗体为一抗进行Western Blot(采用GAPDH蛋白作为内参)。
实验结果见图8。结果表明,与未经etoposide处理的p53+/+HCT116细胞相比,经etoposide处理的p53+/+HCT116细胞中puma蛋白的表达水平显著降低。
五、实验五
实验重复三次取平均值,每次重复的步骤如下:
1、将p53+/+HCT116细胞接种于装有0.5mL DMEM培养基的24孔板的6个孔中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,进行如下处理:
第1个孔:加入0.5μg siRNA-con,共转染48h;
第2个孔:加入0.5μg siRNA1,共转染48h;
第3个孔:加入0.5μg siRNA2,共转染48h;
第4个孔:加入0.5μg siRNA-con,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第5个孔:加入0.5μg siRNA1,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h;
第6个孔:加入0.5μg siRNA2,共转染36h;然后加入etoposide,得到处理体系(处理体系中,etoposide的浓度为2×10-5mol/L);将该处理体系置于37℃、5%CO2培养箱中培养12h。
2、完成步骤1后,分别提取各个细胞的总蛋白,以Puma抗体、p53抗体、Myc抗体或GAPDH抗体为一抗进行Western Blot(采用GAPDH蛋白作为内参)。
实验结果见图9(1为第1个孔,2为第2个孔,3为第3个孔,4为第4个孔,5为第5个孔,6为第6个孔)。结果表明,与未经etoposide处理的p53-/-HCT116细胞相比,经etoposide处理的p53-/-HCT116细胞中puma蛋白的表达水平显著增加。
实施例5、病毒感染应激条件下,ZNF383蛋白能够抑制p53蛋白的活性
本实施例中,采用Poly(I:C)处理细胞来模拟病毒感染细胞。
一、实验一
通过免疫共沉淀实验检测ZNF383蛋白与p53蛋白在体内的结合能力,具体步骤如下:
1、将p53-/-MDM2-/-MEF细胞传入装有5mL DMEM培养基的培养瓶中(培养瓶的规格为25cm2;每个培养瓶5.0×105个细胞),置于37℃、5%CO2培养箱中培养18h(此时融合率达到70~90%),然后进行如下处理:
第1个培养瓶:加入6.0μg pCMV-Myc质粒和1.5μg Flag-p53质粒,共转染48h;
第2个培养瓶:加入6.0μg Myc-ZNF383质粒和1.5μg Flag-p53质粒,共转染48h;
第3个培养瓶:加入6.0μg pCMV-Myc质粒和1.5μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;最后弃液相,用预冷的pH7.4、0.01M的PBS缓冲液洗涤3次(最后1次洗涤需将pH7.4、0.01M的PBS缓冲液吸干);
第4个培养瓶:加入6.0μg Myc-ZNF383质粒和1.5μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;最后弃液相,用预冷的pH7.4、0.01M的PBS缓冲液洗涤3次(最后1次洗涤需将pH7.4、0.01M的PBS缓冲液吸干)。
2、同实施例4步骤一中2。
3、同实施例4步骤一中3。
4、同实施例4步骤一中4。
5、同实施例4步骤一中5。
6、同实施例4步骤一中6。
7、同实施例4步骤一中7。
8、同实施例4步骤一中8。
9、同实施例4步骤一中9。
以Flag-HRP抗体稀释液或Myc-HRP抗体稀释液为一抗,对Lysate和Myc-IP进行Western Blot。
实验结果见图10。结果表明,Poly(I:C)处理后(即病毒感染应激条件下),ZNF383蛋白与p53蛋白仍具有一定的结合能力。
二、实验二
实验重复三次取平均值,每次重复的步骤如下:
1、将p53-/-MDM2-/-MEF细胞接种于装有0.5mL DMEM培养基的24孔板中(每孔8.0×104个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,随机分成八组,每组设置三个复孔,进行如下处理:
第一组:加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.6μg pCMV-Myc质粒,共转染48h;
第二组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.2μg pCMV-Myc质粒和0.3μg Myc-ZNF383质粒,共转染48h;
第三组:加入20ng pG13L质粒、0.2ng pRL-TK质粒和0.6μg pCMV-Myc质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第四组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.2μg pCMV-Myc质粒和0.3μg Myc-ZNF383质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第五组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染48h;
第六组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.2μg Flag-p53质粒和0.3μg Myc-ZNF383质粒,共转染48h;
第七组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第八组:加入20ng pG13L质粒、0.2ng pRL-TK质粒、0.2μg Flag-p53质粒和0.3μg Myc-ZNF383质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h。
2、完成步骤1后,采用双荧光素酶报告基因试剂盒检测荧光强度,然后按组分别取平均值,得到各组的荧光强度。
将第一组荧光强度作为1(即相对p53蛋白活性为1),计算其它组的荧光强度(即相对p53蛋白活性)。
实验结果见图11。结果表明,在p53-/-MDM2-/-MEF细胞中,Poly(I:C)处理后p53蛋白的活性均增加;ZNF383蛋白仍能够抑制内源p53蛋白的活性。
三、实验三
实验重复三次取平均值,每次重复的步骤如下:
1、将p53-/-MDM2-/-MEF细胞接种于装有2mL DMEM培养基的6孔板的8个孔中(每孔2.0×105个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,进行如下处理:
第1个孔:加入0.6μg pCMV-Myc质粒,共转染48h;
第2个孔:加入0.4μg Myc-ZNF383质粒和0.2μg pCMV-Myc质粒,共转染48h;
第3个孔:加入0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染48h;
第4个孔:加入0.4μg Myc-ZNF383质粒和0.2μg Flag-p53质粒,共转染48h;
第5个孔:加入0.6μg pCMV-Myc质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第6个孔:加入0.4μg Myc-ZNF383质粒和0.2μg pCMV-Myc质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第7个孔:加入0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第8个孔:加入0.4μg Myc-ZNF383质粒和0.2μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h。
2、完成步骤1后,分别提取各个细胞的总RNA,然后采用逆转录酶反转录出第一链cDNA,得到各个细胞的cDNA。然后采用实时荧光定量分析各个细胞的cDNA中IRF5基因的相对表达量(内参为GAPDH基因)。检测IRF5基因的引物:5’-CCAGTGACAAGCAGCGCTTCTACAC-3’和5’-TCTGGCCCTTTTGGAACAGGATGAG-3’。检测GAPDH基因的引物为5’-GGGAAGGTGAAGGTCGGAGT-3’和5’-TTGAGGTCAATGAAGGGGTCA-3’。
将第1个孔中IRF5基因的相对表达量作为1,计算其它孔中IRF5基因的相对表达量。
实验结果见图12(从左至右依次为第1个孔、第2个孔、第3个孔、第4个孔、第5个孔、第6个孔、第7个孔和第8个孔)。结果表明,ZNF383蛋白依赖p53蛋白下调IRF5基因的表达量;Poly(I:C)处理p53-/-MDM2-/-MEF细胞后,IRF5基因的表达水平增加,ZNF383蛋白仍能够依赖p53蛋白下调IRF5基因的表达量。
四、实验四
实验重复三次取平均值,每次重复的步骤如下:
1、将p53-/-MDM2-/-MEF细胞接种于装有2mL DMEM培养基的6孔板的8个孔中(每孔2.0×105个细胞),然后置于37℃、5%CO2培养箱中培养,待融合率达到70~90%时,进行如下处理:
第1个孔:加入0.6μg pCMV-Myc质粒,共转染48h;
第2个孔:加入0.4μg Myc-ZNF383质粒和0.2μg pCMV-Myc质粒,共转染48h;
第3个孔:加入0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染48h;
第4个孔:加入0.4μg Myc-ZNF383质粒和0.2μg Flag-p53质粒,共转染48h;
第5个孔:加入0.6μg pCMV-Myc质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第6个孔:加入0.4μg Myc-ZNF383质粒和0.2μg pCMV-Myc质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第7个孔:加入0.4μg pCMV-Myc质粒和0.2μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h;
第8个孔:加入0.4μg Myc-ZNF383质粒和0.2μg Flag-p53质粒,共转染24h;然后加入5μg Poly(I:C),共转染24h。
2、完成步骤1后,分别提取各个细胞的总RNA,然后采用逆转录酶反转录出第一链cDNA,得到各个细胞的cDNA。然后采用实时荧光定量分析各个细胞的cDNA中IFN-β基因的相对表达量(内参为GAPDH基因)。检测IFN-β基因的引物:5’-AAGAGTTACACTGCCTTTGCCATC-3’和5’-CACTGTCTGCTGGTGGAGTTCATC-3’。检测GAPDH基因的引物为5’-GGGAAGGTGAAGGTCGGAGT-3’和5’-TTGAGGTCAATGAAGGGGTCA-3’。
将第1个孔中IFN-β基因的相对表达量作为1,计算其它孔中IFN-β基因的相对表达量。
实验结果见图13(从左至右依次为第1个孔、第2个孔、第3个孔、第4个孔、第5个孔、第6个孔、第7个孔和第8个孔)。结果表明,Poly(I:C)处理p53-/-MDM2-/-MEF细胞后,Poly(I:C)处理细胞后,ZNF383蛋白能够依赖p53蛋白下调IFN-β基因的表达量。
<110> 中国人民解放军军事医学科学院放射与辐射医学研究所
<120> ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 475
<212> PRT
<213> 人工序列
<220>
<223>
<400> 1
Met Ala Glu Gly Ser Val Met Phe Ser Asp Val Ser Ile Asp Phe Ser
1 5 10 15
Gln Glu Glu Trp Asp Cys Leu Asp Pro Val Gln Arg Asp Leu Tyr Arg
20 25 30
Asp Val Met Leu Glu Asn Tyr Gly Asn Leu Val Ser Met Gly Leu Tyr
35 40 45
Thr Pro Lys Pro Gln Val Ile Ser Leu Leu Glu Gln Gly Lys Glu Pro
50 55 60
Trp Met Val Gly Arg Glu Leu Thr Arg Gly Leu Cys Ser Asp Leu Glu
65 70 75 80
Ser Met Cys Glu Thr Lys Leu Leu Ser Leu Lys Lys Glu Val Tyr Glu
85 90 95
Ile Glu Leu Cys Gln Arg Glu Ile Met Gly Leu Thr Lys His Gly Leu
100 105 110
Glu Tyr Ser Ser Phe Gly Asp Val Leu Glu Tyr Arg Ser His Leu Ala
115 120 125
Lys Arg Leu Gly Tyr Pro Asn Gly His Phe Ser Gln Glu Ile Phe Thr
130 135 140
Pro Glu Tyr Met Pro Thr Phe Ile Gln Gln Thr Phe Leu Thr Leu His
145 150 155 160
Gln Ile Ile Asn Asn Glu Asp Arg Pro Tyr Glu Cys Lys Lys Cys Gly
165 170 175
Lys Ala Phe Ser Gln Asn Ser Gln Phe Ile Gln His Gln Arg Ile His
180 185 190
Ile Gly Glu Lys Ser Tyr Glu Cys Lys Glu Cys Gly Lys Phe Phe Ser
195 200 205
Cys Gly Ser His Val Thr Arg His Leu Lys Ile His Thr Gly Glu Lys
210 215 220
Pro Phe Glu Cys Lys Glu Cys Gly Lys Ala Phe Ser Cys Ser Ser Tyr
225 230 235 240
Leu Ser Gln His Gln Arg Ile His Thr Gly Lys Lys Pro Tyr Glu Cys
245 250 255
Lys Glu Cys Gly Lys Ala Phe Ser Tyr Cys Ser Asn Leu Ile Asp His
260 265 270
Gln Arg Ile His Thr Gly Glu Lys Pro Tyr Glu Cys Lys Val Cys Gly
275 280 285
Lys Ala Phe Thr Lys Ser Ser Gln Leu Phe Gln His Ala Arg Ile His
290 295 300
Thr Gly Glu Lys Pro Tyr Glu Cys Lys Glu Cys Gly Lys Ala Phe Thr
305 310 315 320
Gln Ser Ser Lys Leu Val Gln His Gln Arg Ile His Thr Gly Glu Lys
325 330 335
Pro Tyr Glu Cys Lys Glu Cys Gly Lys Ala Phe Ser Ser Gly Ser Ala
340 345 350
Leu Thr Asn His Gln Arg Ile His Thr Gly Glu Lys Pro Tyr Asp Cys
355 360 365
Lys Glu Cys Gly Lys Ala Phe Thr Gln Ser Ser Gln Leu Arg Gln His
370 375 380
Gln Arg Ile His Ala Gly Glu Lys Pro Phe Glu Cys Leu Glu Cys Gly
385 390 395 400
Lys Ala Phe Thr Gln Asn Ser Gln Leu Phe Gln His Gln Arg Ile His
405 410 415
Thr Asp Glu Lys Pro Tyr Glu Cys Asn Glu Cys Gly Lys Ala Phe Asn
420 425 430
Lys Cys Ser Asn Leu Thr Arg His Leu Arg Ile His Thr Gly Glu Lys
435 440 445
Pro Tyr Asn Cys Lys Glu Cys Gly Lys Ala Phe Ser Ser Gly Ser Asp
450 455 460
Leu Ile Arg His Gln Gly Ile His Thr Asn Lys
465 470 475
<210> 2
<211> 1428
<212> DNA
<213> 人工序列
<220>
<223>
<400> 2
atggctgagg gatcagtgat gttcagtgat gtgtccatag acttctctca ggaggagtgg 60
gactgcctgg accctgttca gagggactta tacagagatg tgatgttgga gaactacggc 120
aatctggttt caatgggact ttacactcct aagcctcaag tgatctcctt attggaacaa 180
gggaaagagc cctggatggt tggcagagag cttacaagag gcctgtgttc agatctggaa 240
tcgatgtgtg aaaccaagtt attatctcta aagaaggaag tttatgaaat agaattatgc 300
cagagggaga taatgggact tacaaagcat ggccttgagt actccagttt tggagatgtt 360
ttggaatata gaagccacct tgcaaaacga ctgggatatc caaatgggca ttttagtcaa 420
gaaatattca ctcctgaata catgcccaca tttattcaac agacattcct tactctccat 480
caaataatta ataatgaaga cagaccctat gaatgtaaga aatgtggaaa ggcctttagt 540
cagaactcac aatttattca acatcagaga attcatattg gtgaaaaatc ttatgaatgt 600
aaagagtgtg ggaaattctt tagttgtggt tcacatgtta ctcggcatct gaaaattcat 660
actggcgaaa aaccctttga atgtaaggaa tgtggaaagg ccttcagttg tagctcatac 720
ctttctcaac atcagagaat ccataccggt aagaaaccct atgaatgtaa ggaatgtggg 780
aaggccttta gttattgctc aaatcttatt gaccatcagc gaattcacac tggtgaaaaa 840
ccttatgaat gtaaagtatg tgggaaagcc tttactaaga gctcacaact ttttcagcat 900
gcacgaattc atacaggtga gaaaccctat gaatgtaagg aatgtggcaa agcctttacc 960
cagagctcaa agcttgttca acatcagaga attcatactg gtgagaaacc ctatgagtgc 1020
aaggaatgtg gcaaagcctt tagtagtggc tcagcactta ctaatcatca gagaattcac 1080
actggtgaga aaccctatga ttgtaaggaa tgtggaaagg cttttactca gagctcacag 1140
cttcgtcaac atcagagaat tcacgctggt gagaaaccct ttgaatgtct tgaatgtggg 1200
aaggccttta ctcagaactc acaacttttc cagcatcaga gaattcatac agatgaaaaa 1260
ccatatgaat gtaatgaatg tggaaaggcc tttaataaat gctcaaacct tactcgacat 1320
ctgagaattc acactggtga aaagccctat aactgtaagg aatgtgggaa ggcttttagt 1380
agtggctcgg atctcattcg tcatcaggga attcatacta ataaataa 1428
<210> 3
<211> 393
<212> PRT
<213> 人工序列
<220>
<223>
<400> 3
Met Glu Glu Pro Gln Ser Asp Pro Ser Val Glu Pro Pro Leu Ser Gln
1 5 10 15
Glu Thr Phe Ser Asp Leu Trp Lys Leu Leu Pro Glu Asn Asn Val Leu
20 25 30
Ser Pro Leu Pro Ser Gln Ala Met Asp Asp Leu Met Leu Ser Pro Asp
35 40 45
Asp Ile Glu Gln Trp Phe Thr Glu Asp Pro Gly Pro Asp Glu Ala Pro
50 55 60
Arg Met Pro Glu Ala Ala Pro Pro Val Ala Pro Ala Pro Ala Ala Pro
65 70 75 80
Thr Pro Ala Ala Pro Ala Pro Ala Pro Ser Trp Pro Leu Ser Ser Ser
85 90 95
Val Pro Ser Gln Lys Thr Tyr Gln Gly Ser Tyr Gly Phe Arg Leu Gly
100 105 110
Phe Leu His Ser Gly Thr Ala Lys Ser Val Thr Cys Thr Tyr Ser Pro
115 120 125
Ala Leu Asn Lys Met Phe Cys Gln Leu Ala Lys Thr Cys Pro Val Gln
130 135 140
Leu Trp Val Asp Ser Thr Pro Pro Pro Gly Thr Arg Val Arg Ala Met
145 150 155 160
Ala Ile Tyr Lys Gln Ser Gln His Met Thr Glu Val Val Arg Arg Cys
165 170 175
Pro His His Glu Arg Cys Ser Asp Ser Asp Gly Leu Ala Pro Pro Gln
180 185 190
His Leu Ile Arg Val Glu Gly Asn Leu Arg Val Glu Tyr Leu Asp Asp
195 200 205
Arg Asn Thr Phe Arg His Ser Val Val Val Pro Tyr Glu Pro Pro Glu
210 215 220
Val Gly Ser Asp Cys Thr Thr Ile His Tyr Asn Tyr Met Cys Asn Ser
225 230 235 240
Ser Cys Met Gly Gly Met Asn Arg Arg Pro Ile Leu Thr Ile Ile Thr
245 250 255
Leu Glu Asp Ser Ser Gly Asn Leu Leu Gly Arg Asn Ser Phe Glu Val
260 265 270
Arg Val Cys Ala Cys Pro Gly Arg Asp Arg Arg Thr Glu Glu Glu Asn
275 280 285
Leu Arg Lys Lys Gly Glu Pro His His Glu Leu Pro Pro Gly Ser Thr
290 295 300
Lys Arg Ala Leu Pro Asn Asn Thr Ser Ser Ser Pro Gln Pro Lys Lys
305 310 315 320
Lys Pro Leu Asp Gly Glu Tyr Phe Thr Leu Gln Ile Arg Gly Arg Glu
325 330 335
Arg Phe Glu Met Phe Arg Glu Leu Asn Glu Ala Leu Glu Leu Lys Asp
340 345 350
Ala Gln Ala Gly Lys Glu Pro Gly Gly Ser Arg Ala His Ser Ser His
355 360 365
Leu Lys Ser Lys Lys Gly Gln Ser Thr Ser Arg His Lys Lys Leu Met
370 375 380
Phe Lys Thr Glu Gly Pro Asp Ser Asp
385 390
<210> 4
<211> 1182
<212> DNA
<213> 人工序列
<220>
<223>
<400> 4
atggaggagc cgcagtcaga tcctagcgtc gagccccctc tgagtcagga aacattttca 60
gacctatgga aactacttcc tgaaaacaac gttctgtccc ccttgccgtc ccaagcaatg 120
gatgatttga tgctgtcccc ggacgatatt gaacaatggt tcactgaaga cccaggtcca 180
gatgaagctc ccagaatgcc agaggctgct ccccccgtgg cccctgcacc agcagctcct 240
acaccggcgg cccctgcacc agccccctcc tggcccctgt catcttctgt cccttcccag 300
aaaacctacc agggcagcta cggtttccgt ctgggcttct tgcattctgg gacagccaag 360
tctgtgactt gcacgtactc ccctgccctc aacaagatgt tttgccaact ggccaagacc 420
tgccctgtgc agctgtgggt tgattccaca cccccgcccg gcacccgcgt ccgcgccatg 480
gccatctaca agcagtcaca gcacatgacg gaggttgtga ggcgctgccc ccaccatgag 540
cgctgctcag atagcgatgg tctggcccct cctcagcatc ttatccgagt ggaaggaaat 600
ttgcgtgtgg agtatttgga tgacagaaac acttttcgac atagtgtggt ggtgccctat 660
gagccgcctg aggttggctc tgactgtacc accatccact acaactacat gtgtaacagt 720
tcctgcatgg gcggcatgaa ccggaggccc atcctcacca tcatcacact ggaagactcc 780
agtggtaatc tactgggacg gaacagcttt gaggtgcgtg tttgtgcctg tcctgggaga 840
gaccggcgca cagaggaaga gaatctccgc aagaaagggg agcctcacca cgagctgccc 900
ccagggagca ctaagcgagc actgcccaac aacaccagct cctctcccca gccaaagaag 960
aaaccactgg atggagaata tttcaccctt cagatccgtg ggcgtgagcg cttcgagatg 1020
ttccgagagc tgaatgaggc cttggaactc aaggatgccc aggctgggaa ggagccaggg 1080
gggagcaggg ctcactccag ccacctgaag tccaaaaagg gtcagtctac ctcccgccat 1140
aaaaaactca tgttcaagac agaagggcct gactcagact ga 1182
<210> 5
<211> 21
<212> DNA/RNA
<213> 人工序列
<220>
<223>
<400> 5
gggauaucca aaugggcaut t 21
<210> 6
<211> 21
<212> DNA/RNA
<213> 人工序列
<220>
<223>
<400> 6
augcccauuu ggauauccct t 21
<210> 7
<211> 21
<212> DNA/RNA
<213> 人工序列
<220>
<223>
<400> 7
gcucacagcu ucgucaacat t 21
<210> 8
<211> 21
<212> DNA/RNA
<213> 人工序列
<220>
<223>
<400> 8
uguugacgaa gcugugagct t 21
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺