治疗系统性红斑狼疮的药物组合物的制作方法
本发明涉及一种治疗系统性红斑狼疮的药物组合物,具体涉及一种含有化合物CinnamtaninB-1和/或CinnamtaninD-1的治疗系统性红斑狼疮的药物组合物。
背景技术:
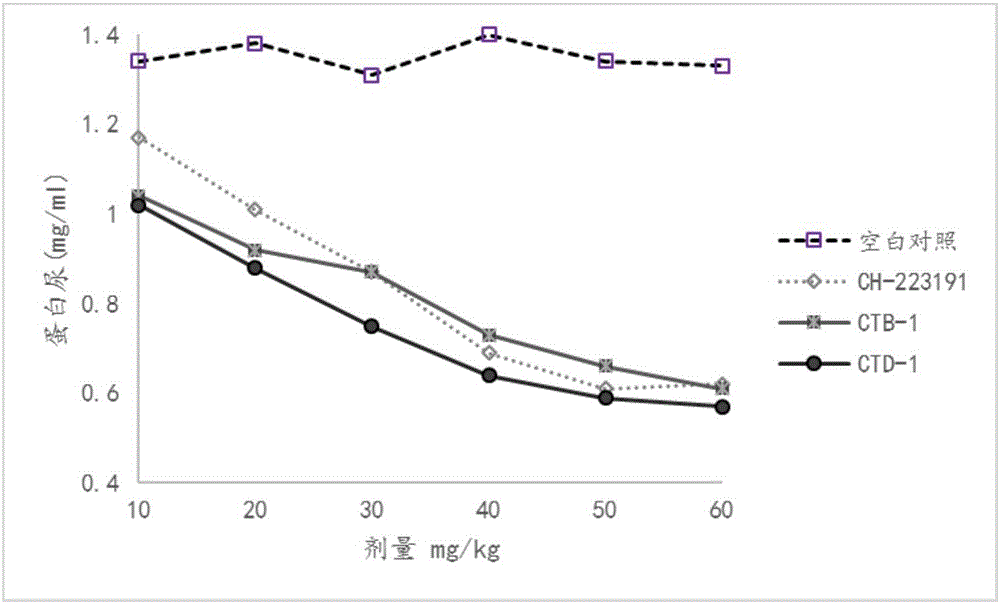
:系统性红斑狼疮(Systemiclupuserythematosus,SLE)是一种累及多系统多脏器的自身免疫性疾病,男女发病的比率为1:7~10不等,我国患病率约为70/10万人,并呈逐年增加趋势。已知SLE的发病与性激素密切相关,但具体与哪一项性激素或其含量有关,至今仍存在较大争议。SLE病因不明,目前尚缺乏特效的治疗药物。在没有激素治疗之前,红斑狼疮患者的5年死亡率几乎是100%,在应用激素及免疫抑制剂等治疗后,目前5年死亡率降到了27%。但是,终生服用激素和免疫抑制剂不仅成为患者沉重的经济负担,而且造成机体的免疫功能低下,诱发感染、糖尿病、消化道出血、骨质疏松等疾病。因而加紧对系统性红斑狼疮研究具有重要意义。现在临床上用于治疗系统性红斑狼疮的药物主要有以下几类。1.糖皮质激素类:是现在治疗系统性红斑狼疮的首选药物,用于急性暴发性狼疮、脏器受损、急性溶血性贫血、血小板减少性紫癜等。通常采用泼尼松,每日3mg/kg,根据病情调整剂量。4~6周病情好转后缓慢逐渐减量,防止病情反复。但是长期服用此类药物,会诱发感染、水盐代谢异常、神经精神紊乱、骨质疏松等疾病。2.非甾体类抗炎药:均为口服用药,主要用于发热、关节、肌肉酸痛,而无明显血液病变的轻症患者,常用的有阿司匹林、吲哚美辛、布洛芬等。3.免疫抑制剂:应用于易复发但因严重不良反应而不能使用激素者。常用的有环磷酰胺、硫唑嘌呤、甲氨蝶呤、长春新碱等。此类药毒性和副作用较大,使用中应定期查血象、肝功能。4.抗疟药:主要治疗盘状狼疮,通常用磷酸氯喹,每日250~500mg,其衍生物排泄缓慢,可在体内蓄积,引起视网膜退行性病变,故应定期查眼底。芳香烃受体AhR是一种胞质受体,属于基本螺旋-环-螺旋转录因子家族。其配体多为外源性配体主要包括合成的和天然的多环芳烃类物质,如二恶英和黄酮类、多酚类与吲哚类化合物等,内源性配体发现较少。虽然现在系统性红斑狼疮的发病机理尚不明确,但是CTD4+T细胞亚群中的Th17细胞在系统性红斑狼疮的发病过程中起重要作用,而Treg细胞起抑制过度的免疫应答的作用。因此,靶向调节Th17细胞和Treg细胞两者的平衡在疾病的治疗中有重要的意义。芳香烃受体(AhR)普遍存在于脊椎动物细胞质中,是一种配体激活型转录因子,属于碱性螺旋-环-螺旋超家族中的PAS蛋白亚型。AhR存在于各种免疫细胞中,如Th17细胞、γδT细胞、调节性T细胞和抗原提呈细胞等。Veldhoen等利用基因芯片分析检测到AhR在Th17细胞内表达,并且AhR仅在分化的Th17细胞内起作用。AhR的高亲和力内源性配体,色氨酸衍生的光产物FICZ(6-formylindolo[3,2-b]carbazole)可以促使Th0细胞向Th17方向分化。另外,外界环境毒素TCTDD作为AhR的外源性配体却可以使CTD4+T细胞向Treg分化。且在EAE小鼠模型中,给予TCTDD可以缓解疾病的严重程度。综上所述,芳香烃受体可以通过配体依赖的方式调节Th17与Treg细胞分化,从而为自身免疫性疾病的治疗提供了新的靶点。原花青素类化合物具有多种生物活性,如抗氧化作用,抗衰老作用,降血糖作用等。如富含原花青素类化合物的茶多酚制剂已广泛用于临床。但低聚原花青素类化合物的活性报道较少,未见报道化合物CinnamtaninB-1和CinnamtaninD-1的治疗红斑狼疮疾病报道,而且也未见报道化合物CinnamtaninB-1和CinnamtaninD-1具有芳香烃受体的抑制作用。因此,CinnamtaninB-1和CinnamtaninD-1有望作为AhR抑制药物,为治疗红斑狼疮疾病提供一种新的方法,并有望克服先要治疗药物中的缺陷。技术实现要素:本发明的目的是提供一种治疗系统性红斑狼疮的药物组合物,具体提供一种含有化合物CinnamtaninB-1(本文简称CTB-1)和/或CinnamtaninD-1(本文简称CTD-1)的治疗系统性红斑狼疮的药物组合物。同时,还提供CinnamtaninB-1和CinnamtaninD-1的一种药物用途。本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1的一种药物用途,是指以化合物CinnamtaninB-1和/或CinnamtaninD-1作为活性成分之一或唯一的活性成分用于制备治疗红斑狼疮的药物制剂。进一步说,本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1具有如下化学结构式:本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1的一种制备方法,包括如下步骤:将富含原花青素类化合物的植物,用95vol%的乙醇水溶液回流提取,减压浓缩提取液得浸膏;向所得浸膏中加1倍量水混悬后,依次用石油醚和乙酸乙酯萃取,收集乙酸乙酯萃取液;减压回收乙酸乙酯后进行硅胶柱层析,依次用石油醚和乙酸乙酯进行梯度洗脱,分段接收,合并,得17个流分;各流分再用硅胶柱层析、反相硅胶柱层析分离,最后用SephadexLH-20纯化,即获得cinnamtanninD-1单体化合物和cinnamtanninB-1单体化合物。所述富含原花青素类化合物的植物,可列举有肉桂、柴桂、油桂、天竺桂、细叶香桂、锡兰桂、阴香、黑枸杞、蓝莓、黑桑葚、紫薯、紫甘蓝、紫洋葱、紫葡萄、红心火龙果、樱桃、荔枝壳、荔枝核、桂圆壳、桂圆核、紫茄子、红石榴、山楂等。研究表明:本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1的半数细胞致死浓度(CC50)>50μg/mL,并在自发性狼疮模型中显示有明显的抑制蛋白尿的作用,可望作为活性成分之一或唯一的活性成分用于制备治疗红斑狼疮的药物制剂。本公开中所述的药物制剂形式是任何可药用的口服剂型或注射剂,包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、注射液、粉针剂等。本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1来自植物,但不限定来自植物,任何化学合成的方法得到的化合物CinnamtaninB-1和CinnamtaninD-1,只要具有同样的活性,也在本发明的保护范围之内。本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1来自天然肉桂药材,所述天然肉桂药材是樟科植物肉桂的干燥树皮。本发明人在使用乙醇对肉桂药材进行提取,并依次用石油醚(1000mL×3)和乙酸乙酯(1000mL×3)萃取,收集乙酸乙酯萃取液;减压回收乙酸乙酯后进行硅胶柱层析,依次用石油醚和乙酸乙酯进行梯度洗脱,分段接收,合并,得17个流分;第14流分用反相硅胶柱层析分离,甲醇-水洗脱,分段接收,合并,得5个流分;然而在第3流分和第4流分中,分别获得了化合物CinnamtaninB-1和CinnamtaninD-1,所得化合物CinnamtaninB-1和CinnamtaninD-1互为同分异构体,除了提取过程中表现出的物理性质的差异外,本发明人还惊奇地发现了不同异构体的活性表现出差异,当两种不同的同分异构体共同作用时,表现出了比单独使用时更好的效果,即出现了协同作用。本发明人在多次创造性试验的基础上,发现了最优选的混合比例,并取得了意想不到的效果,从而完成了本发明。具体实施方式下面结合实施例对本公开作进一步详细、完整地说明,但并不因此限制本发明;本领域的技术人员根据下述内容所作的一些非本质的改进或替换均属于本发明的保护范围。实施例1:化合物CinnamtanninB-1(CAS号:88082-60-4)的制备将1.0kg肉桂药材,用5L的95vol%的乙醇水溶液进行回流提取,每次回流2小时,共回流提取3次,合并提取液,减压浓缩得浸膏(约800mL);向该浸膏中加1倍量水混悬后,依次用石油醚(1000mL×3)和乙酸乙酯(1000mL×3)萃取,收集乙酸乙酯萃取液;减压回收乙酸乙酯后进行硅胶柱层析,依次用石油醚和乙酸乙酯进行梯度洗脱,分段接收,合并,得17个流分;第14流分用反相硅胶柱层析分离,甲醇-水洗脱,分段接收,合并,得5个流分;第3流分用SephadexLH-20纯化,即得化合物CinnamtanninB-1,为白色粉末。经分析,该化合物具有以下光谱学特征:ESI-MS,m/z,887[M+Na]+,863[M-H]-。1H-NMR(400MHz,CD3OD)中,高场δH2.00-5.00为黄烷三醇C环上质子信号,其中有一对典型AB系统的质子信号(d,3.4Hz)为上部结构单元中C环上H-3,4的信号;低场δH6.00左右有四个黄烷三醇A环上芳香氢质子信号;低场δH6.50-7.50有三组B环上ABX芳香氢信号。13C-NMR(100MHz,CD3OD)中的缩酮碳信号δC100.0[C-2],氢谱中出现A型连接方式化合物C环上H-3,4的典型信号3.31(d,3.5Hz,H-3)和4.17(d,3.5Hz,H-4)。23-trans和23-cis构型的区别可以通过底部黄烷三醇C环上C-2的位移大小来判断,具体可参考Balde,A.,Phytochemistry(植物化学)1995,40,933-938.上的文章。CTB-1化合物该单元中的C-2位移在80ppm,确定底部黄烷三醇为表儿茶素构型。由上述光谱学特征,根据文献FoodChemistry,2007,105,1446-1451可确知所得化合物为CinnamtanninB-1。HPLC纯度测定方法:仪器,WATERSUPLCACQUITY;色谱柱,AgilentExtentC18(4.6*250mm,5μm);流动相,乙腈-0.1%乙酸水溶液梯度洗脱;检测波长,3D全波长和2D280nm。该方法下,CinnamtanninB-1保留时间为12.2min。经测定得知,本实施例所获得的化合物CinnamtanninB-1的HPLC纯度为95.03%。实施例2:化合物CinnamtanninD-1(CASNo.97233-60-2)的制备将10.0kg肉桂药材,用5L的95vol%的乙醇水溶液进行回流提取,每次回流2小时,共回流提取3次,合并提取液,减压浓缩得浸膏(约800mL);向该浸膏中加1倍量水混悬后,依次用石油醚(1000mL×3)和乙酸乙酯(1000mL×3)萃取,收集乙酸乙酯萃取液;减压回收乙酸乙酯后进行硅胶柱层析,依次用石油醚和乙酸乙酯进行梯度洗脱,分段接收,合并,得17个流分;第14流分用反相硅胶柱层析分离,甲醇-水洗脱,分段接收,合并,得5个流分;第4流分用SephadexLH-20纯化,即得化合物CinnamtanninD-1,为白色粉末。经分析,该化合物具有以下光谱学特征:ESI-MS,m/z,887[M+Na]+,863[M-H]-。1H-NMR(400MHz,CD3OD)中,高场δH2.00-5.00为黄烷三醇C环上质子信号,其中有一对典型AB系统的质子信号(d,3.4Hz)为上部结构单元中C环上H-3,4的信号;低场δH6.00左右有四个黄烷三醇A环上芳香氢质子信号;低场δH6.50-7.50有三组B环上ABX芳香氢信号。13C-NMR(100MHz,CD3OD)中的缩酮碳信号δC100.4[C-2],氢谱中出现A型连接方式化合物C环上H-3,4的典型信号3.31(d,3.5Hz,H-3)和4.17(d,3.5Hz,H-4)。与CTB-1不一样的是,13C-NMR中,CTD-1化合物该单元中的C-2位移在82ppm,确定CTD-1的底部黄烷三醇是儿茶素构型。由上述光谱学特征,根据文献Killday,K.B.,JNatProd.2011,74,1833-1841.可确知所得化合物为CinnamtanninD-1。HPLC纯度测定方法:仪器,WATERSUPLCACQUITY;色谱柱,AgilentExtentC18(4.6*250mm,5μm);流动相,乙腈-0.1%乙酸水溶液梯度洗脱;检测波长,3D全波长和2D280nm。该方法下,CinnamtanninD-1的保留时间为10.5min。经测定得知,本实施例所获得的化合物CinnamtanninD-1的HPLC纯度为98.08%。实施例3用MTT法检测本发明所述化合物的细胞毒性MTT实验过程:样品组:用DMSO溶剂对实施例1和2所制备的化合物分别配制成浓度为12.5μg/mL、25μg/mL及50μg/mL的溶液;对照组:RPMI-1640培养液;6周龄Balb/c小鼠处死,75%乙醇消毒,无菌取脾脏,用玻片碾磨脾脏,过200目滤膜,4℃1200rpm,离心5分钟,弃上清,每个脾脏加0.6ml的红细胞裂解液,混匀,静置30s,待有絮状沉淀,加PBS至10ml,4℃1200rpm,离心5分钟,弃上清,加2mlPBS,过200目滤膜,加PBS至10ml,4℃1200rpm,离心5分钟,加入1640培养液,取10μl细胞悬液加入190μl台盼蓝,混匀,取10μl,显微镜下计数,调细胞浓度至4×105个/孔,与各实验组样品分别共培养48h,在培养结束前4h加入MTT溶液(5mg/mL)。培养结束后,吸去培养上清150μL,再加150μLDMSO溶解甲臜颗粒,低速摇床10min,用酶标仪于570nm处读取OD值。样品组:用DMSO溶剂对实施例1和2所制备的化合物分别配制成浓度为12.5μg/mL、25μg/mL及50μg/mL的溶液;对照组:RPMI-1640培养液;将BALB/c小鼠脾淋巴细胞(4×105个/孔)与各实验组样品分别共培养48h,在培养结束前4h加入MTT溶液(5mg/mL)。培养结束后,吸去培养上清150μL,再加150μLDMSO溶解甲臜颗粒,低速摇床10min,用酶标仪于570nm处读取OD值。检测各实验组的细胞活性值(OD值),详细检测结果见表1所示。表1各实验组在作用48h后所测的细胞OD值(n=5)实验组nOD值对照组50.210±0.018CinnamtanninB-1(12.5μg/mL)50.221±0.016CinnamtanninB-1(25μg/mL)50.208±0.013CinnamtanninB-1(50μg/mL)50.202±0.021CinnamtanninD-1(12.5μg/mL)50.311±0.028CinnamtanninD-1(25μg/mL)50.267±0.024CinnamtanninD-1(50μg/mL)50.223±0.020由表1结果可见:本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1在浓度为12.5μg/mL、25μg/mL及50μg/mL时均没有细胞毒性,并根据细胞试验得到半数致死剂量(LC50)>2g/kg。实施例4选用红斑狼疮动物模型:NZB/WF1新西兰狼疮鼠,是国际上公认的与人类系统性红斑狼疮最接近的模型。NZB/WF1小鼠自出生后5、6个月开始出现蛋白尿,8月龄鼠群即有80%以上出现蛋白尿,到12个月,几乎全部自发SLE,免疫异常与人SLE非常相似,产生多种自身抗体(包括IgG、抗dsDNA抗体、抗红细胞抗体)、蛋白尿及狼疮性肾炎。本实验以蛋白尿作为临床观察指标,检测药物的作用。35周龄(8个月作用)小鼠,在检测到蛋白尿后,随机分组,每组5只,设对照组及六个给药组,连续给药4周后测蛋白尿。实验结果如图1所示,CTB-1和CTD-1均表现出良好的降低尿蛋白的作用,并显示了浓度依赖性,尤其是在剂量为40-60mg/kg之间,表现出更优异的降低蛋白尿的效果。本发明中,将CTB-1和CTD-1混合使用后,如图2所示的结果表示两种同分异构体的混合使用产生了协同作用,即混合使用后比单独使用产生了更好的效果,因此混合使用CTB-1和CTD-1时,优选CTB-1的使用量为10-40mg/kg,同时CTD-1的优选使用量为10-60mg/kg;更优选CTB-1:10-40mg/kg,CTD-1:10-50mg/kg;进一步优选CTB-1:20-40mg/kg,CTD-1:20-50mg/kg;最优选CTB-1:30mg/kg,CTD-1:30mg/kg。实施例5CH-223191是一种有效的特定arylhydrocarbonreceptor(AhR)拮抗剂,本发明将其作为阳性对照,来评价本发明的化合物的效果。本发明的CH-223191购自Sigma公司。用MTT法检测本公开所述化合物及已知芳香烃受体拮抗剂的细胞毒性,并用3H法检测两者的体外活性。MTT法同实例3。3H法实验过程:样品组:用DMSO溶剂对实施例1和2所制备的化合物分别配制成浓度为12.5μg/mL、25μg/mL及50μg/mL的溶液;6周龄Balb/c小鼠处死,75%乙醇消毒,无菌取脾脏,用玻片碾磨脾脏,过200目滤膜,4℃1200rpm,离心5分钟,弃上清,每个脾脏加0.6ml的红细胞裂解液,混匀,静置30s,待有絮状沉淀,加PBS至10ml,4℃1200rpm,离心5分钟,弃上清,加2mlPBS,过200目滤膜,加PBS至10ml,4℃1200rpm,离心5分钟,加入1640培养液,取10μl细胞悬液加入190μl台盼蓝,混匀,取10μl,显微镜下计数,调细胞浓度至4×105个/孔,与各实验组样品分别共培养48h,在培养结束前8h加入3H溶液。培养结束后,收集细胞,液闪仪读取cpm值,结果如图4所示。检测各实验组的细胞活性值(cpm),详细检测结果见图3所示。CTD-1、CTB-1均显示没有细胞毒性,CTD-1、CTB-1的抑制活性要高于CH-223191(p<0.001)。CTD-1和CTB-1同时给药的情况下抑制性高于CTD-1、CTB-1单独给药(p<0.001)。综上所述可见:本公开所述的化合物CinnamtaninB-1和CinnamtaninD-1的半数细胞致死浓度(CC50)>50μg/mL,并能有效抑制NZB/W小鼠的狼疮样病变,其作用机理为抑制芳香烃受体。可望作为活性成分之一或唯一的活性成分用于制备治疗系统性红斑狼疮的药物制剂,具有药用价值。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1