一种针体可溶而基底不可溶的微针制备方法与流程
本发明涉及微针技术领域,特别涉及一种针体可溶而基底不可溶的微针制备方法。
背景技术:
微针是一种尺寸在微米级的针状突起阵列,主要用于药物的经皮输送;它与皮下注射针一样有效,又和传统的经皮贴片一样方便,已成为制剂领域的研究热点之一。可溶微针作为其中最热门的一种类型,具有适合量产,使用简单,生物相容性高,不产生尖锐的医疗垃圾等优点。目前的可溶微针的制作方法主要包括模具浇注法(占大多数)和“stepwise controlled drawing”等。模具浇注法一般分为两步:先将含有药物的溶液注入模具,干燥后形成针体层(0.5-1小时),然后加入不含药物的溶液作为基底层,干燥(12-24小时)后,脱模获得可溶微针。“stepwise controlled drawing”将熔融的含药的麦芽糖(103℃)注入9*9的空心柱体容器内,将熔液推出到另一块金属板上,然后将空心柱体容器慢慢上移,使麦芽糖凝固,最后形成可溶微针。这两种方法制备的可溶微针存在给药效率低、制作时间长和药物容易失活等严重问题。
缺点1:采用模具浇注法制作的可溶微针存在给药效率低的问题。产生可溶微针给药效率低的问题的因素主要有以下2点。第一,由药物扩散引起的:通常可溶微针制备过程分为两步,先将含有药物的溶液注入模具,干燥后形成针体层,然后加入不含药物的溶液作为基底层,由于存在浓度差,药物从针体层逐渐扩散到基底层,导致针体层含药量降低。第二,可溶微针的针体层不能完全刺入皮肤:由于皮肤的弹性和可溶微针较差的机械强度,刺入皮肤的深度一般不会超过针体层的一半。在这2个因素共同作用下,导致可溶微针给药效率低。
缺点2:采用模具浇注法制作的可溶微针存在制备时间长的问题。模具浇注法分为2步,第一步主要是针体层溶液的干燥,由于溶液体积很小,因此干燥时间很短,一般为0.5-1小时;第二步主要是基底层溶液的干燥,由于溶液体积大,而且通过提高温度快速干燥容易产生气泡和基底层不平整等问题,因此需要控制在较低温度和适宜的湿度下干燥,所以干燥时间长,一般为12-24小时。因此,传统的可溶微针制备时间为两步时间之和,约为12.5-25小时。
缺点3:采用“stepwise controlled drawing”,药物会因温度过高(103℃)而导致失活。“stepwise controlled drawing”的制备过程使用了熔融的麦芽糖(103℃)作为可溶微针的材料,药物需要在此温度下停留较长时间,因此会对药物稳定性造成影响,尤其是一些具有生物活性的大分子药物。
技术实现要素:
为解决上述可溶微针给药效率低、药物容易失活和制作时间长的问题,发明人提供了一种针体可溶而基底不可溶的微针制备方法;
步骤一、在室温下称取水溶性高分子,加入蒸馏水中,进行搅拌溶解,配制成质量百分浓度为5%-20%的高分子水溶液,备用;
步骤二、将药物加入所述高分子水溶液中,配制成含药物质量百分浓度为0.1%-30%的含药高分子水溶液;
步骤三、将预设体积的含药高分子水溶液加入到微针模具中,采用离心或真空法使含药高分子水溶液进入微针模具的微孔中,吸取残留在微针模具表面上的溶液,将微针模具干燥至含药高分子水溶液在微针模具内形成微针的针体层;
步骤四、将预设低熔点的材料加热至融化后,加入到含有微针针体层的微针模具中,将钢板放置于熔液之上,反复向下按压多次,直至将熔液压入微针模具微孔中,放置2-5分钟,使基底层凝固,脱模获得针体可溶而基底不可溶的微针。
作为本发明的一种优选方法,步骤一中所述的水溶性高分子为聚乙烯醇、聚乙烯吡咯烷酮、聚马来酸酐、聚丙烯酸、羟丙基甲基纤维素、羧甲基纤维素、葡聚糖以及明胶,其中任意一种或组合。
作为本发明的一种优选方法,步骤三中含药高分子水溶液的预设体积为2-500微升。
作为本发明的一种优选方法,步骤三中所述针体层的高度与药物浓度、高分子浓度以及含药高分子水溶液的体积成正比。
作为本发明的一种优选方法,步骤四中低熔点材料的预设熔点为55-65℃。
作为本发明的一种优选方法,步骤四中预设低熔点的材料为聚己内酯或聚乙二醇,其中任意一种或组合。
区别于现有技术,上述技术方案为解决可溶微针给药效率低、药物容易失活和制作时间长的问题,提出针体层和基底层采用不同类型的材料,即针体层采用水溶性材料,而基底层采用水不溶性材料。基底层不再由溶液干燥制备,而是直接由低熔点的高分子熔液凝固而成。由于基底层不再是水溶液,没有漫长的干燥时间(12-24小时),药物不会从针体层再扩散到基底层。药物不发生扩散,因此全部都集中在针体层中。通过控制针体层溶液的浓度和体积,控制针体层的长度,使得含药部分均能刺入皮肤。采用低熔点的高分子作为基底层,不仅能够保证药物的活性,而且大大减少了微针制备的时间。
附图说明:
图1为具体实施方式所述以美洛昔康作为药物,其药物的给药效率;
图2为具体实施方式所述以酪氨酸酶即一种生物活性药物为模型,药物活性保持图;
图3为具体实施方式所述以美洛昔康做为药物模型,大鼠作为动物模型的血药浓度曲线;
图4为具体实施方式所述以美洛昔康做为药物模型,以小鼠热板痛觉试验为检验方式,不同剂量下小鼠舔足的时间图。
具体实施方式:
为详细说明技术方案的技术内容、构造特征、所实现目的及效果,以下结合具体实施例详予说明。
实施例一:
S1、在室温下称取水溶性高分子,加入蒸馏水中,进行搅拌溶解,配制成质量百分浓度为5%的高分子水溶液,备用;述的水溶性高分子为聚乙烯醇、聚乙烯吡咯烷酮、聚马来酸酐、聚丙烯酸、羟丙基甲基纤维素、羧甲基纤维素、葡聚糖以及明胶,其中任意一种或组合。
S2、将药物加入所述高分子水溶液中,配制成含药物质量百分浓度为0.1%的含药高分子水溶液;
S3、将预设体积的含药高分子水溶液加入到微针模具中,采用离心或真空法使含药高分子水溶液进入微针模具的微孔中,吸取残留在微针模具表面上的溶液,将微针模具干燥至含药高分子水溶液在微针模具内形成微针的针体层;具体的含药高分子水溶液的预设体积为500微升;所述针体层的高度与药物浓度、高分子浓度以及含药高分子水溶液的体积成正比。
S4、将预设低熔点的材料加热至融化后,加入到含有微针针体层的微针模具中,通过钢板将熔液压入微针模具微孔中,将钢板放置于熔液之上,反复轻轻向下按压多次,直至将熔液压入微针模具微孔中,放置5分钟,使基底层凝固,脱模获得针体可溶而基底不可溶的微针;低熔点材料的预设熔点为55℃;为聚己内酯或聚乙二醇,其中任意一种或组合。
实施例二:
S1、在室温下称取水溶性高分子,加入蒸馏水中,进行搅拌溶解,配制成质量百分浓度为20%的高分子水溶液,备用;述的水溶性高分子为聚乙烯醇、聚乙烯吡咯烷酮、聚马来酸酐、聚丙烯酸、羟丙基甲基纤维素、羧甲基纤维素、葡聚糖以及明胶,其中任意一种或组合。
S2、将药物加入所述高分子水溶液中,配制成含药物质量百分浓度为30%的含药高分子水溶液;
S3、将预设体积的含药高分子水溶液加入到微针模具中,采用离心或真空法使含药高分子水溶液进入微针模具的微孔中,吸取残留在微针模具表面上的溶液,将微针模具干燥至含药高分子水溶液在微针模具内形成微针的针体层;具体的含药高分子水溶液的预设体积为2微升;所述针体层的高度与药物浓度、高分子浓度以及含药高分子水溶液的体积成正比;
具体的离心或真空法操作方法:将加满药高分子水溶液的微针模具放置在离心管中,使微针模具的微孔朝外,盖上离心管盖,开启离心机使微针模具进行离心运动,药高分子水溶液进入到微针模具微孔中;通过对离心管旋转产生的离心力,使药高分子水溶液注入到微针模具的各微孔中。
S4、将预设低熔点的材料加热至融化后,加入到含有微针针体层的微针模具中,通过钢板将熔液压入微针模具微孔中,将钢板放置于熔液之上,反复轻轻向下按压多次,直至将熔液压入微针模具微孔中,放置5分钟,使基底层凝固,脱模获得针体可溶而基底不可溶的微针;低熔点材料的预设熔点为65℃;为聚己内酯或聚乙二醇,其中任意一种或组合。
实施例三:
S1、在室温下称取水溶性高分子,加入蒸馏水中,进行搅拌溶解,配制成质量百分浓度为15%的高分子水溶液,备用;述的水溶性高分子为聚乙烯醇、聚乙烯吡咯烷酮、聚马来酸酐、聚丙烯酸、羟丙基甲基纤维素、羧甲基纤维素、葡聚糖以及明胶,其中任意一种或组合。
S2、将药物加入所述高分子水溶液中,配制成含药物质量百分浓度为20%的含药高分子水溶液;
S3、将预设体积的含药高分子水溶液加入到微针模具中,采用离心或真空法使含药高分子水溶液进入微针模具的微孔中,吸取残留在微针模具表面上的溶液,将微针模具干燥至含药高分子水溶液在微针模具内形成微针的针体层;具体的含药高分子水溶液的预设体积为230微升;所述针体层的高度与药物浓度、高分子浓度以及含药高分子水溶液的体积成正比。
S4、将预设低熔点的材料加热至融化后,加入到含有微针针体层的微针模具中,将钢板放置于熔液之上,反复轻轻向下按压多次,直至将熔液压入微针模具微孔中,放置3分钟,使基底层凝固,脱模获得针体可溶而基底不可溶的微针;低熔点材料的预设熔点为60℃;为聚己内酯或聚乙二醇,其中任意一种或组合。
以下用实验数据或指标数据说明本发明达到的效果
优点1:以美洛昔康作为药物,实现药物只集中于针体层,而不向基底层扩散。通过控制药物溶液的浓度,控制微针上的载药量。动物实验结果表明,数据下图1所示,该微针大大地提高了给药效率(76、79和82%),而一般可溶微针的给药效率只有20%。
如图1所示以美洛昔康作为药物,其药物的给药效率
优点2:可溶微针制作时间大大缩短,从12.5-25小时缩短到2小时左右。
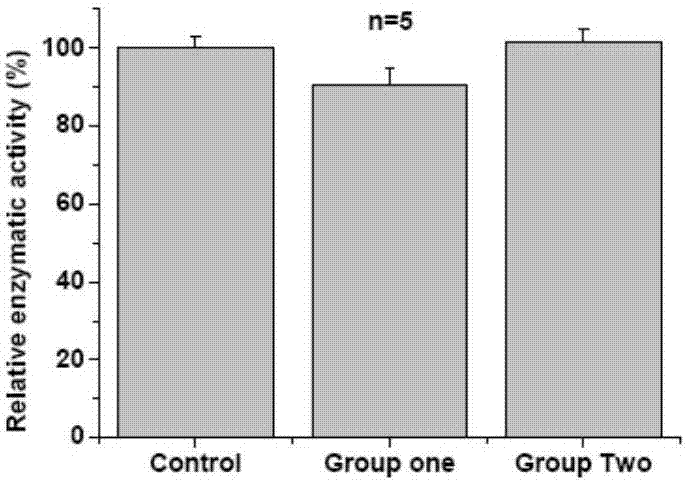
优点3:以酪氨酸酶(生物活性药物)为模型,证明药物活性基本不受影响,如下图2所示。
如图2所示以酪氨酸酶即一种生物活性药物为模型,药物活性保持图
整个制作过程(Group one,活性保持91%)和针体层干燥过程(Group two,活性保持100%)对药物活性的影响规律,发现针体干燥过程药物活性不受影响,而整个制作过程中,药物活性只有轻微下降。
优点4:以美洛昔康作为模型药物,大鼠作为动物模型,对可溶微针的药代动力学进行研究。实验分为两组,一组为灌胃组(IG),一组为可溶微针组,不同时间点采血。血样经过处理后用液相色谱法检测,然后绘制药时曲线图,如下图3所示。结果表明可溶微针组的血药浓度曲线与灌胃组相近,而且药时曲线下面积比灌胃组更高,说明可溶微针比灌胃组更加有效。这一实验结果证明了采用专利所示的方法能够实现药物的输送。
如图3所示以美洛昔康做为药物模型,大鼠作为动物模型的血药浓度曲线
优点5:以美洛昔康为药物模型,以小鼠热板痛觉试验为检验方式,发现美洛昔康微针的低剂量组、中剂量组和高剂量组都能有效地提高小鼠舔足的时间如下图4所示,证明采用该方法制备的可溶微针是有效的。
如图4所示以美洛昔康做为药物模型,以小鼠热板痛觉试验为检验方式,不同剂量下小鼠舔足的时间图。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者终端设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者终端设备所固有的要素。在没有更多限制的情况下,由语句“包括……”或“包含……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者终端设备中还存在另外的要素。此外,在本文中,“大于”、“小于”、“超过”等理解为不包括本数;“以上”、“以下”、“以内”等理解为包括本数。
尽管已经对上述各实施例进行了描述,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改,所以以上所述仅为本发明的实施例,并非因此限制本发明的专利保护范围,凡是利用本发明说明书所作的等效方法或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!