一种物理包裹的肿瘤靶向纳米递药系统及制备方法和应用与流程
本发明属药物制剂领域,具体地说是用物理包裹作用实现靶向元件修饰在纳米胶束药物中的制备方法及用途。
背景技术:
神经胶质瘤是最常见的脑部肿瘤之一,约占脑瘤发病率的40%,其恶化程度和术后复发率高且侵袭速度快,致使神经胶质瘤病人存活期短:临床上诊断出的ⅰ期或者ⅱ期病人存活时间为6-8年,ⅲ期病人为3年,而ⅳ期病人一般只有12-18个月。作为颅内肿瘤,神经胶质瘤具有许多独特的地方,其肿瘤形成和发展有复杂的各种壁垒,如酶屏障,血脑屏障(bbb)和肿瘤血脑屏障(bbtb),阻碍了药物或药物输送系统到达肿瘤部位。目前治疗脑胶质瘤的方法主要有手术、放疗和化疗。然而因脑胶质瘤呈浸润性生长,且多接近中枢神经系统,故难以通过手术完全切除肿瘤,易导致肿瘤复发。放射性疗法易造成放射性痴呆;常规化疗药物因对肿瘤组织无选择性而往往导致严重的毒副作用,使其对神经胶质瘤治疗效果不佳,严重影响了患者的生活质量。
肿瘤靶向纳米递药系统是指利用肿瘤组织特殊的生理病理特点,纳米载体包载肿瘤诊断或治疗药物构建而成的对肿瘤组织具有靶向定位功能的递药系统。由于临床上常规化疗药物对肿瘤组织无靶向性,常导致对正常组织严重的毒副作用,为避免给病人造成伤害,从而限制了抗癌药物的给药用量。成功的肿瘤治疗的首要目标之一是在尽可能减少对正常组织伤害的同时传递足够量的药物到肿瘤。大部分化疗药物由于对肿瘤组织用药量低于最佳剂量会引起不完整肿瘤反应,将会导致疾病的复发和抗药性。但用添加了多肽靶向分子的肿瘤靶向纳米递药系统则可以有效的解决这个问题。
为实现有效的药物递送以及到达肿瘤部位并蓄积的效果,必须找到一种合适的靶向配体。neuropilin-1(nrp-1)是细胞表面的一种ⅰ型跨膜糖蛋白,人类许多肿瘤组织上有nrp-1的表达,包括前列腺癌、乳腺癌、黑色素瘤、胰腺癌和神经胶质瘤,但在相应的正常组织上皮细胞中却没有表达。研究显示在人神经胶质瘤临床病理标本中检测到有nrp-1显著表达,且其表达量随神经胶质瘤恶性程度的增加而增加。最近有研究者通过多肽筛选技术筛选出一类具有肿瘤血管穿透性和肿瘤组织穿透性的多肽,这类多肽可以介导与其共价连接的药物分子或纳米递药系统穿透肿瘤血管壁并渗透进入肿瘤内部,分布到整个肿瘤组织中,这类多肽被称为“肿瘤穿透肽”。研究表明rgerppr是nrp-1的特异性配体,表现出对肿瘤细胞和肿瘤血管的双重亲和性。对肿瘤血管的亲和性可使其靶向肿瘤血管壁,而肿瘤穿透性可使其穿透肿瘤血管壁渗透进入肿瘤组织内部,对肿瘤细胞的亲和性可使其与肿瘤细胞特异性结合,因此作为靶向分子,这类多肽与一般的肿瘤细胞靶向分子相比具有更明显的优势。
聚合物胶束是一种核-壳结构体,它具有亲水性外壳和疏水性内核。疏水内核一般由可生物降解的聚合物构成,它起着水不溶性药物储库的作用。由于要求聚合物对细胞无毒性并能由肾脏代谢。胶束在生物体内的分布主要取决于壳的性质,同时,壳的性质也对胶束的稳定性及胶束与血浆蛋白、细胞膜的相互作用起决定性作用,胶束的黏度影响胶束的物理稳定性和药物的释放行为。
技术实现要素:
本发明的目的在于构建一种基于物理包裹作用实现rgerppr-peg-dspe靶向元件修饰pgg-ptx递药系统及制备和应用,用于实现肿瘤的靶向递药。本发明的递药系统可以通过静脉注射给药,通过rgerppr介导的靶向作用于肿瘤部位,并可穿透肿瘤血管壁,渗透进入肿瘤组织内部。
本发明的目的是这样实现的:
一种物理包裹的肿瘤靶向纳米递药系统,特点在于,该系统包括rgerppr多肽修饰的靶向元件,纳米胶束及抗肿瘤药物,所述靶向元件为二硬脂酰磷脂酰乙醇胺-聚乙二醇-rgerppr(dspe-peg-rgerppr);所述胶束为聚谷氨酸(pgg)高分子骨架及骨架上的谷氨酸支链;所述抗肿瘤药物为紫杉醇(ptx)。聚谷氨酸高分子骨架和谷氨酸支链通过肽键连接,在谷氨酸支链末端与抗肿瘤药物ptx通过酯键键合,形成pgg-ptx,其结构如下:
然后ptx和靶向元件中的二硬脂酰磷脂酰乙醇胺通过疏水的相互作用,将靶向元件疏水端二硬脂酰磷脂酰乙醇胺包裹进入pgg-ptx中,从而形成靶向抗肿瘤纳米递药系统;式中,r=na或紫杉醇。
一种上述递药系统的制备方法,特点在于,该方法包括如下步骤:
步骤1:制备多肽修饰的靶向元件:将多肽rgerppr的巯基与二硬脂酰磷脂酰乙醇胺-聚乙二醇-马来酰亚胺的马来酰亚胺基团反应,连接组成靶向元件。反应方程式如下:
步骤2:分别称取a、pgg-ptx和b、rgerppr-peg-dspe,摩尔比a:b=98:2。将pgg-ptx
用0.5%的胆酸钠溶液溶解,rgerppr-peg-dspe用二氯甲烷:丙酮=3:1的混合溶液溶解。将b溶液加入a溶液中,边滴加边涡旋;冰浴中细胞超声破碎仪超声300w,超2s,间隔3s,超声2min得到乳液;向乳液中加入1%的胆酸钠溶液8ml,磁力搅拌10min。35℃水浴旋转蒸发除去有机溶剂;4℃,21000g离心45min,弃上清,将沉淀用生理盐水重悬得纳米粒溶液;样品通过连接有蛋白纯化仪的g-50葡聚糖凝胶柱,在228nm的紫外检测波长下分离提纯。得到物理作用包裹有靶向元件的胶束纳米抗肿瘤递药系统;
步骤3:测定所述多肽的分子量及纯度;
步骤4:测定所述靶向元件dspe-peg-rgerppr核磁图谱;
步骤5:测定所述纳米递药系统的粒径、形态;
步骤6:测定所述纳米递药系统的体外药物释放特征;
步骤7:测定所述纳米递药系统体外对神经胶质瘤u87mg肿瘤细胞的摄取;
步骤8:测定所述纳米递药系统体外对神经胶质瘤u87mg肿瘤细胞的活性评价;
步骤9:测定所述纳米递药系统的体内抗神经胶质瘤活性效果。
通过荧光失踪纳米粒,考查肿瘤细胞分别对载有荧光染料细胞膜绿色荧光探针(dio)的靶向胶束纳米药物和无靶向胶束纳米药物的细胞摄取,结果证实本发明通过物理包裹作用可以实现靶向元件rgerppr-peg-dspe修饰的胶束纳米递药系统进入肿瘤细胞。
本发明的递药系统具有以下特征:粒径在100nm左右,呈球形;在磷酸盐缓冲液中比较稳定;药物释放特性也得到了提高;细胞摄取实验中肿瘤细胞对该递药系统的摄取明显增多,该递药系统对肿瘤的靶向性较好;体外抗神经胶质瘤活性评价中该递药系统显著增强了胶束纳米药物对神经胶质瘤的体外生长抑制作用;通过静脉注射给药,通过肿瘤epr效应和rgerppr介导作用将其靶向至肿瘤部位,此递药系统可用作肿瘤治疗药物的靶向递送,且在治疗脑胶质瘤上获得了良好的疗效,延长了balb/c脑胶质瘤裸鼠的中位生存期。
附图说明
图1为本发明递药系统制备流程示意图;
图2为本发明多肽c-rgerppr高效液相hplc图谱;
图3为本发明多肽c-rgerppr的质量ms图谱;
图4为本发明mal-peg-dspe和rge-peg-dspe核磁nmr图谱;
图5为本发明pgg-ptx和rge/pgg-ptx粒径图;
图6为本发明pgg-ptx和rge/pgg-ptx透射电镜图(a)pgg-ptx,(b)rge/pgg-ptx;
图7为本发明纳米递药系统长期稳定性实验图;
图8为本发明纳米递药系统药物释放曲线图;
图9为本发明u87mg神经胶质瘤细胞定性定量摄取图;
图10为本发明u87mg细胞活性曲线图;
图11为本发明给药后神经胶质瘤裸鼠生存曲线图。
具体实施方式
通过下述实施例将有助于进一步理解本发明,但并不限制本发明的内容。
参阅图1,为本发明的递药系统制备流程示意图。
高分子前药pgg-ptx紫杉醇载药量为35%。
实施例1
多肽c-rgerppr的表征
将购买得到的多肽纯品用hplc、lc-ms方法进行表征。
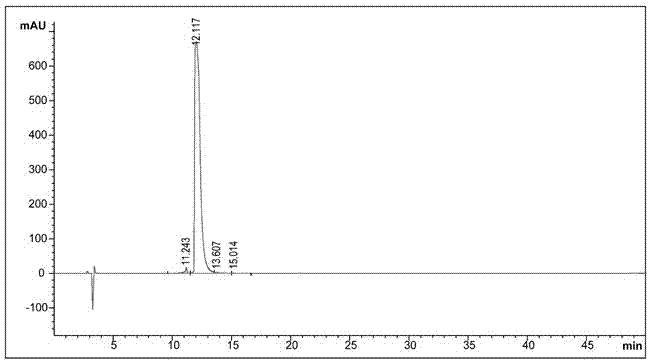
分析型hplc色谱方法如下,色谱柱:diamonsilc18(5μm,200×4.6mm);流动相a:0.1%tfa水,流动相b:0.1%tfa乙腈;洗脱程序:0~2min:5%b,2~32min:5%~65%b,32~33min:65%~90%b,33~36min:90%b;,36~37min:90%~5%b,37~45min:5%b;流速:0.7ml/min;柱温:40℃;波长:uv214、280nm。图2表明其纯度大于98%;图3显示多肽分子量为970.4,质量ms图谱显示其分子量与理论相符。
实施例2
dspe-peg-rgerppr的合成与表征
取c-rgerppr纯品25mg溶于ph7.0-7.4的2mlpbs(ph7.0-7.4,1xpbs)溶液中,取马来酰亚胺-聚乙二醇-磷脂复合物dspe-peg-mal(摩尔当量为rgerppr的0.8倍)溶于0.5mldmf,加入多肽水溶液中,超声除去气泡,搅拌反应约1小时,dspe-peg-mal反应完全,透析(截留分子量3500da,透析介质为水)去除过量的c-rgerppr和dmf,冷冻干燥,得到rgerppr-peg-dspe,h1-nmr。h1-nmr图谱显示,图4.为rgerppr-peg-dspe和马来酰亚胺-聚乙二醇-磷脂复合物(mal-peg-dspe)的核磁图谱。rgerppr-peg-dspe核磁图谱在6.7ppm即马来酰亚胺特征峰消失,显示rgerppr-peg-dspe合成成功。
实施例3
物理包裹作用rgerppr-peg-dspe修饰pgg-ptx的纳米递药系统的制备和表征
分别称取a、pgg-ptx和b、rgerppr-peg-dspe,摩尔比a:b=98:2。将pgg-ptx用0.5%的胆酸钠溶液溶解,rgerppr-peg-dspe用二氯甲烷:丙酮=3:1的混合溶液溶解。将b溶液加入a溶液中,边滴加边涡旋。冰浴中细胞超声破碎仪超声300w,超2s,间隔3s,超声2min得到乳液。向乳液中加入1%的胆酸钠溶液8ml,磁力搅拌10min。35℃水浴旋转蒸发除去有机溶剂;4℃,21000g离心45min,弃上清,将沉淀用生理盐水重悬得纳米粒溶液。样品通过连接有蛋白纯化仪的g-50葡聚糖凝胶柱,在228nm的紫外检测波长下分离提纯。得到物理作用包裹有靶向元件的胶束纳米抗肿瘤递药系统。
配制高分子载紫杉醇前药(pgg-ptx)和修饰靶向的胶束纳米递药系统(rge/pgg-ptx)1mg/ml,过0.22um滤膜,用马尔文激光粒度仪测定其粒径大小和粒径分布,图5中显示纳米颗粒粒径分布情况,pgg-ptx和rge/pgg-ptx两种纳米粒的平均粒径分别为25nm和109nm左右。
pgg-ptx和rge/pgg-ptx的形态通过透射电子显微镜(tem)来观察,需用1%的磷钨酸负染制备样品,具体操作如下:(1)滴一滴样品溶液于铜网上;(2)空气中干燥约10分钟,用滤纸吸去多余的液体;(3)再滴一滴1%的磷钨酸于铜网上,室温干燥8分钟后用滤纸吸去多余的染液;(4)待样品完全干燥后置于透射电镜下观察。图6中a和b分别为pgg-ptx和rge/pgg-ptx两种纳米粒的透射电镜图片,两种纳米粒形态均比较规则,呈球形。
实施例4
pgg-ptx和rge/pgg-ptx两种纳米粒稳定性验证
将pgg-ptx和rge/pgg-ptx用1xpbs液配制成1.0mg/ml,用动态光散射仪(dls)测定粒径大小和分散性指数(pdi),每两天测定一次,连续测定3周,考察纳米粒子的长期稳定性。结果如图7,两种纳米粒的稳定性良好,放置3周后粒径无明显变化(p>0.05)。
实施例5
pgg-ptx和rge/pgg-ptx两种纳米粒药物释放性能验证
pgg-ptx和rge/pgg-ptx的释药性能:用ph为7.4缓冲盐溶液分别配制一定浓度的pgg-ptx和rge/pgg-ptx,每组三个重复,将所有样品放置于37℃恒温振荡器中。分别在不同时间点取每种样品缓冲盐溶液各一组,用乙酸乙酯萃取溶液中释放出来的紫杉醇,用高效液相色谱仪测定紫杉醇的含量(标准曲线法)。如图8所示,rge/pgg-ptx的药物释放在一定程度上有所提高,改善了pgg-ptx紫杉醇释放慢释放量少的缺点。
实施例6
纳米递药系统体外神经胶质瘤靶向性验证
以u87mg细胞为模型,每孔3×104cells/ml密度接种于6孔板中培养24,每孔体积2ml,将培养板移入二氧化碳培养箱中,37℃,5%二氧化碳及饱和湿度条件下培养24h,使细胞贴壁长至80%。用含10%胎牛血清的dmem培养液配制一系列不同浓度的rge/pgg-ptx和pgg-ptx溶液。将培养皿中的培养液吸出,加入rge/pgg-ptx和pgg-ptx的系列溶液,同时设置对照组,37℃孵育2h。吸取上清液遗弃,用pbs溶液轻轻洗涤两次,分别用激光共聚焦定性和流式细胞仪定量评价细胞摄取情况。细胞核用hochest染成蓝色。流式细胞仪分析的细胞先用pbs洗涤2次;然后消化、离心、重悬,重复三次;重悬后的细胞用流式细胞仪检测。参阅图9,图中a为游离荧光素dio细胞摄取图、b为pgg-ptx包裹dio细胞摄取图、c为rge/pgg-ptx包裹dio细胞摄取图,于37℃分别与肿瘤细胞作用2小时后的荧光显微照片,结果显示rge/pgg-ptx摄取量明显高于细胞对pgg-ptx的摄取,说明rge/pgg-ptx胶束纳米递药系统制备成功,并对肿瘤细胞具有良好的体外靶向性。
实施例7
测定所述纳米递药系统体外对神经胶质瘤u87mg肿瘤细胞的活性评价
体外细胞毒性试验以u87mg细胞为模型,采用cck-8试剂盒分析ic50值来考查pgg-ptx和rge/pgg-ptx和游离ptx对细胞的抑制率,具体方法:将密度为2×103cells/ml的u87mg悬浮液接种于96孔板中,放置在5%co2条件下的37℃培养箱,培养24小时;向96孔板中加入不同浓度的taxol、pgg-ptx和rge/pgg-ptx三种药物溶液,并设置空白对照,和阴性对照(不加药),每组至少设三个复孔;加药后将96孔板放置在5%co2条件下的37℃培养箱中继续孵育48小时;移去孔中的液体,每孔再次加入100μl新鲜培养基和10μlcck-8试剂;将96孔板放在37℃恒温震荡箱中轻微震荡培养4小时;用酶标仪测定在450nm处的od值。
细胞的存活率计算公式:
细胞活力(%)=[a(加药)-a(空白)]/[a(不加药)-a(空白)]×100%。
公式中:
a(空白):具有培养基和cck-8溶液而没有u87mg细胞的孔的od值;
a(加药):具有u87mg细胞、cck-8溶液和药物溶液的孔的od值;
a(不加药):具有u87mg细胞、cck-8溶液而没有药物溶液的孔的od值。
如图10所示,taxol,pgg-ptx和rge/pgg-ptx处理u87mg细胞48h后,ic50值分别为0.14μm,2.39μm和1.44μm,。很显然,rge/pgg-ptx的抗肿瘤细胞生长活性比无靶向的pgg-ptx要高,而pgg-ptx的ic50值高于ptx说明高分子通过键合形式连接紫杉醇形成的纳米药物,细胞毒性明显降低。
实施例8
测定所述纳米递药系统体外内抗神经胶质瘤的活性评价
取对数生长期的u87mg细胞,消化后离心,在磷酸缓冲液pbs中分散为单细胞悬液,将1×106个细胞(分散于10ulpbs中)用立体定位仪接种5ul于裸鼠右侧纹状体中。接种位置坐标定位如下:裸鼠前囟前0.6mm,右侧1.8mm,深3mm。
将裸鼠随机分为4组每组7只,分别在接种后第11,15,18和21天注射100ul生理盐水、ptx、pgg-ptx、rge/pgg-ptx,累积紫杉醇注射剂量为40mg/kg,记录模型裸鼠的生存时间。参阅图11,图中结果显示,生理盐水n.s、游离紫杉醇ptx、无靶向的pgg-ptx、有靶向元件的rge/pgg-ptx各组的中位生存期分别为22、29、36、47天。由此可知,rge/pgg-ptx组荷瘤裸鼠的生存时间远长于pgg-ptx组,说明crngrgpdc的修饰可显著增强阿霉素脂质体的抗肿瘤作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 含叔胺药物物质的靶向递送的制造方法与工艺
- 一种磁靶向双载药递释系统及其制备方法与流程
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 附载蟾毒灵的多肽修饰的聚甲基丙烯酸寡聚乙二醇酯-聚己内酯纳米制剂的制作方法
- 附载蟾毒灵的多肽修饰的聚甲基丙烯酸寡聚乙二醇酯-聚己内酯纳米制剂的制作方法
- 一种用于治疗去势抵抗性前列腺癌的靶向前药及其纳米制剂和制备方法
- 一种具有内涵体逃逸功能的肿瘤靶向前药及其纳米制剂和制备方法
- 具有脑肿瘤靶向和肿瘤组织穿透能力的d构型多肽及其基因递释系统的制作方法
- 聚乙二醇-聚乳酸羟基乙酸-聚赖氨酸纳米递送系统、制备方法及其应用的制作方法
- 载蟾蜍灵的环肽修饰的聚乙二醇-聚乳酸羟基乙醇酸-聚赖氨酸纳米粒的制作方法