miR125b‑5p在制备抗内皮细胞损伤药物的应用的制作方法
本发明属于生物医药技术领域,具体涉及一种mir125b-5p在制备抗内皮细胞损伤药物的应用。
背景技术:
内皮细胞提供氧和营养物质,是维持组织稳态所必须的。代谢的不平衡以及环境的刺激因素,如细胞因子或低剪切应力等,诱发内皮细胞炎症,内皮细胞渗透性增加,促进细胞增殖,最终导致细胞死亡。这些因素促进内皮细胞功能障碍,成为心血管疾病形成的关键因素。此外,超氧阴离子羟基自由基和过氧化氢对血管内皮细胞功能有害。人们普遍认为,胞内ros水平升高,损伤各种细胞成分,阻断其生理功能,导致各种氧化应激相关的疾病,如心血管疾病。众所周知,氧化应激是内皮细胞功能障碍的主要原因,也是引起组织损伤的主要原因。
一些药物如他汀类及肾素-血管紧张素-醛固酮抑制剂能改善内皮细胞功能障碍。然而内皮细胞功能改善并不意味着心血管疾病发病率和死亡率下降。因此,急需发现新的治疗方法来预防和治疗内皮细胞损伤引起的心血管疾病。
现有研究证明,microrna已经作为潜在的治疗靶点引起人们极大的关注。microrna是一类长度约20-24个核苷酸的非编码rna,其可通过与靶基因mrna序列的3’非翻译区互补,从而降解mrna来实现对靶基因的转录后调控。因为microrna涉及微调的生理反应,已经成为诊断和治疗许多疾病的热点,包括心血管疾病。因此调控microrna水平,有可能成为治疗或缓解心血管疾病的有效措施,通过调控microrna水平来保护血管内皮损伤具有前景。
文献报道microrna125b可能促进巨噬细胞活化以及抑制上皮间质的转化,并提出microrna125b-5p抑制3t3-l1前脂肪细胞增殖,促进其成脂分化的相关报道,而目前并没有任何有关microrna125b-5p抗氧化应激引起内皮细胞损伤的相关报道。
技术实现要素:
本发明的目的是提供一种mir125b-5p在制备抗内皮细胞损伤药物的应用。
本发明所采用的技术方案是,mir125b-5p在制备抗内皮细胞损伤药物的应用,其中mir125b-5p的核苷酸序列如seq.id.no.1所示。
本发明的特点还在于,
抗内皮细胞损伤的药物为用于防治氧化应激引起内皮细胞损伤的药物。
抗内皮细胞损伤药物为能够减少内皮细胞坏死的药物。
抗内皮细胞损伤药物为能够减少脐静脉内皮细胞坏死的药物。
抗内皮细胞损伤药物为能够减少内皮细胞凋亡药物。
抗内皮细胞损伤药物为能够降低smad4表达的药物。
抗内皮细胞损伤药物为能够减少脐静脉内皮细胞凋亡和坏死的药物。
抗内皮细胞损伤药物为能够降低过氧化氢刺激导致脐静脉内皮细胞凋亡和坏死的药物。
相对于现有技术,本发明的有益效果为:
本发明提供了mir125b-5p在制备抗内皮细胞损伤药物的应用,其中mir125b-5p是采用化学合成的方法获得的一种由12个核苷酸组成的新型肽,mir125b-5p的核苷酸序列如seq.id.no.1所示。本发明首次发现mir125b-5p对氧化应激引起的内皮细胞具有改善作用,能够用于制备抗氧化应激引起的内皮细胞损伤的药物。
过表达mir125b-5p,内皮细胞坏死和凋亡较对照组显著减少。而干涉mir125b-5p,内皮细胞坏死和凋亡较对照组显著升高。进一步实验证明,本发明提供的mir125b-5p可抑制smad4表达,通过smad4表达减少,产生降低内皮细胞坏死和凋亡的作用。如过表达smad4,则内皮细胞坏死和凋亡率显著升高,且同时过表达mir125b-5p和smad4,内皮细胞坏死和凋亡较过表达smad4组降低。
附图说明
图1为mirnaagomir转染对照(2’ome修饰+5’cy3+5’chol修饰)转染效率检测
实验分为4组,第1组:终浓度200nmol/lmirnaagomir转染对照;第2组:终浓度100nmol/lmirnaagomir转染对照;第3组:终浓度50nmol/lmirnaagomir转染对照;第4组:未加mirnaagomir转染对照;其中,终浓度为200nmol/l转染效率最高,为78.8%。
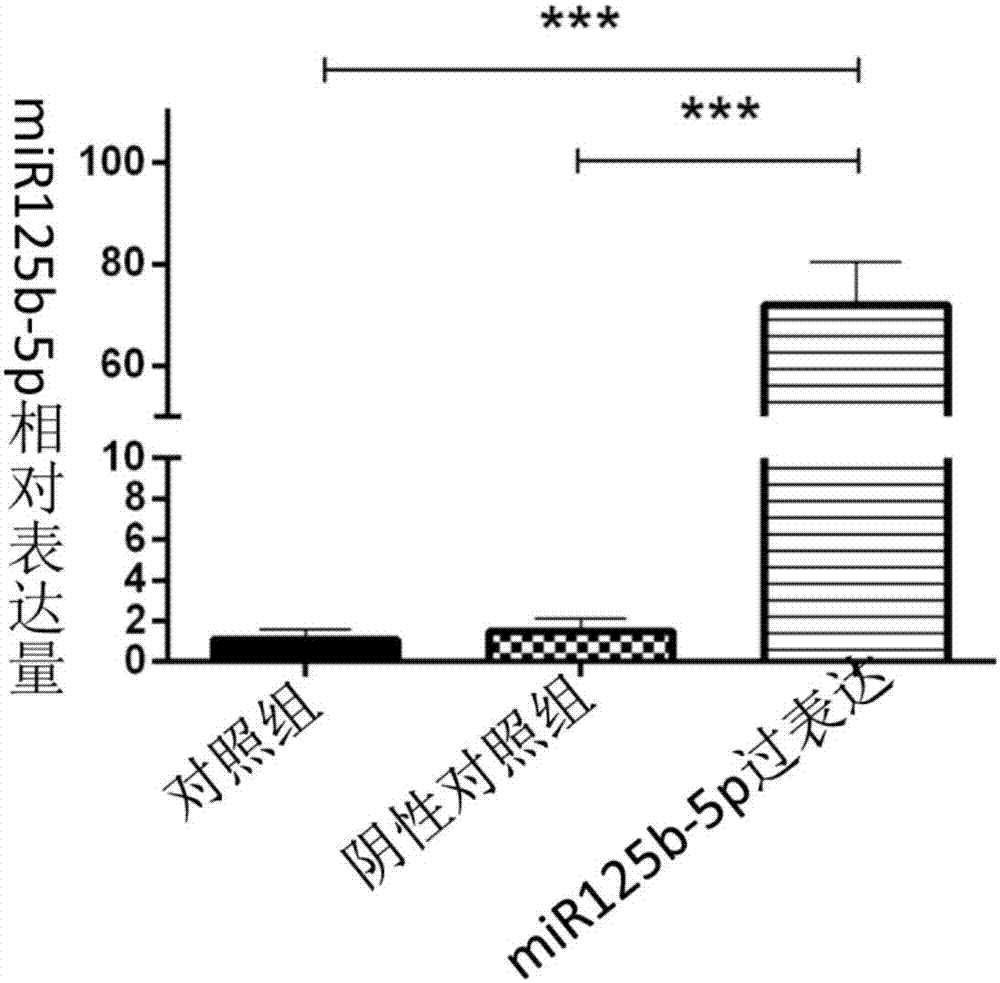
图2为实时定量pcr检测mir125b-5p的表达
预先转染200nmol/lmir125b-5pagomir的内皮细胞在100μmol/lh2o2作用24小时后,mir125b-5p的表达显著升高,其上调幅度约为对照组及阴性对照组的近60倍,各组之间差异有统计学意义(p=0.000)。
图3为过表达mir125b-5p,内皮细胞坏死率和凋亡率显著降低,而干涉mir125b-5p,内皮细胞坏死率和凋亡率显著升高。
图4为与阴性对照组比较,过表达mir125b-5p,内皮细胞坏死率和凋亡率显著降低;与过表达smad4组比较,同时过表达smad4与mir125b-5p组内皮细胞坏死率和凋亡率下降。
图5为过表达mir125b-5p,内皮细胞smad4表达显著降低,而干涉mir125b-5p,内皮细胞smad4表达显著升高。
图6为与阴性对照组比较,过表达mir125b-5p,smad4表达显著降低;与过表达smad4组比较,同时过表达smad4与mir125b-5p组smad4表达下降。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明。
本发明采用化学合成的方法获得了一种由22个核苷酸组成的mir125b-5p,其核苷酸序列如seq.id.no.1所示。通过进一步的研究,检测了该mir125b-5p对氧化应激引起的内皮细胞坏死和凋亡有明显的改善作用,并进一步发现mir125b-5p通过抑制smad4,减少内皮细胞坏死及凋亡。
本发明所研究的mir125b-5p的核苷酸序列如下:
ucccugagacccuaacuuguga(同seq.id.no.1)
下面对本发明提供的mir125b-5p抗内皮细胞坏死和凋亡作用及其抑制smad4表达的具体实验和结果进行详细说明。
1、mirnaagomir转染对照(2’ome修饰+5’cy3+5’chol修饰)转染效率检测
mirnaagomir转染对照(2’ome修饰+5’cy3+5’chol修饰)与mirnaagomir性质相同,只是添加了cy3标记,便于检测转染效率。
实验分为4组:第1组:终浓度200nmol/lmirnaagomir转染对照;第2组:终浓度100nmol/lmirnaagomir转染对照;第3组:终浓度50nmol/lmirnaagomir转染对照;第4组:未加mirnaagomir转染对照;
将细胞接种在12孔板上,待细胞长满孔内面积的50%左右时,进行干预。
①试剂稀释:1nmolmirnaagomir转染对照加入50μlrnasefreeh2o,作为储存液,浓度为20μmol/l。
②用opti-memi将20μmol/l的储存液稀释成终浓度为400nmol/l,200nmol/l,100nmol/l的工作液。
③为了提高局部作用浓度和尽量减低外部干扰因素,每组分别先分别加入400nmol/l,200nmol/l,100nmol/l的opti-memi500μl轻轻摇匀转染8小时后,再加入500μl完全培养液。
④转染48小时后流式细胞仪检测mirnaagomir转染对照的转染效率。
实验结果如图1所示。
图1结果表明,终浓度200nmol/lmirnaagomir转染效率最高,为78.8%。
2、qrt-pcr检测mir-125b-5p的表达
实验分为3组:第1组(空白对照组):100μmol/lh2o2组;第2组(阴性对照组):100μmol/lh2o2+miragomirnegativecontrol组;第3组(mir125b-5pagomir组):100μmol/lh2o2+mir125b-5pagomir组;
将细胞接种在12孔板上,待细胞长满孔内面积的50%左右时,吸弃培养液,第一组加入opti-memi培养液0.5ml,第二组加入含opti-memi培养液0.5ml(含终浓度为400nmol/l的miragomirnegativecontrol),第三组加入opti-memi培养液0.5ml(含终浓度为400nmol/l的mir125b-5pagomir),放入培养箱培养8小时,8小时之后每组再加入0.5ml完全培养液,继续培养40小时。吸弃培养液,每组加入终浓度为100μmol/lh2o2基础培养液1ml培养24小时,24小时后收集细胞,置于-80℃冰箱待测。重复3次。
mirna的相对表达水平结果采用相对定量方法2-δδct表示。△ctsample=ctsample-ctu6sample,△ctcontrol=ctcontrol-ctu6control,△△ct=△ctsample-△ctcontrol)。本实验以第一组为control组。
实验结果如图2所示。
图2结果表明,过表达mir125b-5p,mir125b-5p表达量为对照组和阴性对照组的60倍。
3、流式细胞技术检测细胞凋亡及坏死
将细胞接种在12孔板上,待细胞长满孔内面积的80%时,进行干预。
实验一分为4组。第1组(阴性对照组):加入0.1ml正常妊娠产妇血清和0.9mldmem/f12基础培养液;第2组(过表达mir125b-5p):加入0.1mlpe患者血清和0.9mldmem/f12基础培养液;第3组(阴性对照第2组):加入1mldmem/f12基础培养液;第4组(干涉mir125b-5p组):加入1ml含终浓度100μmol/lh2o2的dmem/f12基础培养液。24小时后进行检测。
实验二分为4组。第1组(阴性对照组):加入0.1ml正常妊娠产妇血清和0.9mldmem/f12基础培养液;第2组(过表达mir125b-5p):加入0.1mlpe患者血清和0.9mldmem/f12基础培养液;第3组(过表达smad4组):加入1mldmem/f12基础培养液;第4组(过表达smad4和mir125b-5p组):加入1ml含终浓度100μmol/lh2o2的dmem/f12基础培养液。24小时后进行检测。
检测方法:培养液上清收集到10ml离心管中,0.25%胰酶消化细胞,将消化下的细胞同样收集到10ml离心管中,用pbs洗涤1次,1000r/min离心5分钟;将细胞悬液收集到ep管中,1000r/min离心5分钟,弃上清;加入200μlbindbuffer重悬细胞,混匀;加入5μlannexinv-fitc,室温下避光孵育15分钟;1000r/min离心5分钟弃上清,加入200μlbindbuffer,混匀;加入5μlpi,直接上机检测。实验重复3次。
实验结果如图3和图4所示。
图3结果表明,与对照组比较,过表达mir125b-5p,内皮细胞坏死率和凋亡率下降,而干涉mir125b-5p,内皮细胞坏死率和凋亡率升高。
图4结果表明,与对照组比较,过表达mir125b-5p,内皮细胞坏死率和凋亡率下降,而与过表达smad4组比较,同时过表达mir125b-5p和smad4组内皮细胞坏死率和凋亡率下降。
4、westernblotting的方法检测smad4蛋白的表达
将细胞接种至6孔板,待细胞长满80%左右时进行干预。
实验一分组:第1组(阴性对照组):加入0.2ml正常妊娠产妇血清和1.8mldmem/f12基础培养液;第2组(过表达mir125b-5p):加入0.2ml重度pe患者血清和1.8mldmem/f12基础培养液;第3组(阴性对照第2组):加入2mldmem/f12基础培养液;第4组(干涉mir125b-5p组):加入2ml含终浓度为100μmol/lh2o2的dmem/f12基础培养液。实验重复3次。
实验二分组:第1组(阴性对照组):加入0.2ml正常妊娠产妇血清和1.8mldmem/f12基础培养液;第2组(过表达mir125b-5p):加入0.2ml重度pe患者血清和1.8mldmem/f12基础培养液;第3组(过表达smad4组):加入2mldmem/f12基础培养液;第4组(过表达smad4和mir125b-5p组):加入2ml含终浓度为100μmol/lh2o2的dmem/f12基础培养液。实验重复3次。
4.1细胞总蛋白提取:
①取6孔板,吸弃培养液,pbs漂洗细胞2次,每孔加入250μl细胞裂解液,冰上放置60分钟使细胞裂解,以枪头间断吹打混匀后,转移细胞裂解物至1.5mlep管,4℃,12000g离心15分钟;
②吸取上清,取2μl上清用于测定蛋白浓度;
③上清中加入上样缓冲液(样品:上样缓冲液=1:5)混匀,100℃加热3-5分钟,使蛋白充分变性。离心后分装,-80℃保存。
4.2细胞蛋白含量的测定
操作步骤参照凯基生物科技发展有限公司提供的bca法蛋白含量检测试剂盒说明书进行。
4.3sds-page电泳
①清洗玻璃板:少量洗洁精清洗玻璃板,再用蒸馏水冲洗干净后立于框里晾干。
②制备12%聚丙烯酰胺分离胶。
表112%聚丙烯酰胺分离胶配方
③灌胶。混匀后立即灌胶,顶层加蒸馏水覆盖,当水和胶之间有一条折射线时,说明胶已凝,待胶充分凝聚后,倒掉覆盖水层,蒸馏水冲洗凝胶上部数次,吸水纸吸干残留液体。
④制备5%聚丙烯酰胺浓缩胶。
表25%聚丙烯酰胺浓缩胶配方
⑤灌胶。将剩余空间灌满浓缩胶后,水平插入点样梳,避免产生气泡。浓缩胶凝固后将梳子竖直向上拔出。
⑥将凝胶固定在电泳装置上,内槽加满1×电泳缓冲液,驱除气泡。
⑦按次序上样,不加样孔加入1×上样缓冲液以防止边缘效应。
⑧电泳:80v恒压50分钟,120v恒压电泳至溴酚蓝刚出胶底部止。
4.4转膜
①裁剪pvdf膜和滤纸,大小与胶相仿,pvdf膜甲醇预处理5秒左右,然后去离子水中洗2分钟,放至转膜液中1小时。滤纸也放入转膜液中。
②上下滤纸各2张压住胶和膜,避免气泡。
③100v恒压60分钟。
4.5免疫印记
①取出pvdf膜,tbst漂洗5分钟×3次;5%脱脂奶粉溶液室温封闭1小时。
②tbst洗5分钟×3次;一抗(1:1000)4℃过夜,次日室温孵育1小时。
③弃一抗溶液,tbst洗5分钟×3次;二抗(1:1000),37℃孵育1小时。
④弃二抗溶液,tbst洗5分钟×3次;蒸馏水漂洗3分钟×3次。
⑤将pvdf膜取出置于培养皿中(蛋白面朝上)。将化学荧光发光底物均匀地加到膜的表面,并使反应持续5分钟左右,用滤纸吸去膜表面多余的底物溶液,放至暗盒,然后曝光、显影。
4.6凝胶图象及数据分析
将胶片进行扫描,用凝胶图象处理系统分析目标条带的净光密度值。smad4蛋白表达以smad4蛋白和gapdh带的密度比值表示。
实验结果如图5和图6所示。
图5结果表明,过表达mir125b-5p,内皮细胞smad4表达降低,而干涉mir-125b-5p,内皮细胞smad4表达升高。
图6结果表明,与过表达smad4组比较,同时过表达mir125b-5p和smad4组smad4表达下降。
综上,本发明通过实验发现mir125b-5p能够降低氧化应激引起的内皮细胞坏死率和凋亡率,而且能够抑制smad4表达,因此mir125b-5p能够应用于制备抗内皮细胞损伤药物,尤其是制备氧化应激引起的内皮细胞损伤相关治疗药物。
<110>西安医学院
<120>mir125b-5p在制备抗内皮细胞损伤药物的应用
<160>1
<210>1
<211>22
<212>rna
<213>人工序列
<400>seq.id.no.1
ucccugagacccuaacuuguga22
- 还没有人留言评论。精彩留言会获得点赞!