包含人参皂苷F1作为有效成分的免疫增强用组合物的制作方法
本发明涉及包含人参皂苷f1作为有效成分的免疫增强用药物组合物。
此外,本发明涉及包含人参皂苷f1作为有效成分的免疫增强用食品组合物。
此外,本发明涉及包括将人参皂苷f1给药至个体的步骤的免疫增强方法。
此外,本发明涉及包含人参皂苷f1和自然杀伤细胞的穿孔素或颗粒酶制备用组合物。
背景技术:
免疫大致分为出生后即具有的先天免疫(innateimmunity)和适应于生活等中而后天性获得的后天免疫(acquiredimmunity)。其中,先天免疫又称为“自然免疫”,与抗原进行非特异性反应且不显示特别的记忆功能。这样的先天免疫实际上防御大部分的感染。另一方面,后天免疫对首次侵入的抗原具有记忆功能,从而具有如下特征:当再次发生侵入时,进行特异性反应而有效去除抗原。
最近,发生因运动不足、精神压力等内因和大气污染等外因的复合作用而免疫力显著下降的问题,实际情况是,需要对显示免疫增强效果的物质进行研究,特别是对防御大部分的感染的先天免疫的重要性逐渐变高。
韩国公开专利第10-2015-0011576号开发了含有刺五加根作为有效成分的免疫增强用药物组合物,韩国公开专利第10-2014-0148087号开发了包含黄柏提取物的先天免疫增强及抗病毒组合物,在多种多样的物质中,尤其利用天然物的免疫增强用组合物的研究正在活跃地进行。
另一方面,已知人参皂苷是存在于人参的皂苷,种类有30种以上,根据结构,分为ppd(protopanaxadiol,原人参二醇)系列和ppt(protopanaxatrio,原人参三醇)系列,根据化学结构的不同而显示各不同的药理活性(currvascpharmacol.2009july;7(3):293-302)。在所述人参皂苷中的极少量地存在于人参中的稀有人参皂苷难以被分离出,因此还未对其进行研究。
由此,本发明人等为了发现免疫增强活性优异的化合物而进行深入研究,结果确认到,人参皂苷f1与其它人参皂苷相比显示更优异的免疫增强效果、特别是显示先天免疫增强效果,从而完成了本发明。
技术实现要素:
技术问题
本发明的主要目的在于提供一种包含人参皂苷f1作为有效成分的免疫增强用药物组合物。
本发明的另一个目的在于提供包含人参皂苷f1作为有效成分的免疫增强用食品组合物。
本发明的又一个目的在于提供包括将本发明的人参皂苷f1给药至个体的步骤的免疫增强方法。
本发明的又一个目的在于提供包含人参皂苷f1和自然杀伤细胞的穿孔素或颗粒酶制备用组合物。
技术方案
本发明的发明人等在进行与免疫增强相关的研究的过程中,用人参皂苷f1预处理自然杀伤细胞(naturalkillercell,nkcell)后,利用多种方法评价自然杀伤细胞的细胞杀伤活性,结果确认到,与其它人参皂苷相比显示更优异的活性,从而首次发现,包含上述人参皂苷f1的组合物显示优异的免疫增强效果。
为了实现上述目的,本发明的一个方式提供包含人参皂苷f1作为有效成分的免疫增强用药物组合物。
本发明中,术语“人参皂苷f1”是作为人参或红参等参的主要活性成分的皂苷的一种,是指属于ppt(原人参三醇)系列的人参皂苷。
本发明中,术语“免疫增强”是指增强活体的内部环境对外源因子的抗原的活体防御能力,上述免疫可分为出生后即具有的先天免疫和后天获得的获得性免疫(适应性免疫),本发明中,上述免疫可以为先天免疫。
上述药物组合物能够增强先天免疫细胞的活性。
上述先天免疫细胞可以为选自包含自然杀伤细胞(naturalkillercell,nkcell)、t细胞、b细胞、外周血单核细胞(peripheralbloodmononuclearcell,pbmc)和树突状细胞(dendriticcell)的组中的任一种,但并不限于此,具体而言,可以为自然杀伤细胞。
上述药物组合物能够促进先天免疫细胞的脱粒活性。
本发明中,术语“脱粒活性”是指释放在分泌颗粒内蓄积的物质的活性,本发明中,脱粒活性可以为释放在先天免疫细胞内蓄积的物质的活性。上述先天免疫细胞的脱粒活性一般可以通过分析作为用于评价脱粒活性的标记的cd107a的表达来测定,但并不限于此。
本发明的一个实施例中,在用人参皂苷f1预处理先天免疫细胞的情况下,确认cd107a的表达增加(图2b和图2c),可知上述人参皂苷f1能够促进自然杀伤细胞的脱粒活性。特别是可知,与其它人参皂苷相比,人参皂苷f1的脱粒活性促进效果最优异。
上述药物组合物能够增强自然杀伤细胞的细胞杀伤活性。
本发明的一个实施例中,用人参皂苷f1预处理自然杀伤细胞后评价上述细胞的细胞杀伤活性,结果确认到,靶细胞的细胞溶解程度显示高(图3a),特别是在预处理原代(primary)自然杀伤细胞的情况下,也确认到靶细胞的细胞溶解程度显示高(图4a)。此外,确认到,在通过对自然杀伤细胞敏感的rma-s细胞的减少评价人参皂苷f1对体内(invivo)细胞杀伤活性的有效性的情况下,rma-s的减少效果也显示优异(图7)。
上述药物组合物还可以包含人参皂苷rg3。上述人参皂苷rg3相当于属于ppd(原人参二醇)系列的人参皂苷的一种
本发明的一个实施例中,用人参皂苷rg3预处理自然杀伤细胞后评价上述细胞的细胞杀伤活性,结果确认,自然杀伤细胞的cd107a的表达增加(图2b和图2c),靶细胞的细胞溶解程度显示高(图3b),特别是,在预处理原代自然杀伤细胞的情况下,靶细胞的细胞溶解程度也显示高(图4b)。由此可知,本发明的药物组合物还可以包含具有免疫增强活性的人参皂苷rg3。
上述药物组合物可以以1:0.1至1:1的重量比包含人参皂苷f1和人参皂苷rg3。
在人参皂苷f1与人参皂苷rg3的比率为1:0.1重量比以下的情况下,几乎不显示基于人参皂苷rg3的免疫增强效果,在1:1重量比以上的情况下,随混合的免疫增强的上升效果可能甚微。
上述药物组合物能够增加自然杀伤细胞的细胞杀伤因子的表达。
本发明中,术语“细胞杀伤因子”是指显示细胞杀伤活性的物质,本发明中,上述细胞杀伤因子是由自然杀伤细胞分泌且显示细胞杀伤活性的物质,具体而言,可以为穿孔素或颗粒酶,但并不限于此。
本发明的一个实施例中,在用人参皂苷f1预处理自然杀伤细胞的情况下,确认到穿孔素和颗粒酶b的表达增加(图6a和图6b),可知,人参皂苷f1能够增加自然杀伤细胞的细胞杀伤因子的表达。
上述药物组合物可以包含药学上可接受的载体。上述“药学上可接受的载体”可以是指在不刺激生物体的同时,不阻碍所注入的化合物的生物学活性和特性的载体、赋形剂或稀释剂,具体地,可以为非天然载体(non-naturallyoccuringcarrier)。本发明中可使用的上述载体的种类没有特别限制,只要是本领域中通常使用的药学上可接受的载体,就可以使用任一种。作为上述载体的非限制性例子,可以举出食盐水、灭菌水、林格氏液、缓冲食盐水、白蛋白注射溶液、葡萄糖溶液、麦芽糊精溶液、甘油、乙醇等。它们可以单独使用或者混合两种以上使用。
包含药学上可接受的载体的上述组合物可以为口服或非口服的多种剂型。制剂化时,可以使用通常使用的填充剂、增量剂、粘合剂、润湿剂、崩解剂、表面活性剂等稀释剂或赋形剂来调制。
详细而言,用于口服给药的固体制剂包括片剂、丸剂、粉剂、颗粒剂、胶囊剂等,这样的固体制剂可以在上述化合物中混合至少一种以上的赋形剂,例如淀粉、碳酸钙、蔗糖、乳糖、明胶等而调制。此外,除了单纯的赋形剂以外,还可以使用硬脂酸镁、滑石等润滑剂。作为用于口服的液体制剂,适用悬浮剂、内服液剂、乳剂、糖浆剂等,除了作为经常使用的单纯稀释剂的水、液体石蜡以外,还可以包括各种赋形剂,例如润湿剂、甜味剂、芳香剂、保存剂等。用于非口服给药的制剂中包括灭菌的水溶液、非水性溶剂、悬浮剂、乳剂、冷冻干燥制剂和栓剂。作为非水性溶剂、悬浮剂,可以使用丙二醇、聚乙二醇、橄榄油等植物性油,油酸乙酯等可注射的酯等。作为栓剂的基剂,可以使用半合成椰油酯/棕榈油酯(witepsol)、聚乙二醇(macrogol)、吐温61、可可脂、月桂脂、甘油明胶等。
此外,本发明的药物组合物可以包含药剂学上有效的量的人参皂苷f1。本发明中,术语“药剂学上有效的量”是指以可应用于医学治疗的合理的益处/风险比率足以治疗疾病的量,可以将下述量一天1次或分几次给药:一般为0.001至1000mg/kg的量,具体而言为0.05至200mg/kg,更具体而言为0.1至100mg/kg。但是,出于本发明的目的,对特定患者的具体治疗有效量优选依据所要实现的反应的种类和程度、根据情况而是否使用其它制剂、具体的组合物、患者的年龄、体重、一般健康状态、性别、饮食、给药时间、给药途径,以及组合物的分泌率、治疗时间、与具体的组合物一起使用或同时使用的药物等的各种因素和医药领域中公知的类似因素而不同。
本发明的药物组合物可以用作免疫增强剂、能够提高疫苗的功效的佐剂(adjuvants)添加物、能够提高治疗功效的辅助治疗剂(例如抗癌助剂)等。
本发明的另一个方式提供包含人参皂苷f1作为有效成分的先天性免疫增强用食品组合物。
本发明中,术语“人参皂苷f1”和“免疫增强”如上述说明。
本发明中,术语“食品”有肉类、香肠、面包、巧克力、糖果类、点心类、饼干类、披萨、方便面、其他面类、口香糖类、包括冰淇淋的乳制品、各种汤、饮料、茶、保健饮料、酒精饮料、维生素复合制剂、功能性保健食品和保健食品等,包括所有通常含义的食品。
上述功能性保健食品(functionalfood)作为与特定保健用食品(foodforspecialhealthuse,foshu)相同的术语,是指被加工成除了营养供给以外还有效显示活体调节功能的医学、医疗效果高的食品。其中,“功能性”是指对人体的结构和功能调节营养素或者获得对生理学作用等之类的保健用途有效的效果。本发明的食品可以根据本领域中通常使用的方法而制造,上述制造时,可以添加本领域中通常添加的原料和成分而制造。此外,上述食品的剂型只要是作为食品被认定可的剂型,就可以没有限制地制造。本发明的食品用组合物可以被制成各种形态的剂型,与一般药品不同,将食品作为原料,存在没有长期服用时可能发生的药品的副作用等的优点且便携性优越,因此本发明的食品可以作为用于增强免疫增强效果的助剂而摄取。
上述保健食品(healthfood)是指,具有与一般食品相比更积极的健康维持或增强效果的食品,保健辅助食品(healthsupplementfood)是指健康辅助目的的食品。根据情况,互用功能性保健食品、保健食品、保健辅助食品的术语。
具体而言,上述功能性保健食品是指,将人参皂苷f1添加至饮料、茶类、香辛料、口香糖、饼干类等食品材料,或者被制成胶囊剂、粉末剂、悬浮液等的食品,摄取这些食品时,健康方面带来特定的效果,但与一般药品不同,将食品作为原料,因此存在如下优点:没有长期服用时可能发生的药品的副作用。
本发明的食品组合物可以日常摄取,因此能够期待高的免疫增强效果,从而非常有效。
上述组合物还可以包含生理学上可接受的载体,载体的种类没有特别限制,只要是所属技术领域中通常使用的载体,就可以使用任一种。
此外,上述组合物可以包含通常用于食品组合物而能够提高气味、味道、视觉等的追加成分。例如可以包含维生素a、维生素c、维生素d、维生素e、维生素b1、维生素b2、维生素b6、维生素b12、烟酸(niacin)、生物素(biotin)、叶酸(folate)、泛酸(panthotenicacid)等。此外可以包含锌(zn)、铁(fe)、钙(ca)、铬(cr)、镁(mg)、锰(mn)、铜(cu)、铬(cr)等矿物质。此外,可以包含赖氨酸、色氨酸、半胱氨酸、缬氨酸等氨基酸。
此外,上述组合物可以包含防腐剂(山梨酸钾、苯甲酸钠、水杨酸、脱氢乙酸钠等)、杀菌剂(漂白粉和高级漂白粉、次氯酸钠等)、抗氧化剂(丁基羟基苯甲醚(bha)、二丁基羟基甲苯(bht)等)、着色剂(焦油色素等)、成色剂(亚硝酸钠、亚硝酸钠等)、漂白剂(亚硫酸钠)、调味料(msg谷氨酸钠等)、甜味料(甘素、环磺酸盐、糖精、钠等)、香料(香草醛、内酯类等)、膨胀剂(明矾、d-酒石酸氢钾等)、增强剂、乳化剂、增稠剂(糊料)、成膜剂、胶基、消泡剂、溶剂、改良剂等食品添加物(foodadditives)。上述添加物可以根据食品的种类来选择并以适宜的量使用。
可以将上述人参皂苷f1直接添加或者与其它食品或食品成分一起使用,可以根据通常的方法适宜使用。有效成分的混合量可以根据其使用目的(预防、保健或治疗处理)来适当确定。一般而言,制造食品或饮料时,相对于食品或饮料,可以以50重量份以下、具体而言为20重量份以下的量添加本发明的食品组合物。但是,以健康和卫生为目的长期摄取时,可以包含上述范围以下的含量,由于在稳定性方面没有任何问题,因此有效成分可以使用上述范围以上的量。
作为本发明的食品组合物的一个例子,可以用作保健饮料组合物,在该情况下,与通常的饮料一样,可以含有各种香味剂或天然碳水化合物等作为追加成分。上述天然碳水化合物可以为葡萄糖、果糖等单糖;麦芽糖、蔗糖等二糖;糊精、环糊精等多糖;木糖醇、山梨醇、赤藓醇等糖醇。甜味剂可以使用奇异果甜蛋白、甜叶菊提取物等天然甜味剂;糖精、阿斯巴甜等合成甜味剂等。关于上述天然碳水化物的比率,本发明的组合物每100ml一般为约0.01~0.04g,具体而言为约0.02~0.03g。
除了上述成分之外,本发明的保健饮料组合物还可以含有各种营养剂、维生素、电解质、增味剂、着色剂、果胶酸、果胶酸盐、藻酸、藻酸盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、酒精或碳酸化剂等。除此之外,可以含有用于制造天然果汁、果汁饮料或蔬菜饮料的果肉。这样的成分可以单独或者混合使用。这样的添加剂的比率并不是很重要,通常,相对于本发明组合物100重量份,在0.01-0.1重量份范围内进行选择。
本发明的食品组合物只要能够显示免疫增强效果,就可以以各种重量%包含,具体而言,相对于食品组合物的总重量,可以以0.00001至100重量%或0.01至80重量%包含人参皂苷f1。
本发明的另一个方式提供包括将人参皂苷f1给药至个体的步骤的免疫增强方法。
本发明中,术语“人参皂苷f1”和“免疫增强”如上述说明。
本发明中,术语“给药”是指,通过任一种适宜的方法将本发明的组合物导入个体,上述组合物的给药途径只要达到目标组织,就可以通过任一种一般途径来给药。可以腹腔内给药、静脉内给药、肌肉内给药、皮下给药、皮内给药、口服给药、局部给药、鼻内给药,但并不限于此。
本发明中,术语“个体”是指需要或可能需要免疫增强的包括人类的大鼠、小鼠、家畜等所有动物。具体而言,可以为包括人类的哺乳动物。
上述组合物可以以药学上有效的量给药。
上述“药学上有效的量”是指以可应用于医学治疗的合理的益处/风险比率足以治疗疾病的量,有效用量水平可以根据将个体种类、严重程度、年龄、性别、药物的活性、对药物的敏感度、给药时间、给药途径、排出比率、治疗持续时间以及同时使用的药物包括在内的因素和其它医学领域中公知的因素来确定。例如,包含人参皂苷f1的上述药物组合物可以一天给药0.0001至1000mg/kg、具体而言为0.001至100mg/kg。
本发明的药物组合物可以每天给药或者可以间歇给药,一天给药次数可以为1次或分2~3次给药。此外,为了增强免疫,本发明的药物组合物可以单独使用或者与其它药物并用。考虑上述全部因素,给药能够以无副作用的最少量得到最大效果的量为重要,可容易由本领域技术人员确定。
本发明的另一个方式提供包含人参皂苷f1和自然杀伤细胞的穿孔素或颗粒酶制备用组合物。
本发明中,术语“人参皂苷f1”和“自然杀伤细胞”如上述说明。
本发明的一个实施例中,在用人参皂苷f1预处理自然杀伤细胞的情况下,确认穿孔素和颗粒酶b的表达增加(图6a和图6b),可知包含人参皂苷f1和自然杀伤细胞的组合物能够生产穿孔素或颗粒酶。
有益效果
根据本发明的组合物促进自然杀伤细胞的脱粒活性,提高细胞杀伤活性,增加细胞杀伤因子的表达,从而能够有效用作免疫增强剂。
附图说明
图1是显示自然杀伤细胞的脱粒现象的示意图。
图2a是在与靶细胞不在一起培养或一起培养的外周血单核细胞(peripheralbloodmononuclearcell,pbmc)中比较cd107a的表达程度的图表。
图2b是显示用人参皂苷rg3、rh2、f1或rg1处理外周血单核细胞(peripheralbloodmononuclearcell,pbmc)时cd107a表达的图表。
图2c是示出用人参皂苷rg3、rh2、f1或rg1处理外周血单核细胞(peripheralbloodmononuclearcell,pbmc)时比较根据人参皂苷的种类而不同的cd107a的表达量的图表。
图3a是显示用人参皂苷f1处理自然杀伤细胞时靶细胞的溶解程度的图表。
图3b是显示用人参皂苷rg3处理自然杀伤细胞时靶细胞的溶解程度的图表。
图4a是显示用人参皂苷f1处理原代自然杀伤细胞时靶细胞的溶解程度的图表。
图4b是显示用人参皂苷rg3处理原代自然杀伤细胞时靶细胞的溶解程度的图表。
图4c是显示用人参皂苷rg1处理原代自然杀伤细胞时靶细胞的溶解程度的图表。
图5是显示人参皂苷f1提高自然杀伤细胞的钙流动的图表。
图6a是用人参皂苷f1或人参皂苷rg1处理自然杀伤细胞时,比较穿孔素(prf1)的表达量的图表。
图6b是用人参皂苷f1或人参皂苷rg1处理自然杀伤细胞时,比较颗粒酶b(gzmb)的表达量的图表。
图7是在将用人参皂苷f1或人参皂苷rg1预处理后的rma-s细胞和rma细胞注射到腹腔的小鼠中,比较rma-s的选择性减少比率的图表。
具体实施方式
以下,通过实施例,更详细说明本发明的构成和效果。这些实施例仅用于例示本发明,本发明的范围并不限于这些实施例。
实施例1:由人参皂苷f1产生的先天免疫细胞的脱粒活性效果
通过流式细胞分析(fluorescenceactivatedcellsorter,facs),测定由人参皂苷f1产生的先天免疫细胞的脱粒(degranulation)活性程度。
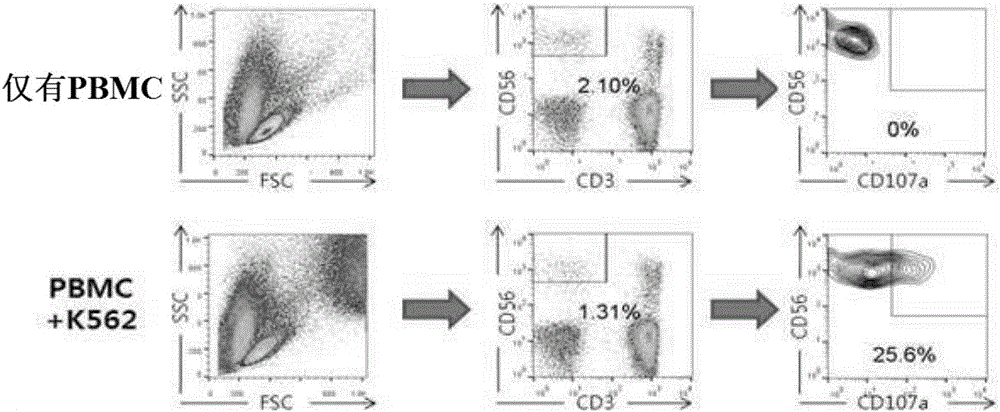
具体而言,用人参皂苷预处理从血液中分离的外周血单核细胞(peripheralbloodmononuclearcell,pbmc)和单纯分离的自然杀伤细胞后,将上述细胞分别与作为靶细胞的k562细胞或721.221细胞一起培养。之后,使用结合有荧光色素(fluorochrome)的抗-cd3、抗-cd56和抗-cd107a抗体,对外周血单核细胞和自然杀伤细胞的表面进行染色。另一方面,如图1所示,外周血单核细胞或自然杀伤细胞的脱粒活性与细胞表面的cd107a的表达成比例,因此利用流式细胞分析仪(facsmachine),测定外周血单核细胞和自然杀伤细胞的cd107a的表达程度。
测定结果确认,与靶细胞不在一起培养的外周血单核细胞几乎不表达cd107a,而与靶细胞一起培养的外周血单核细胞表达cd107a(图2a)。此外确认,即使与靶细胞一起培养,与用dmso(载体,vehicle)处理的组相比,用人参皂苷处理的组中过表达cd107a(图2b)。
具体而言,确认在与作为靶细胞的源自慢性骨髓性白血病患者的细胞株k562细胞、或作为人类b细胞的721.221细胞一起培养的情况下,与用dmso处理的组相比,所有的人参皂苷处理组中cd107a表达增加,人参皂苷f1处理组中cd107a的表达最多(图2b和图2c)。由此确认,人参皂苷f1和rg3显示优异的免疫增强效果,并且确认,尤其人参皂苷f1显示最优异的免疫增强效果。
实施例2:由人参皂苷f1产生的自然杀伤细胞的细胞杀伤活性效果
为了确认人参皂苷f1是否增强自然杀伤细胞的细胞杀伤活性,测定靶细胞的细胞溶解(cytolysis)程度。
具体而言,用人参皂苷f1或rg3预处理从血液中分离的外周血单核细胞(peripheralbloodmononuclearcell,pbmc)和单纯分离的自然杀伤细胞后,将上述细胞与用铕(europium)标记的作为靶细胞的k562细胞或721.221细胞一起培养。将上述自然杀伤细胞与靶细胞以5:1、10:1、20:1和40:1的比率进行混合并培养。另一方面,从靶细胞释放的荧光光度的程度与自然杀伤细胞的细胞杀伤活性程度成比例,因此将上述培养液离心分离后,使用酶标仪(microplatereader),测定因靶细胞的细胞溶解而释放的荧光光度。
测定结果确认,就所有的培养比率而言,人参皂苷f1和rg3给药组与dmso给药组相比,靶细胞的溶解程度显示高(图3a和图3b)。由此确认,人参皂苷f1和rg3对自然杀伤细胞显示优异的细胞杀伤活性。
实施例3:由人参皂苷f1产生的原代自然杀伤细胞的细胞杀伤活性效果
实施例3-1:原代自然杀伤细胞的分离
将健康供者的血液(50ml)采集到包含肝素钠的真空采血细胞制备管(vacutainercellpreparationtube,bdbiosciences公司)。之后,将上述血液离心分离,回收由血小板和白细胞形成的白色的薄层、即白膜层(buffycoat)。使用人类nk细胞阴性选择试剂盒(humannkcellnegativeselectionkit,miltenylbiotech公司),分离用pbs洗涤上述白膜层后得到的外周血单核细胞。将分离的自然杀伤细胞的一部分与facs缓冲液混合后,使用facs仪和结合有荧光色素(fluorochrome)的抗-cd3、抗-cd56和抗-cd107a抗体,测定自然杀伤细胞(cd3-/cd16+)的纯度以及cd56dim/cd16+、cd56bright/cd16-和cd56bright/cd16+的数目和比率,将纯度为95%以上的自然杀伤细胞用于实验。
实施例3-2:原代自然杀伤细胞的细胞杀伤活性效果
使用通过上述实施例3-1的方法而分离的原代自然杀伤细胞,利用与上述实施例2相同的方法,确认人参皂苷f1是否增强原代自然杀伤细胞的细胞杀伤活性。
测定结果确认,与dmso给药组相比,在所有的人参皂苷f1、rg3和rg1给药组中靶细胞的溶解程度显示高(图4a至图4c)。并且确认,与人参皂苷rg3和rg1给药组相比,尤其人参皂苷f1给药组的溶解程度显示显著优异。由此确认,人参皂苷f1和rg3对原代自然杀伤细胞显示优异的细胞杀伤活性,并且确认,尤其人参皂苷f1显示最优异的效果。
实施例4:随人参皂苷f1的处理的钙流分析(calciumfluxassay)
为了查明人参皂苷f1的基于自然杀伤细胞的免疫增强机制,使用利用共聚焦显微镜(confocalmicroscopy)的活细胞成像(livecellimaging),进行单一细胞的钙流分析。
具体而言,利用上述实施例3-1的方法单纯分离原代自然杀伤细胞(>97%)后,用人参皂苷f1或rg1进行处理。在30秒内测定基础钙水平后,利用nkg2d抗体和2b4抗体的组合,使自然杀伤细胞活化,然后通过共聚焦活细胞成像(confocallivecellimaging),分析钙流。
分析结果确认,人参皂苷f1与rg1相比,更有效提高自然杀伤细胞的钙流(图5)。由此确认,人参皂苷f1与人参皂苷rg1相比显示更优异的免疫增强效果。
实施例5:细胞杀伤因子的分析
为了分析由人参皂苷f1产生的自然杀伤细胞的细胞杀伤活性机制,用f1或rg1处理利用上述实施例3-1的方法单纯分离的原代自然杀伤细胞。经过12小时后,分离总rna,然后利用定量rt-pcr,分析作为自然杀伤细胞的代表性细胞杀伤因子的穿孔素(perforin)和颗粒酶b(granzymeb)的表达。
具体而言,使用trizol试剂,从自然杀伤细胞中分离总rna,使用未知序列的引物和逆转录酶(东洋纺公司制品),合成cdna。之后,使用下述表1的引物,利用sybrpcrmastermix(东洋纺公司),实施定量rt-pcr。
[表1]
上述pcr实施条件如下述表2所示。
[表2]
分析结果确认,在所有的人参皂苷处理组中,穿孔素和颗粒酶b的表达增加。具体而言确认,人参皂苷f1处理组与未处理组相比,穿孔素的表达量增加至约2倍,与人参皂苷rg1处理组相比,也显示高表达量(图6a)。此外确认,人参皂苷f1处理组与未处理组相比,颗粒酶b的表达量也增加至约1.5倍以上,与人参皂苷rg1处理组相比,也显示高表达量(图6b)。由此确认,人参皂苷f1与人参皂苷rg1相比显示更优异的免疫增强效果。
实施例6:人参皂苷f1的基于自然杀伤细胞的体内(invivo)免疫增强活性
为了评价人参皂苷f1对体内细胞杀伤活性的有效性,使用对自然杀伤细胞敏感的rma-s(mhci类-)和具有耐受性的rma(mhci类+)靶细胞系统。
具体而言,用25mg/kg浓度的人参皂苷f1预处理小鼠。之后,用分别不同的荧光标记的rma-s/rma细胞混合物向小鼠的腹腔注射。8小时后,利用facs,分析基于自然杀伤细胞的rma-s的选择性减少比率。
分析结果确认,在所有的人参皂苷处理组中,rma-s选择性地减少。具体而言确认,人参皂苷f1处理组显示约70%以上的去除能力,而未处理组(载体)显示约35%左右的去除能力,人参皂苷f1处理组与未处理组相比,显示rma-s减少2倍以上的优异的效果。此外确认,与相同量的人参皂苷rg1处理组相比,也显示优异的减少效果(图7)。由此确认,人参皂苷f1在体内也显示免疫增强效果,尤其人参皂苷f1与人参皂苷rg1相比,显示更优异的免疫增强效果。
根据以上说明,本发明所属的技术领域的技术人员可以理解,本发明在不改变其技术思想和必要特征的情况下可以以其它具体方式实施。与此关联,应理解,上述的实施例在所有方面上为例示的而并非限定性的。应解释,本发明的范围并非由上述说明的内容而是由权利要求书的含义和范围表示,并且由其等同概念导出的所有变更或变形的形态均包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种对11种人参皂苷类成分同时进行定性及定量的方法
- 含有人参皂苷rh4的皮肤外用剂组合物的制作方法
- 一种三七皂苷R1、人参皂苷Rg1、Re、Rb1和Rd的制备方法
- 含有杂质三七皂苷R<sub>1</sub>的人参皂苷Rg<sub>1</sub>的制作方法
- 人参皂苷Compound K酯类衍生物及其在制备防治动脉粥状硬化的药物中的应用的制作方法
- 一种含有人参皂苷Rh2、麦冬皂苷B的药物组合物的制作方法
- 通过微波辐照产生的具有提高的人参皂苷Rg3、Rg5和Rk1含量比的人参属植物提取物、制 ...的制作方法
- 含有来自水耕栽培人参的人参皂苷f2的皮肤外用剂组合物的制作方法
- 20(R)-人参皂苷Rg3在制备白癜风药物中的应用的制作方法
- 20(R)-人参皂苷Rg3在制备痛经药物中的应用的制作方法