一种载含酚羟基难溶性药物的脂质体及制备方法和应用与流程
本发明属于药剂领域,涉及一种脂质体及其制备方法和应用,具体地,此脂质体可以包载绝大部分结构中含酚羟基的难溶性药物。
背景技术:
众所周知,药物的水难溶性始终阻碍着药物的有效传递。研究数据表明,高达40%的经过高通量筛选出的、具有潜在应用前景的备选化合物,由于难溶于水,阻碍了其开发和应用。难溶性药物在疾病治疗应用中存在着诸多弊端,如:水溶性差会阻碍药物的吸收,导致药物生物利用度降低,尤其是口服药物;难溶性药物通过静脉途径给药可能会发生血管阻塞,在局部组织发生沉积,引起多种疾病。然而,疏水性却是许多活性物质所固有的特性,因为其亲脂性有利于药物穿透细胞膜,使更多的药物到达细胞内部,在特定靶点发挥治疗作用。因此,提高难溶性药物的溶解度同时保留药物的治疗活性是当今药剂学领域的一个难点和热点。
目前,提高难溶性药物溶解度的方法主要有:
一是加入酸或碱,调节药物溶液的pH,使药物形成可溶性的盐类。专利文献CN201010537215.9提供了一种加入有机胺增加药物溶解度的方法,该方法简单易行,适合工业化生产。但是形成盐类之后,药物的治疗活性可能会受到影响。而且,成盐的药物进入人体后,由于温度、pH、无机盐、血浆蛋白等体内环境因素,可能会使药物的溶解度重新降低,有严重的安全隐患。
二是将难溶性药物制成前体药物。此方法虽然可以显著提高药物的稳定性,使其进入人体后不易发生变化,但同时会破坏药物原有的结构,可能会使其药物活性发生改变。
三是将难溶性药物制备成包合物、固体分散体、纳米粒、脂质体或乳剂等新型制剂。此方法的优点是在增加药物溶解度的同时,完整地保留了药物的结构,不会对药物活性产生影响。而且某些剂型存在缓释效果,提高了疗效并降低了毒副作用。专利文献CN201310165276.0提供了一种难溶性药物固体分散体及其制备方法,该发明将难溶性的染料木素等多酚羟基类药物通过熔融法与高分子材料制备成固体分散体,显著提高了药物的溶出速率和溶解度。专利文献CN201010023013.2提供了一种水难溶性药物微胶囊的制备方法,该微胶囊具有增加药物溶解度、控制药物释放速率等优点。专利文献CN201510870096.1提供了一种包载难溶性药物的纳米骨架系统及制备方法,此纳米骨架系统具有提高药物溶解度、溶出度和生物利用度等优点。
脂质体是一种新型药物制剂,主要成分是磷脂,可以作为难溶性药物的载体。磷脂是人体内源性成分,有良好的生物相容性和安全性。经静脉给药后,脂质体被体内的网状内皮系统吞噬,使药物主要分布在肺、肝、脾和骨髓等器官。粒径不同,主要的分布器官也不一样。此外,如果机体中长有肿瘤,脂质体也会通过EPR效应滞留于肿瘤部位,从而实现被动靶向。专利文献CN200610021277.8提供了一种脂质体的制备方法和应用,此脂质体可以将难溶性药物和厚朴酚包载其中,用于肿瘤靶向治疗。然而,目前绝大多数脂质体都是以磷脂和胆固醇为基本材料,这种脂质体能够包载的难溶性药物的种类和数量都非常有限,而且载药脂质体的稳定性欠佳,往往几天之内就会有药物析出,极大地限制了其应用。
本发明旨在设计一种新型脂质体,不以传统的磷脂+胆固醇的组合为材料,此脂质体可以将大多数或一大类难溶性药物包载其中,增加药物溶解度,同时具有优秀的稳定性,可以在一周之内或更长时间内无药物析出且无明显的粒径变化。经过一系列的筛选,发明人发现以磷脂和15-羟基硬脂酸聚乙二醇酯(商品名:Kolliphor HS15)为材料制备的脂质体,可以满足上述需求。此外,发明人在研究过程中进一步发现,此新型脂质体可以将两种难溶性药物同时包载其中,且稳定性极佳。众所周知,联合用药是目前药剂研究领域的一大热门,有其特有的优势:一方面,联合用药可以让多种药物同时作用于同一病患部位,提高药物靶向性;另一方面,利用药物的互补特性,可以发挥协同或相加作用,可达到增效减毒的目的,从而更好地发挥药效。此发现极大地拓展了本发明中新型脂质体的应用,研究人员可以自由选择用其包载一种药物或同时包载两种药物用于联合用药治疗。此外,该脂质体也具有一定缓释效果,延长药物作用时间,降低毒副作用。而且,通过改变投料比可以得到不同粒径的脂质体,使其能够分布到不同的器官。按照不同的病变器官选择适宜粒径的脂质体,包载相应的治疗药物,达到靶向精准治疗的目的。
技术实现要素:
本发明的目的之一,提供一种新型脂质体,此脂质体不以普通脂质体常用的磷脂+胆固醇的组合为材料。
本发明的目的之一,提供一种可以包载大多数或一大类难溶性药物的脂质体,增加难溶性药物的溶解度,拓展脂质体的应用。
本发明的目的之一,提供一种可以同时将两种难溶性药物包载其中的脂质体,能够用作联合用药的载体。
本发明的目的之一,提供一种具有缓释效果的脂质体。
本发明的目的之一,提供一种具有被动靶向效果的脂质体。改变处方可以得到不同粒径的脂质体,被动靶向到不同组织器官。
本发明人通过研究难溶性药物的结构发现,含酚羟基结构的难溶性药物由于酚羟基的负电性质,可以与磷脂中带正电性的季胺氮产生作用力,使药物与磷脂形成复合物。此外,酚羟基结构也可以与磷脂的亲水性头部形成氢键,进一步增加了用磷脂包载含酚羟基结构的难溶性药物的可能性。但是单独使用磷脂无法稳定地包载难溶性药物。在进行了多种表面活性剂的筛选之后,发明人发现,使用15-羟基硬脂酸聚乙二醇酯与磷脂合用制备的脂质体,能将大多数含酚羟基结构的难溶性药物包载其中,且稳定性极佳。因而创造性地发明了这一载药能力更强的新型脂质体,此脂质体具有载药种类多、稳定性好及应用广等优势。
本发明人还发现,此脂质体可以同时包载两种或两种以上含酚羟基结构的难溶性药物,具有载药能力强、可用于联合给药等优势。
本发明提供了一种以磷脂和15-羟基硬脂酸聚乙二醇酯为材料的脂质体;磷脂和15-羟基硬脂酸聚乙二醇酯质量比优选为20:1~1:20,15-羟基硬脂酸聚乙二醇酯比例越大,脂质体粒径越小。单独使用磷脂或15-羟基硬脂酸聚乙二醇酯无法将药物稳定地包载到其中。
所述的脂质体,其粒径优选为40nm~200nm。
所述的脂质体,其载药量为0.1%~20%,优选为2%~10%。
本发明的目的之一,提供上述脂质体的应用。此脂质体不但可以用于包载含酚羟基结构的难溶性药物,还可以用于联合用药、药物缓释、肿瘤等组织的被动靶向治疗等。
本发明的目的之一,提供上述脂质体的制备方法。
作为具体的实施方案之一,本发明的脂质体的制备方法如下:
(1)将磷脂、15-羟基硬脂酸聚乙二醇酯和药物按照一定质量比例混合溶于有机溶剂,置于圆底烧瓶中;
(2)旋转蒸发成膜,加水水化,探头超声或高压均质,即得。
优选地,所述水包括去离子水、注射用水、生理盐水和5%葡萄糖溶液等。
步骤(1)中的磷脂选自商业来源不同规格的天然大豆磷脂、天然蛋黄磷脂、氢化磷脂以及合成磷脂,可以选自德国Lipoid公司磷脂S45、S75、S100、SPC、E80、EPCS、EPG、SPC-3、DSPE、DPPA、DSPA、DMPC等,日本丘比株式会社磷脂PC98-T、
PL-100M、HSPC、PGE、PGSH等,韩国斗山公司磷脂DS-PL95E等,优选磷脂E80、S100、PC98-T、EPCS等常用市售磷脂。
步骤(1)中的有机溶剂优选为乙醇、甲醇、二氯甲烷、氯仿、丙酮等及其混合溶剂。
步骤(1)中磷脂和15-羟基硬脂酸聚乙二醇酯质量比优选为20:1~1:20。
步骤(1)中的载药量优选为2%~10%。适用于本发明的含酚羟基的难溶性药物包括但不限于如下:
抗肿瘤药物,包括但不限于,姜黄素及其衍生物、白藜芦醇、和厚朴酚、替尼泊苷、替莫泊芬、柔红霉素、去甲柔红霉素、二乙氧二酰氧柔红霉素、佐柔比星、伊达比星、阿柔比星、氨柔比星、吡柔比星、流柔比星、美多比星、美诺立尔、奈莫柔比星、罗多比星、地托比星、依索比星、阿霉素、表阿霉素、阿克拉霉素、诺拉霉素、司替霉素、米托蒽醌、吡咯蒽醌、依托泊苷、兰瑞肽、伐普肽、依多曲肽、橄榄霉素、安曲霉素、羟基喜树碱、考布他丁A-4等。
其他药物,包括但不限于,左旋多巴、多巴酚丁胺、水飞蓟宾、羟基香豆素、门冬托星、伐普肽、氯喹那多、氯胺羟喹、氯碘羟喹、双碘喹啉、替布喹、甲羟喹、甲溴羟喹、异烟腙、曲格列酮、羟布宗、对乙酰氨基酚、沙丁胺醇等。
优选和厚朴酚、姜黄素、水飞蓟宾、白藜芦醇、吡柔比星或替尼泊苷等。
可以同时包载两种药物的组合,包括但不限于,姜黄素及其衍生物+和厚朴酚,白藜芦醇+和厚朴酚,替尼泊苷+和厚朴酚,柔红霉素+和厚朴酚,阿霉素+和厚朴酚,羟基喜树碱+和厚朴酚,水飞蓟宾+和厚朴酚,姜黄素及其衍生物+白藜芦醇,替尼泊苷+水飞蓟宾,白藜芦醇+阿霉素,水飞蓟宾+白藜芦醇等。
优选以下组合:和厚朴酚+替尼泊苷,姜黄素+白藜芦醇,阿霉素+白藜芦醇,和厚朴酚+白藜芦醇,和厚朴酚+姜黄素等。
有益效果
(1)本发明的脂质体,载药量大,稳定性好,有很好的安全性和生物相容性。
(2)本发明的脂质体,粒径多样,可以通过控制投料比例得到粒径40nm~200nm的脂质体,满足不同的靶向需求。
(3)本发明的脂质体,可以将含酚羟基结构的这一大类难溶性药物包载其中,载药种类多,应用范围广。
(4)本发明的脂质体,可以同时将两种含酚羟基结构的难溶性药物包载其中,载药能力强,适用于联合给药。
(5)本发明的脂质体具有被动靶向性。不同粒径的脂质体可以选择性地被动靶向到骨髓、肝脏、脾脏、肿瘤和肺等器官。
(6)本发明的脂质体具有一定的缓释效果。
(7)本发明脂质体的制备工艺简单、易控,适合工业化生产。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1表示实施例1中脂质体的透射电镜图(放大倍数为8万倍)。
图2表示实施例1中脂质体的体外释放实验结果。
图3表示DiD标记脂质体的肿瘤细胞摄取实验结果。
图4表示DiD标记脂质体的体内分布结果。
图5表示本发明脂质体的安全性评价结果。
图6表示本发明脂质体用于联合用药的药效结果。
图7表示本发明脂质体与常用脂质体的稳定性对比结果。
图8表示本发明脂质体与常用脂质体的体内药代动力学对比结果。
具体实施方式
以下实施例是对本发明的进一步说明,但绝不是对本发明范围的限制。下面参照实施例进一步详细阐述本发明,但是本领域技术人员应当理解,本发明并不限于这些实施例以及使用的制备方法。而且,本领域技术人员根据本发明的描述可以对本发明进行等同替换、组合、改良或修饰,但这些都将包括在本发明的范围内。
实施例1
将40mg磷脂E80、25mg 15-羟基硬脂酸聚乙二醇酯和6mg和厚朴酚溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得和厚朴酚脂质体,粒径84nm,静脉注射用于肿瘤靶向治疗。
实施例2
将100mg磷脂S100、5mg 15-羟基硬脂酸聚乙二醇酯和3mg姜黄素溶于二氯甲烷置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得姜黄素脂质体,粒径200nm,静脉注射缓释用于炎症治疗。
实施例3
将5mg磷脂SPC、100mg 15-羟基硬脂酸聚乙二醇酯和2mg水飞蓟宾溶于丙酮置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,探头超声即得水飞蓟宾脂质体,粒径40nm,静脉注射用于肝纤维化治疗。
实施例4
将50mg磷脂E80、15mg 15-羟基硬脂酸聚乙二醇酯和3mg白藜芦醇溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得白藜芦醇脂质体,粒径85nm,静脉注射用于肿瘤靶向治疗。
实施例5
将60mg磷脂S45、60mg 15-羟基硬脂酸聚乙二醇酯和3mg吡柔比星溶于氯仿置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得吡柔比星脂质体,粒径68nm,静脉注射用于肿瘤靶向治疗。
实施例6
将40mg磷脂S75、25mg 15-羟基硬脂酸聚乙二醇酯和2mg替尼泊苷溶于甲醇和丙酮的混合溶剂置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得替尼泊苷脂质体,粒径78nm,静脉注射用于肿瘤靶向治疗。
实施例7
将20mg磷脂E80、40mg 15-羟基硬脂酸聚乙二醇酯和3mg白藜芦醇溶于二氯甲烷置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,高压均质即得白藜芦醇脂质体,粒径65nm,静脉注射用于肿瘤靶向治疗。
实施例8
将80mg磷脂S100、10mg 15-羟基硬脂酸聚乙二醇酯和6mg姜黄素溶于甲醇置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,探头超声即得姜黄素脂质体,粒径110nm,静脉注射用于肿瘤靶向或炎症治疗。
实施例9
将50mg磷脂EPCS、10mg 15-羟基硬脂酸聚乙二醇酯和7mg和厚朴酚溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得和厚朴酚脂质体,粒径86nm,静脉注射用于肿瘤靶向治疗。
实施例10
将10mg磷脂PC98-T、100mg 15-羟基硬脂酸聚乙二醇酯和4mg水飞蓟宾溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得水飞蓟宾脂质体,粒径50nm,静脉注射用于肝纤维化治疗。
实施例11
将15mg磷脂E80、60mg 15-羟基硬脂酸聚乙二醇酯和3mg吡柔比星溶于氯仿置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得吡柔比星脂质体,粒径60nm,静脉注射用于肿瘤靶向治疗。
实施例12
将70mg磷脂EPG、7mg 15-羟基硬脂酸聚乙二醇酯和2mg替尼泊苷溶于甲醇和丙酮的混合溶剂置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,高压均质即得替尼泊苷脂质体,粒径78nm,静脉注射用于肿瘤靶向治疗。
实施例13
将4mg磷脂E80、48mg 15-羟基硬脂酸聚乙二醇酯和5mg姜黄素溶于甲醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得姜黄素脂质体,粒径48nm,静脉注射用于肿瘤靶向或炎症治疗。
实施例14
将15mg磷脂PL-100M、75mg 15-羟基硬脂酸聚乙二醇酯和4mg和厚朴酚溶于丙酮置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得和厚朴酚脂质体,粒径57nm,静脉注射用于肿瘤靶向治疗。
实施例15
将75mg磷脂E80、5mg 15-羟基硬脂酸聚乙二醇酯和4mg白藜芦醇溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,探头超声即得白藜芦醇脂质体,粒径150nm,静脉注射用于肿瘤靶向治疗。
实施例16
将60mg磷脂S100、10mg 15-羟基硬脂酸聚乙二醇酯和7mg水飞蓟宾溶于二氯甲烷置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得水飞蓟宾脂质体,粒径90nm,静脉注射用于肝纤维化治疗。
实施例17
将6mg磷脂E80、90mg 15-羟基硬脂酸聚乙二醇酯和3mg吡柔比星溶于氯仿置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得吡柔比星脂质体,粒径45nm,静脉注射用于肿瘤靶向治疗。
实施例18
将12mg磷脂EPCS、96mg 15-羟基硬脂酸聚乙二醇酯和4mg替尼泊苷溶于甲醇和丙酮的混合溶剂置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得替尼泊苷脂质体,粒径55nm,静脉注射用于肿瘤靶向治疗。
实施例19
将72mg磷脂E80、6mg 15-羟基硬脂酸聚乙二醇酯和5mg白藜芦醇溶于甲醇置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,探头超声即得白藜芦醇脂质体,粒径130nm,静脉注射用于肿瘤靶向治疗。
实施例20
将90mg磷脂S100、5mg 15-羟基硬脂酸聚乙二醇酯和4mg和厚朴酚溶于丙酮置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,高压均质即得和厚朴酚脂质体,粒径180nm,静脉注射用于肿瘤靶向治疗。
实施例21
将40mg磷脂E80、25mg 15-羟基硬脂酸聚乙二醇酯、3mg和厚朴酚和3mg替尼泊苷溶于甲醇和丙酮的混合溶剂置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得和厚朴酚-替尼泊苷共载药脂质体,粒径90nm,静脉注射用于肿瘤靶向协同给药治疗。
实施例22
将50mg磷脂S100、15mg 15-羟基硬脂酸聚乙二醇酯、4mg姜黄素和4mg白藜芦醇溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得姜黄素-白藜芦醇共载药脂质体,粒径100nm,静脉注射用于肿瘤靶向协同给药治疗。
实施例23
将60mg磷脂EPCS、20mg 15-羟基硬脂酸聚乙二醇酯、4mg阿霉素和3mg白藜芦醇溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入5%葡萄糖溶液水化,探头超声即得阿霉素-白藜芦醇共载药脂质体,粒径95nm,静脉注射用于肿瘤靶向协同给药治疗。
实施例24
将100mg磷脂E80、30mg 15-羟基硬脂酸聚乙二醇酯、5mg和厚朴酚和5mg白藜芦醇溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得和厚朴酚-白藜芦醇共载药脂质体,粒径110nm,静脉注射用于肿瘤靶向协同给药治疗。
实施例25
将70mg磷脂PC98-T、20mg 15-羟基硬脂酸聚乙二醇酯、4mg和厚朴酚和3mg姜黄素溶于丙酮置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,高压均质即得和厚朴酚-姜黄素共载药脂质体,粒径105nm,静脉注射用于肿瘤靶向协同给药治疗。
实验例1磷脂E80和15-羟基硬脂酸聚乙二醇酯的投料比与脂质体粒径的关系
控制磷脂E80和15-羟基硬脂酸聚乙二醇酯(表格中用HS15表示)的投料比例,可以得到不同粒径的脂质体,满足不同给药需求,如表1所示。结果表明,15-羟基硬脂酸聚乙二醇酯比例越大,脂质体粒径越小。
表1. 投料比与粒径的关系
实验例2磷脂E80和15-羟基硬脂酸聚乙二醇酯联合使用的重要性
发明人考察了单独使用磷脂E80或15-羟基硬脂酸聚乙二醇酯(表格中用HS15表示)来制备载药脂质体,如表2所示。结果表明,单独使用磷脂E80或15-羟基硬脂酸聚乙二醇酯制备的脂质体粒径和PDI较大,且非常不稳定。因此,磷脂E80和15-羟基硬脂酸聚乙二醇酯必须在一定比例下联合使用才能制备出符合发明人要求的脂质体。
表2. 单独使用磷脂E80或15-羟基硬脂酸聚乙二醇酯制备载药脂质体
实验例3载药脂质体稳定性考察
本发明选择实施例1中的和厚朴酚脂质体作为模型,研究此新型脂质体包载一种难溶性药物时的稳定性;选择实施例21中的共载药脂质体作为模型,研究此新型脂质体同时包载两种难溶性药物时的稳定性。将制备出的脂质体,分别放置于4°C、室温和37°C下保存,每隔一定时间取样测粒径,记录粒径的变化,如表3、表4所示。
表3. 单独包载一种药物的脂质体的稳定性考察
表4. 同时包载两种药物的脂质体的稳定性考察
结果表明,本发明的脂质体包载一种或两种药物均有出色的稳定性,10天之内粒径没有明显变化,也无药物析出,且温度对脂质体的保存无明显影响。
实验例4脂质体的形态、粒径测定
将实施例1中和厚朴酚脂质体的浓度(药物+辅料)稀释成1mg/ml,于透射电镜下观察脂质体的形态和粒径大小。
图1为和厚朴酚脂质体的透射电镜图。结果表明,和厚朴酚脂质体外观圆整,粒径均一。在此实施例下,和厚朴酚脂质体的粒径约为80~100nm。
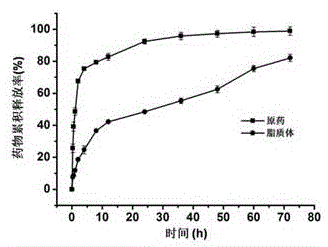
实验例5和厚朴酚脂质体的体外释放
将2ml和厚朴酚原药溶液(0.5mg/ml)和2ml实施例1中的和厚朴酚脂质体混悬液(0.5mg/ml,按和厚朴酚浓度计算)分别置于透析袋中(分子截留量为1000Da)。将透析袋置于含100ml PBS(pH7.4)的棕色广口瓶中,于37°C恒温摇床(100rpm)中振摇。每隔一段时间取5.0ml透析袋外的透析液测定紫外吸收值,同时向广口瓶中补加5.0ml新鲜PBS。将紫外吸收值代入标准曲线计算出和厚朴酚的浓度,进而计算出和厚朴酚原药与和厚朴酚脂质体在各个时间点的释放度(n=3)。
图2为实施例1中和厚朴酚脂质体的体外释放实验结果。结果表明,和厚朴酚脂质体在体外比和厚朴酚原药有更好的缓释效果,本发明的脂质体可以用于药物缓释。
实验例6肿瘤细胞摄取试验
用亲脂性荧光染料DiD标记脂质体,对脂质体进行示踪,制备方法与实施例1相似,具体为:将40mg磷脂E80、25mg 15-羟基硬脂酸聚乙二醇酯和0.6mg DiD溶于乙醇置于圆底烧瓶中,旋转蒸发成膜,加入生理盐水水化,探头超声即得DiD标记的脂质体(DiD-Lip),粒径82nm。
将小鼠黑色素瘤细胞(B16F10)接种于12孔板中,每孔1×105个细胞,用RPMI-1640培养基(含10%胎牛血清,50U/ml青霉素,50U/ml链霉素)在37°C、5%CO2培养箱中培养过夜,使细胞的单层覆盖率达到80%。吸去培养基,每孔分别加入1ml DiD原药溶液和DiD-Lip混悬液(用培养基将浓度稀释成0.5μg/ml,按DiD浓度计算)。原药组和脂质体组各做三个复孔,另设三孔作为对照。继续培养2h后,弃去培养基,PBS洗两遍,用胰酶消化细胞。1min后终止消化,将细胞转移至2ml离心管中离心,弃去上清,加入300μl PBS重悬,用流式细胞仪测定DiD的荧光强度。
图3为DiD-Lip的肿瘤细胞摄取结果(**:p<0.01)。结果表明,肿瘤细胞对脂质体的摄取要明显高于DiD原药,本发明的脂质体有作为肿瘤靶向药物载体的潜力。
实验例7体内分布研究
将6周龄的C57小鼠腋下接种B16F10细胞(每只给予2×106个细胞,分散在0.2ml PBS中)。待肿瘤长至约200mm3时(接种14天后)将小鼠分为2组:DiD原药组和DiD-Lip组(制备方法同实验例6),每组3只。分别静脉注射原药和脂质体后(给药剂量为10μg/kg,按DiD浓度计算),于2h后处死,取心、肝、脾、肺、肾、肿瘤,洗净,用活体成像仪对各器官进行半定量,测定器官中的DiD含量。
图4为DiD-Lip的体内分布结果。结果表明,脂质体在肿瘤组织中的分布要明显高于原药组,进一步证明本发明的脂质体可作为肿瘤靶向治疗的载体。
实验例8安全性评价
将10只雄性SD大鼠随机分为2组,每组5只。两组分别静脉注射生理盐水和脂质体(不载药,处方同实施例1,浓度为50 mg/kg),每2天注射一次,连续注射4周。在给药期间观察大鼠进食、活动、精神状态等生活情况,于末次给药24h后取血测定血液学指标,包括白细胞计数(WBC)、红细胞计数(RBC)和血小板数(Plt)。处死大鼠后取出心、肝、脾、肺、肾等各器官,4%多聚甲醛固定后,经石蜡包埋切片和苏木精-伊红染色后在光学显微镜下做病理组织学检查,观察两组大鼠的各个器官的病理变化情况。
图5为脂质体的安全性评价结果(a:血常规指标;b:各主要器官的病理切片,刻度代表200μm)。结果显示,脂质体组的血液学指标与生理盐水组无明显区别,表明脂质体对骨髓造血无影响。此外,脂质体对各主要器官没有明显毒性,进一步表明了本发明的脂质体安全性好。
实验例9脂质体用于联合用药
发明人选取替尼泊苷与和厚朴酚两种抗肿瘤药物,将其分别单独包载于脂质体和同时包载于同一脂质体中,比较联合用药与单独用药的抗肿瘤效果,探索此脂质体在联合用药领域的应用前景。
将6周龄的C57小鼠腋下接种B16F10细胞(每只给予2×106个细胞,分散在0.2ml PBS中)。待肿瘤长至约50mm3时(接种8天后)将小鼠分为5组:生理盐水组(a)、替尼泊苷脂质体组(b)、和厚朴酚脂质体组(c)、替尼泊苷脂质体+和厚朴酚脂质体组(d)和替尼泊苷+和厚朴酚共载药脂质体组(e),每组3只。每组分别给与对应的制剂,此后每隔1天给药一次,6次给药后停止给药,接种21天后停止实验。最后一次给药后解剖小鼠,将肿瘤取出后观察各组肿瘤大小。各组制剂制备过程如下:
a组:生理盐水;
b组:将替尼泊苷按照实施例1下的处方量包载到脂质体中,给药剂量为10mg/kg;
c组:将和厚朴酚按照实施例1下的处方量包载到脂质体中,给药剂量为10mg/kg;
d组:按照实施例1下的处方量分别制备替尼泊苷脂质体与和厚朴酚脂质体,然后将两种脂质体按体积比1:1混合后共给药,给药剂量按总药量计算,为10mg/kg;
e组:将替尼泊苷与和厚朴酚按照实施例21下的处方量按质量比1:1共同包载到同一脂质体中,给药剂量按总药量计算,为10mg/kg。
实验结果如图6所示。结果表明,脂质体包载两种药物联合用药的治疗效果明显优于使用单一药物脂质体进行治疗。而且,将两种药物包载于同一脂质体中进行治疗比混合两种单一药物脂质体进行治疗效果更优。因此,本发明的脂质体有极大的用于联合用药的潜力。
对比实验
为了进一步体现本发明的脂质体相比于目前常用的脂质体的优越性,发明人设置了对比实验。专利文献CN200610021277.8提供了一种脂质体,此脂质体以常用的磷脂和胆固醇为材料进行制备,并添加了PEG化的磷脂,而且也包载了和厚朴酚,符合我们的对比需求。因此,本发明人以专利文献CN200610021277.8中的脂质体作为对比制剂。
包载药物种类对比
发明人选择了几种有代表性的难溶性药物,分别用本发明的脂质体与专利文献CN200610021277.8中的脂质体包载,比较两者的包载能力。本发明的脂质体按照本发明实施例1下的处方量进行制备;对比脂质体按照专利文献CN200610021277.8中实施例1下的方法进行制备,结果如表5所示。
可以看出,本发明的脂质体可以将所有选择的药物包载其中,粒径和PDI较小,外观较好;而对比脂质体只能将和厚朴酚较好地包载其中,对其他选择的药物无法很好地包载。结果表明,本发明的脂质体能包载种类更多的难溶性药物,包载能力强。
表5. 包载药物种类对比
2.脂质体稳定性对比
分别按照本发明实施例1下的处方和专利文献CN200610021277.8中实施例1下的处方制备和厚朴酚脂质体,于室温下保存,每隔一定时间取样测粒径。用取样粒径与初始粒径的比值表征粒径的变化,考察两种脂质体各自的稳定性,结果如图7所示。
可以看出,本发明的脂质体在10天之内粒径几乎没有变化;而对比脂质体粒径一直在增加,10天之后粒径从100nm左右增加到了300nm左右。结果表明,本发明的脂质体具有更好的稳定性。
脂质体体内药代动力学对比
分别按照本发明实施例1下的处方和专利文献CN200610021277.8中实施例1下的处方制备和厚朴酚脂质体。将9只健康雄性Wistar大鼠(180±20g)随机分为和厚朴酚原药组、对比脂质体组和本发明的脂质体组三组,每组3只,分别给予各制剂,给药剂量按和厚朴酚计算为20mg/kg。给药后每隔一段时间,眼眶取血300μl于含有1%肝素钠的EP管中,6000rpm离心5min。取100μl上清,加400ul甲醇沉淀蛋白,涡旋10min后水浴超声10min,13000rpm离心10min,取上清,用HPLC测定各个时间点的血浆药物浓度,结果如图8所示。
结果表明,在没有使用PEG化磷脂的情况下,本发明脂质体的长循环效果还要略优于处方中含有PEG化磷脂的对比脂质体,体现了本脂质体在长循环方面的优越性,而且制备成本更加廉价。
- 还没有人留言评论。精彩留言会获得点赞!