一种胶原/硫酸软骨素复合人工眼角膜及其制备方法与流程
本发明涉及一种胶原蛋白/硫酸软骨素复合人工角膜的制备方法,属于生物材料领域。
背景技术:
在全球范围内,角膜病患者数量高达三亿,且这一数据正处在逐年递增。同时,由于角膜供体严重短缺,以及存在安全性不可控等其他问题,导致角膜病治疗困难。利用组织工程技术体外制备人工角膜的新思路为广大科研工作者所关注。
目前人工角膜的研究主要集中在光学镜柱材料和支架材料方面。光学镜柱材料要求其具有良好透光性,一般多采用聚甲基丙烯酸甲酯(polymethy1methacrylate,pmma),但存在硬度高,不宜高压加热蒸汽消毒,表面细胞粘附性差等问题。而基于生物材料制备的孔隙支架材料则有利于减轻免疫排斥反应,有较好的发展前景。由此,寻找一种组织相容性好、性能优异的人工角膜支架材料成为亟待解决的问题。
胶原蛋白(collagen,col),作为细胞外基质中一种重要的结构蛋白,在哺乳动物内含量丰富,约占到其自身蛋白质总量的25-33%。胶原蛋白具有三股肽链螺旋的特殊结构,拥有热变性,是优良的组织工程支架的生物材料。约占角膜厚度90%的基质层则由有序排列的胶原纤维板及铺展其间隙的分支状角膜基质细胞构成。可见胶原蛋白是角膜细胞外基质中的主要成分。它是由三股肽链通过强氢键、静电作用力形成三螺旋构象,呈现刚性链,能自组装形成纤维。胶原支架材料具有很多优点,它能为表皮细胞的迁移、增殖铺垫了支架,并提供了良好的营养基础,有利于上皮细胞的增生修复,因而能促进创面的愈合。然而,由于胶原分子中存在强的非共价键力而具有较高的结晶度,使得它无法溶解于普通溶剂中。目前,制备的胶原膜因力学性能差、降解快等缺点而无法真正得到应用。
硫酸软骨素是一类糖胺聚糖(gags),广泛分布于动物组织的细胞外基质和细胞表面。硫酸软骨素对角膜胶原纤维具有保护作用,能促进基质中纤维的增长,增强通透性,改善血液循环,加速新陈代谢,促进渗透液的吸收及炎症的消除;其聚阴离子具有强的保水性,能改善眼角膜组织的水分代谢,对角膜有较强的亲和力,能在角膜表面形成一层透气保水膜,改善眼部干燥症状。通过促进基质的生成,为细胞的迁移提供构架,有利于角膜上皮细胞的迁移,从而促进角膜创伤的愈合,渗出液的吸收及炎症的消除。然而,有关以胶原和硫酸软骨素进行化学交联制备组织工程材料的研究鲜有报道。
因此,寻找一种性能优良,接近天然眼角膜特性的人工角膜支架材料显得尤为重要,材料需具备的性能有:
1、生物相容性高,可降解,免疫排斥反应少;
2、力学性能优良,具有投入临床应用的可行性;
3、采用无毒副作用的交联剂交联,方法简便易操作;
4、角膜上皮细胞能够在人工角膜构筑的三维网络中良好地生长、增殖和再生。
目前国内外文献中对人工角膜的研究大多集中在主要原料为合成高分子上,对本发明涉及的利用角膜组织主要成分的胶原蛋白和硫酸软骨素为原料还未有报道。
技术实现要素:
本发明公开了一种胶原/硫酸软骨素复合人工眼角膜的制备方法。利用本发明所述的方法制备人工角膜具有优良力学性能和透光性,且生物相容性好等优点。
为实现上述目的,本发明所采取的技术方案是:
将胶原冻干原料溶于一定浓度的咪唑类离子液体溶液中制备得到不同浓度的胶原蛋白-离子液体混合体系。溶解充分的胶原浓溶液进行离心脱气泡,再采用流延法将其倾倒于模具中铺展成膜,模具浸泡在95%乙醇凝固浴中4-5h进行再生成型,然后用80%乙醇水溶液进行多次浸泡洗涤以置换出凝胶膜中的离子液体,最终得到厚度约为0.2mm凝胶薄片,在18℃恒温箱中脱水干燥形成胶原膜。将以上胶原凝胶浸泡在mes缓冲溶液中2h达到平衡,同时配置不同浓度的硫酸软骨素溶液,完全溶解后,用交联剂edc-nhs对硫酸软骨素进行活化05h。将上述mes平衡的胶原凝胶浸泡在活化好的硫酸软骨素溶液中,进行交联反应4h。然后将凝胶膜取出,用超纯水洗涤三次,室温下晾干,即得不同交联度的胶原/硫酸软骨素(col/cs)复合膜。将交联膜浸泡于1-100μg/ml生长因子fgf-10溶液中1-3小时,得到湿态胶原/硫酸软骨素/fgf-10复合膜col/cs/fgf。
通过图1中红外光谱(ir)表明胶原溶解于离子液体前后未发生明显的化学反应,说明[bmim]cl溶剂可以作为胶原溶解的优良溶剂,溶解过程不产生副反应,且未对原始胶原的三螺旋构象造成破坏。由此,在制备胶原基生物材料时,能够更有利于发挥胶原分子本身的优良性能,包括刚性的三螺旋构象提供优异的力学性能和流变学性能,同时三螺旋结构的自组装行为也可提供天然疏水空腔,从而用作药物载体和药物控制释放的研究。
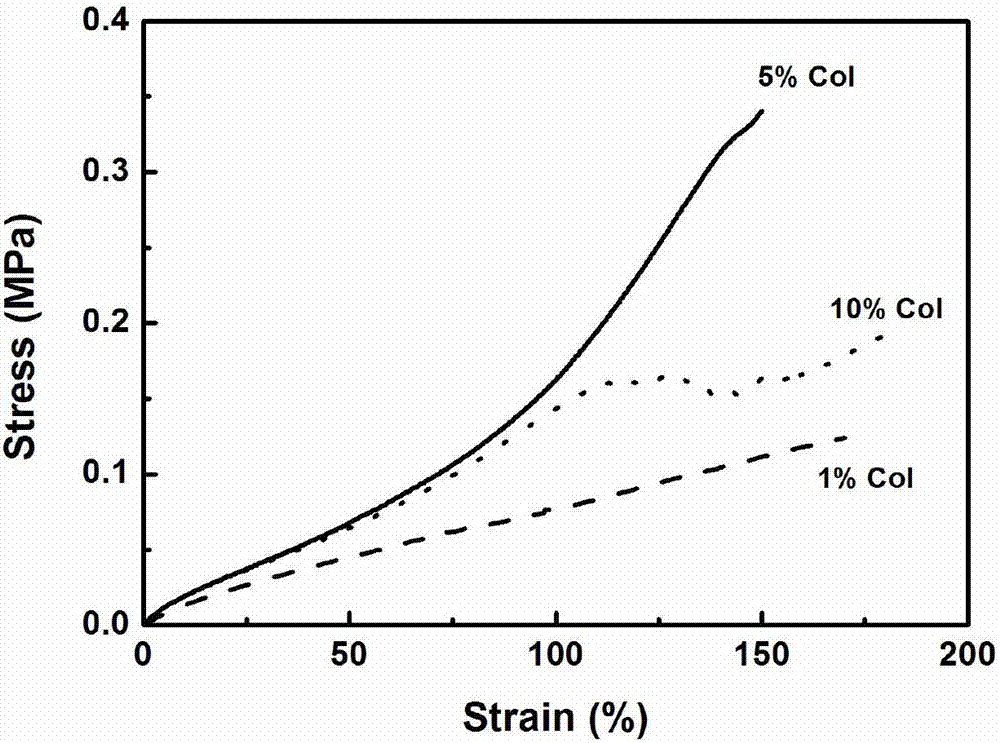
通过图2中力学拉伸曲线表明不同浓度制备得到的系列再生胶原膜fcol-1、fcol-2和fcol-3具有良好的拉伸弹性。为了更好的评估再生胶原膜作为人工眼角膜的可行性,我们将再生胶原膜浸泡在pbs缓冲溶液中平衡48h后,使用万能实验拉力机对它们在模拟体液状态下的拉伸强度进行了测试。当拉伸应变高达150%时,湿态膜在夹具处断裂,这可能是夹具对膜造成了损伤,表明实验测定值比实际值偏低。同时,胶原膜发生韧性断裂时具有较好的拉伸强度>0.1mpa,其中由5%胶原浓度制备的再生膜fcol-2表现最优的力学性能,即拉伸应变为150%和断裂强度为0.35mpa,能够满足人工眼角膜的强度要求。由此,我们选用5%胶原浓度用于下一步交联复合膜的制备。
通过图3中扫描电镜图(sem)表明col/cs复合膜在微观尺寸上达到了均一复合。将复合膜col/cs浸泡在纯水中24h充分溶胀,取出浸泡在液氮中10min,淬断,并在-50℃真空冻干。对冻干后的膜表面和断面进行喷金,用于扫描电镜测试。图中可看出,复合膜的表面微观结构分布有大量多孔结构,孔的尺寸为2~8μm。从截面图可清晰看到复合膜内部微观结构是由多孔三维支架构成,而胶原分子形成的片层结构和纤维形成孔壁。这种均一的多孔微观结构不仅为胶原基膜提供了平整的外观、良好透光性,同时蜂窝状的微米级孔使膜具有优异的拉伸强度和弹性形变,另外,这种多孔结构也使其具有很好的保水性。值得注意的是,微米孔壁上非常平整,没有杂质,表明硫酸软骨素在胶原内部交联达到了微观尺寸上的均一。由此,说明col/cs复合膜具有完好的微观结构,为其力学性能和光学性能提供了理论依据。
通过图4中光学显微镜图表明角膜上皮细胞在胶原基复合膜表面的细胞生长良好。图a为细胞培养48小时的空白对照样,可以看到细胞形态呈三角形或梭形,贴壁生长密度适中。在相同条件下,图b中细胞在col/cs/fgf复合膜上的生长密度基本达到饱和,而细胞形态也趋于多边形。结果说明col/cs/fgf复合膜能促进角膜上皮细胞的生长增殖。同时,细胞在胶原基膜上貼附生长良好,细胞分布均匀,没有发生团聚现象。
附图说明
图1为实施例1~3中所制备的胶原膜col-1、col-2和col-3的红外光谱图;
图2为实施例1~3中所制备的胶原膜col-1、col-2和col-3的力学拉伸曲线图;
图3为实施例4中所制备的胶原膜col/cs-1复合膜扫描电镜图;
图4为实施例6中所制备的胶原膜col/cs/fgf复合膜与角膜上皮细胞共培养48h的表面光学显微镜图。
具体实施方式
以下结合具体的实例对本发明的技术方案作进一步说明:
实施例1
称量10mg胶原冻干原料,溶于10mg离子液体中,55℃搅拌溶解2-4h,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度0.2mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-1。
实施例2
称量100mg胶原冻干原料,溶于100mg离子液体中,55℃搅拌溶解2天,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度02mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-2。
实施例3
称量300mg胶原冻干原料,溶于300mg离子液体中,55℃搅拌溶解3天,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度0.2mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-3。
实施例4
称量100mg胶原冻干原料,溶于100mg离子液体中,55℃搅拌溶解2天,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度02mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-2。称量10mg硫酸软骨素,溶于10ml水中,搅拌1~4h,制备得到1mg/ml的硫酸软骨素溶液。将膜col-2浸泡于mes缓冲溶液2小时,取出,再浸泡于1mg/ml硫酸软骨素水溶液1小时,添加交联剂edc-nhs,反应2-8小时。将膜取出,用水洗涤3次,于18℃恒温箱中脱水形成干态胶原/硫酸软骨素复合膜col/cs-1。
实施例5
称量100mg胶原冻干原料,溶于100mg离子液体中,55℃搅拌溶解2天,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度0.2mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-2。称量100mg硫酸软骨素,溶于10ml水中,搅拌1-4h,制备得到10mg/ml的硫酸软骨素溶液。将膜col-2浸泡于mes缓冲溶液2小时,取出,再浸泡于10mg/ml硫酸软骨素水溶液1小时,添加交联剂edc-nhs,反应2-8小时。将膜取出,用水洗涤3次,于18℃恒温箱中脱水形成干态胶原/硫酸软骨素复合膜col/cs-2。
实施例6
称量100mg胶原冻干原料,溶于100mg离子液体中,55℃搅拌溶解2天,将完全溶解的胶原溶液进行4000rpm,10min离心脱气泡,采用流延法将其倾倒于模具中铺展成膜。将模具浸泡于65-95%乙醇凝固浴中2-5h进行再生成型,用80%乙醇水溶液进行3次浸泡洗涤,除去凝胶膜中的离子液体,得到厚度0.2mm的凝胶薄片,于18℃恒温箱中脱水形成干态胶原膜col-2。称量100mg硫酸软骨素,溶于10ml水中,搅拌1-4h,制备得到10mg/ml的硫酸软骨素溶液。将膜col-2浸泡于mes缓冲溶液2小时,取出,再浸泡于10mg/ml硫酸软骨素水溶液1小时,添加交联剂edc-nhs,反应2-8小时。将膜取出,用水洗涤3次,将交联膜浸泡于1-100μg/ml生长因子fgf-10溶液中1-3小时,得到湿态胶原/硫酸软骨素/fgf-10复合膜col/cs/fgf。
- 还没有人留言评论。精彩留言会获得点赞!