口服药物组合物和其用于制备治疗或预防疾病的药物的用途的制作方法
本发明涉及一种口服药物组合物,具体地但不唯一地涉及一种包含精油的口服药物组合物。本发明还涉及治疗和/或预防受治疗者中的疾病的方法。本发明还涉及包含精油的膳食补充剂组合物。
背景技术:
科学报告和临床观察已经揭示出过量摄入含有促炎性物质的食物可能导致慢性炎性相关疾病。促炎性物质包括花生四稀酸,其通过产生促炎性白细胞三烯促进我们身体中的炎症。这些物质易于使我们的身体发炎。发现摄取具有相当大量的促炎性物质的不恰当食物的患者罹患有慢性疾病,诸如肝病和心血管疾病。相关疾病通常包括动脉粥样硬化症、动脉栓塞、关节炎、肝功能不全、哮喘等。然而,目前的药物方法诸如非甾体类消炎药具有不期望的副作用的巨大风险。
精油通常用在芳香疗法中用于局部涂抹或吸入来减压并增强免疫。虽然对使用精油存在一些安全担忧,诸如当涂抹未稀释的精油可能造成对使用者皮肤的刺激,但是不能否认的是精油具有显著的抗氧化剂特性。
因此,仍很需要开发一种用于治疗和/或预防疾病,尤其是伴随炎性反应的那些疾病的药物组合物和方法。本发明人对于精油可以减轻皮肤炎症方面有一定的经验,且因此发明人意识到精油可以用于对抗慢性炎性相关的疾病,尤其是那些由饮食诱导的炎症疾病。还很需要能够改善在日常食物源中缺乏某些营养物的受治疗者和/或经常食用促炎性物质的受治疗者的健康状况的膳食补充剂组合物。还需求可以用作防止受治疗者罹患炎性相关疾病的手段的膳食补充剂组合物。
技术实现要素:
发明人开发了一种口服药物组合物且发现该含有精油的口服药物组合物对治疗和/或预防疾病呈现出令人惊奇的效果。
根据本发明,提供了一种口服药物组合物,包括:
精油部分,包含衍生自植物的精油,其中植物的属选自由母菊属、柑橘属、牛至属、迷迭香属、刺柏属以及薰衣草属组成的组;和
载体油部分,具有脂肪酸。
具体地,本发明提供了一种口服药物组合物,包括精油部分和载体油部分,所述精油部分基本上由下述组成:
基于精油部分的总体积的约20vol.-%到约50vol.-%衍生自香柠檬橘的精油;
基于精油部分的总体积的约20vol.-%到约50vol.-%衍生自德國洋甘菊的精油;
基于精油部分的总体积的约10vol.-%到约30vol.-%的衍生自牛至的精油;
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自欧洲刺柏的精油;以及
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自迷迭香的精油;和
其中所述载体油部分包括脂肪酸。
本发明的口服药物组合物被证明有效地用于治疗和/或预防疾病。本发明的口服药物组合物可用于制备治疗或预防疾病的药物的用途。虽然不期望受到理论的限制,但是认为具体地,该口服药物组合物能够减少诸如干扰素-γ和肿瘤坏死因子-α的炎性因子的水平并增加诸如白细胞介素-10的抗炎性因子。而且,认为该口服药物组合物可以改善器官的功能,例如通过维持血液中的丙氨酸转氨酶和天冬氨酸转氨酶的水平,以便对肝作出保护效果。
本发明还涉及一种通过向受治疗者施用有效量的所述口服药物组合物来治疗和/或预防受治疗者中的疾病的方法。
本发明进一步涉及所述口服药物组合物用于制备治疗和/或预防疾病的药物的用途。
另外,本发明涉及一种膳食补充剂组合物,包括精油部分和载体油部分,所述精油部分基本上由下述组成:
基于精油部分的总体积的约20vol.-%到约50vol.-%衍生自香柠檬橘的精油;
基于精油部分的总体积的约20vol.-%到约50vol.-%衍生自德國洋甘菊的精油;
基于精油部分的总体积的约10vol.-%到约30vol.-%的衍生自牛至的精油;
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自欧洲刺柏的精油;以及
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自迷迭香的精油;和
其中所述载体油部分包括脂肪酸。
膳食补充剂组合物优选包括受治疗者需要的来自食物源的必需脂肪酸。本发明的膳食补充剂组合物允许受治疗者通过根据受治疗者的情况每天、每周或每月消耗膳食补充剂来维持膳食均衡。
附图说明
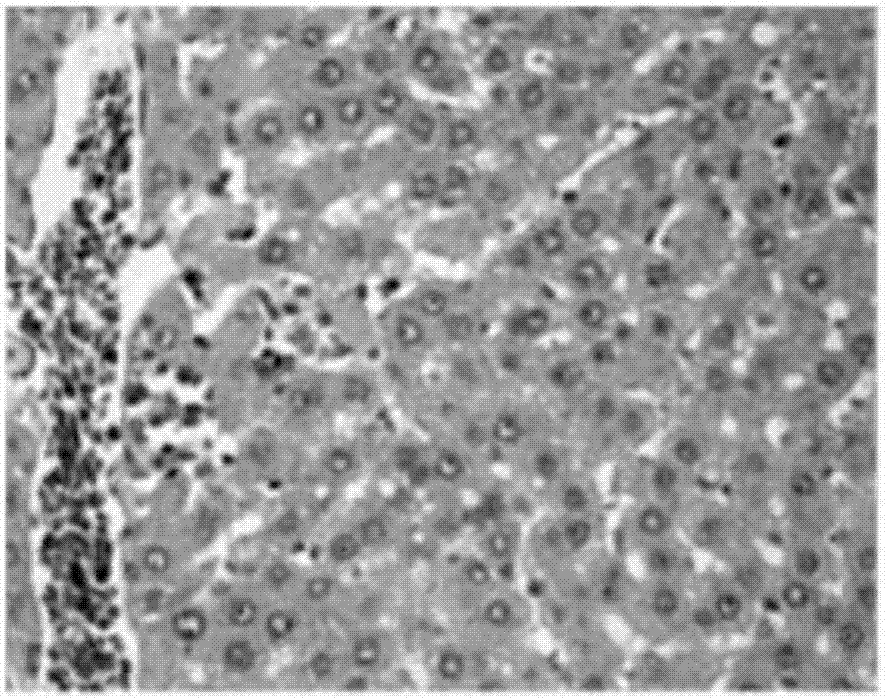
图1展示了通过对由伴刀豆球蛋白a诱导的小鼠施加根据本发明的口服药物组合物后,小鼠肝组织在he染色后的情况,其中图1a是正常对照组小鼠肝组织,图1b是模型组小鼠肝组织,图1c至1e是施加不同浓度的本发明的组合物a的小鼠肝组织。
图2展示了通过对由伴刀豆球蛋白a诱导的小鼠施加根据本发明的口服药物组合物后,cyp5a1,cyp2e1和cyp3a在小鼠肝组织中的表达。
具体实施方式
本发明提供了一种口服药物组合物,包括:
精油部分,包含衍生自植物的精油,其中植物的属选自由母菊属、柑橘属、牛至属、迷迭香属、刺柏属以及薰衣草属组成的组;和
载体油部分,具有脂肪酸。
本发明的术语“口服药物组合物”指的是适于通过向受治疗者口腔施用,即通过口腔施用的治疗性和/或预防性治疗或预防疾病的组合物。因此,本发明的口服药物组合物可以呈分散剂、乳液、悬浮剂、糖浆、片剂、硬或软明胶囊、丸剂、球丸、粉剂、颗粒等形式。在优选的实施方案中,口服药物组合物呈分散剂、乳液、悬浮剂、硬或软明胶囊和/或压制片剂。
口服药物组合物可以包括适于向受治疗者施用的药学上可接受的赋形剂或媒介物。在本文的一个实施方案中,受治疗者是诸如啮齿动物或人的哺乳动物。优选地,受治疗者是人。药学上可接受的赋形剂包括液体或固体填料、润滑剂、稀释剂、溶剂或包封材料,用于携带并递送口服药物组合物的活性成分至受治疗者身体的器官或部位以施加治疗作用。
本发明的口服药物组合物包含精油部分和载体油部分。精油部分的量是基于口服药物组合物的总体积的约0.1vol.-%到约20vol.-%。在一个实施方案中,精油部分是基于口服药物组合物的总体积的约0.2vol.-%到约1vol.-%;或约0.3vol.-%到约10vol.-%;或约0.4vol.-%到约5vol.-%;或约0.5vol.-%到约3vol.-%。在本文的一个实施方案中,精油部分的量是基于口服药物组合物的总体积的约1vol.-%。
此外,载体油部分的量是基于口服药物组合物的总体积的约80vol.-%到99.9vol.-%。在一个实施方案中,载体油部分是基于口服药物组合物的总体积的约85vol.-%到约99.8vol.-%;或约90vol.-%到约99.7vol.-%;或约95vol.-%到约99.6vol.-%;或约97vol.-%到约99.5vol.-%。在一个实施方案中,载体油部分的量是基于口服药物组合物的总体积的约99vol.-%。
正如在本文中使用的术语“精油”(也称为香精油和挥发油)指的是含有挥发性香料化合物的浓缩的疏水性液体。精油通常通过一些提取形式诸如蒸馏、溶剂萃取以及冷压榨以从植物材料中分离出挥发性化合物而从植物材料获得。优选地,植物材料是非转基因的。在本文的一个实施方案中,精油呈提取物的形式。本领域技术人员知晓从植物材料获得精油的合适的方法。在一些实施方案中,具有不同品质和纯度的精油从全世界的摊贩和公司容易地且市售获得。在此特定短语中的术语“精”指的是植物的“精华”。将理解,本领域技术人员将不会混淆此术语与“必需脂肪酸”,后者指的是人或动物为了健康,即为了均衡的膳食,必需从食物源获得的脂肪酸。
本发明的精油部分包括衍生自植物的精油,其中植物的属选自由母菊属、柑橘属、牛至属、迷迭香属、刺柏属以及薰衣草属组成的组。在实施方案中,精油部分包括衍生自德国洋甘菊(matricariachamomilla)、香柠檬橘(citrusbergamia)、牛至(origanumvulgare)、欧洲刺柏(juniperuscommunis)或迷迭香(rosmarinusofficinalis)的精油。在一个实施方案中,精油部分包括衍生自德國洋甘菊的精油和衍生自香柠檬橘的精油。在另外的实施方案中,精油还可以包括衍生自牛至的精油;仍另外地,精油可以另外包括衍生自欧洲刺柏的精油和衍生自迷迭香的精油。
在本文的实施方案中,精油部分包括或基本上由下述组成:
基于精油部分的总体积的约20vol.-%到约50vol.-%的衍生自香柠檬橘的精油;
基于精油部分的总体积的约20vol.-%到约50vol.-%的衍生自德國洋甘菊的精油;
基于精油部分的总体积的约10vol.-%到约30vol.-%的衍生自牛至的精油;
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自欧洲刺柏的精油;以及
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自迷迭香的精油。
此外,精油部分还可以包括衍生自其它属的一种或多种额外的精油。本领域技术人员将会理解,组合物可以基于口服药物组合物的用途来调节。
精油部分包括多种萜和类萜,尤其是单萜化合物和它们的衍生物。在实施方案中,精油部分包括选自由柠檬烯、1,8-桉树脑以及香芹酚组成的组的化合物。柠檬烯是具有下式(i)的单萜。
1,8-桉树脑是具有下式(ii)的单类萜
香芹酚是具有下式(iii)的单类萜酚
在一个实施方案中,口服药物组合物包括基于口服药物组合物的总体积的至少5%的柠檬烯、至少5%的1,8-桉树脑以及至少5%的香芹酚。在另外的实施方案中,口服药物组合物中的柠檬烯、1,8-桉树脑以及香芹酚中的每一种的量分别是基于口服药物组合物的总体积的约5%到15%;或约8%到10%的量。因此,虽然不期望受理论限制,但是认为口服药物组合物对受治疗者的器官呈现出抵抗不期望的氧化的保护效果。
本发明的术语“载体油”(也称为基础油)指的是用于稀释精油以使口服药物组合物中为呈现出期望效果所具有的合适量的精油的基于油的液体。载体油还可以用作组合物中的可接受的剂。载体油通常不包括浓缩的香料化合物。载体油可以衍生自植物材料或动物材料。在本文的实施方案中,载体油呈提取物的形式,尤其呈含植物脂肪酸的油基提取物的形式。正如本文中使用的,术语“脂肪酸”指的是具有长脂肪烃链的羧酸。脂肪酸指的是饱和脂肪酸和不饱和脂肪酸两者。对于“植物脂肪酸”,其指衍生自植物材料的脂肪酸。
植物脂肪酸衍生自植物,且其中植物的属选自由大麻属、芝麻属、李属以及迷迭香属组成的组。在一个实施方案中,植物脂肪酸衍生自大麻(cannabissatival.)、印度大麻(cannabisindicalam.)、莠草大麻(cannabisruderalisjanisch)、芝麻(sesamumindicuml.)、扁桃仁(prunusdulcis(mill.)d.a.webb)以及迷迭香(rosmarinusofficinalis)中的至少一种的种。本领域技术人员知晓从植物材料获得载体油的合适的方法。在一些实施方案中,具有不同品质和纯度的载体油从全世界的摊贩和公司容易地且通过市售获得。例如,植物脂肪酸可以衍生自市售的大麻、芝麻、甜杏仁油或迷迭香花。
在优选的实施方案中,口服药物组合物中的载体油部分包括衍生自一种或多种植物材料的一种或多种油基提取物。植物材料选自由大麻、芝麻以及甜杏仁组成的组。在一个实施方案中,载体油部分包括衍生自大麻、芝麻以及甜杏仁油的三种油基提取物,即载体油部分包括大麻油、芝麻油以及甜杏仁油。大麻油的量是基于载体油部分的总体积的约5vol.-%到约35vol.-%;或约10vol.-%到约30vol.-%;或约15vol.-%到约25vol.-%;或约20vol.-%。芝麻油的量是基于载体油部分的总体积的约15vol.-%到约45vol.-%;或约20vol.-%到约40vol.-%;或约25vol.-%到约35vol.-%;或约30vol.-%。甜杏仁油的量是基于载体油部分的总体积的约35vol.-%到约65vol.-%;或约40vol.-%到约60vol.-%;或约45vol.-%到约55vol.-%;或约50vol.-%。具体地,载体油部分包括约20vol.-%的大麻油、约30vol.-%的芝麻油以及约50vol.-%的甜杏仁油。
在本文的一个实施方案中,本发明的载体油部分包括选自由油酸、异油酸、亚油酸、α-亚麻酸以及γ-亚麻酸组成的组的至少两种植物脂肪酸。在另外的实施方案中,载体油部分包括所有油酸、异油酸、亚油酸、α-亚麻酸以及γ-亚麻酸。在另一个实施方案中,口服药物组合物包含基于口服药物组合物中的脂肪酸的总量的至少0.5wt.-%;或约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到3wt.-%的量的异油酸。在一个实施方案中,口服药物组合物包括基于口服药物组合物中的脂肪酸的总量的约20wt.-%到60wt.-%;或约30wt.-%到55wt.-%;或约40wt.-%到50wt.-%的量的油酸。在另一个实施方案中,口服药物组合物包括基于口服药物组合物中的脂肪酸的总量的约20wt.-%到60wt.-%;或约35wt.-%到55wt.-%;或约30wt.-%到40wt.-%的量的亚油酸。在另外的实施方案中,口服药物组合物包括基于口服药物组合物中的脂肪酸的总量的至少0.5wt.-%;或约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到4wt.-%的量的α-亚麻酸。在另一个实施方案中,口服药物组合物包括基于口服药物组合物中的脂肪酸的总量的至少0.5wt.-%;或约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到3wt.-%的量的γ-亚麻酸。
虽然不期望受理论限制,但是认为口服药物组合物中的植物脂肪酸可以帮助抑制花生四烯酸的释放,呈现抗凝作用,改善血管弹性,降低血液中有害胆固醇即低密度脂蛋白的水平和/或抑制炎性因子的释放并增强胰岛素的作用。
在本发明的实施方案中,口服药物组合物可以另外包括聚合物以将精油部分和载体油部分包封在聚合物中。在本文的一个实施方案中,精油部分和载体油部分可以被基本上由聚合物组成的包衣膜包衣。优选地,聚合物是多糖诸如藻酸钠。在另一个实施方案中,聚合物可以是聚乳酸、聚乳酸-共-乙醇酸或其组合。
为了便于存储和施用,口服药物组合物可以被包封以形成微囊。这允许口服药物组合物被存储在相对更稳定的条件下且为摄取所述组合物的使用者提供可选择的剂型。这样的微囊为口服提供更方便的服用方法。在一个实施方案中,微包封系统可以被用于形成微囊。微包封系统优选地包括射流微包封技术。
在一个实施方案中,包封精油部分和载体油部分以形成微囊的方法包括下述步骤:
充分混合精油部分和载体油部分与聚合物和水的混合物以形成聚合物溶液,优选地所述聚合物包括藻酸钠;
通过使用注射器以预定的流速将聚合物溶液引入到胶凝化溶液中以形成微囊,优选地胶凝化溶液包括氯化钙或钙盐;
借助恒磁搅拌持续预定的时间段来固化胶凝化溶液中的微囊;
过滤固化的微囊;
重新悬浮滤出的微囊以形成用于冻干的悬浮液;以及
收集所得到的微囊。
本领域技术人员将理解,用于制备微囊的其他合适的方法可以适用于本发明。
此外,本发明还涉及通过向受治疗者施用有效量的上述口服药物组合物来治疗和/或预防受治疗者中的疾病的方法。
表达“有效量的”通常表示足以产生期望的治疗结果的量,其中结果的确切性质根据被治疗的具体疾病而变化。当疾病伴有炎症,结果通常是炎性因子的表达或功能活性的抑制或减轻。结果也可以是抗炎性因子的表达或功能活性的增强。具有本领域普通技术知识的医生或兽医将会理解以测定并规定本发明的口服药物组合物的有效量。医生或兽医也将能够根据待缓解的病情的严重度来调节口服药物组合物的有效量。
在一个实施方案中,若受治疗者是人,则口服药物组合物被向受治疗者施用基于受治疗者的总体重的约0.04ml/kg到约0.4ml/kg;或约0.05ml/kg到约0.3ml/kg的量。具体地,向受治疗者施用口服药物组合物,其量为每天约0.055ml/kg、0.11ml/kg或0.22ml/kg,取决于待缓解的病情的严重度。口服药物组合物可以以液体形式施用。
在另一个实施方案中,若受治疗者是啮齿动物,口服药物组合物被向受治疗者施用基于受治疗者的总体重的约0.5ml/kg到约2.0ml/kg的量。具体地,口服药物组合物被向受治疗者施用每天约0.5ml/kg、约1ml/kg或约2ml/kg的量,取决于待缓解的病情的严重度。口服药物组合物可以被以液体形式施用。
虽然不期望受理论限制,但是认为本发明的方法对治疗和/或预防炎性疾病是有效的,炎性疾病诸如自身免疫性疾病、肝脏疾病以及心血管疾病,这些疾病可以或可以不伴有炎性反应。在本文的实施方案中,该方法被用于治疗和/或预防肝脏疾病或心血管疾病。
肝脏疾病(也称为肝炎疾病)涵盖肝脏的所有可能的疾患,其中肝脏不能正常工作。肝脏疾病可以选自由肝炎、酒精性肝病、脂肪肝疾病、遗传性疾病、肝纤维化(fascilasis)、肝硬化、肝癌及其组合组成的组。在一些实施方案中,口服药物组合物用于治疗和/或预防受治疗者的肝炎、酒精性肝病或脂肪肝疾病。
心血管疾病涵盖心脏和血管的所有可能的疾患,其中心脏和血管不能正常工作。心血管疾病可以选自由动脉粥样硬化、再狭窄、冠状动脉疾病、外周动脉疾病、动脉瘤、血栓症、栓塞、心肌梗塞、局部缺血及其组合组成的组。在本文的实施方案中,口服药物组合物用于治疗和预防受治疗者的动脉粥样硬化、冠状动脉疾病或外周动脉疾病。
在其他实施方案中,方法被用于治疗胃肠道疾病,尤其是伴有炎症的胃肠道疾病,诸如胃炎、肠胃炎、胃溃疡、消化性溃疡、小肠结肠炎、腹泻以及结肠炎。
本文使用的口服药物组合物还可以与适于待治疗的特定适应症的一种或多种其他治疗剂组合。治疗剂以实现期望的治疗效果的有效量存在。
此外,本发明提供了上述口服药物组合物用于制备治疗和/或预防疾病的药物的用途。在本文的一个实施方案中,疾病是上述肝脏疾病或心血管疾病。肝脏疾病或心血管疾病可以伴有炎性反应。在另一个实施方案中,疾病是伴有炎性反应的胃肠道疾病。
本文描述的方法为治疗和/或预防罹患某些疾病或疾患的受治疗者的医生或兽医提供了可选择的方法。具体地,本发明的方法在治疗和/或预防受治疗者的肝脏疾病和心血管疾病方面是有效的,而不会对肝脏施加不利的影响。方法还可具有低的严重副作用风险。
此外,本发明进一步涉及膳食补充剂组合物。膳食补充剂组合物包括本文描述的精油部分和载体油部分。具体地,膳食补充剂组合物包含:
精油部分,包含衍生自植物的精油,其中植物的属选自由母菊属、柑橘属、牛至属、迷迭香属、刺柏属以及薰衣草属组成的组;和
载体油部分,具有脂肪酸。
正如本发明中使用的术语“膳食补充剂”指的是期望向受治疗者提供营养物以维持均衡膳食的组合物。术语精油和载体油在本文中其他地方被定义。
在一个实施方案中,膳食补充剂组合物包括基于膳食补充剂组合物的总体积的约0.1vol.-%到约5vol.-%;或约0.2vol.-%到约2vol.-%;或约0.3vol.-%到约1vol.-%的精油部分。而且,膳食补充剂组合物包括基于膳食补充剂组合物的总体积的约95vol.-%到约99.9vol.-%;或约98vol.-%到约99.8vol.-%;或约99vol.-%到约99.7vol.-%的载体油部分。具体地,膳食补充剂组合物包括约1vol.-%的精油部分和约99vol.-%的载体油部分。
此外,膳食补充剂组合物的精油部分包括或基本上由衍生自植物的精油组成,其中植物的属选自由母菊属、柑橘属、牛至属、迷迭香属、刺柏属以及薰衣草属组成的组。在一个实施方案中,精油部分包括衍生自德國洋甘菊的精油和衍生自香柠檬橘的精油。在另外的实施方案中,精油还可以包括衍生自牛至的精油;仍另外地,精油可以另外包括衍生自欧洲刺柏的精油和衍生自迷迭香的精油。
在具体的实施方案中,精油部分包括或基本上由下述组成:
基于精油部分的总体积的约20vol.-%到约50vol.-%的衍生自香柠檬橘的精油;
基于精油部分的总体积的约20vol.-%到约50vol.-%的衍生自德國洋甘菊的精油;
基于精油部分的总体积的约10vol.-%到约30vol.-%的衍生自牛至的精油;
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自欧洲刺柏的精油;以及
基于精油部分的总体积的约5vol.-%到约20vol.-%的衍生自迷迭香的精油。
膳食补充剂组合物的精油部分还包括选自由柠檬烯、1,8-桉树脑以及香芹酚组成的组的化合物。具体地,膳食补充剂组合物包括基于膳食补充剂组合物的体积的至少5%的柠檬烯、至少5%的1,8-桉树脑以及至少5%的香芹酚。
优选地,膳食补充剂组合物包括衍生自大麻、印度大麻、莠草大麻、芝麻、扁桃仁或迷迭香中的至少一种的种的植物脂肪酸。在一个实施方案中,膳食补充剂组合物包括衍生自选自由大麻、芝麻以及甜杏仁油组成的组的植物材料的一种或多种油基提取物,即载体油部分包括大麻油、芝麻油以及甜杏仁油。大麻油的量是基于载体油部分的总体积的约5vol.-%到约35vol.-%;或约10vol.-%到约30vol.-%;或约15vol.-%到约25vol.-%;或约20vol.-%。芝麻油的量是基于载体油部分的总体积的约15vol.-%到约45vol.-%;或约20vol.-%到约40vol.-%;或约25vol.-%到约35vol.-%;或约30vol.-%。甜杏仁油的量是基于载体油部分的总体积的约35vol.-%到约65vol.-%;或约40vol.-%到约60vol.-%;或约45vol.-%到约55vol.-%;或约50vol.-%。具体地,载体油部分包括约20vol.-%的大麻油、约30vol.-%的芝麻油以及约50vol.-%的甜杏仁油。
载体油部分包括选自由油酸、异油酸、亚油酸、α-亚麻酸以及γ-亚麻酸组成的组的至少两种脂肪酸。具体地,膳食补充剂组合物包括油酸、异油酸、亚油酸、α-亚麻酸以及γ-亚麻酸的植物脂肪酸。
在一个实施方案中,膳食补充剂组合物包括:
基于膳食补充剂组合物中的脂肪酸的总量的约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到3wt.-%的异油酸;
基于膳食补充剂组合物中的脂肪酸的总量的约20wt.-%到60wt.-%;或约30wt.-%到55wt.-%;或约40wt.-%到50wt.-%的油酸;
基于膳食补充剂组合物中的脂肪酸的总量的约20wt.-%到60wt.-%;或约35wt.-%到55wt.-%;或约30wt.-%到40wt.-%的亚油酸;
基于膳食补充剂组合物中的脂肪酸的总量的约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到4wt.-%的α-亚麻酸;以及
基于膳食补充剂组合物中的脂肪酸的总量的约0.5wt.-%到10wt.-%;或约0.8wt.-%到5wt.-%;或约1wt.-%到3wt.-%的γ-亚麻酸。
虽然不期望受理论限制,但是认为本发明的膳食补充剂组合物为缺乏某些营养物的受治疗者提供了足够的营养物。受治疗者需要的所述营养物可以包括必需脂肪酸,如油酸、亚油酸以及α-亚麻酸。因此,本发明提供了受治疗者可以摄取的,例如每天摄取以维持健康所要求的均衡膳食的膳食补充剂。膳食补充剂组合物可以被每天、每周或每月服用一次或两次,这取决于与通常的每天食物来源结合的必要性。
在本文的一个实施方案中,若受治疗者是人,则受治疗者可以摄取基于受治疗者的总体重的每天约0.01ml/kg到0.1ml/kg;或每天约0.02ml/kg到0.08ml/kg;或每天约0.03ml/kg到0.06ml/kg的量的膳食补充剂组合物。具体地,受治疗者可以摄取每天约0.05mg/kg的量的膳食补充剂组合物。
在另一个实施方案中,膳食补充剂还可以包括聚合物以包封精油部分和载体油部分。正如本文中其他地方所描述的,聚合物可以形成包衣膜以包衣精油部分和载体油部分。在一个实施方案中,膳食补充剂组合物可以呈微囊的形式,使得膳食补充剂组合物可以被存储在相对稳定的条件下并向摄取膳食补充剂组合物的使用者提供更加用户友好的形式。具体地,微囊可以根据与上面关于口服药物组合物所描述的类似的方法制备。
下面提供的实施例进一步阐释了本发明。上面描述的优选实施方案以及下面给出的实施例代表了优选的或示例性的实施方案且本领域技术人员将理解提到的实施方案或实施例并不预期是限制性的。
实施例1
口服药物组合物的制备
制备具有下述成分的口服药物组合物:
2.5ml香柠檬橘精油;
2.5ml德國洋甘菊精油;
1.9ml牛至精油;
1.25ml欧洲刺柏精油;
1.25ml迷迭香精油;
0.6ml薰衣草精油;
200ml大麻油;
300ml芝麻油;以及
490ml甜杏仁油。
上述成分从商业供应商获得。具体地,大麻油衍生自大麻、印度大麻和/或莠草大麻的非转基因植物。测量各成分并通过使用涡旋混合器充分混合以获得均匀的油溶液。
在其他实施例中,衍生自诸如月见草的其他植物材料的额外的载体油也可以被添加到组合物中以构成载体油部分的全部量。
实施例2
组合物中的活性脂肪酸和可溶的脂肪物质
进行脂肪酸测试以证实实施例1中获得的口服药物组合物中的活性脂肪酸组分。由具有标准测试条件和方法的iso认可的实验室进行脂肪酸测试。表1显示了口服药物组合物中的脂肪酸含量,具体地,所述组合物包括1.5%异油酸、42%油酸、34%亚油酸、3.5%α-亚油酸、1.7%γ-亚油酸以及其他脂肪酸组分。
表1a.口服药物组合物中的脂肪酸和脂肪可溶物质
脂肪酸主要衍生自载体油。油酸和亚油酸的高值是有优势的,因为它们帮助降低受治疗者中的低密度脂蛋白胆固醇的水平。组合物中存在这些脂肪酸通过向缺乏某些必需营养物的受治疗者提供足够的营养物进一步维持了受治疗者的健康。
实施例3
柠檬烯、1,8-桉树脑以及香芹酚的测定
口服药物组合物进一步进行色谱分析以测定组合物中的柠檬烯、1,8-桉树脑、香芹酚以及其他组分的浓度。具体地,使用本领域的标准条件进行经过验证的气相色谱(gc)。口服药物组合物和标准溶液被注入gc系统进行测试。gc结果揭示了53种组分。在53种组分中,其中10种具有超过基于口服药物组合物的总量的3vol.-%的量。表1b显示了一部分gc结果分析。
表1b.口服药物组合物中的10种组分的gc结果。
具体地,结果证实存在基于口服药物组合物的总量的9.66%的柠檬烯、9.34%的1,8-桉树脑以及8.05%的香芹酚。
实施例4
对罹患诱导性急性肝损伤的动物模型中的白细胞三烯水平和alt水平的影响
丙氨酸转氨酶(alt)(以前称为血清谷丙转氨酶)通常是所测试的受治疗者的肝脏是否被损伤/功能不全的标示。alt即转氨酶最常见于肝脏。当肝脏受损时,肝脏向血流释放alt。为了证实肝脏是否受损,另外的因子天冬氨酸转氨酶(ast)水平通常被测量以形成与alt的检测值的比。如果ast的检测水平显著低于alt的,则肝脏被认为受损。继而,如果ast:alt的比大于2:1,则可能意味着受治疗者罹患酒精性肝病。
为了测定口服药物组合物对白细胞三烯水平和alt水平的影响,通过使用诱导急性肝损伤的痤疮棒状杆菌-脂多糖(lps)建立动物模型。使用七周龄的雄性(18-22g体重)的昆明小鼠(km小鼠)。口灌治疗第二天时,热杀死的痤疮棒状杆菌被以20mg/kg/小鼠的剂量通过尾部静脉注射。5天后,静脉注射lps(5μg/kg/小鼠)。
lps注射后5小时,小鼠被处死以便分析肝脏损伤。从二乙醚麻醉下的小鼠的心脏采集血液样品。血液样品被收集在含有2%肝素钠的管中。以1000gr/min离心管15min且收集上清液作为测试样品。在进行随后的测定之前,所有测试样品被存储在-20℃下。
小鼠被随机分成5组且每一组有10只小鼠。5个组为对照组、肝损伤模型组以及3个治疗组。3个治疗组进一步如下:
高剂量组,下文以“ah”表示:0.04ml/天/20g剂量的口服药物组合物被口服施用给小鼠;
中等剂量组,下文以“am”表示:0.02ml/天/20g剂量的口服药物组合物被口服施用给小鼠;以及
低剂量组,下文以“al”表示:0.01ml/天/20g剂量的口服药物组合物被口服施用给小鼠。
组中的每一只小鼠的单次口灌施用的总体积是0.5ml。
具体地,被用媒介物(对照组的蒸馏水)或标示剂量的目标组合物每天对小鼠口灌预处理一次,连续进行7天。在建立模型之前,进行这些口服施用一天。最后一次口服施用在lps注射之前30min进行。血液样品从后腔静脉收集,离心并存储用于生化分析。进一步进行生化分析以测定测试样品中的白细胞三烯b4和c4以及alt的水平。
对于生化分析。使用elisa试剂盒并使用标准溶液绘制标准曲线。表2到4显示了从elisa测试获得的结果。首先,鉴于alt水平以及白细胞三烯b4和c4水平的显著增加,肝脏损伤的疾病模型被成功建立。
从表2,与模型组中的结果相比,口服药物组合物呈现出alt水平的剂量依赖的降低。表3和表4揭示了口服药物组合物能够降低白细胞三烯b4和c4水平。因此,口服药物组合物被证明有效地预防急性肝损伤。
表2.不同剂量的口服药物组合物对alt水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表3.不同剂量的口服药物组合物对ltb4水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表4.不同剂量的口服药物组合物对ltc4水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
实施例5
对动物模型中的细胞因子水平的影响
进行另外的动物测试以测定口服药物组合物对细胞因子水平的影响,尤其是另外三种动物模型中的细胞因子水平的影响。测定了丙氨酸转氨酶(alt)、白细胞介素-10(il-10)、干扰素-γ(ifn-γ)、肿瘤坏死因子-α(tnf-α)、总胆固醇(tc)、甘油三酯(tg)以及前列腺素e1(pge1)的水平。
在此实施例中,施用两组口服药物组合物。
从实施例1获得的口服药物组合物,下文用“组合物a”表示,而“ah”、“am”以及“al”用于表示具有不同剂量的所述组合物;
通过加热从实施例1获得的口服药物组合物至100℃持续5分钟并在施用之前冷却至室温来制备煮沸过的组合物,所述煮沸过的组合物在下文用“组合物a100”表示,而“a100h”、“a100m”以及“a100l”用于表示具有不同剂量的所述组合物。
类似于实施例4,高剂量组的小鼠(ah和a100h)被口服施用0.04ml/天/20g剂量的上述组合物。中等剂量组的小鼠(am和a100m)被口服施用0.02ml/天/20g剂量的上述组合物。低剂量组的小鼠(al和a100l)被口服施用0.01ml/天/20g剂量的上述组合物。
显著地,如上所述的高剂量、中等剂量以及低剂量分别基本上等同于成人的0.22ml/天/kg、0.1ml/天/kg、0.055ml/天/kg。
24只小鼠被随机分成8组,即对照组、疾病模型组、组合物a(ah)的高剂量组、组合物a(am)的中等剂量组、组合物a(al)的低剂量组、组合物a100(a100h)的高剂量组、组合物a100(a100m)的中等剂量组以及组合物a100(a100l)的低剂量组。
spss软件用于统计分析以确保组之间不存在统计差异。具体地,spss13.0用于进行统计分析。实验结果以平均值±sd值给出。p<0.05是统计学上的显著性。
实施例5a
对具有由ccl4诱导的肝损伤的动物模型的影响
km小鼠用媒介物(盐水)或标示剂量的目标组合物(如低、中和高)每天口灌预处理一次,连续进行7天。小鼠被禁食16小时且ccl4(花生油中20%,2ml/kg)被口服施用以诱导小鼠的肝损伤。48小时后,小鼠处死。收集血液样品。血液样品的血浆被通过将血液样品置于室温下2小时来收集。在进行随后的生化分析之前,将血浆样品存储在-20℃下。
使用elisa试剂盒且使用标准溶液来绘制标准曲线。表7到13显示了从elisa测试获得的细胞因子水平。结果显示出组合物a可以显著改善ccl4诱导的急性肝损伤中的alt、il-10、ifn-γ、tnf-α以及peg1的水平。具有高剂量和中等剂量的组合物a呈现出降低tg和tc水平的效果。
对于组合物a100,其还显著改善了alt水平。组合物a100还降低了ifn-γ和tnf-α的水平,但是以非显著的方式。然而,其对调节il-10、tg、tc以及pge1的水平没有影响。
因此,结果证明了组合物a可以对肝脏呈现保护效果。因而组合物a可以避免受治疗者罹患急性肝损伤。还推荐本发明的口服药物组合物在施用之前不应该被加热或沸腾。此外,建议不与热食物一起摄取口服药物组合物,以便维持组合物的作用。虽然不期望受理论限制,但是认为组合物a中的组分在热处理过程中改变了,如一些活性组分改变或蒸发了,且因而组合物a100产生了比未处理的组合物a相对中等或更弱的影响。
表7.不同剂量的口服药物组合物对alt水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表8.不同剂量的口服药物组合物对il-10水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表9.不同剂量的口服药物组合物对ifn-γ水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表10.不同剂量的口服药物组合物对tnf-α水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表11.不同剂量的口服药物组合物对tg水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表12.不同剂量的口服药物组合物对tc水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表13.不同剂量的口服药物组合物对pge1水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
实施例5b
对具有由伴刀豆球蛋白a诱导的自身免疫性肝炎的动物模型的影响
km小鼠用媒介物(盐水)或标示剂量的目标组合物(如低、中和高)每天口灌预处理一次,连续进行7天。小鼠被禁食过夜,然后通过尾部静脉经受静脉注射伴刀豆球蛋白a(cona,sigmachimica,milan,italy)溶液。cona溶液通过具有无菌pbs的稀释液来制备以便形成20mg/kg体重的剂量。在施用后的8小时内,模型组被观察到肝炎的组织学迹象。从后腔静脉收集血液样品。在随后的生化分析之前,血液样品的血浆被收集并存储在-20℃下。另外,取肝组织用于he染色和免疫印迹检测。
使用elisa试剂盒且使用标准溶液来绘制标准曲线。表14到20显示了由elisa测试获得的细胞因子水平。结果显示出组合物a可以显著提高cona诱导的肝炎中的alt、il-10、ifn-γ、tnf-α以及peg1水平。组合物对tg和tc水平没有可观察到的影响。对于组合物a100,并未显示出对细胞因子水平的显著改进效果。仅显示出改善tnf-α水平的较小影响。
部分肝组织用中性福尔马林固定,石蜡包埋。脱蜡後用100%,95%,70%酒精梯度地浸泡,並以蒸馏水作短暂冲洗。之後進行苏木精染色以及伊红溶液處理。最後在光学显微镜下观察肝组织病理改变。正常对照组小鼠肝细胞、肝窦未见异常(见图1a)。模型组小鼠肝组织出现许多位于肝小叶或肝窦的凋亡细胞,凋亡的肝细胞体积较正常肝细胞缩小,细胞皱缩,胞浆内出现空泡,胞核和胞浆浓缩,可见许多凋亡小体肝细胞。凋亡小体呈现圆形,大小不一,在he染色下小体胞浆呈现嗜伊红色,中央核染色质深染,胞核浓缩,有些胞核裂解为碎片。而肝细胞坏死程度相对较轻,呈点状,灶状坏死。大多数肝细胞浆肿胀、疏松,有的呈气球样变,枯否细胞增生,肝窦内红细胞堆集,汇管区纤维组织增生(见图1b)。组合物a处理组肝细胞坏死和凋亡细胞减少,炎症细胞浸润减少(见图1c-1e)。
另一部分的肝组织通過均质器處理后,提取蛋白质样品並進行变性以供存储在-20℃。進行10%sds-page凝胶电泳。电泳后蛋白质被转印在pvdf膜(bio-rad)上,脱脂牛奶封闭过夜。随后孵化膜用2%牛血清白蛋白的一抗(cyp5a1、cyp2e1cyp3a),在室温3小时。用tbst洗3次,每次10分钟。2%牛血清白蛋白稀释的二抗在室温孵育1小时。tbst洗涤后,膜上滴加abfrontierwestsave化学发光检测试剂盒。通过x光片(柯达)显影。将光片扫描转换成数字图形分析(imagej,nih)。蛋白质的表达通过评估灰度值表示,用平均光密度±sd量化。免疫印迹结果显示:与正常组相比,con-a诱导的肝损伤模型组中cyp2e1和cyp3a表达量显著增加。与模型组相比,组合物a处理组的cyp5a1和cyp2e1表达量明显下降(图2)。结果表明con-a诱导的肝损伤机制与cyp2e1和cyp3a相关,组合物的肝损伤保护机制与cyp2e1相关,而对cyp5a1的表达无影响,但能增加cyp3a表达。
因此,结果证明组合物a可以呈现出对肝脏的保护效果。因而,组合物a可以保护受治疗者免受罹患肝炎诸如自身免疫性肝炎。还推荐本发明的口服药物组合物在施用之前不应该被加热或沸腾。此外,建议不与热食物一起摄取口服药物组合物,以便维持组合物的治疗效果。虽然不期望受理论限制,但是认为组合物a中的组分在热处理过程中改变了,如一些活性组分改变或蒸发了,且因而组合物a100产生了比未处理的组合物a相对中等或更弱的影响。
表14.不同剂量的口服药物组合物对alt水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表15.不同剂量的口服药物组合物对il-10水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表16.不同剂量的口服药物组合物对ifn-γ水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表17.不同剂量的口服药物组合物对tnf-α水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表18.不同剂量的口服药物组合物对tg水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表19.不同剂量的口服药物组合物对tc水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表20.不同剂量的口服药物组合物对pge1水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
实施例5c
对具有由乙醇诱导的慢性酒精性肝病的动物模型的影响
km小鼠被喂食营养物充足的液体对照膳食持续5天,治疗组被喂食对照膳食加上上述组合物持续10天。在第11天,模型组和治疗组中的小鼠被施用单剂量的20%乙醇(5g/kg基于小鼠的总体重),而对照组中的小鼠被施用等热量的糊精麦芽糖。在清晨进行施用。从后腔静脉收集血液样品。在随后的生化分析之前,血浆被获得并存储在-20℃下。
使用elisa试剂盒且使用标准溶液来绘制标准曲线。表21到27显示了从elisa测试获得的细胞因子水平。结果显示出组合物a可以显著改善ccl4诱导的急性肝损伤中的alt、il-10、ifn-γ、tnf-α以及peg1水平。具有高剂量和中等剂量的组合物a可以呈现出降低tg和tc水平的效果。
结果显示出组合物a100对改善ifn-γ水平有某些效果,而对其他细胞因子没有明显的效果。
因此,结果证明组合物a可以呈现出对肝脏的保护效果。因而,组合物a可以保护受治疗者免受罹患肝炎诸如自身免疫性肝炎。还推荐本发明的口服药物组合物在施用之前不应该被加热或沸腾。此外,建议不与热食物一起摄取口服药物组合物,以便维持组合物的治疗效果。虽然不期望受理论限制,但是认为组合物a中的组分在热处理过程中改变了,如一些活性组分改变或蒸发了,且因而组合物a100产生了比未处理的组合物a相对中等或更弱的影响。
表21.不同剂量的口服药物组合物对alt水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表22.不同剂量的口服药物组合物对il-10水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表23.不同剂量的口服药物组合物对ifn-γ水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表24.不同剂量的口服药物组合物对tnf-α水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表25.不同剂量的口服药物组合物对tg水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表26.不同剂量的口服药物组合物对tc水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
表27.不同剂量的口服药物组合物对pge1水平的影响
##p<0.01vs.对照组;*p<0.05,**p<0.01vs.模型组.
实施例6
对罹患乙型肝炎的患者的影响
10ml/天的剂量,即每天约2匙的如根据实施例1制备的口服药物组合物从2014年05月24日开始口服施用给罹患乙型肝炎的患者。在口服施用之前,发现患者的ast水平和alt水平分别是152u/l和349u/l。γ-谷氨酰转移酶的水平是31u/l。
在每天摄取口服药物组合物持续近1个月后,ast水平和alt水平在28天时分别降低至30u/l和51u/l。γ-谷氨酰转移酶的水平是18u/l。在64天时,ast水平和alt水平分别降低至23u/l和30u/l。γ-谷氨酰转移酶的水平是15u/l。因此,在口服施用组合物之后,ast水平和alt水平在2个月内恢复至正常水平。
ast水平和alt水平在正常条件即健康状态时的最大值分别大致是约36u/l和45u/l。因此,本发明的口服药物组合物被证明有效地治疗肝脏疾病,尤其是肝炎。
实施例7
对罹患动脉栓塞的患者的影响
基于2015年2月发布的x线断层摄影术报告,发现罹患动脉栓塞的患者在任何口服施用之前具有下述病症:
小的中间动脉;
中间左前降支(lad)动脉中的中度到重度(约70%)的非钙化斑块;以及
远侧lad动脉中的中度(25-50%)非钙化斑块。
在10ml/天,即每天约2匙的剂量摄取如根据实施例1制备的口服药物组合物持续近5个月后,患者在2015年06月又进行了一次计算机断层扫描。结果显示出中间动脉的尺寸恢复到正常条件且仅在中间的lad动脉存在软斑块。总的钙分数是0。
因此,证明了本发明的口服药物组合物能够治疗罹患心血管疾病如动脉栓塞的患者。本领域技术人员将会理解应用本发明的口服药物组合物用于治疗和/或预防各种疾病,诸如与肝脏疾患和心血管疾患相关的那些疾病。
可以理解的是,本文已经描述了大量可选择的实施方案。本领域技术人员将会理解,所描述的可选择的实施方案可以部分或整个与所描述的任一个实施方案一起使用。还将理解,现有技术中已知的或本领域技术人员已知的部分或要素并未明确描述。本领域技术人员还将理解可以对在具体实施方案中显示的本发明做出许多改变和/或变动而并不背离宽泛描述的本发明的精神或范围。因此,本实施方案将会被认为在所有方面是示例性的而不是限制性的。
- 还没有人留言评论。精彩留言会获得点赞!