石菖蒲提取物在制备激活HSP70药物中的应用的制作方法
本发明属于生物医药领域,具体涉及一种中药提取物在制备hsp70启动子激活剂中的应用以及在制备激活hsp70药物中的应用。
背景技术:
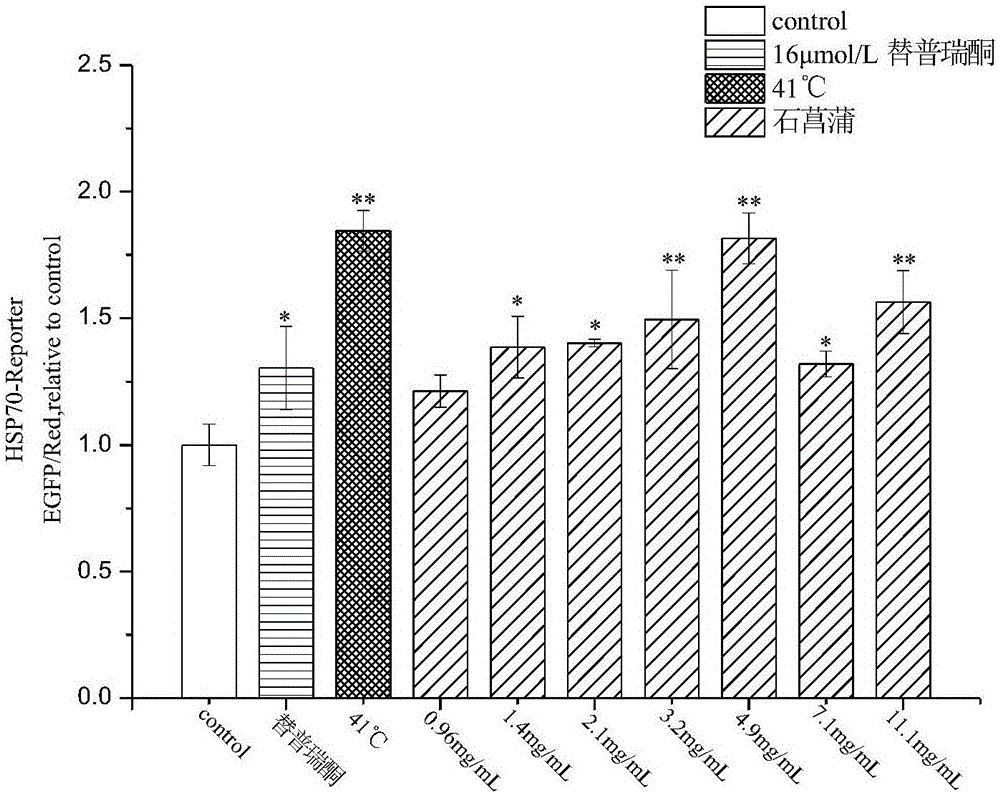
:热休克蛋白(hsp)是广泛存在于原核细胞和真核细胞中,在进化上非常保守的一类热应激蛋白,按照分子量的大小分为hsp90(83-90kd)、hsp70(66-78kd)、hsp60和小hsp等4个家族,其中hsp70为热休克蛋白家族中最保守和最重要的一族,同时是最受关注、研究最为深入的一种(kiangandtsokos,1998)。人hsp70家族至少包含八个基因表达产物蛋白,分别为hsp70-1a、hsp70-1b、hsp70-1t、hsp70-2、hsp70-5、hsp70-6、hsc70、hsp70-9,它们都是hsp70基因不同位置表达的产物,结构上具有高度保守的氨基酸序列和结构域,结构域包括atp结合域、蛋白酶敏感域、多肽结合域、可变域、富含g/p的c端域(daμgaardetal.,2007)。其中hsp70-1a、hsp70-1b是两种应激可诱导蛋白,其对应的启动子为诱导型启动子,分别为hspa1a和hspa1b。在各种应激环境下(包括高温、氧化应激、损伤等),这两种启动子被迅速激活,使hsp70-1a和hsp70-1b高水平表达,与蛋白质的疏水残基结合,稳定蛋白质的结构,防止蛋白质的错误折叠和聚集,进而保护细胞。在不同组织和细胞中,hspa1a和hspa1b基因的表达量有所不同,一般情况下,hspa1a的表达要高于hspa1b。hspa1a的启动子区位于转录起始位点-1000bp到100bp处,其中包括两个tata-box、三个ccaat-box、四个gc-box,还包括多个ngaan区,称为热休克元件(heatresponseelement,hse)。hse是热应激应答中必不可少的功能区,它的存在使启动子高水平活化转录,从而使热休克蛋白具有可诱导性。在hspa1a启动子中含有184个转录因子结合位点,其中最重要的有hsf1、nf-kappab1、stat3等。在高温、氧化应激、细胞内环境ph发生变化以及细胞受到损伤时,hsf1与hse结合从而激活hspa1a启动子,诱导产生大量的hsp70,从而保护细胞免受损伤。因此可以将hspa1a启动子作为研究对象,根据hspa1a启动子被诱导的情况,筛选出能明显激活hspa1a启动子进而产生大量的hsp70的激活剂,以用于和hsp70相关的疾病治疗中。hsp70具有多种生物学功能,主要包括以下几个方面:(1)分子伴侣功能:hsp70与新生、未折叠、错误折叠或聚集的蛋白质结合,使某些蛋白质解离,帮助需要折叠的蛋白质正确折叠。许多神经退行性疾病都与蛋白质错误折叠和聚集密切相关,例如阿尔兹海默、帕金森症、肌萎缩侧索硬化症。目前认为错误折叠的α-synuclein的聚集和细胞毒性在帕金森氏病和带有lewy小体的痴呆的发病过程中起到十分关键的作用,hsp70可以在体内和体外减少错误折叠和聚集的α-synuclein的种类,并使机体免受α-synuclein的毒害作用。此外过表达的hsp70能够抑制aβ早期的聚集,促进aβ在小胶质细胞中的降解,使错误折叠的蛋白质重新折叠从而减少低聚物,过表达的hsp70还能够降低过度磷酸化的难溶的tau蛋白,减少tau蛋白的积累。(2)抗细胞凋亡作用:hsp70的过量表达能够抑制有害应激所导致的jnk、p38等应激激酶的激活,从而防止细胞凋亡,例如一种hsp70合成诱导剂肝细胞生长因子hgf能够通过诱导hsp70的合成,来抑制肿瘤坏死因子tnf-α所致的肝细胞凋亡。(3)免疫作用:过量表达的hsp70能够提高细胞内的总谷胱甘肽的含量,防止细胞受tnf等细胞因子的攻击,能够通过抑制il-1及干扰素对no合成酶的诱导作用,从而保护胰腺的生理功能。(4)细胞保护作用:当机体细胞受到各种应激刺激时,如高热、氧化、机械损伤等,细胞会产生异常蛋白,同时产生的hsp70能够加速异常蛋白的降解,或者使蛋白质肽链重新折叠,恢复蛋白质原来的构象,增强细胞内稳态,从而起到细胞保护的作用,此外,hsp70被认为是损伤后脑组织产生的一种重要的内源性保护因子。hsp70的生物学功能十分广泛,在疾病中的作用和意义非常重大,成为解决众多疾病的关键点,所以寻找hsp70激活剂将成为亟待解决的问题。目前已经发现了一些hsp70的激活剂,如有用于治疗胃溃疡的替普瑞酮、用于神经退行性疾病中的蛋白酶抑制剂,用于组织转移的氯化亚锡等等,但这些激活剂的毒性较大,副作用多,而中药的毒副作用相对较小,靶点多,所以从中药库中筛选出显著激活hsp70的激活剂将对治疗或预防与hsp70有关的疾病大有裨益。参考文献daμgaard,m.,rohde,m.,andjaattela,m.(2007).theheatshockprotein70family:highlyhomologousproteinswithoverlappinganddistinctfunctions.febsletters581,3702-3710.kiang,j.g.,andtsokos,g.c.(1998).heatshockprotein70kda:molecμlarbiology,biochemistry,andphysiology.pharmacolther80,183-201.技术实现要素:本发明的目的在于提供一种石菖蒲提取物在制备hsp70启动子激活剂中的应用。本发明中所用的石菖蒲为天南星科、菖蒲属禾草状多年生草本植物的根,拉丁学名为acorustatarinowii,根肉质,有芳香味,具多数须根,具有化湿开胃,开窍豁痰,醒神益智等功效,研究显示石菖蒲具有镇静、镇咳、抗真菌作用、改善消化机能等多方面的药理作用。其中,所述的石菖蒲提取物为石菖蒲水煎液。进一步地,所述的石菖蒲水煎液是通过下述方法制备的:称取石菖蒲药材,加蒸馏水浸泡30分钟,煮沸后煎煮30分钟;纱布过滤取滤液,滤渣加蒸馏水后浸泡30分钟,煮沸后煎煮30分钟;纱布过滤后合并两次滤液,浓缩;待自然冷却后1000rpm离心10分钟,用滤纸过滤除杂,定容,制得石菖蒲水煎液。其中,所述的石菖蒲水煎液的生药浓度为1.4mg/ml-12.5mg/ml。其中,所述的与hsp70启动子有关的疾病为神经退行性疾病,心血管疾病。进一步地,所述的神经退行性疾病为阿尔兹海默、帕金森症、肌萎缩侧索硬化症。本发明的目的还在于提供一种石菖蒲提取物在制备预防或治疗与hsp70启动子有关的神经退行性疾病药物中的应用。其中,所述的石菖蒲提取物能够通过激活hsp70启动子激活hsp70。其中,所述的神经退行性疾病为阿尔兹海默、帕金森症、肌萎缩侧索硬化症。进一步地,所述的石菖蒲水煎液是通过下述方法制备的:称取石菖蒲药材,加蒸馏水浸泡30分钟,煮沸后煎煮30分钟;纱布过滤取滤液,滤渣加蒸馏水后浸泡30分钟,煮沸后煎煮30分钟;纱布过滤后合并两次滤液,浓缩;待自然冷却后1000rpm离心10分钟,用滤纸过滤除杂,定容,制得石菖蒲水煎液。其中,所述的石菖蒲水煎液的生药浓度为125μg/ml-500μg/ml。在本发明中,通过构建hsp70启动子激活剂高通量筛选细胞模型,对石菖蒲水煎液进行检测后发现,石菖蒲水煎液能明显激活hsp70启动子,并通过构建ad细胞模型,对能激活hsp70启动子的石菖蒲水煎液进行抗ad效果验证,发现石菖蒲水煎液在ad细胞模型中能够减轻由aβ25-35引起的细胞损伤程度。附图说明图1为阳性药物hsp70启动子激活剂替普瑞酮对hsp70启动子的激活情况图2为石菖蒲水煎液对hsp70启动子激活的半定量结果图3为石菖蒲水煎液hsp70启动子激活的定量结果图4为石菖蒲水煎液对pc12细胞生长抑制作用结果图5为aβ25-35对pc12细胞生长抑制作用结果图6为mtt检测石菖蒲水煎液对aβ25-35引起pc12细胞损伤模型的作用结果图7为ldh法检测石菖蒲水煎液对aβ25-35引起pc12细胞损伤模型的作用结果具体实施方式以下提供具体实施例以实现本发明所述的石菖蒲提取物在制备激活hsp70启动子药物中的应用,但不限于这些实施例。主要实验仪器pcr仪(美国abiveriti);imagequant300型凝胶成像仪(ge);hzq-f16oa型恒温振荡培养箱(上海一恒);hdb-plus型恒温金属浴(thermofisher);dyy-8b型电泳仪(伯乐);超纯水仪(millipore);制冰机、离心机(hitachi);倒置荧光显微镜(olympus1x71);多功能酶标仪(varioskanflash)。主要实验材料限制性内切酶hindⅲ-hf(neb公司产品);血液dna提取试剂盒;无内毒素质粒大提试剂盒购于天根生化科技有限公司;primestargxldnapolymerase;sanprep柱式质粒dna小量抽提试剂盒;dna胶回收试剂盒;pcr产物纯化试剂盒;rtaq酶;卡那霉素;氨苄青霉素;pmdtm19-tvectorcloningkit均购于上海生工生物工程股份有限公司;质粒pegfp-1购于优宝生物;pgl3-enhancer由上海交通大学生命科学学院金卫林教授惠赠;lipofectamine2000购于invitrogen;胎牛血清购于四季青;dmem/highglucose;penicillin-streptomycinsolution购于hyclone;luciferaseassaysystem购于promega。大肠杆菌感受态细胞e.colidh5α和大肠杆菌top10购买自天根生化科技(北京)有限公司。hek293t购自于中国科学院细胞库。实施例1基于hspa1apromter筛选细胞模型的建立1.hspa1apromoter基因的克隆(1)设计合成hspa1apromoterpcr引物p1:cccaagcttcggatcagccaacgcccacatacctcp2:cgcggatcccggttccctgctctctgtcggctcc(2)pcr扩增采集人血液,按照血液基因组dna提取试剂盒说明书提取dna,以人dna为模板,以p1和p2分别作为上下游引物进行pcr扩增。pcr体系(25μl)如下:表1pcr反应体系pcr反应条件:98℃:10s;60℃:15s;68℃:1min;循环40次。将pcr产物进行1%琼脂糖凝胶电泳,结果显示扩增出约1000bp大小的hspa1apromoterdna条带。(3)hspa1apromote的ta克隆pcr产物经胶回收后对其进行加“a”处理,反应体系如下:纯化的pcr产物hspa1apromoter10μl,dntps2μl,10xpcrbuffer1μl,rtaq酶0.2μl。在pcr仪器上72℃反应30min。用pcr产物纯化试剂盒纯化加“a”尾的hspa1apromoter基因片段。按照pmdtm19-tvectorcloningkit的说明书进行ta克隆,从而构建含有hspa1apromoter基因的重组质粒pmd19-t-hspa1apromoter载体,连接产物热激转化入感受态e.colidh5α,涂于含有100μg/ml氨苄青霉素(amp)的lb平板上,37℃培养12小时,挑取单个菌落培养进行菌液pcr检测,并提取质粒后进行质粒dna限制性酶切分析和dna测序确定插入的目的基因序列的准确性。2.phspa1a-egfp重组载体的构建本实验以pmd19-t-hspa1apromoter载体为模板进行扩增hspa1apromoter基因片段,引物设计如下:p3:tctcgagctcaagcttcggatcagccaacgcccacataccp4:gcagaattcgaagcttcggttccctgctctctgtcggctccpcr反应体系(25μl)如下:表2pcr反应体系ddh2o15μl5xprimestargxlbuffer5μldntpmixture(2.5mm)2μlp3(10μm)0.75μlp4(10μm)0.75μlpmd19-t-hspa1apromoter1μlprimestargxldnapolymerase0.5μlpcr反应条件:98℃:10s;60℃:15s;68℃:1min;循环40次。将pcr产物进行1%琼脂糖凝胶电泳,结果显示扩增出约1000bp大小的hspa1apromoterdna条带。通过琼脂糖凝胶电泳以及胶回收试剂盒回收hspa1apromoterdna片段,用hindⅲ-hf酶切质粒pegfp-1质粒,酶切反应体系如下:pegfp-110μl,cutsmart5μl,hindⅲ-hf1μl,ddh2o34μl,总体积为50μl,37℃金属浴反应30分钟后,用胶回收试剂盒回收线性化的pegfp-1片段。本次实验采用无缝克隆技术进行连接,按照takara公司的hdcloningkit操作手册进行,具体如下:in-fusion反应液的配置:纯化的hspa1apromoterdna片段73ng,线性化的pegfp-1载体100ng,5xin-fusionhdenzymepremix2μl,总体积为10μl,将混合液置于50℃金属浴上反应30分钟,反应结束后瞬时离心,将离心管置于冰上冷却5分钟,进行后续的转化反应,转化反应如下:取3μl反应混合液,加入50μltop10感受态细胞,轻轻混匀后置于冰山30分钟;42℃热激45秒,冰上放置2分钟;加150μl无抗生素的空lb培养基,37℃150rpm复苏1小时;将复苏后的细胞全部均匀涂布于含卡那霉素的lb平板上,37℃孵育20小时。挑取单个菌落到900μl含卡那霉素的lb培养液中,置于37℃摇床上200rpm培养6.5小时后,进行菌液pcr检测,并提取质粒后进行质粒dna限制性酶切分析和dna测序确定插入的目的基因序列的准确性。3.pgl3-e-hspa1apromoter重组载体的构建本实验以pmd19-t-hspa1apromoter为模板,进行扩增hspa1apromoter基因片段,引物设计如下:p5:cgatctaagtaagcttcggatcagccaacgcccacatacp6:ccggaatgccaagcttcggttccctgctctctgtcpcr反应体系(25μl)如下:表3pcr反应体系ddh2o15μl5xprimestargxlbuffer5μldntpmixture(2.5mm)2μlp5(10μm)0.75μlp6(10μm)0.75μlpmd19-t-hspa1apromoter质粒1μlprimestargxldnapolymerase0.5μlpcr反应条件:98℃10s;60℃15s;68℃1min;循环40次。将pcr产物进行1%琼脂糖凝胶电泳,结果显示扩增出约1000bp大小的hspa1apromoterdna条带。通过琼脂糖凝胶电泳以及胶回收试剂盒回收hspa1apromoterdna片段,用hindⅲ-hf酶切质粒pgl3-enhancer,酶切反应体系如下:pgl3-enhancer10μl,cutsmart5μl,hindⅲ-hf1μl,ddh2o34μl,总体积为50μl,37℃金属浴反应30分钟后,用胶回收试剂盒回收线性化的pgl3-enhancer片段。采用无缝克隆技术进行连接,实验方法同步骤2所述。4.基于hspa1apromter筛选细胞模型的建立将293t细胞复苏后,传代4次,观察细胞状态良好,备用。(1)phspa1a-egfp重组载体的瞬时转染a.细胞铺板:转染24小时,使用0.25%胰酶消化细胞并计数,将细胞以1×106个细胞/ml的密度接种于6cm培养皿中,总体积为4ml。转染时要求细胞汇合度为70-80%;b.转染前吸掉细胞培养液上清,使用无血清的dmem培养基清洗一遍后,加入3mlopti-mem减血清培养基;c.将4μg的phspa1a-egfp质粒和4μg的pdsred-express-n1质粒加至500μl的opti-mem减血清培养基中,轻轻摇晃均匀;d.将16μl的lipofectamine2000加至另外500μl的opti-mem减血清培养基中,轻轻摇晃均匀,室温静置5分钟;e.将dna悬液和lipofectamine2000悬液混合,总体积为1ml,轻轻混匀,室温静置20分钟;f.将dna和lipofectamine2000混合液加至6cm皿中,前后左右摇晃均匀,置于细胞培养箱中培养;h.转染6小时后,先用pbs清洗2次后,加300μl0.25%胰酶消化细胞1分钟,转移至无菌蓝盖瓶中,再加24ml10%fbs培养液,进行96孔板铺板,每孔200μl;培养12小时后,进行药物处理,继续培养24小时后,用倒置荧光显微镜观察并拍照绿色荧光和红色荧光。利用imagej分别求一组中绿色荧光蛋白和红色荧光蛋白的平均荧光强度,用绿色荧光蛋白的平均荧光强度比红色荧光蛋白的平均荧光强度,再与对照组相比求得相对荧光强度。即相对荧光强度=(药物处理组中绿色荧光蛋白的平均荧光强度/药物处理组中相对应的红色荧光蛋白的平均荧光强度)/(对照组中绿色荧光蛋白的平均荧光强度/对照组中相对应的红色荧光蛋白的平均荧光强度)(2)pgl3-e-hspa1apromoter重组载体的瞬时转染转染的方法同步骤(1)中的phspa1a-egfp重组载体的瞬时转染。待转染的为pgl3-e-hspa1apromoter和prl-tk,质量比为23:1,dna总质量为8μg。加药处理后,继续培养24小时,用luciferaseassaysystem检测荧光素酶的活性。具体方法如下:从细胞培养箱中取出96孔板,平衡至室温,吸去上清;每孔加入80μlpassitive(1x)lysis裂解细胞1分钟;吹打细胞使之充分裂解,每孔取40μl转移至corningcostar全白96孔板中;每孔加入40μldual-gloluciferasereagent,摇晃2分钟,室温孵育10分钟,用多功能酶标仪检测萤火虫荧光素酶的活性;每孔再加入40μldual-glostop&gloreagent,室温孵育10分钟,其中摇晃2分钟,多功能酶标仪检测海肾荧光素酶的活性。实施例2基于hspa1apromter筛选细胞模型的验证1.热激对hspa1apromter的作用转染6小时后,进行96孔板铺板,培养12小时后,进行热激处理,具体操作如下:取3孔细胞作为热激处理组,同时设置空白对照孔。吸掉上清后,用pbs清洗细胞一次,加20μl的胰酶消化1分钟,再加200μl完全培养液,转移至1.5mlep管中,放在金属浴上41℃热激处理1小时后,再转移到96孔板中,放到细胞培养箱中继续培养24小时后,用倒置荧光显微镜观察并拍照绿色荧光和红色荧光,或者用luciferaseassaysystem检测荧光素酶的活性。结果:如图1所示,41℃能够明显激活hsp70启动子,说明hsp70启动子细胞筛选模型构建成功。(*表示和cotrol相比p<0.05,**表示和cotrol相比p<0.01)2.替普瑞酮对hspa1apromter的作用替普瑞酮为文献报道的hspa1apromter激活剂,所以用替普瑞酮作为阳性对照。替普瑞酮的配制:精密称取0.3305g替普瑞酮,溶于5ml5%阿拉伯胶溶液中,制得200mmol/l的替普瑞酮储备液,使用时稀释至所需浓度。加药处理:转染6小时后,进行96孔板铺板,培养12小时后,分别添加不同浓度的替普瑞酮,继续培养24小时后,用倒置荧光显微镜观察并拍照绿色荧光和红色荧光,或者用luciferaseassaysystem检测荧光素酶的活性。替普瑞酮作为hsp70激活剂的阳性药物,在3.90μmol/l-125.0μmol/l浓度范围内能激活hsp70启动子,进一步说明已成功构建hsp70启动子激活剂筛选细胞模型,结果如图1所示(*表示和cotrol相比p<0.05,**表示和cotrol相比p<0.01)。实施例3石菖蒲水煎液对hspa1apromter的作用1.石菖蒲水煎液的制备称取25g石菖蒲药材,加入200ml蒸馏水浸泡30分钟;武火煮沸后文火煎煮30分钟;用纱布过滤取滤液,滤渣添加150ml蒸馏水后浸泡30分钟;武火煮沸后再文火煎煮30分钟;纱布过滤后合并两次滤液,文火浓缩至25ml左右;待自然冷却后1000rpm离心10分钟,用滤纸过滤除杂,用25ml容量瓶定容,从而制备1g/ml的石菖蒲水煎液储备液,使用时稀释至所需浓度。2.mtt法确定石菖蒲水煎液的有效药物作用浓度范围加药处理前一天进行96孔板铺板,每孔1×104个细胞,培养24小时后,添加不同浓度的石菖蒲水煎液,每组三孔,处理24小时后,加入5mg/ml的mtt,使其终浓度为0.5mg/ml,放到细胞培养箱中培养4小时后,吸掉上清,每孔加入150μldmso,置于摇床上低速震荡10分钟,用酶标仪检测490nm处的吸光值。计算得到石菖蒲水煎液的有效药物作用浓度范围为:小于12.5mg/ml。3.石菖蒲水煎液对hspa1apromter的作用转染6小时后,进行96孔板铺板,培养12小时后,用dmem稀释石菖蒲水煎液后,分别添加不同浓度的石菖蒲水煎液,空白对照为dmem培养液,继续培养24小时,倒置荧光显微镜观察并拍照绿色荧光和红色荧光,或者用luciferaseassaysystem检测荧光素酶的活性。定性和定量筛选的结果显示,在1.4mg/ml-11.1mg/ml浓度范围内,石菖蒲水煎液能够激活hsp70启动子,如图2和图3所示(*表示和cotrol相比p<0.05,**表示和cotrol相比p<0.01)。实施例4石菖蒲水煎液对aβ25-35引起pc12细胞损伤模型的作用1.石菖蒲水煎液对pc12细胞生长抑制作用本实验采用mtt法检测石菖蒲水煎液对pc12细胞的生长抑制作用,方法同实施例3中的步骤2。实验结果显示石菖蒲水煎液在小于1.0mg/ml时对pc12细胞没有毒性,故选择小于等于1.0mg/ml的浓度范围来检测石菖蒲水煎液对aβ25-35引起的pc12细胞损伤模型的作用,如图4所示(*表示和cotrol相比p<0.05,**表示和cotrol相比p<0.01)。2.aβ25-35对pc12细胞生长抑制作用精密称取aβ25-35粉末溶于过滤灭菌去离子双蒸水,配成1mmol/l的储备液,0.22μm滤膜过滤除菌后,于37℃环境中孵育7天,使其形成聚集态aβ25-35,然后用dmem培养液稀释成不同浓度梯度(10μmol/l、15μmol/l、20μmol/l、25μmol/l、30μmol/l)后进行加药处理细胞,用mtt的方法检测不同浓度梯度的aβ25-35对pc12细胞生长抑制作用,以确定aβ25-35对pc12细胞损伤的最佳浓度,具体方法同实施例3中的步骤2。实验结果显示,aβ25-35对pc12细胞的毒性作用呈现梯度依赖关系,在30μmol/l时细胞生存率为54.3%,选择此浓度作为随后实验中的模型组aβ25-35的浓度,如图5所示(*表示和cotrol相比p<0.05,**表示和cotrol相比p<0.01)。3.mtt检测石菖蒲水煎液对aβ25-35引起pc12细胞损伤模型的作用加药处理前一天进行96孔板铺板,每孔1×104个细胞,培养24小时后,对照组加入空培养基,模型组中加入30μmol/laβ25-35,实验组加入30μmol/laβ25-35和不同浓度(125μg/ml、250μg/ml、500μg/ml)的石菖蒲水煎液,每组三孔,处理24小时后用mtt的方法检测,方法同实施例3中的步骤2。实验结果显示,与空白对照相比,石菖蒲水煎液能够明显抑制由aβ25-35引起的pc12细胞死亡,并出现浓度梯度依赖关系,说明石菖蒲水煎能通过激活hsp70启动子,产生hsp70热休克蛋白,以此减轻由aβ25-35导致的细胞毒害作用,如图6所示(*表示和0μg/ml组相比p<0.05,**表示和和0μg/ml组相比p<0.01)。4.ldh(lactatedehydrogenase,乳酸脱氢酶)法检测石菖蒲水煎液对aβ25-35引起pc12细胞损伤模型的作用加药处理前一天进行96孔板铺板,每孔1×104个细胞,每孔200μl,培养24小时,使细胞密度不超过80%-90%,将各培养孔分成如下几组:无细胞的培养孔(背景空白对照孔),未经药物处理的对照细胞孔(样品对照孔),未经药物处理的用于后续裂解的细胞孔(细胞最大酶活性对照孔),以及药物处理的细胞孔(药物处理样品孔),其中包括模型组(加入30μmol/laβ25-35)和实验组(加入30μmol/laβ25-35和不同浓度的石菖蒲水煎液),每组三孔,处理24小时,到预定的检测时间点前1小时,从细胞培养箱中取出细胞培养板,在“样品最大酶活性对照孔”中加入20μlldh释放剂,反复吹打数次混匀,然后在细胞培养箱中孵育。到达预定时间后,将细胞培养板用多孔板离心机400g离心5min。分别取各孔中的上清液120μl,加入到新的96孔板相应孔中,随即进行样品检测。样品检测如下:各孔中分别加入60μlldh检测工作液;混匀,室温(约25℃)避光孵育30min,然后在490nm处测定吸光度,以600nm波长作为参考波长进行双波长测定。细胞死亡率%=(处理样品吸光度-样品对照孔)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100。实验结果显示,aβ25-35引起细胞释放的ldh升高,导致细胞死亡增高,而加入石菖蒲水煎后,细胞内释放的ldh明显降低,细胞死亡率降低,说明石菖蒲水煎液能抑制由aβ25-35引起的细胞死亡,进一步证明石菖蒲水煎液能通过激活hsp70启动子,生成hsp70热休克蛋白,以此减轻aβ25-35所导致的细胞毒害作用,如图7所示(*表示和0μg/ml组相比p<0.05,**表示和和0μg/ml组相比p<0.01)。综上所述,石菖蒲水煎液能够通过激活hsp70启动子,生成hsp70热休克蛋白,减少aβ引起的pc12细胞死亡,降低aβ引起的pc12细胞内乳酸脱氢酶的释放,从而说明石菖蒲水煎液能够抑制aβ导致的神经毒性,具有一定的抗ad的潜力。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1