肿瘤靶向的新型钌多吡啶配合物载siRNA的制备与评价的制作方法
本发明涉及4’-甲基-(2,2’-联吡啶)-4-酰基-rgds二氯化钌(ru-co-rgds)的制备及ru-co-rgds/vegf-sirna基因递送系统的构建,并且对其进行了体内外抗肿瘤活性和基因沉默效率的评价。本专利主要是通过rgds修饰,增强钌吡啶配合物ru-cooh的靶向性,使在靶部位的浓度增加,从而减小副作用,提高了治疗指数。
背景技术:
基因治疗以改变人的遗传物质为基础,将外源正常基因导入靶细胞,以纠正基因缺陷或沉默相关基因表达,从而起到抗肿瘤的目的。血管内皮生长因子(vascularendothelialgrowthfactor,vegf)能促进血管内皮细胞增殖、迁移和肿瘤的新血管生成淋巴管的形成,增加血管通透,促进肿瘤生长、转移。在基因治疗领域中,具有的基因沉默靶向性的rna干扰(rnainterfence,rnai)治疗重大疾病方面显示出非常大的应用潜力。
rna干扰是指通过双链rna(dsrna)在逆转录后引起该序列的同源mrna产生特异性降解,从而达到基因沉默的作用。rnai具有高特异性、高效性、高稳定性。vegf存在于卵巢癌、宫颈癌等实体瘤,血液系统肿瘤等大多数重要的人类肿瘤中,且vegf受体过高表达。因此,在根本上从基因水平抑制vegf表达,实现抗新生血管的生成,从而达到抑制肿瘤的生长和迁移的目的。vegf-sirna转染被认为是一种潜在的抗肿瘤策略。
钌多吡啶金属配合物应用广泛。与核酸通过嵌入,沟槽结合和静电模式等模式结合,可作为核酸结构探针、核酸分子光开关、化学核酸酶、基因载体,因低毒性、易吸收及代谢快等并被认为成为新的最有前景的抗癌药物之一。钌多吡啶配合物作为非病毒类载体与阳离子聚合物等相比,具有更好的水溶性、更丰富的结构多样性和更合理的正电荷密度,而且更易制备,因此其作为基因领域中安全的高效的非病毒型基因载体。
精氨酸-甘氨酸-天冬氨酸(arg-gly-asp-x,rgdx)rgd肽可作为整合素和其配体相互作用的识别位点,介导细胞与细胞外基质蛋白及细胞间的粘附作用,同时具有信号传导功能。rgds与整合素的特异结合,可以将治疗效应分子靶向性地导入肿瘤部位,有效地减少了对正常细胞的损害。此外,含rgdx的多肽或化合物被应用于新型材料的修饰与合成。其中,精氨酸-甘氨酸-天冬氨酸-丝氨酸(arg-gly-asp-ser,rgds)中的丝氨酸的修饰,增加了化合物的亲水性,所以在抗肿瘤药物的修饰中rgds靶向肽具有广泛应用。
技术实现要素:
本发明的目的在于提供一种具有抗肿瘤活性的基因递送系统,由抗肿瘤基因治疗药物vegf-sirna和基因载体ru-co-rgds制备而成。
本发明所述的基因递送系统,其特征在于,ru-co-rgds和vegf-sirna的重量比为1.66:1。
本发明所述的基因递送系统,为纳米结构。
本发明的另一个目的在于提供基因递送系统的制备方法,包括以下步骤:基因载体ru-co-rgds与抗肿瘤基因治疗药物vegf-sirna在常温下以质量比为1.66:1混合,即得ru-co-rgds/vegf-sirna。
其中,ru-co-rgds的制备方法如下:4’-甲基-(2,2’-联吡啶)-4-甲酸与hcl·arg(tos)-gly-asp(obzl)-ser-obzl液相接肽法,用三氟乙酸/三氟甲磺酸脱去保护基,形成4’-甲基-(2,2’-联吡啶)-4-酰基-rgds,最后与钌吡啶配合物回流反应即得ru-co-rgds。
其中,ru-co-rgds的制备方法如下:通过液相接肽法,将4’-甲基-(2,2’-联吡啶)-4-甲酸与hcl·arg(tos)-gly-asp(obzl)-ser-obzl在thf/dmf中通过ddc/hobt反应,得到4’-甲基-(2,2’-联吡啶)-4-酰基-r(tos)-g-d(obzl)-s-obzl;然后用三氟乙酸/三氟甲磺酸脱去保护基,形成4’-甲基-(2,2’-联吡啶)-4-酰基-rgds;将顺-2,2'联吡啶二氯化钌与4’-甲基-(2,2’-联吡啶)-4-酰基-rgds在n2环境下避光回流反应,回流反应结束后,旋干溶液,加入纯净水溶解后,加入饱和六氟磷酸盐溶液,出现红橙色沉淀,离心,取上清液,旋干,甲醇乙醚体系重结晶,得到ru-co-rgds。
本发明所述的基因递送系统ru-co-rgds/vegf-sirna的制备方法如下:将vegf-sirna与小牛胸腺dna按照2:1(v:v)的比例混合,反复吹打,室温下静置10min,同时将ru-co-rgds与鱼精蛋白混合,反复吹打,室温下静置10min,然后将ru-co-rgds/鱼精蛋白复合物加入到vegf-sirna/dna复合物中,反复快速吹打,室温静置30min,即得ru-co-rgds/vegf-sirna。
优选的,本发明所述的基因递送系统的制备方法,包括以下步骤:hcl·ar
g(tos)-gly-asp(obzl)-ser-obzl的合成:
取400mgboc-arg(tos)-gly-asp(obzl)-ser-obzl中加入适量无水hcl-乙酸乙酯溶液溶解,室温搅拌4h,可见大量白色固体析出,用tlc板监测反应。反应结束后,室温下减压浓缩,残留物用乙酸乙酯溶解,反复数次,并用少量乙醚减抽滤,以除去氯化氢,即得hcl·arg(tos)-gly-asp(obzl)-ser-obzl,
4’-甲基-(2,2’-联吡啶)-4-酰基-arg(tos)-gly-asp(obzl)-ser-obzl的合成:
将4’-甲基-(2,2’-联吡啶)-4-甲酸87mg溶解于无水thf中,无水dmf助溶,冰浴条件下加入hobt55mg和dcc100mg完全溶解,活化30min,加入制备好的hcl·arg(tos)-gly-asp(obzl)-ser-obzl312mg,并用dmm调节ph=8.0-9.0,室温下搅拌反应14h,用tlc板监测反应,得到粉红色固体粉末,
4’-甲基-(2,2’-联吡啶)-4-酰基-rgds的合成:
将86mg4’-甲基-(2,2’-联吡啶)-4-酰基-arg(tos)-gly-asp(obzl)-ser-obzl冰浴条件下加入1.35ml三氟乙酸,0.45ml三氟甲磺酸(v:v=3:1),反应30min,所得化合物为用乙醇反复磨洗,得到标题产物,
ru-co-rgds的合成
取顺-2,2'联吡啶二氯化钌35mg和4’-甲基-(2,2’-联吡啶)-4-酰基-rgds79mg于50ml两口烧瓶中,加入50%乙醇10ml,避光,充入n2的条件下回流反应10h。回流反应结束后,旋干溶液。加入5ml纯净水溶解,加入饱和六氟磷酸盐溶液,出现红橙色沉淀。1000rpm,离心3min。经过鉴定,上清液中产物含量多。取上清液,旋干。甲醇乙醚体系重结晶,最后得到终产物150mg,
ru-co-rgds/vegf-sirna的制备
将vegf-sirna与小牛胸腺dna按照2:1(v:v)的比例混合,反复吹打,室温下静置10min。同时将ru-co-rgds与鱼精蛋白混合,反复吹打,室温下静置10min。后将ru-co-rgds/鱼精蛋白复合物加入到sirna/dna复合物中,反复快速吹打,室温静置30min,即得ru-co-rgds/vegf-sirna。
本发明所述的基因递送系统在制备抑制肿瘤中的应用。
本发明涉及以宫颈癌hela细胞株为模型,用mtt法评价基因载体ru-co-rgds对vegf-sirna的细胞毒性和ru-co-rgds/vegf-sirna的体外抗肿瘤活性,结果显示ru-co-rgds对hela细胞表现出低毒性,并且ru-co-rgds/vegf-sirna具有良好的体外抗肿瘤活性,其ic50为122.6nm。
本发明涉及以宫颈癌hela细胞株为模型,通过elisa测定蛋白水平的基因沉默效率,通过rt-pcr测定mrna水平的基因沉默效率。在mrna水平,ru-co-rgds/vegf-sirna能够下调vegf相应mrna的表达,浓度为100nm的抑制率为59±5.2%;在蛋白水平,ru-co-rgds/vegf-sirna能够下调vegf蛋白的表达,浓度为100nm的抑制率为64.1±2.5%。
本发明涉及以荷s180腹水瘤小鼠模型进行体内抗肿瘤活性评价,ru-co-rgds/vegf-sirna复合物中vegf-sirna的给药剂量为0.3mg/kg,其抑瘤率为52.54%。
对说明书中出现的以下词语作进一步的解释:
ru:钌多吡啶配合物
rgds:精氨酸-甘氨酸-天冬氨酸-丝氨酸
ru-co-rgds:4’-甲基-(2,2’-联吡啶)-4-酰基-rgds二氯化钌
dcc:碳二亚氨
hobt:1-羟基苯并三唑
vegf:血管内皮生长因子
sirna:小干扰rna
thf:四氢呋喃
od值:光密度值
depc:焦碳酸二乙酯
dmf:n,n-二甲基甲酰胺
tfa:三氟乙酸
tfmsa:三氟甲磺酸
ru(bpy)2cl2:顺-2,2'联吡啶二氯化钌
4′-methyl-2,2′-bipyridyl-4-carboxylicacid:4’-甲基-(2,2’-联吡啶)-4-甲
酸
tlc:薄层色谱分析
dmso:二甲基亚砜
dmem:改良杜氏伊格尔培养基
fbs:胎牛血清
fam:羟基荧光素
mtt:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐
elisa:酶联免疫吸附测定
rt-pcr:逆转录-聚合酶链式反应
mtt:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐
dmso:二甲基亚砜
ns:生理盐水
附图说明:
附图1为rgds的制备路线。
附图2为ru-co-rgds的制备路线。
(i)4′-methyl-2,2′-bipyridyl-4-carboxylicacid,dcc,hobt,nmm,thf;
(ii)tfa/tfmsa;
(iii)ru(bpy)2cl2,n2,50%ethanol,refluxedinthedark
附图3为boc-arg(tos)-gly-asp(obzl)-ser-obzl的质谱((867.35[m+1]+))。
附图4为boc-arg(tos)-gly-asp(obzl)-ser-obzl的核磁1hnmr(300mhz,dmso-d6)。
附图5为boc-arg(tos)-gly-asp(obzl)-ser-obzl的hplc。
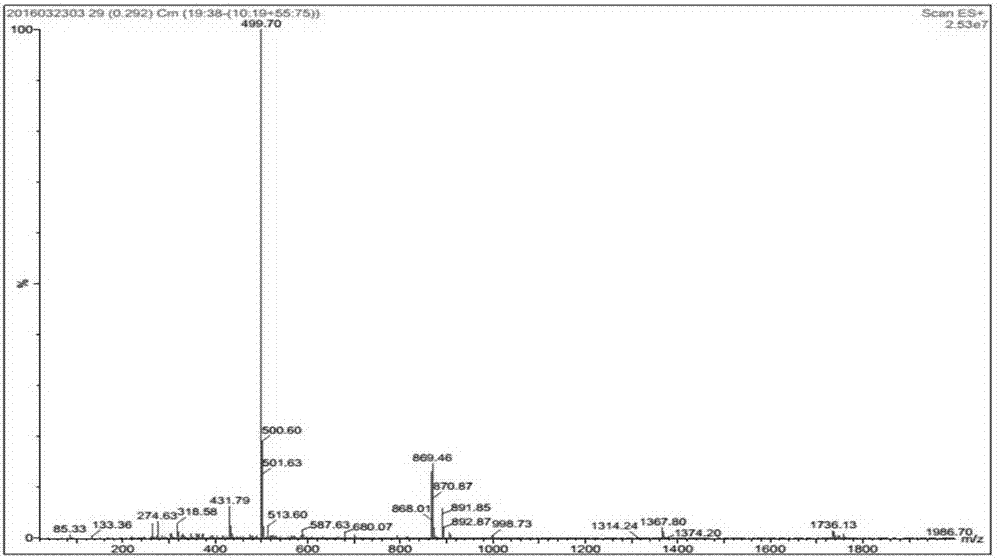
附图6为ru-co-rgds的质谱([m/2]2+=521.6482)。
附图7为ru-co-rgds的红外。
附图8为ru-co-rgds的紫外。
附图9为ru-co-rgds的荧光。
附图10为ru-co-rgds在hela细胞的转染效果图。
a:空白细胞对照组
b:游离的fam-vegf-sirna组
c:ru-co-rgds/fam-vegf-sirna基因递送体系组
d:lipo/fam-vegf-sirna阳性对照组
附图11为ru-co-rgds对hela细胞的细胞毒性。
附图12为ru-co-rgds/vegf-sirna的体外抗肿瘤活性。
附图13为各组vegf蛋白的含量。
附图14为各组vegf-mrna的含量。
附图15为ns、ru-co-rgds/vegf-sirna、ru-co-rgds、vegf-sirna和dox组瘤重。
附图16为ru-co-rgds/vegf-sirna、ru-co-rgds、vegf-sirna和dox组抑瘤率。
具体实施方式
通过以下具体实施例对本发明作出进一步的说明,但不作为对于本发明的限制。
实施例1.ru-co-rgds/vegf-sirna的制备
h-arg(tos)-gly-asp(obzl)-ser-obzl的制备路线如图1。ru-co-rgds的制备路线如图2。
hcl·arg(tos)-gly-asp(obzl)-ser-obzl的合成
合成boc-arg(tos)-gly-asp(obzl)-ser-obzl。esi-ms(m/e):(867.35[m+1]+)。取400mg中加入适量无水hcl-乙酸乙酯溶液溶解,室温搅拌4h,可见大量白色固体析出,用tlc板监测反应。反应结束后,室温下减压浓缩,残留物用乙酸乙酯溶解,反复数次,并用少量乙醚减抽滤,以除去氯化氢。即得hcl·arg(tos)-gly-asp(obzl)-ser-obzl。esi-ms(m/e):767.30[m+1]+。
4’-甲基-(2,2’-联吡啶)-4-酰基-arg(tos)-gly-asp(obzl)-ser-obzl的合成
将4’-甲基-(2,2’-联吡啶)-4-甲酸87mg溶解于无水thf中,无水dmf助溶。冰浴条件下加入hobt55mg和dcc100mg完全溶解,活化30min。加入制备好的hcl·arg(tos)-gly-asp(obzl)-ser-obzl312mg,并用dmm调节ph=8.0-9.0。室温下搅拌反应14h,用tlc板监测反应。得到粉红色固体粉末328mg(产物89%)。esi-ms(m/e):964.36[m+1]+。
4’-甲基-(2,2’-联吡啶)-4-酰基-rgds的合成
将86mg4’-甲基-(2,2’-联吡啶)-4-酰基-arg(tos)-gly-asp(obzl)-ser-obzl冰浴条件下加入1.35ml三氟乙酸,0.45ml三氟甲磺酸(v:v=3:1),反应30min。所得化合物为用乙醇反复磨洗,得到标题产物80mg。esi-ms(m/e):629.62[m+1]+
ru-co-rgds的合成
取顺-2,2'联吡啶二氯化钌35mg和4’-甲基-(2,2’-联吡啶)-4-酰基-rgds79mg于50ml两口烧瓶中,加入50%乙醇10ml,避光,充入n2的条件下回流反应10h。回流反应结束后,旋干溶液。加入5ml纯净水溶解,加入饱和六氟磷酸盐溶液,出现红橙色沉淀。1000rpm,离心3min。经过鉴定,上清液中产物含量多。取上清液,旋干。甲醇乙醚体系重结晶,最后得到终产物150mg。q-tof(m/e):521.6482[m/2]2+。
实验结果
对boc-arg(tos)-gly-asp(obzl)-ser-obzl进行鉴定,质谱(esi-ms,见图3),氢谱(见图4),液相(见图5)。对产物ru-co-rgds进行鉴定,旋光结果:[α]26d=6.817±0.9388(c=0.1g/100ml,h2o);熔点163.3±1.2℃;质谱(q-tof见图6),红外(见图7),紫外(见图8),荧光(见图9)检测:激发波长450nm,最高峰出现在634.5nm。
ru-co-rgds/vegf-sirna的制备
将vegf-sirna与小牛胸腺dna按照2:1(v:v)的比例混合,反复吹打,室温下静置10min。同时将ru-co-rgds与鱼精蛋白混合,反复吹打,室温下静置10min。后将ru-co-rgds/鱼精蛋白复合物加入到sirna/dna复合物中,反复快速吹打,室温静置30min,即得ru-co-rgds/vegf-sirna。
实施例2.ru-co-rgds/vegf-sirna的体外抗肿瘤活性评价
激光共聚焦显微镜考察sirna的转染效果
宫颈癌细胞hela是贴壁生长的细胞,以适量浓度接种于培养瓶中,加入含10%胎牛血清,100u/ml的青霉素、100μg/ml的链霉素的deme完全培养液,置于37℃恒温、5%co2饱和湿度的培养箱中培养。取对数生长期hela细胞,先用pbs洗涤三遍,加1ml胰酶,消化3min后,离心(2000rpm、3min),用含10%胎牛血清的deme培养基调整细胞浓度至1×105个/ml,每个激光共聚焦培养小皿中加入2ml,共四组,37℃恒温、5%co2培养过夜。小心弃掉上清液,pbs洗一次,加入2ml含有100nmru-co-rgds/fam-vegf-sirna、fam-vegf-sirna、lipo2000/fam-vegf-sirna的无血清dmem培养基,另一个空白组培养皿加入2ml无血清dmem培养基,转染4h。吸除上清液,1mlpbs洗3次,每个培养皿加1mlhoechst染液(pbs稀释,工作浓度为4μg/ml),染色15min。之后吸除上清液,用1mlpbs洗3次,最后加入1mlpbs。置于激光共聚焦显微镜下观察。
实验结果
本实验中,ru-co-rgds表面吸附的sirna是fam标记的vegf-sirna,从图10中我们可以看出ru-co-rgds/fam-vegf-sirna组的细胞核(被hoechst33342染成蓝色)周围有绿色荧光(fam),而blank组和vegf-sirna组细胞核周围没有绿色的荧光,阳性对照组lipo2000/fam-vegf-sirna有绿色荧光。可以得出结论:vegf-sirna被ru-co-rgds成功递送进hela细胞内,并且分布在细胞核周围。
ru-co-rgds的细胞毒作用
将hela细胞以适量浓度接种于培养瓶中,加入含10%胎牛血清,100u/ml的青霉素、100μg/ml的链霉素的dmem完全培养液,置于37℃恒温、5%co2饱和湿度的培养箱中培养。取对数生长期hela细胞,先用pbs洗涤三遍,加1ml胰酶,消化3min后,离心(2000rpm、3min),用含10%胎牛血清的dmem培养基调整细胞浓度至4×104个/ml。取96孔培养板,pbs液封,设空白培养基组,其余每孔加入100μl细胞悬液,在37℃,5%co2的培养箱中培养过夜。小心弃去培养液,加入含ru-co-rgds的dmem培养基100μl,浓度依次为5μg/ml、10μg/ml、20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml、150μg/ml。每个浓度设置六个复孔。置于培养箱内培养48h。每孔加入25μl新鲜配制的浓度为5mg/ml的mtt,37℃,5%co2培养箱继续培养4h。离心后小心弃去上清液,并加入150μldmso,用微型振荡器震荡700r,10min。混匀后,在酶标仪上以检测波长为490nm测定吸光度(od)值,计算细胞存活率。细胞存活率(%)=[(实验组od值-空白组od值)/(对照组od值-空白组od值)]×100%。上述实验重复三次。
实验结果
从图11中我们可以看出随着浓度的增加,与空白组相比较,细胞存活率没有明显性差异(p>0.05)。因此修饰后的载体ru-co-rgds对hela细胞是没有毒性的。
ru-co-rgds/vegf-sirna的体外抗肿瘤活性
取对数生长期的hela细胞,胰酶消化后,用含10%胎牛血清的dmem培养基调整细胞浓度至4×104个/ml。每孔种100μl细胞悬液于96孔培养板内,37℃,5%co2培养过夜。小心弃去培养液,加入100μl含40nm,80nm,100nm和120nmru-co-rgds、vegf-sirna、ru-co-rgds/nc、ru-co-rgds/vegf-sirna、lipo2000/nc和lipo2000/vegf-sirna的无血清dmem培养基。每组每个浓度设置六个复孔。转染4h,小心弃掉上清液,加入完全dmem培养基弃继续培养44h。每孔加入25μl新鲜配制的浓度为5mg/ml的mtt,37℃,5%co2培养箱继续培养4h。离心后小心弃去上清液,并加入150μldmso,用微型振荡器震荡700r,10min。混匀后,在酶标仪上以检测波长为490nm测定吸光度(od)值,计算细胞存活率。细胞存活率(%)=[(实验组od值-空白组od值)/(对照组od值-空白组od值)]×100%。上述实验重复三次。
实验结果
从图12中可以得出以下结论:
(1)不同浓度的ru-co-rgds、ru-co-rgds/nc、和阴性对照组vegf-sirna分别与blank(即浓度为0的细胞)比较,无显著性差异(p>0.05),说明裸的vegf-sirna和单独的载体ru-co-rgds对细胞增殖均无抑制作用。
(2)不同浓度的ru-co-rgds/vegf-sirna与blank(即浓度为0的细胞)比较,当浓度为40nm时,有差异(p<0.05),当浓度为60nm时,有显著性差异p<0.01);相同浓度的ru-co-rgds/vegf-sirna与ru-co-rgds/nc、阴性对照组vegf-sirna相比较,当浓度为40nm时,有差异(p<0.05),当浓度为60nm时,有显著性差异(p<0.01);相同浓度的ru-co-rgds/vegf-sirna与阳性对照组lipo2000/vegf-sirna比较,无显著性差异(p>0.05),即ru-co-rgds/vegf-sirna表现出较好的体外抗肿瘤活性。
(3)ru-co-rgds/vegf-sirna对hela细胞的抑制作用呈现一定的浓度依赖性,即随着浓度的增加,其抑制作用表现出增强趋势。
从图9中我们可以看出随着ru-co-rgds/vegf-sirna的浓度增加,细胞存活率逐渐下降,即其抗肿瘤活性逐渐增强,呈现浓度依赖性。其ic50为122.6nm。
实施例3ru-co-rgds/vegf-sirna的蛋白水平沉默效率评价
细胞培养
取对数生长期hela细胞,胰酶消化后,用含10%胎牛血清的dmem培养基调整细胞浓度至1×105个/ml,每孔加2ml于六孔板中,设三个复孔,培养过夜当细胞密度长至80%左右时,弃掉上清,加入2ml含有100nmvegf-sirna,ru-co-rgds/nc、ru-co-rgds/vegf-sirna、lipo2000/vegf-sirna和lipo2000/nc的无血清dmem培养基,空白组加入2ml无血清dmem培养基,转染4h后换成新鲜的含10%fbs的dmem培养基,继续培养44h。
提取蛋白
冰上操作:细胞培养48h后,离心(1000rpm,10min)取上清即可。
bcaproteinassaykit定量裂解液中蛋白浓度
将上一步提取的蛋白裂解液稀释十倍,每组设置三个复孔,根据bca工作液试剂盒操作步骤,测定每组蛋白浓度,做下记录,求每组样品总蛋白浓度平均值。
humanvegfelisa试剂盒测定样品蛋白中vegf的含量
蛋白上样量为120μg,根据蛋白浓度,加入相应体积的蛋白裂解液并用depc水定容到50μl,根据试剂盒步骤操作最后在450nm下测定od值。上述实验重复三次。
实验结果
蛋白定量结果
绘制标准曲线
不同浓度的标准蛋白的od值
标准方程为y=0.001x+0.1345。r2=0.9939
各组蛋白样品中总蛋白量
elisa
各组蛋白样品中vegf蛋白的相对含量
从图13中我们可以看出,裸的vegf-sirna组与空白组相比,没有明显性差异(p>0.05),即裸的vegf-sirna不能下调hela细胞vegf蛋白的表达;ru-co-rgds/nc和lipo2000/nc与空白组相比较,没有明显性差异(p>0.05),表明载体材料对vegf蛋白的表达没有影响;而ru-co-rgds/vegf-sirna分别与vegf-sirna/nc、blank组相比均有明显性差异(p<0.01),与lipo2000/vegf-sirna阳性对照组相比,没有明显性差异(p>0.05),说明ru-co-rgds将vegf-sirna递送进入细胞并成功下调vegf蛋白的表达。
实施例4.ru-co-rgds/vegf-sirna的mrna水平沉默效率评价
细胞培养
取对数生长期hela细胞,细胞密度达到80%左右时,用pbs洗涤三遍,加入1ml胰酶消化3min,离心(2000rpm,3min),用含10%胎牛血清的dmem培养基调整细胞浓度至1×105个/ml,每孔加2ml于六孔板中,培养过夜,设三个复孔,弃掉上清,加入2ml含有100nmvegf-sirna,ru-co-rgds/nc,ru-co-rgds/vegf-sirna,lipo2000/nc,lipo2000/vegf-sirna的无血清dmem培养基,转染4h,换成新鲜含血清的dmem培养基,继续培养44h。
rna的提取
(1)首先弃掉六孔板的上清液,然后用1mlpbs洗涤三次,每孔加入1mltrizol裂解液(每10cm2加入1mltrizol)。吹打均匀并室温裂解10min,将裂解液转移至无rnaseep管,静置5min。
(2)相分离。在每1mltrizol加入0.2ml氯仿,然后剧烈振荡,室温放置3分钟,离心(4℃,12000rpm,15min)。液体分成三层,下层的红色为苯酚-氯仿相,上层是无色的水相。rna存在于水相中,水相约占总体积的50%。
(3)沉淀rna。小心地将上层水相液体转移到另一干净的无rnaseep管中,然后每管加入0.5ml异丙醇,混匀,室温静置10min,然后离心(4℃,12000rpm,10min)。离心后在管的底部可看到絮状半透明胶样的rna沉淀。
(4)洗涤rna。小心去除上清,加入1ml配制好的75%乙醇(depc水配制),洗涤rna沉淀,振荡器混匀,离心(4℃,12000rpm,10min),小心弃去上清。
(5)rna的复溶。将rna沉淀放置10min,待rna沉淀干燥。但是注意不能将rna沉淀完全干燥,因为这会极大地降低它的溶解度。用depc水重悬rna沉淀,并且用枪头反复吹打几次,静置10分钟,55℃水浴10-15min。-20℃保存;
(6)测rna浓度:用depc水校正nanodrop-1000后,取2μl混匀后的rna溶液样品,滴加到测量臂上,选择rna,点击measure测量。同法依次测量所有rna溶液样品。
逆转录
(1)样品准备:逆转录rna上样量为2μg,根据上一步测得的rna浓度,计算出我们所需rna体积。
(2)取microamptmoptical96-wellreactionplate,每个反应孔加10μl2×rtbuffer,1μl20×rtenzymemix,加入相应体积的rna溶液,用depc水补足20μl。用opticaladhesivefilm将板子封口。离心(4℃,1000rmp,3min),排出聚集在反应孔底部的气泡。
(3)放入pcrsystem9700中,设置反应条件:94℃-5min,94℃-30s,55℃-30s,72℃-25s,72℃7min,4℃∞,共30个循环。
(4)测浓度:反应结束后,首先用depc水校正nanodrop-1000,取2μl混匀后的cdna溶液样品,滴加到测量臂上,盖上测量臂,选择dna-50,点击measure测量。同法依次测量所有cdna溶液样品,并记录下测量的结果。按照上样量进行稀释,稀释后用同样的方法进行测定。
rt-pcr
cdna的上样量为20ng,据此计算所需加入的各cdna样品的体积。每个反应孔加入10μl
数据处理中,根据ct值以gapdh为内参,运用2^-△△ct法相对定量各实验组mrna的量。上述实验重复三次。
实验结果
提取的各组rna浓度
提取的各组rna浓度
逆转录后各组的cdna的浓度
逆转录后各组的cdna的浓度
rt-pcr
rt-pcr后各组2^-△△ct值如下表所示:
genesilencingefficiencyonvegf-sirnalevel
从图14可以看出:
(1)裸的vegf-sirna组与空白组相比,没有显著性差异(p>0.05),说明裸的vegf组对vegf-mrna的转录没有影响;
(2)ru-co-rgds/nc组和lipo2000/nc组与空白组相比,没有显著性差异(p>0.05),说明载体材料对vegf-mrna的转录没有影响;
(3)ru-co-rgds/vegf-sirna组分别与空白组和ru-co-rgds/nc相比较,均有明显性差异(p<0.01),而与lipo2000/vegf-sirna组相比,没有明显性差异(p>0.05),可以得出ru-co-rgds/vegf-sirna能够下调vegf-mrna的转录水平,并且效率和阳性对照组相当。
实施例6.ru-co-rgds/vegf-sirna的体内抗肿瘤活性研究
实验分组
实验共分为5组,分别是生理盐水组(ns),ru-co-rgds/vegf-sirna组,裸vegf-sirna组,ru-co-rgds组,盐酸阿霉素组(dox)。每组12只小鼠,四组共60只。
给药剂量
(1)ru-co-rgds/vegf-sirna组:vegf-sirna剂量为0.3mg/kg,ru-co-rgds的剂量为0.498mg/kg,即按质量比为1.66:1配制药品并给药
(2)vegf-sirna组:剂量为0.3mg/kg
(3)ru-co-rgds组:剂量为0.498mg/kg
(3)dox组:剂量为2μmol/kg
(4)ns:等体积的生理盐水,即每只0.2ml
给药方式:尾静脉注射
实验动物:icr小鼠,雄性,体重20±2g(x±sd),由北京维通利华动物实验技术有限公司提供。
实验方案
建立荷s180腹水瘤小鼠模型:取1×107个/ml的s180细胞悬液于健康小鼠腋皮下接种,0.2ml/只,小鼠接种瘤液后养7天至瘤体积(长×宽2/2)为150mm3左右,将全部小鼠随机分组,分为5组,并编号。测量体重,然后开始给药,ru-co-rgds/vegf-sirna、vegf-sirna、ru-co-rgd组按给药剂量每天尾静脉注射给药一次,每次0.2ml/只,连续给药5天;阴性对照以等体积的生理盐水尾静脉注射给药,每天给药一次,0.2ml/只,连续给5天;阳性对照dox组以尾静脉注射给药,按给药剂量每天给药一次,0.2ml/只,连续给药5天,每天按编号测量小鼠体重。
实体瘤抑瘤率及脏器指数的测定
每组连续给药5天后,于第6天脱颈椎处死小鼠,处死前称取体重,然后将小鼠解剖,取出瘤、脑、心、肝、脾、肾,并称重,按如下公式计算抑瘤率。
抑瘤率%=[(生理盐水组平均瘤重-给药组平均瘤重)/生理盐水组平均瘤重]×100%。数据统计均采用t检验和方差分析,以(mean±sdg)表示。
从图15中我们可以看出,裸的vegf-sirna组与空白组相比,没有显著性差异(p>0.05),说明裸的vegf-sirna对肿瘤的生长无抑制作用;ru-co-rgds/vegf-sirna与空白组相比较,有显著性差异(p<0.05),与dox组相比,没有显著性差异(p>0.05),说明ru-co-rgds/vegf-sirna明显抑制肿瘤的生长,抑瘤率接近于阳性药dox;从图16中可以看出,ru-co-rgds/vegf-sirna组,裸vegf-sirna组,ru-co-rgds组,盐酸阿霉素组(dox)的抑瘤率。
- 还没有人留言评论。精彩留言会获得点赞!