一种用于癌症精准诊断的智能纳米靶向探针的制备方法与流程
本发明涉及肿瘤检测技术领域,更具体涉及一种检测肿瘤纳米靶向探针的制备方法,通过在ctla-4蛋白笼型结构表面偶合黑色素探针抗体蛋白并在其内腔合成ag2s纳米颗粒,制备出具有黑色素肿瘤靶向抗体、纳米蛋白笼和携带荧光三种功能的纳米颗粒探针。这种三功能纳米探针能够用于近红外二区1200nm激光及活体的黑色素瘤的实时监控和荧光成像等检测。
背景技术
恶性黑色素瘤(malignantmelanoma,mm)是一种恶性程度极高、发生隐匿的肿瘤,少数早期患者可以通过外科手术的方法治疗,但因其对放化疗不敏感,晚期恶性黑色素瘤病人的临床治疗十分棘手。ctla-4单克隆抗体临床治疗显示阻断ctla-4后肿瘤的控制率提高。ctla-4抗体产生的抗肿瘤作用包括两种机制:①干扰肿瘤特异性效应细胞如cd8细胞,导致其克隆扩增。②去除肿瘤诱导的调节性t细胞(treg),treg细胞可抑制肿瘤相关抗原的免疫反应。近十多年来fda从未批准过任何治疗晚期黑色素瘤的药物,近期抗ctla-4单克隆抗体ipilimumab在晚期黑色素瘤的治疗中取得了历史性的突破,临床研究证实该药是第一个被发现的可延长晚期黑色素瘤患者总生存期的药物,部分难治性晚期黑色素瘤患者可对其产生持久且完全的应答。ipilimumab先于2011年3月25日被fda批准作为单一疗法用于治疗不可切除或转移性黑色素瘤的初治患者或未化疗患者,后于同年7月被欧盟委员会(europeancommission)批准用于未经治疗的晚期黑色素瘤患者。ipilimumab作为第一个被证实可以延长晚期黑色素瘤患者总生存期、并具有一定安全性而被准入临床应用的药物,无疑为人类对抗晚期黑色素瘤带来了希望的曙光。但是,ipilimumab的临床应用仍存在某些棘手的问题:①其有效率仅为10.9%,对大多数患者仍无效;②并非所有有效患者,其效力都可持续6年之长,部分患者在短期内病情仍会继续进展;③可能存在长达3个月的起效潜伏期;④约1/3的患者会出现较严重的药物中毒反应。如何能够从分子水平对肿瘤进行超早期诊断及治疗治疗过程中癌症细胞分子水平上的变化是临床上长期困扰人们的难题。近年来,“智能炸弹”(smartbomb)被用来描述这一系列向癌细胞运输细胞毒性分子的单抗。这些分子包括放射免疫偶联物,具有细胞毒性的小分子以及免疫系统里的细胞因子。放射性元素被用于标记抗体,进行肿瘤的诊断和治疗。目前被fda批准的药物有ibritumomabtiuxetan和tositumomab。抗体-药物偶联物(antibody-drugconjugates)是最近研发的极具前景的抗癌药物。它将带有细胞毒性的药物和具有特异性的抗体偶联,提高了特异性同时更好地靶向杀死肿瘤细胞。智能纳米但白笼与活体之间的相互作用规律提供了便捷途径,对发展蛋白质药物、活体传感技术和高效靶向递送载体具有重要的促进作用。携带纳米靶向探针和荧光的蛋白质纳米笼(proteinnanocage,pnc)是颇具发展潜力的纳米生物医学创新诊断平台,对pnc的活体行为进行实时追踪可以为诊断和治疗肿瘤提供十分重要的信息。
随着生物医学影像技术的不断发展,近红外荧光成像技术在生物医学研究领域得到了越来越多的关注和应用。其中,近红外二区(1000nm-1400nm)荧光对生物组织穿透能力强,成像信噪比高,该区域荧光成像技术在生物活体成像领域已展现出巨大潜力。量子点(quantumdots,qds)作为一种新型的纳米荧光探针,具有亮度高、光稳定性强、光谱可调等传统荧光染料不可比拟的优势,在生物标记、成像与传感等方面得到了广泛应用,而开发具有近红外二区荧光发射、生物相容性好、量子产率高的qds是当前其用于活体荧光成像所面临的重要挑战。本专利近红外二区激光及纳米靶向荧光分子探针的开发,为分子靶向受体的研究及高灵敏度激光检测系统的发展开创了人类对深层组织进行非侵入式荧光定量和成像开创了新纪元。近红外二区激光及纳米靶向荧光分子成像,提高了肿瘤筛查的特异性和敏感性,有助于临床医生早期发现肿瘤、识别微小肿瘤以及实时指导医生制定治疗方案。
技术实现要素:
本发明的日的是在于提供了一种用于癌症精准诊断的智能纳米靶向探针的制备方法,在蛋白笼腔内转入ag2s纳米颗粒,在其外表偶合ctla-4靶向探针抗体,从而发展具有靶向探针、纳米蛋白笼及携带荧光三种功能的纳米探针发光纳米颗粒。这种三功能纳米探针颗粒能够用于特异地靶向连接恶性黑色素瘤的细胞毒t淋巴细胞抗原4(ctla-4),可通过活体荧光成像及近红外二区1200nm激光的实时检测与黑色素肿瘤的精准诊断。
为了实现上述的目的,本发明采用以下技术措施:以豇豆花叶病毒(cowpeamosaicvirus.cpmv)主要衣壳蛋白形成的pnc(pnc-cpmv)为蛋白笼,建立了一种通过在pnc内部包装近红外二区荧光(nir-ii,1200nm)ag2s量子点对可对其活体黑色素肿瘤进行实时成像和快速精准诊断。借助nir-ii荧光成像的高时空分辨和对组织高穿透性,实现了pnc-cpmv在活体黑色素肿瘤的高保真实时动态追踪,并通过聚乙二醇修饰pnc-cpmv外表面,揭示了pnc-cpmv表面化学性质依赖的活体行为规律。这种包装量子点的标记方式有效避免了纳米探针对pnc-活体相互作用的干扰。
具体实施方式:
一种用于癌症精准诊断的智能纳米靶向探针的制备方法其步骤是:
1.构建表达铁蛋白重能的表达质粒,cpmv衣壳由60个拷贝的蛋白亚基构成,每个蛋白亚基又由41kda大亚基蛋白(l)和24kda小亚基蛋白(s)组成,针对量子点与病毒样颗粒体外的可控自组装展开了工作,通过制备不同表面修饰的量子点,进行特定的cpmv病毒蛋白质体外包装蛋白制作、表达、纯化铁蛋白,电子显微镜验证表征其笼型结构。
2.量子点的修饰,巯基丙酸修饰的量子点200“l3一毓基丙酸(mpa)加入到1mlag2s量子点氯仿溶液中,混合物在室温中剧烈震荡30分钟,然后6000转/分离心5分钟,沉淀用氯仿反复冲洗。
3.蛋白笼氨基端融合ctla-4抗体、表达纯化制各表面展示了蛋白笼型结构,进行结构和抗体表征。
4.用cpmv衣壳蛋白分别去包装上述表面带有不同电荷的量子点,得到并表征了这些cpmv病毒样颗粒。量子点复合纳米颗粒,结果发现cpmv病毒样颗粒能包装各种不同表面修饰的带有不同表面电荷的量子点并且保持了其“侵染”活性。
5.显微成像检测该三功能探针用于恶性黑色素瘤的细胞毒t淋巴细胞抗原4(ctla-4)识别的纳米靶向探针的荧光成像功能。
6.近红外二区激光及纳米靶向探针荧光成像验证三功能探针用于黑色素肿瘤的纳米靶向荧光探针成像功能。
本发明与现有技术相比,具体以下优点和效果:
本研究利用基因操纵技术,在蛋白笼表面经过处理,其氨基端融合了靶向抗体,并基于蛋白原有的60个拷贝的蛋白亚基构成,每个蛋白亚基又由41kda大亚基蛋白(l)和24kda小亚基蛋白(s)功能,在其空腔内装载ag2s纳米颗粒,从而制备出出一种有机/无机杂合的三功能肿瘤检测纳米探针。经过处理的cpmv蛋白本身具有优良的生物相容性、作为ag2s纳米颗粒的表面保护基团,还可以稳定内腔ag2s纳米颗粒。该纳米探针把肿瘤靶向探针、荧光成像、近红外二区1200nm激光及成像多功能融为一体,使用方使并能够实现多模式的同步检测,可望应用于特异的黑色素瘤细胞诊断、以及治疗过程中指导。
附图说明:
[图1纳米靶向探测肿瘤与纳米结构。
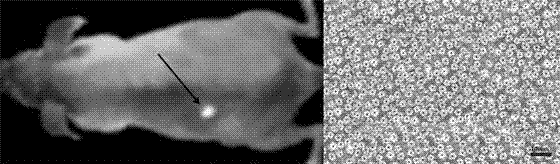
图2活体黑色素瘤。
图3黑色素瘤病理诊断。
图4纳米靶向ctla-4探针识别细胞毒t淋巴细胞。
例子1量子点的cpmv包装1)在dhla-ag2sqds表面修饰6peg,得到了高溶于水、缓冲液和血清的peg-ag2sqds。这种水溶的、稳定的peg-ag2sqds在磷酸盐缓冲液(pbs)中长达10个多月仍然具有明亮的近红外荧光,并且peg-ag2sqds的量子产率可以达到15.5%,远远高于dhla-ag2sqds的5.8%。
2)0.20nmol量子点溶液摄氏28度,超声l5分钟后与0.12nmol五聚体蛋白溶液混合,定容体积为o.6ml,然后在300ml组装缓冲液,摄氏5度透析24小时,12小时换缓冲液一次。
3)agƨs—qds的纯化
量子点和cpmv的包装混合液用蔗糖密度梯度离心纯化,未包装的量子点为对照。混合液在12%的蔗糖密度管上面,用cpmvti转子摄氏4度38000rpm离心6小时,在手提紫外灯的照射下,分别收集离心管中不同层面的各个组分。各个组分的蛋白质浓度用sds.page粗略定量。各个组分溶液通过amiconultral5超滤管(100kdamwcut—off)除去蔗糖,除糖缓冲液用没有甘油的组装缓冲液。
4)通过持续照射peg-ag2sqds以检测ag2sqds的荧光衰减情况,发现在123.8mw/cm2的功率下持续照射120min后ag2sqds的荧光强度依然可以达到照射前的70%左右。组织模拟实验证明了ag2sqds深的组织穿透力和高保真度。小鼠尾静脉注射peg-ag2sqds后实现了在活体水平对小鼠微管系统的检测。
5)小鼠肿瘤模型尾静脉注射0.85nmol(低于报道的其他量子点用于活体成像的注射量)peg-ag2sqds,1200nm激光器激发,ingaasccd收集信号。注射后3s内就可以清楚的看到ag2sqds尾静脉进入静脉血管并循环至小鼠心脏和肺部,随后又循环至肾脏等器官。注射后的ag2sqds开始靶向于肿瘤部位,并在肿瘤部位聚集。2分钟后,通过ag2sqds的近红外荧光已经可以准确的识别肿瘤区域。纳米蛋白笼携带peg-ag2sqds实现了小鼠肿瘤靶向和活体成像示踪。
例子2量子点的cpmv包装
1)在dhla-ag2sqds表面修饰6peg,得到了高溶于水、缓冲液和血清的peg-ag2sqds。这种水溶的、稳定的peg-ag2sqds在磷酸盐缓冲液(pbs)中长达12个多月仍然具有明亮的近红外荧光,并且peg-ag2sqds的量子产率可以达到19.5%,远远高于dhla-ag2sqds的6.8%。
2)0.18nmol量子点溶液摄氏26度,超声l2分钟后与0.12nmol五聚体蛋白溶液混合,定容体积为o.5ml,然后在500ml组装缓冲液,摄氏3度透析28小时,14小时换缓冲液一次。
3)agƨs—qds的纯化
量子点和cpmv的包装混合液用蔗糖密度梯度离心纯化,未包装的量子点为对照。混合液在12%的蔗糖密度管上面,用cpmvti转子摄氏4度40000rpm离心6小时,在手提紫外灯的照射下,分别收集离心管中不同层面的各个组分。各个组分的蛋白质浓度用sds.page粗略定量。各个组分溶液通过amiconultra12超滤管(100kdamwcut—off)除去蔗糖,除糖缓冲液用没有甘油的组装缓冲液。
4)通过持续照射peg-ag2sqds以检测ag2sqds的荧光衰减情况,发现在163.8mw/cm2的功率下持续照射120min后ag2sqds的荧光强度依然可以达到照射前的80%左右。组织模拟实验证明了ag2sqds深的组织穿透力和高保真度。小鼠尾静脉注射peg-ag2sqds后,实现了在活体水平对小鼠微管系统的检测。5)小鼠肿瘤模型尾静脉注射0.95nmol(低于报道的其他量子点用于活体成像的注射量)peg-ag2sqds,1200nm激光器激发,ingaasccd收集信号。注射后5s内就可以清楚的看到ag2sqds尾静脉进入静脉血管并循环至小鼠心脏和肺部,随后又循环至肾脏等器官。注射后的ag2sqds开始靶向结合肿瘤部位,并在肿瘤部位聚集。3分钟后,通过ag2sqds的近红外荧光已经可以准确的识别肿瘤区域。纳米蛋白笼携带peg-ag2sqds实现了小鼠肿瘤靶向和活体成像示踪。
- 还没有人留言评论。精彩留言会获得点赞!