玫瑰花渣活性部位萃取方法及其应用与流程
本发明属于化学工艺领域,涉及玫瑰花渣活性部位萃取方法及其应用。
背景技术:
大马士革玫瑰(rosadamascena),常用名damaskrose,又名突厥蔷薇,蔷薇科蔷薇属,属古典庭院玫瑰,丛生灌木植物,原产于叙利亚,14世纪开始在法国广为栽种,大马士革玫瑰是保加利亚种植的主要的玫瑰品种,也是世界公认的优质玫瑰品种。所产精油为玫瑰中的上品,因而被广泛种植用以提取玫瑰精油。
玫瑰在我国的栽培历史悠久,目前在全国各地均有种植。山东平阴是中国最大的玫瑰花种植基地,玫瑰花资源十分丰富。近年来,各地相继引进用于提取精油的大马士革玫瑰,提取精油后产生大量的花渣,营养成分丰富,含有多糖、黄酮、蛋白质、维生素c、维生素e、β-胡萝卜素及矿质营养元素。玫瑰具有很强的滋补身心的功效,能提高机体免疫力,调节荷尔蒙水平,促进循环代谢,改善及增强泌尿系统机能,利尿,强肾。此外玫瑰还能活化血管、促进血液循环,增强血管壁弹性,降低心脏的充血现象,降低心脏病的发生率,改善脾脏功能,利脾益心。玫瑰具有一定的抗菌、抑菌功能;并能促进肠道蠕动,有轻泻作用,净化消化道,帮助毒素排解及代谢,能改善反胃、呕吐及便秘;并能增强及改善肝功能,清除毒素,尤其能减低酒精对肝脏的毒害作用,改善过量酒精造成的肝充血。玫瑰能够平衡及强化胃肠道功能,调节消化液的分泌,促进消化和吸收:对消化不良及胃酸分泌过多等慢性疾病有一定的调节和改善作用;对情绪紧张、压抑等引起的胃痛有明显的改善功能。像所有的天然产物一样,玫瑰花成分复杂,含有多酚类、黄酮类等多种化学成分,具有减少和消除自由基,抗氧化活性,抗血栓,抗癌,抗炎,抗菌,免疫调节作用,如果将这些花渣丢掉,不仅造成巨大的浪费,还将污染环境。若能将这些废渣加工制成玫瑰保健功能食品、玫瑰黄酮抗氧化剂及高档化妆品,则既可丰富了市场,有利于环境保护,又提高了玫瑰的综合利用价值,产生一定的经济效益。
机体或细胞的衰老和死亡以及很多疾病被认为是由过量的自由基的氧化损伤造成,抗氧化剂是能阻止或很大程度抑制易氧化物质氧化过程,能清除活性氧或者阻止活性氧生成的一类物质,在病理学和饮食中都起着不可或缺的作用。从植物组织中提取的天然抗氧化剂不仅能够有效清除机体的自由基,抑制氧化损伤,而且具有来源广泛、成本低、安全性好、环境友好等优点。清除abts自由基法是评价抗氧化能力的常用方法,abts法广泛用于评价抗氧化剂清除自由基的能力。abts自由基可与任何羟基化的芳香族化合物反应。此法快速简单,广泛应用于食品和天然水溶性酚类物质抗氧化活性的测定。
清除dpph自由基法也是评价抗氧化能力的常用方法,该方法快速、简单、灵敏、直接。
天然产物抗氧化作用的机理之一是清除羟自由基,机体在一定的病理条件下能够产生较多的羟自由基,多种疾病与羟自由基所致的氧化性损伤有关,采用水杨酸法清除反应产生的·oh,该法仪器简单,操作简便,稳定性好,测定快速。
酪氨酸酶,又称多酚氧化酶,广泛存在于动、植物以及微生物的组织细胞中,与果蔬褐变、人色素障碍性疾病及其恶性黑色素瘤的发生有着重要关系。酪氨酸酶是黑色素形成过程的关键酶。由于酪氨酸酶是黑色素形成过程中的关键酶,抑制酪氨酸酶的活性可减少黑色素的形成。酪氨酸酶首先催化酪氨酸羟基化为l-dopa,再进一步催化l-dopa为醌类。在美白化妆品中添加能抑制酪氨酸酶活性的美白剂,可以通过抑制酪氨酸酶活性直接抑制黑色素的形成,从而达到美白肌肤的目的。酪氨酸酶氧化酪氨酸为黑色素的流程图如下:
没食子酸具有抗炎、抗突变、抗氧化、抗自由基等多种生物学活性;同时没食子酸具有抗肿瘤作用,可以抑制肥大细胞瘤的转移,从而延长生存期;对肝脏具有保护作用,可以抵抗四氯化碳诱导的肝脏生理和生化的转变;可以通过抑制内皮no的生成诱导血管内皮依赖性收缩和对内皮依赖性松弛。对多种细菌、真菌以及流感病毒均有一定的抑制作用。没食子酸的一些酯类常常作为优良的抗氧化剂广泛应用于食品、化妆品等领域。欧、美、日等发达国家大部分的水产品浸渍防腐均用没食子酸替代有致癌作用的丁基-4-羟基苯甲醚。目前国内外工业化生产没食子酸主要以五倍子为原料,采用酸水解、碱水解、发酵法和酶水解法制备没食子酸,但均纯在一定的弊端,酸水解法不仅引入了无机杂质,而且对设备腐蚀很严重;碱水解法工艺较为繁琐,耗能大;发酵法和酶法效率虽得到提高,但生产成本也大幅提高,对人员要求较高,且引入了一些有机杂质。
玫瑰花渣营养成分丰富,含有多糖、黄酮、蛋白质、维生素c、维生素e、β胡萝卜素及矿质营养元素,文献报道其渣有抗菌,抗氧化等生理活性。
技术实现要素:
本发明为解决玫瑰花残渣的综合利用的技术问题,公开了玫瑰花渣活性部位萃取方法及其应用。
为解决上述技术问题,本发明采用以下技术方案:
玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备;
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr(damaskroseflowerresidue)-a和活性部位drfr-b;
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c;
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d。
所述步骤(1)的操作为:取玫瑰花渣,加入8~12倍质量的酶解液,浸泡30~60min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。
所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
所述步骤(2)的操作为:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.0~1.3,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。
所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为(1~10):(1~10)。
所述步骤(3)的操作为:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为65%~85%,静置8~12小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
所述步骤(4)的操作为:
将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为65%~85%,静置8~12小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
所述的玫瑰花渣活性部位萃取方法制备的玫瑰花渣活性部位的应用,所述玫瑰花渣活性部位作为制备没食子酸结晶的应用。
制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取3~5次后,剩下的部分用体积分数为50%~70%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的(1/2~1/3),移至4℃冰箱内静置12~18h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为(1~10):(1~10),石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入4~8ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于10~20℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为(10~20):(0.5~4.5),二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入4~8ml二氯甲烷-甲醇混合溶剂;
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
所述玫瑰花渣活性部位作为抗氧化、抗黑色素产品的应用。
本发明的有益效果在于:
1.本发明以提取精油之后产生的玫瑰渣为原料,组织破碎提取后,进行有机溶剂萃取,并对萃取的各个部位进行抑制酪氨酸酶和抗氧化活性筛选,以期分离出具有高度生物活性的单体或一类物质,为玫瑰花的综合利用,奠定理论基础。
2.本发明用闪式提取器提取玫瑰渣中的成分,依靠高速机械剪刀力和超动分子渗透技术,在室温及溶剂存在下短时间内把其组织破碎至细微颗粒,同时使有效成分迅速达到组织内外平衡,通过过滤达到提取之目的。
3.本发明采用液-液萃取法进行初步分离,萃取原理是根据化合物在两种互不相溶或微溶的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中,经过反复多次萃取,而实现物质的分离。
4.各部位对dpph自由基的清除效果关系如图4所示,它们均有一定的清除dpph自由基的能力,且在实验浓度范围内,各成分随浓度的不断增大,其对dpph自由基的清除效果呈不断增加的趋势。
5.本发明的三个萃取部位对abts清除的能力相对弱于vc,它们对abts清除能力从大到小依次为:vc>drfr-a>drfr-b>drfr-c,从数值上来看,同等浓度drfr-a与vc对abts清除能力几乎相当,各部位对abts清除效果关系如图5所示,该活性部位均有一定的清除abts的能力,且在实验浓度范围内,各成分随浓度的不断增大,其对abts的清除效果呈不断增加的趋势。
6.本发明的效果实施例以曲酸为阳性对照,考察了drfr-a部位对酪氨酸酶的抑制活性,结果表明此部位对酪氨酸酶有较强的抑制作用,此部位中具有潜在高活性成分抑制酪氨酸酶的活性。玫瑰渣是纯天然的,具有安全无毒的副作用。因此,对抑制酪氨酸酶活性较强的此部位进一步分析其抑制机理及功能成分具有重要的意义。
7.本发明首次利用萃取结晶方法分离纯化玫瑰花渣中的抗氧化的主要活性成分没食子酸,不经过柱层析,方法简便、环保,收率高,生产周期短,便于产业化;制备的没食子酸具有纯度高、杂质少、生产工艺简单、成本低、对设备要求低等特点,本发明以天然产物玫瑰花渣为原料,无需昂贵设备,也不会引入新的杂质,仅用萃取和结晶的方法就能生产高纯度没食子酸,在化妆品和食品抗氧化方面具有广阔的应用前景。
附图说明
图1dpph全波长扫描图;
图2abts全波长扫描图;
图3羟自由基全波长扫描图;
图4drfr-a,drfr-b,drfr-c和vc对dpph的清除能力;
图5drfr-a,drfr-b,drfr-c和vc对abts的清除能力;
图6玫瑰渣萃取各部位与vc和羟自由基反应时的吸光度变化趋势;
图7曲酸抑制酪氨酸酶活性曲线;
图8各浓度对酪氨酸酶抑制曲线;
图9drfr-a抑制酪氨酸酶活性曲线;
图10没食子酸结晶hplc色谱图;
图11没食子酸结晶1h-nmr;
图12没食子酸结晶ir图。
具体实施方式
实施例1
1.玫瑰渣浸膏的制备
取9kg的玫瑰渣,加入11倍质量的酶解液(酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5;上述酶购自河南正兴食品添加剂有限公司),浸泡40min,组织破碎提取3次,每次3分钟,用八层纱布过滤,滤渣加一定量再次提取3次,每次3分钟,如此反复三次。合并3次滤液,用多级闪蒸器浓缩成浸膏。
2.有机溶剂梯度萃取
取55克玫瑰渣浸膏,加350ml水分散,使之比重在1.2左右。超声20分钟助溶,依次用乙酸乙酯,乙酸乙酯:95%乙醇=6:2,进行萃取,萃取结束后,在旋转蒸发仪上旋去水相中的残留的有机溶剂。合并各梯度萃取所得,旋去有机溶剂后,于55℃烘箱里干燥至恒重。乙酸乙酯和乙酸乙酯:95%乙醇=6:2两个萃取部位命名为drfr-a和drfr-b。
3.玫瑰多糖的分离与纯化
将萃取剩下的水相,加适量95%乙醇,使乙醇浓度为85%左右。静置一夜,抽滤得到粗多糖沉淀,命名为drfr-c部位。55℃烘箱干燥至恒重。
4.多糖沉淀后溶液的处理
85%醇沉粗多糖后,对抽滤的溶液进行旋干,于55℃烘箱中干燥至恒重。此部位命名为drfr-d。
5.各部位萃取的平均得率
重复三次,计算各次各部位的得率,算出此萃取方法的平均得率。
6.结果与讨论
6.1玫瑰渣组织破碎提取得膏率
玫瑰渣经多级闪蒸器提取后,得膏852克。得膏率=得膏量/玫瑰渣质量=852/8000=10.65%.
6.2各梯度有机溶剂萃取得率
6.2.1乙酸乙酯萃取部位(drfr-a)得率
表1drfr-a萃取次数与所用溶剂量(ml)
本梯度共萃取9次,第9次,用乙酸乙酯:丙酮:10%甲酸=8:2:0.4作展开剂,tlc检测,三氯化铁显色,第9次时,几乎在薄层板上不显色,表明量已很少,此相萃取结束。合并9次滤液,旋去有机溶剂,55℃烘箱干燥至恒重得乙酸乙酯部位干物质1.4512克。得率为2.697%.
6.2.2乙酸乙酯:95%乙醇=6:2萃取部位(drfr-b)得率
表2drfr-b萃取次数与所用溶剂量(ml)
本梯度共萃取20次,用乙酸乙酯:甲醇:水=5:2:1作为tlc展开剂,三氯化铁显色,检视发现,第20次时,主斑点颜色与第一次比较颜色很淡,几乎无色。标志着此梯度萃取结束。合并20次滤液,旋去有机溶剂,55℃烘箱干燥至恒重时得此部位干物质为5.0413克。得率为9.370%.
6.3玫瑰粗多糖(drfr-c)的分离
80%乙醇沉淀得到的玫瑰粗多糖55℃烘箱干燥至恒重后为7.2859克。得率为13.54%。
6.4萃取各部位的平均得率
表3萃取各部位的平均得率
上表中,对不同浸膏量萃取三次,drfr-a,drfr-b和drfr-c平均得率为4.105%,9.381%和11.782%。
实施例2
一、玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备:取玫瑰花渣,加入11倍质量的酶解液,浸泡55min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr-a和活性部位drfr-b:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.2,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为7:4。
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为85%,静置11小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为70%,静置10小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
二、本发明制备的玫瑰花渣活性部位作为制备没食子酸结晶的应用。
1、没食子酸结晶的制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取3次后,剩下的部分用体积分数为50%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的1/2,移至4℃冰箱内静置12h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为10:7,石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入4ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于17℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为14:3,二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入7ml二氯甲烷-甲醇混合溶剂。
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
实施例3
一、玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备:取玫瑰花渣,加入9倍质量的酶解液,浸泡50min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr-a和活性部位drfr-b:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.2,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为9:2。
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为80%,静置9小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为70%,静置9小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
二、本发明制备的玫瑰花渣活性部位作为制备没食子酸结晶的应用。
1、没食子酸结晶的制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取4次后,剩下的部分用体积分数为55%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的3/8,移至4℃冰箱内静置16h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为6:5,石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入7ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于17℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为17:3,二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入7ml二氯甲烷-甲醇混合溶剂。
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
实施例4
一、玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备:取玫瑰花渣,加入10倍质量的酶解液,浸泡45min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr-a和活性部位drfr-b:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.2,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为5:8。
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为70%,静置10小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为70%,静置10小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
二、本发明制备的玫瑰花渣活性部位作为制备没食子酸结晶的应用。
1、没食子酸结晶的制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取4次后,剩下的部分用体积分数为60%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的5/12,移至4℃冰箱内静置15h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为8:5,石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入6ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于15℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为15:2.5,二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入5ml二氯甲烷-甲醇混合溶剂。
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
实施例5
一、玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备:取玫瑰花渣,加入8倍质量的酶解液,浸泡30min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr-a和活性部位drfr-b:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.0,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为1:10。
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为65%,静置8小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为65%,静置8小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
二、本发明制备的玫瑰花渣活性部位作为制备没食子酸结晶的应用。
1、没食子酸结晶的制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取3次后,剩下的部分用体积分数为50%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的1/2,移至4℃冰箱内静置12h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为1:10,石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入4ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于10℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为10:0.5,二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入4ml二氯甲烷-甲醇混合溶剂。
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
实施例6
一、玫瑰花渣活性部位萃取方法,步骤如下:
(1)玫瑰花渣浸膏的制备:取玫瑰花渣,加入12倍质量的酶解液,浸泡60min,组织破碎法提取3次,每次3分钟,用八层纱布过滤,合并滤液,经多级闪蒸器回收溶剂,浓缩成膏。所述酶解液为2w/v%纤维素酶、1w/v%半纤维素酶、0.5w/v%果胶酶、0.5w/v%离析酶,ph为6.5。
(2)梯度萃取玫瑰花渣浸膏,分离有机相和水相,从有机相得到活性部位drfr-a和活性部位drfr-b:取经步骤(1)得到的玫瑰花渣浸膏,加水制成混悬,使之比重在1.3,分别用乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液进行萃取,萃取结束后,回收有机溶剂,于55℃烘箱里干燥至恒重,将经乙酸乙酯溶液萃取的活性部位命名为drfr-a,经乙酸乙酯-乙醇混合溶液萃取的活性部位命名为drfr-b。所述乙酸乙酯溶液和乙酸乙酯-乙醇混合溶液均采用梯度溶剂量进行萃取;乙酸乙酯:乙醇的体积比为10:1。
(3)从步骤(2)中的水相中分离沉淀、纯化制得活性部位drfr-c:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为85%,静置12小时,经抽滤得到沉淀,于55℃烘箱内干燥至恒重,将沉淀命名为活性部位drfr-c。
(4)对步骤(2)中的水相进行抽滤并回收滤液、纯化制得活性部位drfr-d:将经步骤(2)萃取剩下的水相加入体积分数为95%乙醇,使乙醇的体积分数为85%,静置12小时,经抽滤后,对抽滤的溶液进行旋干,于55℃烘箱里干燥至恒重,将此部位命名为活性部位drfr-d。
二、本发明制备的玫瑰花渣活性部位作为制备没食子酸结晶的应用。
1、没食子酸结晶的制备方法如下:
(1)在drfr-a部位中加入石油醚-乙酸乙酯混合溶剂制得drfr-a混合液,超声萃取5次后,剩下的部分用体积分数为70%的乙醇溶解得混合液ⅱ,浓缩至混合液ⅱ体积的1/3,移至4℃冰箱内静置18h,离心后除去上清液,即得没食子酸粗品;石油醚:乙酸乙酯的体积比为10:1,石油醚-乙酸乙酯混合溶剂的加入量为:以1gdrfr-a部位为基准,加入8ml石油醚-乙酸乙酯混合溶剂;
(2)取步骤(1)制得的没食子酸粗品,用二氯甲烷-甲醇混合溶剂溶解后,于20℃条件下,置于真空箱中,8小时后,收集瓶壁上的针状晶体;二氯甲烷:甲醇的体积比为20:4.5,二氯甲烷-甲醇混合溶剂的加入量:以1g没食子酸粗品为基准,加入8ml二氯甲烷-甲醇混合溶剂。
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸结晶。
效果实施例1:作为抗氧化物的应用鉴定
1.试验材料
1.1原料
实施例1制备的:drfr-a,drfr-b,drfr-c。
1.2试剂
abts,k2s2o8,甲醇,磷酸盐缓冲液,1,1-二苯基-2-三硝基苯肼(dpph),维生素c(纯度99%),水杨酸,无水乙醇等(试剂均为分析纯)。
1.3主要仪器
数显恒温水浴锅,uv-2550紫外分光光度计(日本岛津),phs-25型数显ph计,旋转蒸发仪(re-52系列),高速离心机。
2试验方法
2.1溶液的配制
样品溶液的配制:精密称取drfr-a,drfr-b,drfr-c和vc(阳性对照)各50.0000mg,用少量dmso溶解后,补加超纯水,定容至25ml,使之浓度均为2mg/ml。取96孔板,将2mg/ml的drfr-a,drfr-b,drfr-c和vc用连续稀释法分别稀释至2,1,0.5,0.25,0.125,0.0625,0.03125mg/ml,共八个浓度梯度。
dpph溶液的配制:精密称取5mgdpph于250ml容量瓶中,无水乙醇定容至250ml,使其浓度为0.05mmol/ml。
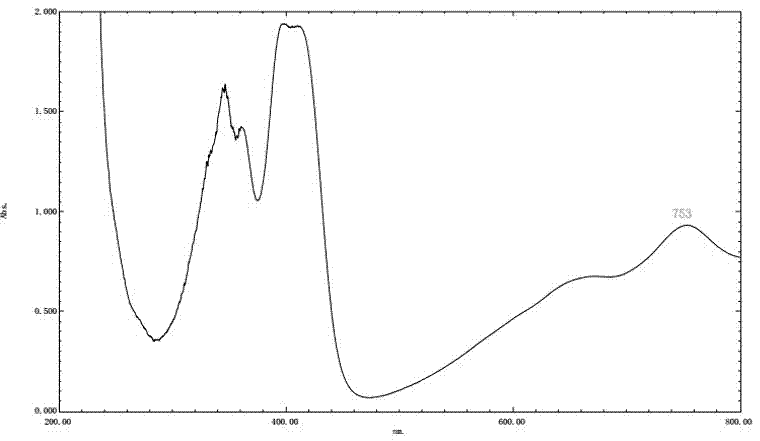
abts溶液的配制:将5ml7mmol/labts和88μl140mmol/l过硫酸钾溶液混合,在室温、避光条件下静置过夜(12h-16h),形成abts+储备液,该储备液在室温、避光的条件下可稳定3h-4h,使用前用磷酸盐缓冲液(10mmol/l,ph7.4)稀释成工作液,要求其在734nm波长下的吸光度为0.70±0.02。
2.2dpph法及最大吸收波长的确定
吸取3mldpph溶液于1cm比色皿中,用无水乙醇做对照,在200~800nm间进行全波长扫描,确定本设备本实验条件下的最大吸收波长为515nm。如图1所示。在确立了最大吸收波长之后,用移液枪吸取0.05mmol/ml的dpph溶液2.906ml于5mlep管中,然后再往每个含有dpph溶液的ep管中精密加入96μl不同浓度梯度的样品,最终,与dpph反应时,样品的终浓度为0.064,0.032,0.016,0.008,0.004,0.002,0.001,0.0005mg/ml。室温下避光静置30min后,在515nm处测量其吸光度as,对照样本用无水乙醇代替提取物,以乙醇为空白样品,测得吸光度a0。以vc为阳性对照,用去离子水配制成与样品同等质量浓度的对照液。蒸馏水做空白对照。各测定三次取平均值,并计算自由基清除率。
对dpph自由基的清除率按下式计算:
ao为空白对照样品的吸光度;as为待测样品的吸光度。
2.3abts法
吸取3mlabts溶液于1cm比色皿中,用超纯水做对照,在200~800nm间进行全波长扫描,确定本设备本实验条件下的最大吸收波长位753nm。如图2所示。用移液枪吸取吸光度为0.7±0.02的abts溶液2.906ml于5mlep管中,然后再往每个含有abts溶液的ep管中精密加入96μl不同浓度梯度的样品,最终,与abts反应时,样品的终浓度为0.064,0.032,0.016,0.008,0.004,0.002,0.001,0.0005mg/ml。准确振荡30s,静置6mim后测753nm波长处的吸光度。以vc为阳性对照,用去离子水配制成与样品同等质量浓度的对照液。蒸馏水做空白对照。各测定三次取平均值,并计算自由基清除率。
对abts的清除率按下式计算:
ao为空白对照样品的吸光度;as为待测样品的吸光。
2.4羟自由基清除实验
按文献方法配制,用移液枪吸取1ml6mmol/l的硫酸亚铁溶液,1ml6mmol/l的水杨酸(用乙醇溶解),1ml6mmol/l的过氧化氢溶液于5mlep管中,37度保温30min后,倒于1cm比色皿中,用超纯水做对照,在200~800nm间进行全波长扫描,确定本设备本实验条件下的最大吸收波长位526nm。如图3所示。然后按上述方法,往每个含有3ml工作液的ep管中精密加入100μl不同浓度梯度的样品,最终反应时,样品的终浓度近似为0.064,0.032,0.016,0.008,0.004,0.002,0.001,0.0005mg/ml。以去离子水为对照,空白组去离子水代替水杨酸,用vc作阳性对照做三次平行实验。37℃水浴30min,在526nm波长下测吸光度。其清除率计算公式为:
其中a0为空白对照的吸光值,ax为加样品的吸光值,ax0为不加显色剂h2o2时的吸光值。
3.实验结果分析
3.1对dpph的清除效果
表4玫瑰渣萃取各部位与vc对dpph的清除能力比较
表4.中drfr-a,drfr-b,drfr-c的ic50值均大于vc的ic50值。说明此三个萃取部位对dpph清除的能力相对弱于vc。它们对dpph清除能力从大到小依次为:vc>drfr-a>drfr-b>drfr-c。从数值上来看,同等浓度的drfr-a与vc对dpph清除能力较为相近。各部位对dpph自由基的清除效果关系如图4所示。它们均有一定的清除dpph自由基的能力。且在实验浓度范围内,各成分随浓度的不断增大,其对dpph自由基的清除效果呈不断增加的趋势。
3.2对abts的清除效果
表5玫瑰渣萃取各部位与vc对abts的清除能力比较
表5中drfr-a,drfr-b,drfr-c的ic50值均大于vc的ic50值。说明此三个萃取部位对abts清除的能力相对弱于vc。它们对abts清除能力从大到小依次为:vc>drfr-a>drfr-b>drfr-c。从数值上来看,同等浓度drfr-a与vc对abts清除能力几乎相当。各部位对abts清除效果关系如图5所示。它们均有一定的清除abts的能力,且在实验浓度范围内,各成分随浓度的不断增大,其对abts的清除效果呈不断增加的趋势。
3.3对羟自由基的清除效果
表6玫瑰渣萃取各部位与vc和羟自由基反应时的吸光度
表6中,理论上随着drfr-a,drfr-b,drfr-c浓度的升高,吸光度的数值应逐渐变小,然后趋于稳定,而本实验中,却出现了吸光度随浓度升高而增大的“反常”趋势,而vc却表现出了正常的趋势,见图6。
观察发现,drfr-a,drfr-b,drfr-c三个部位与羟自由基反应时,产生了蓝黑色的沉淀,并且浓度越高,产生的沉淀越多,从而导致了吸光度逐渐增大的“反常”趋势。经前期预实验,玫瑰渣萃取的三个部位中含有大量的酚类成分,与fe3+反应能产生蓝黑色沉淀,故猜测,本实验中羟自由基生成过程中的fe3+与drfr-a,drfr-b,drfr-c的酚类发生了反应,产生了蓝黑色沉淀,且drfr-b比drfr-a含有更多的酚类物质。
4.结论
实施例1制备的玫瑰渣三个萃取部位(drfr-a,drfr-b,drfr-c)均有一定的抗氧化能力,通过dpph和abts自由基清除实验,以vc为阳性对照,可以得出抗氧化能力vc>drfr-a>drfr-b>drfr-c,其中,在abts自由基清除能力上,vc与drfr-a效果几乎相当。
5.注意事项
(1)abts储备液的配置需遮光静置12h-16h,储备液于-20℃保存。
(2)dpph应现配现用,因其见光受热均易变质。
(3)此实验各步骤均应在避光条件下做。
效果实施例2:抗黑色素功能的鉴定
1.材料与方法
1.1实验材料
实施例1制备的:drfr–a。
1.2试剂
l-dopa,酪氨酸酶(tyrosinase,tyr)(ec.1.14.8.1),磷酸钠盐缓冲液(ph6.8),dmso(分析纯),超纯水,曲酸。
1.3主要仪器
数显恒温水浴锅,酶标仪,旋转蒸发仪(re-52系列),循环水式多用真空泵,高速离心机,精密分析天平,超纯水制备系统。
1.4试剂的配制
磷酸钠缓冲液(1/15m,ph=6.8):精确称取0.5000g磷酸二氢钠,0.5930g磷酸氢二钠,加入少量去离子水溶解后,定容至250ml,4℃冰箱保存备用。
l-dopa溶液(7.5mmol/l):精确称取l-dopa0.074g,加去离子水约25ml,微热完全溶解后,加去离子水定容至50ml。
受试液:精确称取drfr–a0.1001g,分别溶于20mldmso,得到5mg/ml的待测液,再对倍稀释到2.5、1.25、0.625、0.3125mg/ml,共5个浓度梯度。
阳性对照:精确称取0.1001g曲酸粉末,溶于20ml的去离子水中,得到5mg/ml的阳性对照母液,再对倍稀释到2.5mg/ml、1.2500mg/ml、0.6250mg/ml、0.3125mg/ml,共5个浓度梯度。
酪氨酸酶溶液(5×10-6mol/l):精密称取0.0032g酪氨酸酶,加缓冲溶液定容至5ml,使其摩尔浓度为5×10-6mol/l。
1.5酪氨酸酶活性测定
设空白对照组、阳性对照组(曲酸)、drfr-a。总反应体系为300μl。依次在96孔板中加入酪氨酸酶溶液50μl,,磷酸盐缓冲液90μl,受试溶液60μl,l-dopa溶液100μl。在此体系中,受试液(包括阳性对照曲酸)的终浓度梯度为0.0625、0.125、0.25、0.5和1mg/ml。每个样品设3个平行孔,取平均值,重复实验3次。然后将孔板置于微孔板检测系统中(37℃),于475nm时测定波长处的吸光度值,每隔30s测一次吸光度,共测80min。
k是与抑制剂反应的动力学方程斜率,k0是无抑制剂反应的动力学方程斜率。
2.实验结果分析
2.1曲酸抑制酪氨酸酶活性的ic50测定
标准品曲酸抑制酪氨酸酶活性的曲线如图7所示。以曲酸浓度(μg/ml)为横坐标(x),以对酪氨酸酶活性的抑制率为纵坐标(y)进行回归分析,得到回归方程为y=0.204ln(x)+0.147,r2=0.995。
由回归方程计算得到,曲酸抑制酪氨酸酶活性的半抑制浓度(ic50)为5.6μg/ml。
2.2drfr-a抑制酪氨酸酶活性的ic50测定
由图8可知,随着浓度的增加,drfr-a对酪氨酸酶的抑制作用逐渐增强,即抑制率与浓度呈正相关。根据3.4.2的计算方法得到线性方程如图9所示。以样品浓度(mg/ml)为横坐标(x),以对酪氨酸酶活性的抑制率为纵坐标(y)进行回归分析,得到回归方程为y=1.048x3-1.881x2+1.452x+0.291,r2=0.987。
由回归方程计算得到,drfr-a抑制酪氨酸酶活性的半抑制浓度(ic50)为0.2mg/ml。
3.结论
本实验以曲酸为阳性对照,考察了drfr-a部位对酪氨酸酶的抑制活性,结果表明此部位对酪氨酸酶有较强的抑制作用。
效果实施例3:没食子酸结晶纯化
(1)取实施例2制备的:drfr-a部位100g,加入石油醚-乙酸乙酯=4:1的混合溶剂600ml,于超声清洗机中超声提取15min(此步骤主要是除去一些脂溶性杂质,有利于没食子酸的结晶纯化)。共萃取5次,,混合溶剂萃取后剩下的部分用500ml体积分数为60%的甲醇溶解后,于60~70℃水浴条件下处理6小时,此时体积约为250ml,然后移至4℃冰箱内静置12-18h,离心后除去上清液,即得没食子酸粗品55g;
(2)将步骤(1)制得的没食子酸粗品55g用550ml二氯:甲醇=15:1的混合溶剂微热溶解后,于10~20℃条件下,置于真空箱中,8小时后,壁上逐渐长出晶体(约0.5-1cm左右的针状结晶),待溶剂剩余至50ml时,收集瓶壁上的针状晶体,称重约46g;
(3)重复步骤(2)两次,收集瓶壁上无色透明的针状结晶,即得没食子酸纯品结晶30.8g如图11、图12所示。
hplc测定没食子酸方法的建立:色谱条件为:色谱柱:innovationexplorerc18hplccolumn(25cm×4.6mm,5μm);流动相:乙腈-0.1%磷酸=3:97(v/v);温度:30℃;流速:0.8ml/min;检测波长:273nm;进样量:10μl;等度洗脱25min,色谱图如图10所示。
- 还没有人留言评论。精彩留言会获得点赞!