一种轻木‑溶菌酶抗感染敷料及其制备方法与应用与流程
本发明属于药物制备领域,具体地说,涉及一种轻木-溶菌酶抗感染敷料及其制备方法与应用。
背景技术:
对于大面积严重皮肤缺损的病人而言,急需通过各种手段快速有效的封闭创面从而防止细菌入侵,同时防止体液、水电解质和能量的流失。创面敷料可以重建皮肤屏障,加速创面愈合,为后期手术做好准备。理想的创面敷料应该有以下一些特点:良好的力学性能、适当的水气通透性和优异的生物相容性。更为重要的是,感染、炎症反应失调等会引起创面的愈合减慢甚至不愈合,理想的创面敷料还应当能为创面局部提供一个无菌适宜生长的微环境。而天然材料如甲壳素与壳多糖、葡聚糖类、纤维素类、海藻酸盐、蚕丝蛋白等,由于取材方便,具有良好的生物相容性,被认为是用作制备创面敷料的很好的材料。因此,天然材料负载各种抗菌制剂、生长因子或者其他化学物质促进感染性创面的愈合已成为创面修复领域研究的热点及重点。因此,天然材料负载各种抗菌制剂、生长因子或者其他化学物质促进感染性创面的愈合已成为创面修复领域研究的热点及重点。
做为一种可再生资源,木材具有低密度,高模量,高强度,高韧性和导热系数低等特性。而轻木是目前世界上最轻的商品用材,因其溶重最小、材质均匀、导热系数较低、易加工且体积稳定性较好,轻木可以做各种特殊结构物。目前,已有相关研究可对轻木进行去木质素处理,形成透光率既可达到90%,又可保持纤维素结构的新型透明轻型纤维木。若其用于创面敷料基础物,可能具有造价低廉、透气透光性好和常见敷料的相关作用。而溶菌酶是一种小型单体蛋白质,含129个氨基酸残基,具有抗炎、抗病毒、杀菌及抗组胺活性,目前已广泛用于抗菌。但是,革兰阴性杆菌由于存在保护细菌细胞壁的脂多糖成分,游离溶菌酶对其作用有限。且溶菌酶分子结构不稳定,易失活,临床上常将其以微球囊形式或者与其它抗菌剂结合使用。
目前,将溶菌酶与创面敷料相结合已成为一个热门的研究领域,其可有效提高溶菌酶的持续杀菌能力及对革兰阴性杆菌作用。因此,我们特将去木质素轻木与溶菌酶相结合,设计一种新型的经济、高效的抗菌敷料,并研究其体外抗菌活性、细胞增值抑制以及对创面愈合的影响。
技术实现要素:
有鉴于此,本发明针对上述的问题,提供了一种轻木-溶菌酶抗感染敷料及其制备方法与应用,本发明的轻木-溶菌酶抗感染敷料能够快速有效的封闭创面从而防止细菌入侵,同时防止体液、水电解质和能量的流失;还兼具经济性、良好的生物相容性和亲水性。
为了解决上述技术问题,本发明公开了一种轻木-溶菌酶抗感染敷料的制备方法,包括以下步骤:
步骤1、制备去木质素的轻木:选取轻木,用打孔器打孔制成圆片;将圆片进行干燥处理,然后浸泡在naclo2-醋酸盐缓冲液中;将浸泡后的轻木用去离子水小心清洗并进行干燥处理,制备得到去木质素的轻木;
步骤2、多巴胺胶联溶菌酶处理去木质素的轻木:将tris盐酸溶于去离子,再加入多巴胺粉末,配制成tris-多巴胺溶液;然后将去木质素的轻木浸泡在tris-多巴胺溶液中,并在摇床中进行浸泡处理;称取溶菌酶粉剂溶于去离子水,配置成溶菌酶溶液;将浸泡多巴胺后的轻木用去离子水小心清洗,浸泡在溶菌酶溶液中,并在摇床中进行浸泡处理;反应完毕后取出置于室温下无菌保存备用,制备得到轻木-溶菌酶抗感染敷料。
进一步地,所述步骤1中的轻木的密度为150-170kg/m3;圆片的直径为0.6mm,厚度为0.8mm。
进一步地,所述步骤1中的圆片的干燥温度为102-108℃,干燥时间为20-28小时。
进一步地,所述步骤1中的naclo2-醋酸盐缓冲液的质量浓度为0.5%-1.5%,温度为80℃,ph为4.6,浸泡时间为8-16h。
进一步地,所述步骤1中的浸泡后的轻木的干燥条件为:按照乙醇-乙醇混合丙酮(1:1,v/v)-丙酮三步顺序干燥,每步10min,重复三次,乙醇与丙酮的体积比为1:1。
进一步地,所述步骤2中的tris-多巴胺溶液的浓度为1.8-2.2mg/ml,ph为8.4-8.6。
进一步地,所述步骤2中的溶菌酶的浓度为5-20mg/ml。
进一步地,所述步骤2中的摇床的温度为37℃,摇床的转速为80-120r/min,浸泡处理时间为10-15h。
本发明还公开了一种由上述的制备方法制备得到的轻木-溶菌酶抗感染敷料。
本发明还公开了一种上述的轻木-溶菌酶抗感染敷料在制备治疗创面愈合药物中的应用。
与现有技术相比,本发明可以获得包括以下技术效果:
1)本发明的轻木-溶菌酶抗感染敷料能够高效抗菌:常规的溶菌酶对革兰阳性菌的抑制作用已被熟知,其机制在于水解n-乙酰胞壁酸和细菌细胞壁肽聚糖之间的化学键。但是,革兰阴性菌由于细胞壁中脂多糖(lps)的保护作用,杀菌效果有限。本发明中通过多巴胺胶联溶菌酶的形式,将溶菌酶充分的粘附于轻木的多孔径中,提供了一个相对稳定的释放微环境,从而对革兰阴性菌也有一定的杀菌效果。
2)本发明的轻木-溶菌酶抗感染敷料具有高生物相容性:常规的敷料由于来源广泛,大部分长期使用均有一定的生物不相容。但本发明中,去除木质素的轻木,由于来源天然无化学原料及试剂污染,且复合天然溶菌酶和多巴胺(食品安全级标准),不同浓度溶菌酶对细胞基本无增值抑制。
3)本发明的轻木-溶菌酶抗感染敷料具有较好的经济性:轻木来源广泛,价格低廉,且本技术所需的所有原料及试剂,均较易获得,成本较低,适合于烧伤患者的大量应用。
当然,实施本发明的任一产品必不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
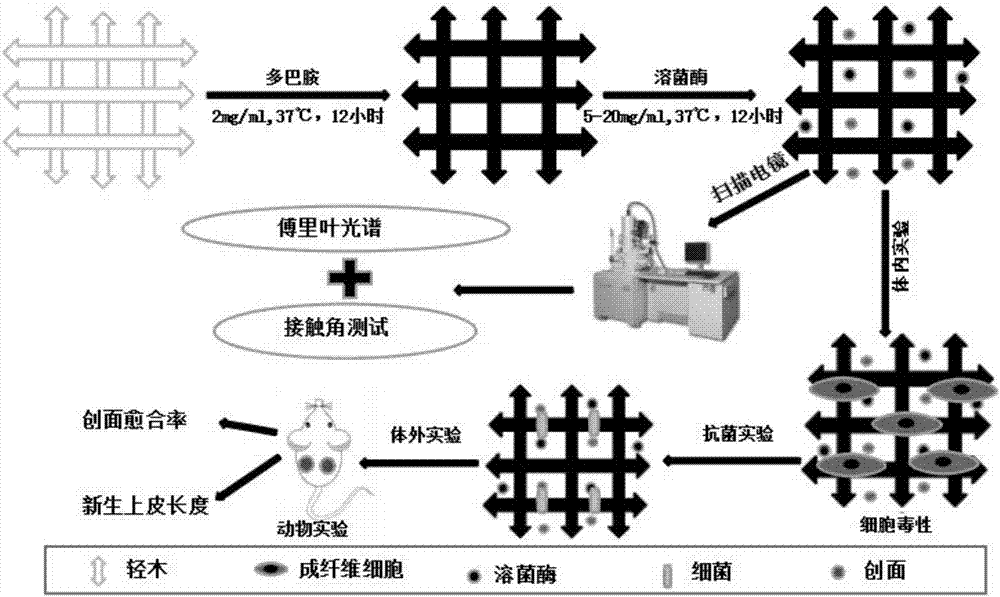
图1是本发明轻木-溶菌酶材料与方法简易图;
图2是本发明a1-a3为经过处理的去木质素轻木组,即空白对照,其中a1(×102倍),a2(×103倍),a3(2×104倍);b组为20mg/ml的轻木-溶菌酶组,其中b1(×102倍),b2(×103倍),b3(2×104倍);
图3是本发明轻木-溶菌酶材料的傅里叶光谱分析;其中,a代表去木质素轻木+多巴胺组,d代表20mg/ml的去木质素轻木-溶菌酶组;
图4是本发明轻木-溶菌酶材料的亲水性分析;a代表去木质素轻木+多巴胺组,d代表20mg/ml的去木质素轻木-溶菌酶组;
图5是本发明不同浓度轻木-溶菌酶敷料对细菌的抑制作用;
图6是本发明不同浓度轻木-溶菌酶敷料对小鼠成纤维细胞增值抑制的od值变化;
图7是本发明不同浓度轻木-溶菌酶敷料对小鼠皮肤缺损模型创面愈合率的影响,其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组,每组中左侧代表直接0.6cm的标准化小圆片,右侧代表小鼠创面面积;
图8是本发明不同浓度轻木-溶菌酶敷料在3天和7天时对小鼠皮肤缺损模型创面愈合率的影响;
图9是本发明不同浓度轻木-溶菌酶敷料对小鼠皮肤缺损模型新生上皮长度的影响的电镜图,其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组;
图10是本发明不同浓度轻木-溶菌酶敷料对小鼠皮肤缺损模型新生上皮长度的影响的柱状图,其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组。
具体实施方式
以下将配合附图及实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
本发明公开了一种轻木-溶菌酶抗感染敷料的制备方法,包括以下步骤:
步骤1、制备去木质素的轻木:选取密度为150-170kg/m3的轻木,用打孔器打孔,制成直径为0.6mm,厚度为0.8mm的圆片;在102-108℃的环境下干燥20-28小时,然后浸泡在质量浓度为0.5%-1.5%的naclo2-醋酸盐缓冲液(ph4.6,80℃)中反应8-16h;将浸泡后的轻木用去离子水小心清洗后按照乙醇-乙醇混合丙酮(1:1,v/v)-丙酮三步顺序干燥,每步10min,重复三次,制备得到去木质素的轻木;
步骤2、多巴胺胶联溶菌酶:将盐酸溶于去离子中,再加入多巴胺粉末,即配制成1.8-2.2mg/ml,ph为8.4-8.6的tris-多巴胺溶液,在该浓度和ph值范围内,多巴胺粘附效能最大化;然后将去木质素的轻木浸泡在多巴胺溶液中10-15h,放置于80-120r/min、37℃摇床中进行浸泡处理。将溶菌酶粉剂溶于去离子水,配置成5-20mg/ml的溶菌酶溶液;将浸泡多巴胺后的轻木用去离子水小心清洗,浸泡在溶菌酶溶液中10-15h,放置于37℃摇床,80-120r/min,反应完毕后取出置于室温下无菌保存备用,制备得到轻木-溶菌酶抗感染敷料。
实施例1
一种轻木-溶菌酶抗感染敷料的制备方法,包括以下步骤:
步骤1、制备去木质素的轻木:选取密度为150kg/m3的轻木,用打孔器打孔,制成直径为0.6mm,厚度为0.8mm的圆片;在105℃的环境下干燥24小时,然后浸泡在质量浓度为1%的naclo2-醋酸盐缓冲液(ph4.6,80℃)中反应12h。将提取样本用去离子水小心清洗后按照乙醇-乙醇丙酮混合物(1:1,v/v)-丙酮三步顺序干燥,每步10min,重复三次,制备得到去木质素的轻木;
步骤2、多巴胺胶联溶菌酶:称取131.14mgtris盐酸溶于100ml去离子,再加入多巴胺粉末200mg,即配制成2mg/ml,ph为8.5的tris-多巴胺溶液。然后将去木质素的轻木浸泡在多巴胺溶液中12h,放置于37℃摇床,100r/min。称取溶菌酶粉剂溶于50ml去离子水,配置成20mg/ml的溶菌酶溶液;将提取样本用去离子水小心清洗,浸泡在溶菌酶溶液中12h,放置于37℃摇床,100r/min,反应完毕后取出置于室温下无菌保存备用,制备得到轻木-溶菌酶抗感染敷料。
实施例2
一种轻木-溶菌酶抗感染敷料的制备方法,包括以下步骤:
步骤1、制备去木质素的轻木:选取密度为170kg/m3的轻木,用打孔器打孔,制成直径为0.6mm,厚度为0.8mm的圆片;在102-108℃的环境下干燥20小时,然后浸泡在质量浓度为1.5%的naclo2-醋酸盐缓冲液(ph4.6,80℃)中反应8h;将提取样本用去离子水小心清洗后按照乙醇-乙醇丙酮混合物(1:1,v/v)-丙酮三步顺序干燥,每步10min,重复三次,制备得到去木质素的轻木;
步骤2、多巴胺胶联溶菌酶:称取tris盐酸溶于去离子,再加入多巴胺粉末,即配制成2.2mg/ml,ph为8.4的tris-多巴胺溶液;然后将去木质素的轻木浸泡在tris-多巴胺溶液中10h,放置于37℃摇床,摇床的转速为120r/min;称取溶菌酶粉剂溶于去离子水,配置成5mg/ml的溶菌酶溶液;将浸泡多巴胺后的轻木用去离子水小心清洗,浸泡在溶菌酶溶液中10h,放置于37℃摇床,摇床的转速为120r/min,反应完毕后取出置于室温下无菌保存备用,制备得到轻木-溶菌酶抗感染敷料。
实施例3
一种轻木-溶菌酶抗感染敷料的制备方法,包括以下步骤:
步骤1、制备去木质素的轻木:选取密度为160kg/m3的轻木,用打孔器打孔,制成直径为0.6mm,厚度为0.8mm的圆片;在102-108℃的环境下干燥28小时,然后浸泡在质量浓度为0.5%的naclo2-醋酸盐缓冲液(ph4.6,80℃)中反应16h;将提取样本用去离子水小心清洗后按照乙醇-乙醇丙酮混合物(1:1,v/v)-丙酮三步顺序干燥,每步10min,重复三次,制备得到去木质素的轻木;
步骤2、多巴胺胶联溶菌酶:称取tris盐酸溶于去离子,再加入多巴胺粉末,即配制成1.8mg/ml,ph为8.6的tris-多巴胺溶液;然后将去木质素的轻木浸泡在tris-多巴胺溶液中15h,放置于37℃摇床,摇床的转速为80r/min;称取溶菌酶粉剂溶于去离子水,配置成15mg/ml的溶菌酶溶液;将浸泡多巴胺后的轻木用去离子水小心清洗,浸泡在溶菌酶溶液中15h,放置于37℃摇床,摇床的转速为80r/min,反应完毕后取出置于室温下无菌保存备用,制备得到轻木-溶菌酶抗感染敷料。
下面结合具体的实验数据来说明本发明的技术效果:
1、材料与方法
1.1扫描电镜观察
将去木质素轻木和浸泡溶菌酶后的轻木材料用去离子水小心清洗,烘干、喷金后,利用扫描电镜真空条件下观察膜的孔径结构并拍照。
1.2拉伸试验
以10%/min的应变速率和25mm的跨度通过使用拉力机约500n的称重传感器。所有样品均控制在24h,50%湿度,气温23℃,每个样品都被切成5mm×60mm条状。
1.3细菌共培养
细菌来源于第三军医大学西南医院全军烧伤研究所冻存staphylococcusaureus(s.aureus)和escherichiacoli(e.coli)菌株,扩增细菌(摇菌过夜)至1*109cfu/ml,用lb培养基稀释菌液为1*104cfu/ml,吸取100ml菌液酶标仪检测od值约0.07即符合标准。取2个96孔板,将各组材料放置孔中,每组3个复孔,每孔加入200ul配制菌液,37℃摇床孵育12h和24h后测各组od值变化,重复三次。
1.4细胞增值抑制
取普通原代新生小鼠,剥离培养原代成纤维细胞,当细胞传至第2和第3代时可使用。细胞计数,按96孔板每孔2000个细胞计算所需要量用dmem培养基配制。将各组材料放置孔中,每组12个复孔(测1,3,5,7日四次),每孔加入150ul配置好的培养基,37℃孵箱放置,重复三次。
1.5小鼠实验
1.5.1实验标本
balb/c小鼠(雄性,体重25g左右)购于第三军医大学动物研究所,共25只,每组5只。动物饲养于spf级饲养间,室温25℃;相对湿度:50%;昼夜节律:12小时。在实验开始前实验小鼠分单笼饲养,并提前适应一周。所有实验操作均遵从第三军医大学实验动物伦理委员会的相关伦理要求。
1.5.2小鼠皮肤全层感染缺损创面模型的制作
实验前一天小鼠1%戊巴比妥钠溶液腹腔注射(70ul/g)后脱毛备皮,并分开单笼饲养。次日,小鼠背部麻醉消毒后,使用打孔器在小鼠背部中下部制备直径约0.6mm的圆形全层皮肤缺损创面,左右对称各一个。将同细菌共培养步骤制备的金葡和大肠杆菌菌液,每孔创面各滴入5ul,细菌浓度均为108个/ml。材料用75%酒精消毒后,pbs缓冲液漂洗以彻底去除酒精,将制备得到的轻木-溶菌酶抗感染敷料贴于创面处,并用粘贴手术巾固定。伤后第0,1,3,5,7天对创面进行拍照,更换新的同种材料。简要方法示意图如图1所示。
1.5.3小鼠创面愈合率及he染色
创面愈合率:原始创面面积以及伤后各个时相点创面面积可通过ipp6.0软件进行测量,即用其aoi功能选定创面,利用“countsize”测量创面像素面积,通过比例尺的换算可得出创面的面积。创面愈合率=(原始创面面积-伤后第n天残余创面面积)/原始创面面积×100%。
he染色:取伤后3天和7天小鼠创面组织标本,制备石蜡切片,并选取高质量图片进行he染色,由不同的病理专家采取盲法的方式测量新生上皮长度。
2.实验结果
2.1电镜观察及拉伸实验
如图2所示,低倍镜下(×102)单纯轻木组基本保留普通木质结构,中倍镜下(×103)可见部分化学物质残留,而高倍镜下(2×104)木质纹理清晰完整;而20mg/ml的轻木-溶菌酶组,低倍镜下(×102)下结构同对照组,中倍镜下(×103)可见较多杂质,而高倍镜下(2×104)可见铺垫的多巴胺层及成球团形溶菌酶。
2.2材料学表征
如图3和图4所示,轻木-溶菌酶具有良好的亲水性,且光谱显示多巴胺和溶菌酶较好的粘附于去木质素轻木上。
2.3细菌共培养
如表1和图5所示,空白对照组12h和24h金葡菌生长基本符合正常趋势,而当溶菌酶浓度逐步升高,对细菌的抑制作用亦逐步增强,且各组间差异有统计学意义(p<0.05);细菌共培养24h时,当溶菌酶浓度逐步升高,对细菌的抑制作用亦逐步增强,且各组间差异有统计学意义(p<0.05);如表2和图5所示,空白对照组12h和24h大肠杆菌生长基本符合正常趋势,而当溶菌酶浓度逐步升高,对细菌的抑制作用亦逐步增强,且各组间差异有统计学意义(p<0.05)。
表1不同浓度轻木-溶菌酶敷料与金黄色葡萄球菌共培养的od值变化
其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组。
表2不同浓度轻木-溶菌酶敷料与大肠杆菌共培养的od值变化
其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组。
2.4细胞增值抑制
由表3和图6可知,1-5天,不同浓度溶菌酶对细胞基本无增值抑制(p>0.05),仅当到第7日时,d组对细胞有轻微增值抑制(p<0.05)。
表3不同浓度轻木-溶菌酶敷料对小鼠成纤维细胞增值抑制的od值变化
其中,control代表单纯去木质素轻木组,a代表去木质素轻木+多巴胺组,b代表5mg/ml的去木质素轻木-溶菌酶组,c代表10mg/ml的去木质素轻木-溶菌酶组,d代表20mg/ml的去木质素轻木-溶菌酶组。
2.5感染创面愈合影响
如图7所示,伤后3天,空白组,a,b,c,d组愈合率分别为17.9%,20.6%,25.8%,30.1%,31.5%;伤后7天创面愈合率分别为30.7%,38.3%,50.7%,61.2%,62.4%。伤后3天、7天c、d组创面愈合率均大于其余三组(p<0.05),c、d组间差异不明显(p>0.05)。
如图8所示,无轻木空白对照,0mg/ml,5mg/ml,10mg/ml,20mg/ml(即control,a,b,c,d组)5组创面1-7天生长状况对比。不同浓度溶菌酶伤后3天、7天c、d组创面愈合率均大于其余三组(p<0.05),c、d组间差异不明显(p>0.05)。
2.6新生上皮影响
如图9所示,伤后3天各组新生上皮长度无差异(p>0.05)。而伤后7天,空白组,a,b,c,d组创面新生上皮长度分别为631.7μm,702.5μm,759.4μm,825.3μm和836.6μm。伤后7天c、d组新生上皮长度均大于其余三组(p<0.05),且c、d组间无差异(p>0.05)。
如图10所示,伤后3天各组新生上皮长度无差异(p>0.05),伤后7天c、d组新生上皮长度均大于其余三组(p<0.05),c、d组间无差异(p>0.05)。
3、总结:
如图2中所示,低倍镜下(×102)单纯轻木组基本保留普通木质结构,中倍镜下(×103)可见部分化学物质残留,考虑为酸碱残留物或轻木本身自带杂质。而高倍镜下(2×104)木质纹理清晰完整;而20mg/ml的轻木-溶菌酶组,低倍镜下(×102)下结构同对照组,中倍镜下(×103)可见较多杂质,而高倍镜下(2×104)可见铺垫的多巴胺层及成球团形溶菌酶,考虑为溶菌酶浓度较一般研究过大,作为晶体成球团形析出沉积于表面。
空白对照组12h和24h金葡菌生长基本符合正常趋势,而当溶菌酶浓度逐步升高,对细菌的抑制作用亦逐步增强,且各组间差异有统计学意义(p<0.05);如表1、表2和图5所示,空白对照组12h和24h大肠杆菌生长基本符合正常趋势,而当溶菌酶浓度逐步升高,对细菌的抑制作用亦逐步增强,且各组间差异有统计学意义(p<0.05)。目前,溶菌酶对革兰阳性菌的抑制作用已被熟知,其机制在于水解n-乙酰胞壁酸和细菌细胞壁肽聚糖之间的化学键,在本研究结果中得到验证。但是,革兰阴性菌由于细胞壁中脂多糖(lps)的保护作用,杀菌效果有限。近年来,有很多研究将溶菌酶制备成微胶囊,纳米粒子,颗粒珠等形式,再结合不同材料以提高其稳定性及其对革兰阴性菌的杀菌效果。本发明中通过多巴胺胶联溶菌酶的形式,将溶菌酶充分的粘附于轻木的多孔径中,提供了一个相对稳定的释放微环境,从而对革兰阴性菌也有一定的杀菌效果。而由细胞毒性来看(表3,图6),不同浓度溶菌酶对细胞基本无增值抑制,仅当到第7日时d组对细胞有轻微增值抑制。这可能与溶菌酶来源于蛋清,是一种天然,安全的酶类有关。
由于烧伤患者体内和体表的防御屏障均遭到破坏,机体免疫能力显著下降,广泛组织坏死、体内外菌群的侵袭等均会导致患者发生创面感染。创面感染是烧伤患者最主要的并发症和死亡原因之一,约52%-70%烧伤患者因创面感染而死亡。本发明特采用较为成熟的小鼠创面感染模型,即混合滴入烧伤感染创面常见的革兰阳性菌金黄色葡萄球菌和革兰阴性菌大肠杆菌,细菌浓度均为108个/ml。伤后3天,空白组,a,b,c,d组愈合率分别为17.9%,20.6%,25.8%,30.1%,31.5%;伤后7天创面愈合率分别为30.7%,38.3%,50.7%,61.2%,62.4%。伤后3天、7天c、d组创面愈合率均大于其余三组,c、d组间差异不明显。说明随着溶菌酶浓度的增大,其抗感染效果越明显,但当浓度达到一定水平(10-20mg/ml)时,细菌生长受到最大化抑制,从而感染控制效果不变。而创面愈合的进程包含两部分,即创面收缩和创面的上皮化,对于紧致型皮肤的物种而言(例如人类),创面愈合主要靠创面的再上皮化完成。伤后3天各组新生上皮长度无差异,这主要是因为伤后3天创缘表皮仍主要处于细胞增殖和迁移的准备期,新生上皮并不明显。而伤后7天,空白组,a,b,c,d组创面新生上皮长度分别为631.7μm,702.5μm,759.4μm,825.3μm和836.6μm。伤后7天c、d组新生上皮长度均大于其余三组(p<0.05),且c、d组间无差异(p>0.05)。以上结果提示了在伤后晚期(伤后7天),高浓度溶菌酶可通过控制感染,显著的促进创面的再上皮化从而加速创面的愈合。
总而言之,本发明成功制备了不同浓度的轻木-溶菌酶天然抗感染敷料,且浓度达到10-20mg/ml时,材料抗菌效果较好,亦能促进创面愈合,但需注意其高浓度下的长期细胞增值抑制,从而为天然敷料的创面应用提供新的手段和思路。
如在说明书及权利要求当中使用了某些词汇来指称特定成分或方法。本领域技术人员应可理解,不同地区可能会用不同名词来称呼同一个成分。本说明书及权利要求并不以名称的差异来作为区分成分的方式。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明本发明的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!