一种牛多杀性巴氏杆菌病二价灭活疫苗及其制备方法与流程
本发明属于兽用生物制品
技术领域:
,具体涉及一种牛多杀性巴氏杆菌病二价灭活疫苗。
背景技术:
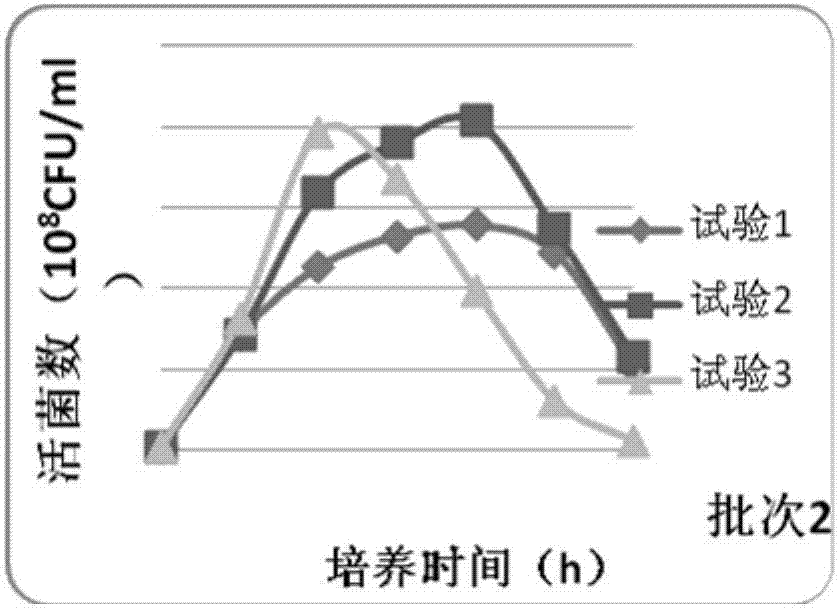
:牛多杀性巴氏杆菌病是由牛多杀性巴氏杆菌感染牛引起的传染病。目前我国流行的牛多杀性巴氏杆菌病主要分为两种,一种是由牛多杀性巴氏杆菌荚膜a型菌引起的牛纤维素性化脓性肺炎,另一种是由牛多杀性巴氏杆菌荚膜b型菌引起的牛出血性败血症。其中牛纤维素性化脓性肺炎是严重侵害牛呼吸系统的疾病,健康牛混群后经长途运输等应激条件刺激下,发病率最高可达100%、死亡率可达40%。该病在我国属于新发传染病,近年已经蔓延至我国所有省份的主要养牛地区,成为了严重危害我国养牛产业的疾病之一。牛出血性败血症是以高热、肺炎、急性胃肠炎以及内脏器官广泛出血为特征的传染病,在我国已有几十年的流行历史,目前仍在多地呈散发或地方性流行。使用疫苗进行免疫接种是预防牛多杀性巴氏杆菌病的主要措施。但我国现有的牛多杀性巴氏杆菌灭活疫苗(简称b型菌单苗)只能预防牛巴氏杆菌荚膜b型菌引起的牛出血性败血症,针对预防牛多杀性巴氏杆菌荚膜a型菌引起的牛纤维素性化脓性肺炎尚无疫苗可用。现有的b型菌单苗系用免疫原性良好的荚膜b型多杀性巴氏杆菌c45-2株(cvcc44502)、c46-2株(cvcc44602)、c47-2株(cvcc44702),根据需要可任选1-3株接种适应培养基培养,将培养物经甲醛溶液灭活后,加氢氧化铝胶制成;该疫苗采用肌肉或皮下注射,针对体重为100kg以下的牛,注射剂量为4ml,针对体重为100kg以上的牛,注射剂量为6ml。由此可见,b型菌单苗选择c45-2株、c46-2株、c47-2株共三株菌用于疫苗制备,在生产过程中,一级种子和二级种子的培养需分别进行培养,无疑增加了操作工艺,且较多的工序不利于控制疫苗批间差异。另外,因为注射剂量(4ml-6ml)较大,在临床规模化养殖场使用中,使得操作不方便且增加了操作时间;同时生产厂家在装量上,装同样头份数的疫苗需要更大的疫苗瓶才能满足,由此增加了包装成本。b型菌单苗能有效预防牛出血性败血症,但近二十年的临床运用中,有相关文章报道和个别客户实际反馈,b型菌单苗注射牛后,存在一定的副反应,严重情况下能导致牛的死亡;因此b型菌单苗的安全性有待进一步的提高。目前我国无商品化针对预防牛多杀性巴氏杆菌荚膜a型菌引起的牛纤维素性化脓性肺炎的疫苗。2006年,自我国爆发牛纤维素性化脓性肺炎疫情以来,中国农业科学院哈尔滨兽医研究所成功分离鉴定出了引起该疾病的病原:牛多杀性巴氏杆菌荚膜a型菌(微生物保藏号:cgmccno.3619),并于2010年2月申请了专利《牛源荚膜a型多杀性巴氏杆菌及其分离鉴定和应用》(专利申请号cn201010115552.9)。该专利描述了将a型菌经bhi培养后,采用油佐剂制备为灭活疫苗,并通过小鼠模型证明能对a型菌强毒攻击提供完全保护,并与b型菌无交叉保护。鉴于多杀性巴氏杆菌不同血清型之间交叉免疫力差,现有商品化的产品无法有效防控荚膜a型菌引起的牛纤维素性化脓性肺炎,给牛多杀性巴氏杆菌病的防控带来了极大困难。因此,最好的方法是制备牛多杀性巴氏杆菌病二价疫苗,才能获得最佳的预防效果。技术实现要素:为了解决现有技术中存在的问题,本发明的目的是提供一种牛多杀性巴氏杆菌病二价灭活疫苗。为了实现本发明目的,本发明的技术方案如下:一种牛多杀性巴氏杆菌病二价灭活疫苗,含有抗原和佐剂,抗原为牛多杀性巴氏杆菌荚膜a型pm-tj株和牛多杀性巴氏杆菌荚膜b型c45-2株,所述牛多杀性巴氏杆菌荚膜a型pm-tj株的保藏编号为cgmccno.3619,牛多杀性巴氏杆菌荚膜b型c45-2株的保藏编号为cvcc44502。所述佐剂为氢氧化铝胶。本发明的牛多杀性巴氏杆菌病二价灭活疫苗中,牛多杀性巴氏杆菌荚膜a型pm-tj株的有效含量为2.0-10.0×109cfu/ml;牛多杀性巴氏杆菌荚膜b型c45-2株的有效含量为2.0-10.0×109cfu/ml。优选地,牛多杀性巴氏杆菌荚膜a型pm-tj株的有效含量为6.0×109cfu/ml;牛多杀性巴氏杆菌荚膜b型c45-2株的有效含量为4.0×109cfu/ml。本发明提供了上述牛多杀性巴氏杆菌病二价灭活疫苗的制备方法,包括以下步骤:(1)牛多杀性巴氏杆菌荚膜a型pm-tj株和牛多杀性巴氏杆菌荚膜b型c45-2株分别进行发酵培养;(2)两个菌株的发酵菌液经离心或中空纤维浓缩纯化,灭活;(3)灭活后的两个菌液,按照体积比2:1混合,加入佐剂,充分混合,加入硫柳汞溶液,使其终浓度为0.005%,且疫苗中两种抗原的含量均不低于2.0×109cfu/ml。本发明的制备方法中,步骤(1)中牛多杀性巴氏杆菌荚膜a型pm-tj株的发酵培养方法为:将pm-tj株菌以1-2%接种量接种于制苗用脑心浸液培养基,35-37℃采用逐渐增大通气量的方法培养6-10小时,具体为0-3小时通气量为0.1m3/h/10l,3-6小时通气量为0.3m3/h/10l,6小时后通气量为0.5m3/h/10l,且最大通气量不超过0.5m3/h/10l。步骤(1)中牛多杀性巴氏杆菌荚膜b型c45-2株的的发酵培养方法为:将c45-2株菌以1%-2%接种量接种于制苗用含0.1%裂解血球全血的马丁肉汤培养基,35-37℃采用逐渐增大通气量的条件培养6-10小时,即0-3小时通气量为0.1m3/h/10l,3-6小时通气量为0.3m3/h/10l,6小时后通气量为0.5m3/h/10l,且最大通气量分别不超过0.5m3/h/10l。步骤(1)中两种菌发酵培养过程中均以不搅拌的方式进行培养。步骤(2)的离心方法为维持菌液流速为2000-3000ml/min,8000-12000r/min连续流离心,收集菌泥沉淀,并用ph7.2-7.4的无菌pbs重悬,制成10倍浓缩菌液。步骤(2)的离心方法为维持菌液流速为2500ml/min,10000r/min连续流离心,收集菌泥沉淀,并用ph7.2-7.4的无菌pbs重悬,制成10倍浓缩菌液。步骤(2)的中空纤维浓缩纯化方法为以0.22μm孔径中空纤维进行浓缩,压力控制在0.03mpa以内,维持流速不超过300ml/min以内,使其浓缩为原倍菌液的1/10。本发明还提供了小鼠在上述牛多杀性巴氏杆菌病二价灭活疫苗的效力检验中的应用。本发明建立的用小鼠对本发明牛多杀性巴氏杆菌病二价灭活疫苗进行效力检验方法为:用体重18~22g小鼠5只,分别肌肉注射疫苗50μl,21日后,连同条件相同的对照鼠5只,各腹腔注射1.0×104mld的牛多杀性巴氏杆菌pm-tj株强毒菌液,观察7日;对照组全部死亡,免疫组应至少4只保护。本发明还提供了兔在上述牛多杀性巴氏杆菌病二价灭活疫苗的效力检验中的应用。本发明建立的用兔对本发明牛多杀性巴氏杆菌病二价灭活疫苗进行效力检验方法为:用体重1.5~2.0kg兔5只,各肌肉或皮下注射疫苗0.5ml,21日后,连同条件相同的对照兔5只,各皮下注射1mld牛多杀性巴氏杆菌c45-2株强毒菌液,观察8日。对照组全部死亡,免疫组应至少3只保护。本发明的有益效果在于:(1)本发明的二价灭活苗对目前我国流行的牛纤维素性化脓性肺炎和牛出血性败血症能提供良好的免疫保护效力。可通过一针免疫牛,同时预防牛纤维素性化脓性肺炎和牛出血性败血症两种疾病、疫苗安全性好,免疫效果稳定,免疫持续期长。(2)本二价灭活疫苗的注射剂量为2ml,与传统的b型菌单苗注射剂量4-6ml相比,极大的提高了临床注射操作便利性,和提高了疫苗包装利用率。(3)本发明二价灭活疫苗在制备过程中采用离心或中空纤维的浓缩纯化方式,能有效去细菌碎片、培养基等杂质成份,以及降低细菌外毒素含量,从而有效降低了副反应,安全性良好,未出现由疫苗引起的任何局部或全身不良反应。(4)本发明选择c45-2作为牛巴氏杆菌荚膜b型菌抗原,相对传统的b型菌单苗(采用c45-2株、c46-2株、c47-2株作为抗原)简便了疫苗生产工艺,降低了疫苗工艺操作复杂程度。(5)本二价灭活疫苗在生产过程中,针对b型菌的发酵培养工艺进行了优化,通过在发酵过程中逐渐增大通气量为0-3小时通气量为0.1m3/h/10l,3-6小时通气量为0.3m3/h/10l,6小时后通气量为0.5m3/h/10l,且最大通气量不超过0.5m3/h/10l的方式,培养时间较b型菌单苗的发酵时间12-24小时大幅缩短至6-10小时,大大提高了生产效率。(6)本发明在二价灭活疫苗在效力检验中建立小鼠与牛、兔与牛的效力检验平行关系模型,因此效力检验采用小鼠和兔即可替代本动物牛的效力检验,维护了动物福利,以及极大程度地节省了人力、物力和财力。附图说明图1a-图1c为不同批次不同通气条件下牛多杀性巴氏杆菌荚膜a型pm-tj株生长曲线。图2a-图2c为不同批次不同通气条件下牛多杀性巴氏杆菌荚膜b型c45-2株生长曲线。具体实施方式下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。实施例中所使用实验方法如无特殊说明,均为常规方法。实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。制造用菌种牛多杀性巴氏杆菌荚膜a型pm-tj株由中国农业科学院哈尔滨兽医研究所提供,保藏编号为cgmccno.3619。牛多杀性巴氏杆菌荚膜b型c45-2株由中牧实业股份有限公司兰州生物药厂提供,保藏编号cvcc44502。制苗用其他仪器、试剂均由中牧实业股份有限公司兰州生物药厂提供。脑心浸液培养基(bhi)、马丁肉汤,均购自北京奥博星生物技术有限责任公司。中空纤维,购自北京旭邦膜设备责任有限公司,孔径大小0.22μm。管式离心机,购自辽阳阳光制药机械有限公司。实施例1牛多杀性巴氏杆菌病二价灭活疫苗的制备1、培养基脑心浸液培养基(bhi)配制:称取37gbhi粉末加入1000ml蒸馏水中,充分混匀后,121℃灭菌15分钟。马丁肉汤培养基配制:称取50g马丁肉汤培养基粉末加入1000ml蒸馏水中,充分混匀后,121℃灭菌15分钟,灭菌后按照培养基体积加入0.1%裂解血球全血。脑心浸液琼脂培养基配制:称取37gbhi粉末和15g琼脂粉加入1000ml蒸馏水中,充分混匀后,121℃灭菌15分钟,冷却至50℃~60℃时,倾倒平板备用。马丁肉汤琼脂培养基配制:称取50g马丁肉汤培养基粉末和15g琼脂粉加入1000ml蒸馏水中,充分混匀后,121℃灭菌15分钟,冷却至50℃~60℃时,按照培养基体积加入0.1%裂解血球全血和4%健康动物血清,充分混匀后倾倒平板备用。2方法2.1牛多杀性巴氏杆菌荚膜a型pm-tj株抗原的制备一级种子繁殖与鉴定将pm-tj株冻干菌种接种于脑心浸液培养基,置37℃、75r/min,培养8~12小时,然后划线接种于脑心浸液琼脂平板,37℃培养16~22小时,挑选5~10个典型菌落,分别接种脑心浸液琼脂斜面若干支,37℃培养24小时,作为一级种子。在2~8℃保存,使用期不超过20日。二级种子繁殖与鉴定取一级种子接种于脑心浸液培养基,置37℃、75r/min,培养8~12小时,经纯粹检验合格后,置2~8℃保存,使用期不超过7日。制苗用抗原制备:菌液培养采用微生物发酵罐培养多杀性巴氏杆菌菌液。将脑心浸液培养基及适量消泡剂装入发酵罐中,121℃灭菌30分钟,待培养基温度冷却至37℃左右时,按培养基总量的1%~2%加入二级种子液,混合均匀,在37℃通气培养,其中为0-3小时通气量为0.1m3/h/10l,3-6小时通气量为0.3m3/h/10l,6小时后通气量为0.5m3/h/10l,且最大通气量不超过0.5m3/h/10l,培养时间为6~10小时。纯粹检验与活菌计数菌液培养完成后,取样按2010版《中国兽药典》附录进行纯粹检验,应纯粹;同时取样进行活菌计数。菌液浓缩将菌液用离心机离心或中空纤维进行浓缩,浓缩菌液用pbs(ph值7.2~7.4)重悬制成菌悬液。灭活按浓缩菌液量的0.1%~0.15%加入甲醛溶液,37℃灭活7~12小时,期间搅拌数次。灭活检验按2010版《中国兽药典》附录进行灭活检验,应无菌生长。2.2牛多杀性巴氏杆菌荚膜b型c45-2株抗原的制备一级种子繁殖与鉴定将牛多杀性巴氏杆菌c45-2株冻干菌种接种于含0.1%裂解血球全血的马丁肉汤中,37℃培养8~12小时,然后划线接种于含0.1%裂解血球全血和4%健康动物血清的马丁琼脂平板,37℃培养16~22小时,挑选5~10个典型菌落,接种鲜血琼脂斜面若干支,37℃培养24小时,作为一级种子。在2~8℃保存,使用期不超过20日。二级种子繁殖与鉴定取一级种子接种于含0.1%裂解血球全血的马丁肉汤中,37℃培养8~12小时后,取样经纯粹检验合格后,置2~8℃保存,使用期不超过7日。制苗用抗原制备:菌液培养采用微生物发酵罐培养牛多杀性巴氏杆菌菌液。将马丁肉汤培养基及适量消泡剂装入发酵罐中,121℃灭菌30分钟,待培养基温度冷却至37℃左右时,按0.1%加入裂解血球全血,按培养基总量的1%~2%加入二级种子液,混合均匀,37℃通气培养,其中0-3小时通气量维持在0.1m3/h/10l,3-6小时通气量维持在0.3m3/h/10l,6小时后通气量维持在0.5m3/h/10l,培养时间为6~10小时。纯粹检验与活菌计数菌液培养完成后,取样按2010版《中国兽药典》附录进行纯粹检验,应纯粹;同时取样进行活菌计数。菌液浓缩将菌液用离心机离心或中空纤维进行浓缩,浓缩菌液用pbs(ph值7.2~7.4)重悬制成菌悬液。灭活按浓缩菌液量的0.1%~0.15%加入甲醛溶液,37℃灭活7~12小时,期间搅拌数次。灭活检验按2010版《中国兽药典》附录进行灭活检验,应无菌生长。2.3疫苗配苗在乳化罐中按牛多杀性巴氏杆菌荚膜a型pm-tj株抗原与牛多杀性巴氏杆菌荚膜b型c45-2株抗原体积2:1的比例先加两株抗原液,低速搅拌5分钟,再按1份佐剂5份抗原体积比例缓慢加入氢氧化铝胶佐剂,充分搅拌15~20分钟,使其充分混合,再加入1%硫柳汞溶液,使其终浓度为0.005%,充分搅拌。最终疫苗中含两株抗原均不低于2.0×109cfu/ml。2.4半成品检验按2010版《中国兽药典》附录进行无菌检验,应无菌生长。2.5分装经无菌检验合格后,定量分装,分装期间应随时搅拌,使其混合均匀,加塞密封,并粘贴标签。置2~8℃保存。实施例2本发明制备的疫苗的安全性试验1材料1.1实施例1的方法制得的疫苗牛多杀性巴氏杆菌病二价灭活疫苗(a型pm-tj株+b型c45-2株)。批号分别为zm201401、zm201402、zm201403。1.2试验动物健康易感牛,3月龄及以上。2方法2.1对靶动物一次单剂量接种的安全性试验将12头试验牛随机分组,每组4头,将3个批次的疫苗分别以一次单剂量2.0ml(1头份)通过颈部肌肉接种一组试验牛,另设条件相同的3头试验牛,按照相同的方法接种灭菌pbs作为对照。观察试验牛临床表现,并于每日同一时间测量体温,观察14日。2.2对靶动物单剂量重复接种的安全性试验将12头试验牛随机分组,每组4头,将3个批次的疫苗分别以一次单剂量2.0ml(1头份)通过颈部肌肉接种一组试验牛,另设条件相同的3头试验牛,按照相同的方法接种灭菌pbs作为对照。首次接种后14日,采用相同的方式再接种一次。重复接种后观察试验牛临床表现,并于每日同一时间测量体温,观察14日。2.3对靶动物一次超剂量接种的安全性试验将12头试验牛随机分组,每组4头;将3个批次的疫苗分别以一次超剂量4.0ml(2头份)通过颈部肌肉接种一组试验牛,另设条件相同的3头试验牛,按照相同的方法接种灭菌pbs作为对照。接种后观察试验牛临床表现,并于每日同一时间测量体温,观察14日。3结果3.1对靶动物一次单剂量接种的安全性试验结果疫苗以一次单剂量接种后,观察期内试验牛的体温、呼吸情况、精神状态、食欲等均正常,注射部位未见红肿和结节形成,试验牛未出现牛多杀性巴氏杆菌病临床症状,与对照组没有明显差异。结果见表1。表1对靶动物一次单剂量接种的安全性试验结果3.2对靶动物单剂量重复接种的安全性试验结果疫苗以单剂量重复接种后,观察期内试验牛的体温、呼吸情况、精神状态、食欲等均正常,注射部位未见红肿和结节形成,试验牛未出现牛多杀性巴氏杆菌病临床症状,与对照组没有明显差异。结果见表2。表2对靶动物单剂量重复接种的安全性试验结果3.3对靶动物一次超剂量接种的安全性试验结果疫苗以一次超剂量接种后,观察期内试验牛的体温、呼吸情况、精神状态、食欲等均正常,注射部位未见红肿和结节形成,试验牛未出现牛多杀性巴氏杆菌病临床症状,与对照组没有明显差异。结果见表3。表3对靶动物一次超剂量接种的安全性试验结果4结论通过对3批本制品进行靶动物的一次单剂量接种试验、单剂量重复接种试验和一次超剂量接种试验,试验动物体温、呼吸情况、精神状态、食欲等均正常,注射部位未见红肿和结节形成,未出现牛多杀性巴氏杆菌病临床症状,与对照组无明显差别。以上结果说明本制品对牛是安全的。实施例3本发明制备的疫苗的效力试验1材料1.1实施例1方法制得的疫苗牛多杀性巴氏杆菌病二价灭活疫苗(a型pm-tj株+b型c45-2株)。批号分别为zm201401、zm201402、zm201403。牛多杀性巴氏杆菌病灭活疫苗(b型菌单苗,c45-2株、c46-2株、c47-2株均含有)批号为1407001。1.2试验动物健康易感牛,6月龄及以上。2方法将本发明制备的3批疫苗以1头份(2.0ml)剂量各肌肉接种8头试验牛,将市售的牛多杀性巴氏杆菌病灭活疫苗(b型菌单苗)以1头份(4.0ml)剂量肌肉接种4头试验牛,另外设置6头未免疫牛作对照。接种后21日,将每批本发明疫苗免疫组8头牛中的4头及6头对照牛中的3头进行a型菌攻毒,即每头牛各气管滴注2mid的pm-tj株菌液,观察10日,观察牛临床症状,每日同一时间记录体温;攻毒后第10日,对免疫牛及对照牛剖检,观察并记录肺部病理变化,分析判定牛的发病和保护情况;将每批本发明疫苗免疫8头牛中的另外4头、单苗免疫的4头牛以及剩余的3头对照牛进行b型菌攻毒,即每头牛各肌肉注射10mld的c45-2株强毒菌液。观察14日,记录牛的死亡情况。3结果本疫苗制品免疫牛后21日进行攻毒,攻毒的保护结果见表4和表5。从表4可见,a型菌攻毒后,本发明制备的3批疫苗免疫组均在3/4及以上保护,非免疫对照组全部发病(3/3);从表5可见,b型菌攻毒后,本发明制备的3批疫苗免疫组均在3/4及以上保护,单苗免疫组为3/4保护,非免疫对照组全部死亡(3/3)。表4本发明二价疫苗免疫牛后a型菌攻毒的保护结果注:“-”表示该项未出现对应的症状,“+”表示该项出现对应的症状。表5本发明二价疫苗免疫牛后b型菌攻毒的保护结果4结论应用本发明制备的3批疫苗接种牛后,均能使免疫牛获得对强毒攻击的有效保护,且保护效果不低于同类产品的单苗,表明本发明制备的疫苗对牛具有良好的免疫保护力。实施例4本发明制备的疫苗大规模培养与浓缩纯化工艺研究1、通气量试验1.1牛多杀性巴氏杆菌荚膜a型pm-tj株将pm-tj株菌以2%接种量接种于3批装有制苗用脑心浸液培养基的20l反应器,每批培养基装量为1.5万毫升,37℃采用逐渐增大通气量的方法培养14小时,且最大通气量分别不超过0.3、0.5、0.75m3/h/10l,通气量调节方法见表6。在培养时间达到4、6、8、10、12、14小时分别取样进行纯粹检验及活菌计数,并绘制生长曲线。每种培养条件分别培养3批。表6pm-tj株菌培养试验通气量调节方法1.2牛多杀性巴氏杆菌荚膜b型c45-2株将c45-2株菌以2%接种量接种于3批装有制苗用马丁肉汤培养基(含0.1%裂解血球全血)的20l反应器,每批培养基装量为1.5万毫升,37℃采用逐渐增大通气量的条件培养14小时,且最大通气量分别不超过0.3、0.5、0.75m3/h/10l,通气量调节方法见表7。在培养时间达到4、6、8、10、12、14小时取样进行纯粹检验及活菌计数,并绘制生长曲线。每种培养条件分别培养3批。表7c45-2株菌培养试验通气量调节方法2、搅拌转速试验2.1牛多杀性巴氏杆菌荚膜a型pm-tj株将pm-tj株菌以2%接种量接种于3批装有制苗用脑心浸液培养基的20l反应器,每批培养基装量为1.5万毫升,采用1.1项试验获得的最佳通气条件,在37℃条件下分别采用0、75、150r/min的搅拌转速进行培养,培养8小时后取样进行纯粹检验及活菌计数。每种培养条件分别培养3批。2.2牛多杀性巴氏杆菌荚膜b型c45-2株将c45-2株2%接种量接种于3批装有制苗用马丁肉汤培养基(含0.1%裂解血球全血)的20l反应器,每批培养基装量为1.5万毫升,采用1.2项试验获得的最佳通气条件,在37℃条件下分别采用0、75、150r/min的搅拌转速进行培养,培养8小时后取样进行纯粹检验及活菌计数。每种培养条件分别培养3批。2.3浓缩纯化工艺研究2.3.1离心浓缩纯化法各取3批扩大培养的pm-tj株和c45-2株菌液,每批10万毫升;维持菌液流速为2500ml/min,10000r/min连续流离心,收集菌泥沉淀,并用无菌pbs重悬,制成10倍浓缩菌液,对浓缩菌液进行活菌计数。2.3.2中空纤维浓缩纯化法各取3批pm-tj株和c45-2株菌液,每批10万毫升。将菌液注入浓缩罐中,以0.22μm孔径中空纤维进行浓缩,压力控制在0.03mpa以内,维持流速300ml/min以内,使其浓缩为原倍菌液的1/10,收集浓缩菌液并取样进行活菌计数。3结果3.1通气量试验牛多杀性巴氏杆菌荚膜a型和b型菌在不同通气条件下培养,收获各培养时间点的菌液进行纯粹检验,结果显示均纯粹,对活菌计数的结果分别见表8和表9,并根据计数结果绘制细菌生长曲线,结果分别如图1a-图1c和图2a-图2c所示。表8a型菌pm-tj株在不同通气条件下各时间点菌液的活菌计数结果表9b型菌c45-2株在不同通气条件下各时间点菌液的活菌计数结果从表8、9和图1a-图1c和图2a-图2c可以看出,试验1组细菌活菌数达到峰值时间最晚,且细菌最大活菌数最低;试验3组细菌活菌数达到峰值时间最早,但是细菌处于稳定期时间较短,在生产中把握收获时间较为困难;试验2组细菌活菌数达到峰值时间介于试验1组和试验3组之间,细菌最大活菌数高于试验1组,并与试验3组相当;因此,为适应工业化生产,确定将试验2组通气条件作为a型菌pm-tj株和b型菌c45-2株的大规模培养条件,即在逐渐增大通气量至0.5m3/h/10l条件下,37℃培养6~10小时收获菌液。3.2搅拌转速试验获得a型菌和b型菌通气培养条件后,采用逐渐增大通气量至0.5m3/h/10l培养条件,对a型菌和b型菌在不同搅拌转速下培养8小时,收获各批次菌液进行纯粹检验,结果显示均纯粹,对活菌计数的结果如表10和表11所示。从表10和表11可以看出,a型菌和b型菌在通气培养条件下,采用不搅拌及不同搅拌转速(75r/min和150r/min)方式下培养,收获的菌液浓度没有明显差异。为避免搅拌产生的剪切力对细菌造成损伤,因此a型菌和b型菌的规模化生产选择以不搅拌的方式进行培养。表10a型菌pm-tj株在不同搅拌转速下收获的菌液活菌计数结果表11b型菌c45-2株在不同搅拌转速下收获的菌液活菌计数结果3.2浓缩纯化试验结果将3批菌液通过离心方法和中空纤维方法进行10倍浓缩,浓缩后菌液活菌计数结果如表12和表13所示,中空纤维浓缩后的细菌浓度略高于离心浓缩方法,但均符合制苗要求。因此,根据工厂条件,可选择离心或中空纤维对a型菌和b型菌进行浓缩纯化用于疫苗的制备。表12a型菌在不同浓缩纯化条件下的细菌计数结果(×108cfu/ml)批次浓缩前离心浓缩(10倍)中空纤维浓缩(10倍)145.5348353232.8265272341.2302321表13b型菌在不同浓缩纯化条件下的细菌计数结果(×108cfu/ml)批次浓缩前离心浓缩(10倍)中空纤维浓缩(10倍)142.9347364247.3361372354.53954124结论通过大规模培养工艺研究,确定了牛多杀性巴氏杆菌a型菌pm-tj株和b型菌c45-2株培养工艺的最佳培养条件:在37℃培养温度下,接种量为1%~2%;通气方法为先以小通气量培养,再逐渐增大通气量的方式进行a型菌及b型菌的培养,并且最大通气量不宜超过0.5m3/h/10l;最佳培养时间为6~10小时。该结果在b型菌的培养时间上将现有b型菌单苗中的培养时间(12~24小时)缩短至6~10小时。通过浓缩纯化工艺研究,确定了菌液采用离心或中空纤维的方法进行浓缩纯化,以用于后续的灭活与配苗。实施例5本发明制备的疫苗与同类产品的比较试验1材料1.1疫苗由实施例1方法制备的牛多杀性巴氏杆菌病二价灭活疫苗(a型pm-tj株+b型c45-2株),批号为zm201401。牛多杀性巴氏杆菌病灭活疫苗(b型菌单苗):中牧实业股份有限公司兰州生物药厂生产,批号为1407001;新疆天康畜牧生物技术股份有限公司生产,批号为20140011.2试验动物6月龄及以上健康易感牛,体重1.5~2.0kg兔。1.3攻毒用强毒菌牛多杀性巴氏杆菌荚膜b型c45-2株(cvcc44502),由中牧实业股份有限公司兰州生物药厂提供。2试验方法2.1牛的免疫及攻毒将本二价灭活疫苗、中牧股份兰州厂和新疆天康生产的b型菌单苗分别肌肉接种试验牛,本制品注射剂量为1头份(2.0ml/头),另2批商品化同类制品注射剂量均为1头份(4.0ml/头),每批疫苗接种4头,同时设3头牛作为对照组。免疫后21日,对所有牛进行攻毒,每头牛肌肉注射10mld的c45-2株强毒菌液,观察14日,记录牛的死亡情况。2.2兔的免疫及攻毒将本制品按0.5ml/只剂量皮下接种免疫5只兔,21日后,连同条件相同的5只对照兔各皮下注射1mld的c45-2株强毒菌液,观察8日,记录兔的死亡情况。将中牧股份兰州厂和新疆天康生产的b型菌单苗按1.0ml/只剂量分别皮下接种免疫4只兔,另2只作对照;接种21日后,连同条件相同的2只对照兔各每只兔各皮下注射1mld的c45-2株强毒菌液,观察8日,记录兔的死亡情况。3结果将本制品和2种商品化单苗产品免疫牛21日后进行攻毒,结果见表14。对照牛攻毒后全部死亡,本制品与中牧股份兰州厂和新疆天康生产的b型菌单苗对牛的保护率均为3/4,表明本制品与同类产品在b型菌攻毒下对牛提供的免疫保护无明显差异。表14同类产品比较效力检验结果(牛效力检验)将本制品和同类产品免疫兔21日后进行攻毒,结果见表15。本制品免疫兔攻毒后保护率为4/5,对照兔全部死亡;中牧股份兰州厂和新疆天康生产的b型菌单苗免疫兔攻毒后保护率均为3/4,对照兔全部死亡。结果表明本制品与2个同类产品均达到各效力检验要求。表15同类产品比较效力检验结果(兔效力检验)3结论由于牛多杀性巴氏杆菌荚膜a型菌与荚膜b型菌之间没有交叉保护力,且目前市场未见本制品商品化的同类产品,因此选择现有商品化的b型菌单苗与本制品进行针对b型菌的免疫效果比较试验是可行的。上述试验结果表明,本发明实施例1方法制得的二价疫苗与其他商品化b型菌单苗在b型菌攻毒下对动物提供的免疫保护力相同。实施例6本发明制备的疫苗对本动物与实验动物效力检验结果相关性研究1材料1.1疫苗实施例1方法制得的牛多杀性巴氏杆菌病二价灭活疫苗(a型pm-tj株+b型c45-2株),批号为zm201401、zm201402、zm201403。1.2试验动物6月龄及以上的健康易感牛。体重18~22gspf级balb/c小鼠。体重1.5~2.0kg兔。2方法2.1本动物效力试验将3批疫苗制品分别按每头1头份(2.0ml)的剂量颈部肌肉接种8头试验牛,同时设条件相同的6头牛作为对照。免疫后21日进行攻毒,从每批疫苗免疫的8头牛中随机挑选4头免疫牛,与3头对照牛采用牛多杀性巴氏杆菌荚膜a型pm-tj株攻毒,每头气管滴注2mid的a型菌菌液;另外4头免疫牛及3头对照牛采用牛多杀性巴氏杆菌荚膜b型c45-2株攻毒,每头牛肌肉注射10mld的b型强毒菌液。进行a型菌攻毒的牛,观察牛的临床症状,每日同一时间记录体温;攻毒后第10日,对免疫牛及对照牛剖检,观察并记录肺部病理变化,分析牛发病和保护情况。进行b型菌攻毒的牛,攻毒后观察14日,记录牛死亡情况。2.2实验室动物替代本动物效力检验相关性试验2.2.1小鼠效力检验方法研究试验将3批疫苗制品分别肌肉接种35只小鼠,每只小鼠的免疫剂量为牛免疫剂量的1/40头份,即50μl/只;同时设条件相同的35只小鼠作为对照。免疫后21日,将每批疫苗的免疫小鼠和对照小鼠分别分为7组,5只/组,用101、102、103、104、105、106、107mld的a型菌液共7个梯度分别腹腔注射一组小鼠;观察7日,记录各组小鼠的死亡情况,并根据小鼠保护结果确定疫苗小鼠效力检验方法。2.2.2小鼠替代牛效力检验相关性试验将3批疫苗分别以牛免疫剂量的100μl、50μl、25μl三种剂量肌肉接种5只小鼠,同时设条件相同的5只小鼠作为对照。免疫后21日,免疫小鼠和对照小鼠按2.2.1试验结果确定的攻毒剂量每只腹腔注射a型菌菌液,攻毒后观察7日,记录各组小鼠的死亡情况。根据试验结果分析小鼠替代牛效力检验的相关性。2.2.3兔替代牛效力检验相关性试验将3批疫苗以牛免疫剂量的1.0ml、0.5ml、0.25ml三种剂量分别以肌肉和皮下注射的方式各接种5只兔,同时设条件相同的5只兔作为对照。免疫后21日,免疫兔和对照兔每只皮下注射1mld的c45-2株强毒菌液,攻毒后观察8日,记录死亡情况。根据试验结果分析兔替代牛效力检验的相关性。3结果3.1本动物效力试验结果3批疫苗制品按1头份(2.0ml)的剂量免疫牛,21天后进行攻毒,攻毒的保护结果见表16和表17。从表16可见,a型菌攻毒后,3批疫苗免疫牛均在3/4及以上保护,对照牛全部发病(3/3);从表17可见,b型菌攻毒后,3批疫苗免疫牛均在3/4及以上保护,对照牛全部死亡。结果表明,本制品对牛均有良好的免疫保护力。表16制品免疫牛后a型菌攻毒的保护结果注:“-”表示该项未出现对应的症状,“+”表示该项出现对应的症状。表17制品免疫牛后b型菌攻毒的保护结果疫苗批号免疫剂量牛数量攻毒菌株死亡数保护率(存活数/攻毒数)zm2014012.0ml4头c45-2株13/4zm2014022.0ml4头c45-2株04/4zm2014032.0ml4头c45-2株04/4对照20ml3头c45-2株30/33.2实验室动物替代本动物效力检验相关性试验结果3.2.1小鼠效力检验方法研究结果将3批疫苗制品按牛免疫剂量的50μl免疫小鼠,21天后进行攻毒,共设置7个攻毒剂量(101~107mld),每个攻毒剂量攻5只小鼠,结果如表18所示,从表18可见,3批疫苗制品的免疫小鼠在采用101~103mld的a型菌攻毒后,小鼠全部保护;104cfu的a型菌攻毒后,小鼠存活数均在4只及以上;105cfu的a型菌攻毒后,小鼠存活数均为2~3只;106与107cfu的a型菌攻毒后,小鼠存活数量均在1只及以下。根据上述结果,确定疫苗小鼠效力检验方法为,以牛免疫剂量的1/40头份(50μl)进行免疫5只小鼠,免疫21天后,连同条件相同的5只小鼠腹腔注射1.0×104cfu的a型菌液,观察7日,对照小鼠全部死亡,免疫小鼠保护至少4只。表18制品免疫小鼠后a型菌攻毒的保护结果3.2.2小鼠替代牛效力检验相关性试验结果将3批疫苗按不同剂量免疫小鼠,免疫21天后,按照3.2.1试验结果确定的小鼠效力检验方法,连同对照小鼠每只小鼠腹腔注射1.0×104cfu的a型菌液,攻毒结果见表19。对照小鼠全部死亡,3批疫苗以100μl、50μl免疫的小鼠保护率均在4/5及以上,而以25μl免疫的小鼠保护率均在1/5及以下。试验结果表明,3.2.1试验结果确定的疫苗小鼠效力检验方法与牛的效力检验方法具有很好的相关性,小鼠效力检验方法可替代牛的效力检验。表19制品不同剂量免疫小鼠后a型菌攻毒保护结果3.2.3兔替代牛效力检验相关性试验结果将3批疫苗按照按不同剂量免疫兔,21天后进行攻毒,攻毒结果见表20。3批疫苗制品的免疫兔在进行b型菌攻毒后,对照兔全部死亡,肌肉和皮下两种方式接种1.0ml、0.5ml剂量的免疫兔存活率均在3/5及以上,而肌肉和皮下两种方式接种0.25ml剂量的免疫兔存活率均在2/5及以下。因此根据上述结果,确定疫苗用兔效力检验方法为:将疫苗以牛免疫剂量的0.5ml肌肉或皮下接种5只兔,免疫后21日,连同条件相同的5只对照兔各皮下注射1mld的c45-2株强毒菌液,攻毒后观察8日,对照兔全部死亡,免疫兔应至少3只保护。该试验结果同时表明,兔效力检验方法与牛的效力检验方法具有很好的相关性,兔效力检验方法可替代牛的效力检验。表20制品不同剂量免疫兔后b型菌攻毒保护结果4结论本制品的本动物效力检验可用小鼠和兔的效力检验替代,并将疫苗采用实验动物效力检验的标准确定为:用体重18~22g小鼠5只,各肌肉注射疫苗50μl,21日后,连同条件相同的对照鼠5只,各腹腔注射1.0×104mld的牛多杀性巴氏杆菌pm-tj株强毒菌液,观察7日;对照组全部死亡,免疫组应至少4只保护。用体重1.5~2.0kg兔5只,各肌肉或皮下注射疫苗0.5ml,21日后,连同条件相同的对照兔5只,各皮下注射1mld牛多杀性巴氏杆菌c45-2株强毒菌液,观察8日。对照组全部死亡,免疫组应至少3只保护。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1